Los stent medicados constituyen la incorporación a la plataforma de metal del stent de un medicamento citotóxico o citostático de liberación retardada que inhibe la proliferación celular, especialmente del músculo liso vascular, responsable de la reestenosis del stent. Los tres componentes de los stent medicados son la plataforma o stent, el mecanismo de liberación (polímero) y el medicamento liberado. Han sido clasificados en cuatro generaciones de acuerdo con las características del polímero.
La evolución de los stents ha permitido el desarrollo de los «armazones» vasculares o scaffold, que son completamente bioabsorbibles, en los que el armazón vascular da soporte mecánico al vaso tratado mientras libera el medicamento antiproliferativo y después de un período de tiempo es completamente absorbido, lo que hace que el vaso recupere su fisiología normal.
Estos avances han permitido la utilización de los stents medicados en pacientes y lesiones con alto riesgo de reestenosis como diabetes, síndrome coronario agudo, enfermedad multivaso, lesiones largas y vasos pequeños, y oclusiones crónicas.
Medicated stents incorporate a delayed-release cytotoxic or cytostatic medication into the metal stent platform, thus inhibiting cellular proliferation, especially that of vascular smooth muscle, which is responsible for stent restenosis. The three components of medicated stents are: the platform or stent, the eluting mechanism (polymer) and the eluted medication. They have been classified in four generations according to the polymer characteristics.
Stent evolution has allowed the development of vascular ¿frames¿ or scaffolds, which are completely bioabsorbable, in which the vascular frame provides mechanical support to the treated vessel while releasing the antiproliferative medication. After a time, it is completely absorbed, which causes the vessel to recover its normal physiology.
These advances have allowed the use of medicated stents in patients and lesions with a high risk of restenosis such as diabetes, acute coronary syndrome, multivessel disease, long lesions and small vessels, and chronic occlusions.
La intervención coronaria percutánea (ICP), inicialmente con balón desde 1977, y posteriormente con la primera implantación de stent en 1984, ha sido uno de los campos de la Cardiología intervencionista con más rápido crecimiento y evolución. En un comienzo, la efectividad de la angioplastia coronaria con balón fue limitada por una alta tasa de reestenosis, la cual es del 50% en el primer año de la intervención, mediada por el retroceso elástico temprano y la hiperplasia intimal como respuesta a la lesión en el sitio tratado, y a la oclusión aguda del vaso, en un 5 a 10% de los pacientes.
A partir de la utilización de los stents convencionales o BMS (su sigla en inglés por bare metal stent), las técnicas de implantación de los stents a alta presión aprendidas con los estudios de ultrasonido intravascular y la doble terapia de antiagregación dual (ASA e inhibidores del receptor P2Y12) disminuyó a menos del 1% los casos de oclusión aguda del vaso tratado aún en casos complejos y síndrome coronario agudo, pero las tasas de reestenosis a seis meses y a un año por hiperplasia intimal, continuaron siendo tan altas como del 11 al 40%, especialmente en lesiones largas y vasos pequeños1. Estas tasas de reestenosis son especialmente altas en pacientes con lesiones complejas largas y vasos pequeños, lo cual limitó el uso de los stents convencionales. Esto llevó al desarrollo de los stents medicados o DES (del inglés drug eluting stents), los cuales son el stent metálico de los stents convencionales (BMS) a los que se les adiciona un polímero que transporta y libera de manera controlada un medicamento citotóxico o citostático, que ejerce una acción antiproliferativa que retarda la cicatrización del vaso y reduce la hiperplasia intimal y las tasas de revascularización del vaso tratado o reestenosis.
La evolución tecnológica de los stents medicados ha permitido el desarrollo de nuevos stents con mayor biocompatibilidad y resultados clínicos, y recientemente ha permitido el desarrollo de stents completamente bioabsorbibles, avances que se describirán en detalle a continuación1,2.
DefinicionesLos stent medicados o DES (sigla en inglés por drug eluting stent) constituyen la incorporación a la plataforma de metal del stent de un medicamento citotóxico o citostático de liberación retardada que inhibe la proliferación celular, especialmente del músculo liso vascular, que es el principal componente del crecimiento neointimal responsable de la reestenosis del stent.
FisiopatologíaEn el contexto de la enfermedad coronaria estable e inestable, existen razones claras para recomendar el uso de stent medicados, al entender los mecanismos por los cuales estos dispositivos actúan y logran disminuir el riesgo de reintervención de las arterias tratadas3.
Los stent medicados surgen como respuesta a las reestenosis recurrentes generadas durante el uso de stent convencionales luego de angioplastia. Su objetivo es disminuir la proliferación neointimal, manteniendo los beneficios en cuanto a disminución del retroceso elástico y la remodelación negativa.
Existen tres componentes de los stent medicados: la plataforma, el mecanismo de liberación (polímero) y el medicamento liberado1,2.
a. Stent o plataforma: los stents iniciales (Cypher® y Taxus®) de primera generación son de acero inoxidable 316 L, con un de strut de 130 a 140μm y adicionalmente son ferromagnéticos (60 a 65% de hierro puro), no compatibles con resonancia magnética nuclear (RMN). Los stents de nueva generación (stent medicados de everolimus, zotarolimus y sirolimus, etc.) son de cobalto o platino (platino-iridio) y cromo, con struts más delgados (81 a 91μm). Estas plataformas de struts más delgados mejoran la flexibilidad y entrega del stent y el acceso a ramas laterales, al igual que reducen la lesión vascular.
Los armazones vasculares o scaffolds son plataformas de stent completamente bioabsorbibles, compuestos de ácido poli-L o D-láctico o ácido glicólico y el copolímero de ácido poliláctico y glicólico, y algunos otros compuestos como magnesio o policarbonato derivado de tirosina.
b. Vehículo de entrega del medicamento o polímero: los polímeros son el vehículo de entrega del medicamento citotóxico o cistostático en el vaso intervenido y permiten una liberación controlada del mismo. La clasificación de los stents medicados se hace de acuerdo con los diferentes polímeros utilizados. Los stents medicados de primera generación utilizaban polímeros durables no degradables (Cypher®: polyethylene-co-vinylacetate [PEVA]/ poly-n-butylmethacrylate [PBMA], Taxus®: polystyrene-b-isobutylene-b-styrene [SIBS]). La pobre biocompatibilidad de estos polímeros de primera generación puede generar reacciones de hipersensibilidad o inflamación crónica, retardo en la cicatrización del vaso o nueva aterosclerosis con consecuencias clínicas como trombosis tardía o muy tardía de los stents, mala aposición del stent en el vaso o más aun reestenosis tardía, hecho que llevó al desarrollo de nuevos polímeros con mayor biocompatibilidad y menor duración intravascular.
Estos polímeros se usan en los stents medicados de segunda y tercera generación los cuales son no trombogénicos y poseen mejores propiedades de biocompatibilidad que optimizan la reendotelialización del vaso. Se describirán más adelante en detalle.
c. Medicamento activo: los medicamentos usados en los stents medicados de primera generación son el placitaxel y el sirolimus, y en los de segunda generación dos análogos del sirolimus: everolimus y zotarolimus. Ambos agentes (placitaxel y sirolimus) son citotóxicos o citostáticos para las células de la pared vascular, con mejores tasas de reendotelialización para los análogos del sirolimus (everolimus, zotarolimus, biolimus). Otro análogo del sirolimus es el biolimus A9, el cual es el componente de los stents medicados de tercera generación.
Se halla en investigación la utilización de dos agentes de manera simultánea en los stent medicados con la finalidad de reducir la reestenosis con un primer medicamento antiproliferativo y promover la endotelialización con un segundo agente, y con ello disminuir las tasas de trombosis tardía y muy tardía1,3.
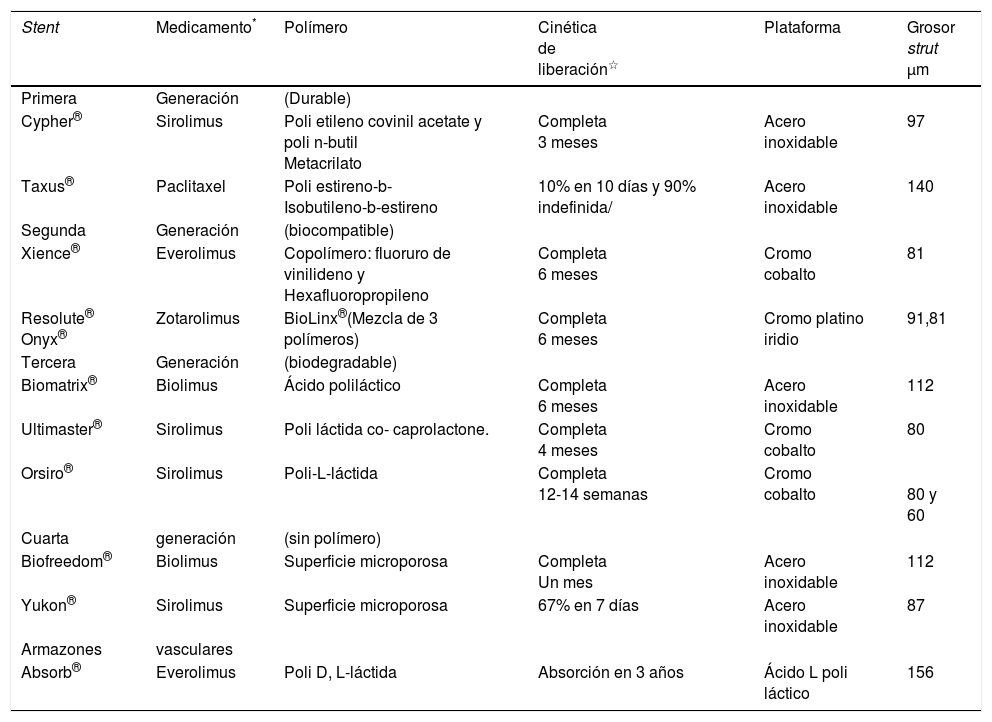
Tipos de stents medicados: generacionesLos stents medicados se clasifican en cuatro generaciones de acuerdo con las características del polímero; a continuación se describe cada generación (tabla 1).
Generaciones de stents medicados y sus características más relevantes
| Stent | Medicamento* | Polímero | Cinética de liberación☆ | Plataforma | Grosor strut μm |
|---|---|---|---|---|---|
| Primera | Generación | (Durable) | |||
| Cypher® | Sirolimus | Poli etileno covinil acetate y poli n-butil Metacrilato | Completa 3 meses | Acero inoxidable | 97 |
| Taxus® | Paclitaxel | Poli estireno-b- Isobutileno-b-estireno | 10% en 10 días y 90% indefinida/ | Acero inoxidable | 140 |
| Segunda | Generación | (biocompatible) | |||
| Xience® | Everolimus | Copolímero: fluoruro de vinilideno y Hexafluoropropileno | Completa 6 meses | Cromo cobalto | 81 |
| Resolute® Onyx® | Zotarolimus | BioLinx®(Mezcla de 3 polímeros) | Completa 6 meses | Cromo platino iridio | 91,81 |
| Tercera | Generación | (biodegradable) | |||
| Biomatrix® | Biolimus | Ácido poliláctico | Completa 6 meses | Acero inoxidable | 112 |
| Ultimaster® | Sirolimus | Poli láctida co- caprolactone. | Completa 4 meses | Cromo cobalto | 80 |
| Orsiro® | Sirolimus | Poli-L-láctida | Completa 12-14 semanas | Cromo cobalto | 80 y 60 |
| Cuarta | generación | (sin polímero) | |||
| Biofreedom® | Biolimus | Superficie microporosa | Completa Un mes | Acero inoxidable | 112 |
| Yukon® | Sirolimus | Superficie microporosa | 67% en 7 días | Acero inoxidable | 87 |
| Armazones | vasculares | ||||
| Absorb® | Everolimus | Poli D, L-láctida | Absorción en 3 años | Ácido L poli láctico | 156 |
Fueron los primeros stents medicados desarrollados, con un amplio uso y evaluación inicial. Usan un polímero durable no absorbible; los representantes de este grupo son los stents Cypher®, liberador de sirolimus, y Taxus® liberador de paclitaxel. El sirolimus del Cypher® se libera en un 50% en 10 días, 90% en 60 días y de manera completa a los 90 días; el paclitaxel del stent Taxus®, solo se libera el 10% en los primeros 10 días de implantación y no hay liberación después, por tanto 90% del paclitaxel permanece en el polímero de forma indefinida3.
El efecto del tratamiento de los stent medicados de primera generación sobre los stents convencionales, consiste en la reducción de la necesidad de revascularización de un 35 a 70%, y en más de los 16 metaanálisis publicados que comparan los stent convencionales vs. los medicados de primera generación (DES con sirolimus -Cypher®-) y DES con paclitaxel (Taxus®), se ha reportado una disminución de la necesidad de revascularización de la lesión tratada de un 60 a 70% a favor de los medicados (95% IC 0,24, 0,37; p<0,001 para Cypher®versus stent convencional y de un 40 a 50% (95% IC 0,33, 0,53; p<0,001 para Taxus®versus stent convencional). El número necesario de pacientes a tratar para prevenir la necesidad de una revascularización es de 7 para el stent medicado con sirolimus y 8 para el stent medicado con paclitaxel1.
Este beneficio en la reducción significativa en la necesidad de revascularización del vaso tratado, persistió en los análisis a cinco años. Sin embargo, el uso de los stents medicados de primera generación se asoció con varios problemas que se describen brevemente:
- •
Tasa mayor, en relación con los convencionales, de trombosis tardía y muy tardía (de un mes hasta un año y más de un año), causada muy probablemente por deterioro en la reendotelialización y la reparación vascular, reacciones alérgicas y de inflamación y neoaterosclerosis por el polímero durable.
- •
Fenómeno «late catch-up», que consiste en una reestenosis retardada o pérdida tardía por un fenómeno de hiperplasia neointimal continuo y lento en el sitio tratado con un pico de seis a nueve meses postimplante del stent, que ha sido descrita para el stent Taxus® hasta cinco años después. Adicionalmente, en estudios de angioscopia y posteriormente de tomografía de coherencia óptica (OCT) en los que se evaluó el porcentaje de struts no cubiertos o con mala aposición en los stents medicados de primera generación, se demostró, en aquellos con OCT, que la frecuencia de strut no cubiertos con el stent Cypher® vs. el convencional a tres meses, fue alta (15 vs. 0,1%, p<0,001). En las evaluaciones posteriores a seis y doce meses, la tasa de celdas de los stents no cubiertos con Cypher® mejoró en el tiempo, 10,4% y 5,7% respectivamente, pero aun a cinco años de observación, hay persistencia de struts no cubiertos en un 1,5% (DES Cypher®). Cuando se comparan los stents Cypher® (sirolimus) con los stents de primera generación de paclitaxel (Taxus®), la tasa de struts no cubiertos a seis meses (6,6 vs. 12,7%, p<0,01), nueve meses (4,9 vs. 12,5%, p=0,01) y dieciocho meses (2,8 vs. 8,1%, p<0,01) siempre es mayor para el Taxus®, pero lo llamativo es que la tasa de struts no cubiertos para el Taxus® no cambia en el tiempo, y hasta un 1% de los struts a cinco años no están cubiertos1. Estos problemas cambiaron la recomendación de terapia dual inicial con ASA e inhibidores del receptor P2Y12 de tres meses para el Cypher® y seis meses para el Taxus®, a mínimo un año para ambos stent, y motivaron al desarrollo de stents medicados de nueva generación4,5.
La principal característica de los stents medicados de segunda generación es el cambio de polímero durable de primera generación por un polímero biocompatible más delgado (7,8μm vs. 13,7μm del stent Cypher®), pero adicionalmente hay variables en los otros dos componentes del stent. La plataforma metálica (stent propiamente dicho), cambió de acero inoxidable a una aleación de cobalto o platino (platino-iridio) y cromo, con struts más delgados (81 a 91μm vs. 140μm del stent Cypher®), característica que mejora la flexibilidad y entrega del stent y el acceso a ramas laterales, al tiempo que reduce la lesión vascular, y en vista de que los estudios de los stents de primera generación demostraron la superioridad del sirolimus frente a paclitaxel, se utilizó un agente antiproliferativo de la familia limus: everolimus y zotarolimus. En los stents con everolimus el polímero es un copolímero de fluoruro de vinilideno y hexafluoropropileno, el cual demostró ser no trombogénico y mejorar la reendotelialización del vaso. El everolimus se libera en un 25% el primer día después de la implantación, 50% en el primer mes y el otro 25% en los siguientes tres meses.
Los stent medicados con everolimus (Promus® y Xience V®), fueron evaluados en los estudios SPIRIT (Clinical Evaluation of the Xience V® Everolimus Eluting Coronary Stent System) II, III y IV, COMPARE (Second-Generation Everolimus-Eluting and Paclitaxel-Eluting Stents in Real-Life Practice) y SORT OUT IV (Scandinavian Organization for Randomized Trials wit Clinical Outcome IV) y en varios metaanálisis y registros, que demostraron la efectividad de los stents de segunda generación con everolimus en la reducción de la necesidad de revascularización del vaso tratado, y aún de eventos cardiovasculares mayores como infarto, muerte y trombosis del stent en comparación con stent convencionales o stent medicados con paclitaxel e incluso con stents medicados con sirolimus6,7.
Los stents medicados con everolimus han demostrado eficacia y seguridad superiores a los de primera generación al compararlos en los diferentes estudios clínicos, con tasas de trombosis tardía (un mes postimplante hasta un año) y muy tardías (más de un año) similares o menores a los stents convencionales, que han planteado un cambio en las guías de terapia antiplaquetaria dual poststent medicado, para reducir el tiempo de terapia dual.
El stent medicado de everolimus se ha convertido en el stent medicado base como comparador para la evaluación de otros stents medicados8.
En el caso de los stents de zotarolimus, el polímero utilizado inicialmente fue fosforilcolina, para mejorar la biocompatibilidad. Sin embargo, la liberación del zotarolimus fue muy rápida, con la entrega de casi todo el medicamento en dos semanas, hecho que generó un cambio del polímero por uno diferente (BioLinx®) que es una mezcla de tres: polímero C19 hidrofílico, polivinil pirrolidinone y polímero C10 hidrofóbico, que permite una liberación más lenta del zotarolimus y conservar la biocompatibilidad. Así, el zotarolimus se libera 50% en la primera semana, 85% en 60 días y de manera completa en 180 días.
El stent con zotarolimus ha sido evaluado en los estudios ENDEAVOR I A IV y ha demostrado su efectividad para reducir las tasas de reestenosis vs. stent convencionales, sin incrementar el riesgo de infarto y muerte. Los stents de segunda generación (everolimus y zotarolimus) han sido evaluados en estudios de OCT; en la comparación con los stents de primera generación se han encontrado mejores tasas de cicatrización vascular determinadas por la reendotelialización de los struts de los stents1.
En 2013 se comparó la eficacia y seguridad entre los stents medicados de polímero biodegradable con los stents convencionales y los stents medicados de polímero durable (primera y segunda generación), en 126 estudios de distribución aleatoria con 258.544 pacientes de seguimiento. Entre los diferentes tipos de stents, los medicados de segunda generación de polímero durable (Resolute®, liberador de zotarolimus, stent de cromo cobalto y cromo-platino liberadores de everolimus) fueron los más eficaces debido a menores tasas de revascularización del vaso tratado, en tanto que los medicados de cromo cobalto liberadores de everolimus (segunda generación) fueron más seguros pues redujeron de manera significativa la trombosis definida del stent (relación: 0,35, 0,21 a 0,53), el infarto de miocardio (relación: 0,65, 0,55 a 0,75) y la muerte (relación: 0,35, 0,21 a 0,53) en comparación con los stents convencionales. Esto confirma la seguridad y eficacia de los stents medicados de segunda generación, en especial los liberadores de everolimus, en el tratamiento de la enfermedad coronaria, frente a otros stents medicados o convencionales estudiados9.
Stents medicados de tercera generaciónSu principal característica es el cambio de polímero, por uno biodegradable, con la intención de reducir de forma completa el riesgo de reacciones inflamatorias o alérgicas de los polímeros durables de primera generación o biocompatibles de segunda generación. Se han desarrollado varios polímeros biodegradables:
- 1.
Polímero de ácido poliláctico: hay dos stents que utilizan este polímero biodegradable que han sido estudiados ampliamente: los stents Biomatrix® y Nobori®, que son liberadores de biolimus A9. En el stent Biomatrix® el biolimus A9 se libera en un período de seis meses y el biopolímero se degrada de manera completa en agua y dióxido de carbono en seis a nueve meses después del implante del stent, quedando solo la estructura metálica del stent (acero inoxidable).
El Biomatrix® se evaluó en el estudio LEADERS frente al stent medicado de sirolimus (SES) en 1.707 pacientes, en el que el Biomatrix® no fue inferior al SES a cinco años, en el punto final compuesto de muerte cardiaca, infarto de miocardio y revascularización del vaso tratado10. Lo llamativo de este estudio es que el stent Biomatrix® redujo significativamente la trombosis muy tardía del stent de uno a cinco años (0,7 vs. 2,5% con SES p=0,003), hallazgos que fueron confirmados en un metaanálisis posterior11. El Nobori® se evaluó frente al stent de segunda generación de everolimus en los estudios COMPARE II y NEXT.
- 2.
Polímero de DL-láctido-co-glucólido: el stent que utiliza este polímero biodegradable es el Synergy®, evaluado en el estudio EVOLVE con 291 pacientes y en el EVOLVE II en 1.684 pacientes, frente al stent Promus® liberador de everolimus. Es liberador de everolimus y tanto el polímero como el medicamento se degradan y liberan de forma completa en cuatro meses12.
- 3.
Polímero de DL-láctido-co-caprolactona: el stent Ultimaster® utiliza este polímero en un stent de cromo-cobalto, con sirolimus como medicamento liberado en la superficie abluminal del stent. Al igual que el Synergy®, el medicamento y el polímero se liberan y degradan de forma completa en cuatro meses.
- 4.
Polímero mezcla ácido poli-L-láctico y ácido poli–láctico-co-glucólico (BioPoly®). El stent que utiliza este biopolímero es el BioMime® el cual es un stent de cromo-cobalto que libera sirolimus. Este polímero transporta el sirolimus en forma de cristal, el cual se libera en forma completa en 60 días y el biopolímero se absorbe en 90 días. No obstante, el sirolimus queda en forma cristalizada en los tejidos vecinos al implante del stent hasta nueve meses después, lo cual es un mecanismo único de liberación del medicamento entre los stents medicados.
- 5.
Existen otros biopolímeros como la polisulfona, utilizados en stents autoexpandibles de nitinol con liberación de sirolimus.
Los stents medicados de cuarta generación no usan polímeros; por tanto el transporte y la liberación del medicamento antiproliferativo se realiza mediante modificaciones en la estructura metálica del stent (microporos) u otros mecanismos.
Los stents de cuarta generación y el medicamento que liberan son el Yukon® (sirolimus), BioFreedom® (Biolimus A9), Cre8® y Amphilimus® (sirolimus). Hasta el momento no hay una superioridad clara de los stents sin polímero sobre los stents de segunda o tercera generación; sin embargo, recientemente se publicaron los resultados del estudio LEADERS FREE, que comparó el stents sin polímero BioFreedom® (stent sin polímero que libera biolimus A9 en un período de 28 días, el cual es altamente lipofílico) vs. los stent convencionales, en 2.466 pacientes con alto riesgo de sangrado a quienes se les realizaba ICP con stents, y con un solo mes de terapia antiplaquetaria dual. Se demostró la superioridad del stent BioFreedom® en los puntos de seguridad (punto final compuesto de infarto, muerte cardiaca y trombosis del stent) y eficacia (revascularización de la lesión tratada)13. La importancia de los resultados de este estudio radica en la utilización de un stent medicado (BioFreedom®) liberador de biolimus A9 con un tiempo de terapia antiplaquetaria dual de un mes, en pacientes de alto riesgo de sangrado con el mismo o menos riesgo de trombosis de los stents convencionales y con las ventajas a un año de reestenosis de los stents medicados, especialmente en el subgrupo de pacientes de síndrome coronario agudo, como se publicó recientemente14.
La evolución tecnológica de los stents medicados ha permitido tener dispositivos con mejor biocompatibilidad al cambiar el polímero de transporte del medicamento o eliminarlo, y variar la plataforma metálica del stent y la concentración y las características de liberación del medicamento antiproliferativo, condiciones que mejoran la seguridad con la misma eficacia inicialmente demostrada en cuanto a la disminución de la reestenosis a largo plazo. Estas particularidades de las nuevas generaciones de stents medicados han permitido su uso en lesiones más complejas y en pacientes con múltiples comorbilidades. Sin embargo, la evolución de estos dispositivos continúa hacia dispositivos temporales para evitar los problemas potenciales de los stents metálicos como implantes intravasculares permanentes. Esto ha facilitado el desarrollo de dispositivos intravasculares completamente bioabsorbibles (plataforma, polímero y medicamento) que permiten que la arteria recupere sus características anatómicas y fisiológicas (vasomotoras) previas al implante. Estos dispositivos se conocen como «armazones vasculares» (scaffold), que a diferencia de los stents permanentes, son temporales. A continuación se describen en detalle.
Armazones vasculares (scaffold)Los «armazones vasculares» o scaffold, son dispositivos intravasculares completamente bioabsorbibles, en los que el armazón vascular da soporte mecánico al vaso tratado mientras libera el medicamento antiproliferativo, y después de un período de tiempo es completamente absorbido sin dejar en el sitio tratado ningún remanente, característica que hace que el vaso recupere su fisiología normal.
El stent más estudiado es el Absorb® cuya plataforma es de ácido-L-poli-láctico, el polímero es D,L poliláctido y el medicamento antiproliferativo es el everolimus. Este dispositivo da soporte mecánico al vaso durante seis meses y desaparece en forma completa en tres años. Al no contar con una plataforma metálica como los stents, estos dispositivos precisan de la preparación adecuada de las lesiones (predilatación, aterectomía, etc.) a tratar. Probablemente los vasos menores de 2,25mm de diámetro no deban ser tratados con Absorb® por el riesgo de trombosis del stent de acuerdo con los resultados del estudio ABSORB III11. Adicionalmente, se recomienda posdilatar los Absorb® con balones no mayores a 0,5mm el diámetro del armazón vascular implantado, especialmente en las lesiones ostiales15.
El stent bioabsorbible Absorb® se ha evaluado en seis estudios clínicos aleatorizados (n=3.738) en los que se compara con stents de segunda generación de everolimus, cinco de estos estudios en pacientes con angina estable (EVERBIO II, ABSORB II, III, ABSORB Japan y China), y el TROFY II en infarto con elevación del ST. El estudio más importante es el ABSORB III, multicéntrico, aleatorizado, en 2.008 pacientes en donde fue comparado con el stent de segunda generación de everolimus Xience® en una relación 2:1. En este estudio el Absorb® demostró no inferioridad con el stent Xience® a un año en el punto final compuesto de falla de la lesión tratada, el cual incluye: muerte cardiaca, infarto en el vaso tratado o isquemia en la lesión revascularizada. Los resultados iniciales con el Absorb® son prometedores, y por su característica de ser 100% bioabsorbible constituye una alternativa muy importante en el manejo de la enfermedad coronaria aterosclerótica. Sin embargo, en el seguimiento a largo plazo (> 1 año) y en metaanálisis posteriores, se han encontrado incremento del riesgo de infarto del vaso tratado y trombosis tardía y muy tardía de los Absorb® comparado con los stents everolimus de segunda generación.
Recientemente se publicó un metaanálisis de 24 estudios clínicos con dos años de seguimiento en el que se compararon los stents bioabsorbibles con stents de segunda generación de everolimus, stents bioabsorbibles n=2.567 y stents everolimus=19.806 pacientes. Este metaanálisis demostró que los stents bioabsorbibles comparado con los stents de segunda generación con everolimus están asociados con un alto riesgo de trombosis del stent a dos años (OR: 2,08 (95% IC, 1,02-4,26) y trombosis muy tardía del stent bioabsorbible (OR: 2,03 (95% IC, 0,62-6,71). En el análisis de los estudios de distribución aleatoria con stent Absorb® (EVERBIO II, ABSORB II, III, ABSORB Japan y China, y TROFY II) se confirman los resultados anteriores, con un riesgo mayor con el Absorb® vs. stent de segunda generación de everolimus en el punto final compuesto de eventos relacionados con el stent (OR: 1,47 (95% IC, 1,00-2,17, p=0,05), es decir un riesgo mayor con los stents Absorb® de infarto del miocardio del vaso tratado, isquemia de la lesión revascularizada y trombosis del stent, pero sin diferencia en el riesgo de muerte de origen cardiaco. Un aspecto importante es el alto riesgo de trombosis muy tardía (> 1 año) de los stents Absorb®: 12 de 996 pacientes (1,4%) comparado con 1 de 701 pacientes (0,5%) de los stents de everolimus de segunda generación. Con base en estos resultados se interrumpió el uso de los stents bioabsorbibles, y con el análisis de las posibles causas de la fallas de estos stents (técnicas de implantación, propiedades mecánicas de los stents bioabsorbibles, perfil de cruce, tiempo de terapia antiplaquetaria dual, etc.) se iniciaron los estudios con stents bioabsorbibles de segunda generación a fin de mejorar algunas condiciones que incrementan los eventos adversos (menor grosor de las celdas de los stents, pérfil de cruce etc.) que permitan definir su papel en el manejo de la enfermedad coronaria aterosclerótica24,25.
Otros armazones vasculares son el DESolve®, de ácido L-poli-láctico, que libera novolimus y se absorbe de manera completa en un período de un año, y el DREAMS®, armazón bioabsorbible de magnesio, cuyo polímero es el ácido coglicólico y poliláctico y el medicamento antiproliferativo paclitaxel15,16. Otros materiales que están en estudio son el policarbonato de tirosina y el polímero de ácido salicílico y hierro.
Aspectos terapéuticosIndicaciones de los stent medicadosFrente a los stent convencionales, los medicados reducen la reestenosis y necesidad de revascularización del vaso tratado sin incrementar los eventos cardiovasculares mayores o la trombosis del stent. La probabilidad de reestenosis depende de las características de la lesión; por esto el beneficio de los stent medicados es aún mayor en las lesiones de alto riesgo de reestenosis.
Existen varios subgrupos de pacientes en alto riesgo de reestenosis en los que se han evaluado los stent medicados o DES, especialmente los de segunda generación:
- •
Diabetes mellitus: los stent medicados de segunda generación reducen la necesidad de revascularización de un 37 a 69% cuando se compara con stents convencionales, sin un incremento significativo de la tasa de muerte o infarto o trombosis del stent17.
- •
Infarto agudo con elevación del segmento ST: los pacientes tratados con stent medicados han demostrado disminuir la necesidad de revascularización en seguimientos realizados a cinco años, sin diferencias significativas en las tasas de muerte, reinfarto, enfermedad cerebrovascular (ECV) o trombosis del stent.
- •
Enfermedad multivaso: existen dos estudios de distribución aleatoria: CARDiav(Coronary Artery Revascularization in Diabetes Trial) y SYNTAX (Synergy Between Percutaneous Coronary Intervention With Taxus and Cardiac Surgery), que concluyen que este subgrupo de pacientes debe evaluarse de manera multidisciplinaria, valorando la complejidad de las lesiones, para lo cual se diseñó el puntaje SYNTAX, que ayuda a estratificar de manera adecuada al paciente hacia el manejo percutáneo con stent medicado o cirugía17.
- •
Lesiones del tronco principal de la coronaria izquierda: existen pocos estudios en este grupo de pacientes; sin embargo en el SYNTAX un tercio de los pacientes con lesiones del tronco y puntaje SYNTAX menor de 32, tuvieron buen resultado con stent medicado con paclitaxel, dato que enfatiza que mientras se esperan estudios de distribución aleatoria con mayor número de pacientes, se deberá seleccionar de manera multidisciplinaria a los candidatos a angioplastia con stent medicado en el tronco principal de la coronaria izquierda18.
En diciembre de 2016 se publicó el estudio EXCEl que compara stents de segunda generación de everolimus con revascularización miocárdica quirúrgica en paciente con enfermedad del tronco, en 1.905 pacientes con anatomía coronaria de complejidad baja o intermedia (puntaje SYNTAX menor o igual a 32). El stent medicado everolimus demostró no ser inferior a la cirugía de revascularización miocárdica en el punto final compuesto de muerte, ACV, o infarto del miocardio a tres años26.
- •
Oclusiones crónicas: en quienes se logra recanalizar exitosamente el vaso ocluido crónicamente, el uso de stent medicados vs. stent convencional ha demostrado disminuir la necesidad de revascularización del vaso tratado en seguimientos hasta de cinco años, en un metaanálisis de más de 4.000 pacientes publicado recientemente, con tasas de muerte, infarto y trombosis del stent similares a las de los stent convencionales19.
- •
Puentes venosos: el uso de stent convencionales en los puentes venosos se ha asociado con altas tasas de infarto periprocedimiento y de reestenosis. Recientemente se publicó un metaanálisis en el que se comparan los stents medicados con stents convencionales en el tratamiento de puentes venosos aortocoronarios. Los stents medicados se asocian con una disminución significativa en las tasas de revascularización del vaso tratado sin diferencias en las de trombosis del stent, infarto o muerte20.
- •
Reestenosis intrastent: los stent medicados son la primera estrategia de manejo en los pacientes con reestenosis intrastent, en especial cuando el compromiso es difuso y en lesiones complejas. En el caso de la reestenosis de un stent medicado el uso del balón medicado u otro DES, son las alternativas recomendadas en la actualidad21,22.
Los stents medicados se han convertido en los dispositivos más utilizados en el tratamiento de la enfermedad coronaria, con indicaciones que han ido ampliándose con su uso y la aparición de nuevas generaciones que mejoran claramente la seguridad al conservar o mejorar la eficacia en la reducción significativa de la reestenosis o revascularización del vaso tratado, ambas a largo plazo, cuando se compara con los stents convencionales23.
Finalmente, algunos estudios han demostrado que los stent medicados son costo/efectivos, o incluso ahorran gastos especialmente en pacientes diabéticos, y lesiones largas y complejas.
En este consenso se revisarán aspectos más detallados del uso de los stents medicados en diferentes subgrupos de pacientes y lesiones coronarias.
Conflicto de interesesNinguno.