Con la aprobación y concesión del Registro Sanitario 201300 4713 del 25 de febrero de 2013, con vigencia hasta el año 2023, por parte del Instituto Nacional de Vigilancia de Medicamentos y Alimentos como órgano oficial del Ministerio de Salud y Protección Social de Colombia, a la plataforma biorreabsorbible Absorb BVS®, con el nombre de stent medicado biorreabsorbible, la introducción de estas plataformas al portafolio terapéutico del cardiólogo intervencionista para el tratamiento de pacientes seleccionados con enfermedad coronaria, ha generado gran expectativa gracias a la seguridad y eficacia que han demostrado en comparación con los stents liberadores de medicamento, con resultados de no inferioridad y con el ofrecimiento de una serie de ventajas por las cuales ha sido considerado la «cuarta revolución». En este artículo se hace una revisión acerca de las plataformas existentes, de su mecanismo de acción, así como de sus potenciales ventajas y limitaciones.
The approval and the concession of the Health Registration 201300 4713 dated February 25th 2013, in force until 2013, by the National Institute of Food and Drug Monitoring as a body of the Colombian Ministry of Health and Social Protection, in favor of the Absorb BVS® bioresorbable scaffold, under the name of bioresorbable medicated stent, has created high expectations regarding the introduction of these scaffolds in the therapeutic repertoire of the interventional cardiologist for treatment of selected patients with coronary disease. The security and efficiency that they have shown in comparison to the drug-eluting stents, with results of non-inferiority and offering various advantages, have been the reasons why they have been called the fourth revolution. This article reviews the existing scaffolds and their operating methods, as well as their advantages and limitations.
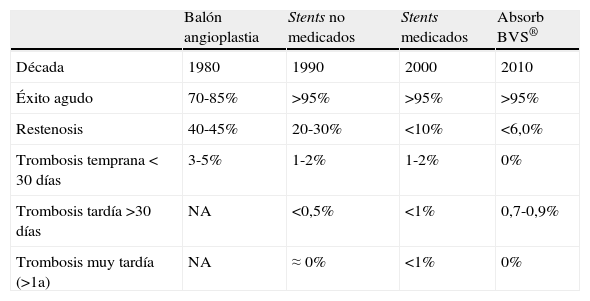
En 1977, Andreas Grüentzig introdujo la angioplastia coronaria como la nueva esperanza en el tratamiento de la enfermedad coronaria severa1,2. Aunque el futuro era evidente, el riesgo de oclusión aguda y la incidencia alta de restenosis causada por retroceso elástico, disección arterial, cierre agudo e hiperplasia neointimal limitaron sus resultados. Surgieron entonces los stents como una solución parcial a estos problemas gracias al soporte mecánico sobre la pared arterial3–5, obteniéndose una reducción significativa en la oclusión aguda y la restenosis6,7. Con la introducción de los stents liberadores de fármaco (SLF), las propiedades antiproliferativas del fármaco suministrado permitieron reducir de manera significativa la hiperplasia neointimal inducida por el stent, y de esta forma la necesidad de repetir la revascularización de la lesión tratada (TLR) a menos del 10%8,9. En la actualidad se ha venido generalizando la utilización de los SLF, para los pacientes con enfermedad coronaria10,11. A pesar de los excelentes resultados demostrados, el proceso de inhibición en la proliferación de células endoteliales tiene como costo un retardo en la reendotelización del vaso y en la exposición prolongada del material metálico del stent a la luz vascular, con lo cual se eleva el riesgo de trombosis tardía y muy tardía del stent (TS)12 (tabla 1).
Tendencias y avances en intervención coronaria percutánea
| Balón angioplastia | Stents no medicados | Stents medicados | Absorb BVS® | |
| Década | 1980 | 1990 | 2000 | 2010 |
| Éxito agudo | 70-85% | >95% | >95% | >95% |
| Restenosis | 40-45% | 20-30% | <10% | <6,0% |
| Trombosis temprana < 30 días | 3-5% | 1-2% | 1-2% | 0% |
| Trombosis tardía >30 días | NA | <0,5% | <1% | 0,7-0,9% |
| Trombosis muy tardía (>1a) | NA | ≈ 0% | <1% | 0% |
En la actualidad se han hecho avances importantes en la tecnología de los SLF, nuevas aleaciones metálicas, fármacos, así como polímeros biocompatibles y biodegradables, con los cuales se ha logrado disminuir la aparición de trombosis del stent. A pesar de estos avances, aún no hay solución a otras limitaciones propias de estos dispositivos, tales como el contacto permanente del metal en la pared arterial, el riesgo potencial de neoaterosclerosis, la imposibilidad de anastomosar un puente arterial o venoso en el segmento tratado previamente limitando la revascularización quirúrgica, la alteración de la anatomía y fisiología normal de la arteria causada por la plataforma metálica, y la distorsión en imágenes no invasivas de las arterias coronarias (TAC multicorte y resonancia magnética nuclear de corazón) (tabla 2)13,14.
Debilidades de los stents coronarios
| • Restenosis - trombosis |
| • Implante permanente de un metal |
| • Stents largos o secuenciales impiden nuevos procedimientos |
| • Pueden interferir con interpretación de imágenes (TAC, RMN) |
| • Uso de terapia antitrombótica a largo plazo |
| • Alteran vasomotilidad y anatomía arterial |
| • Riesgo potencial de neoaterosclerosis |
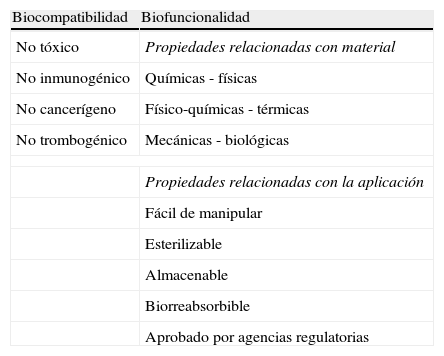
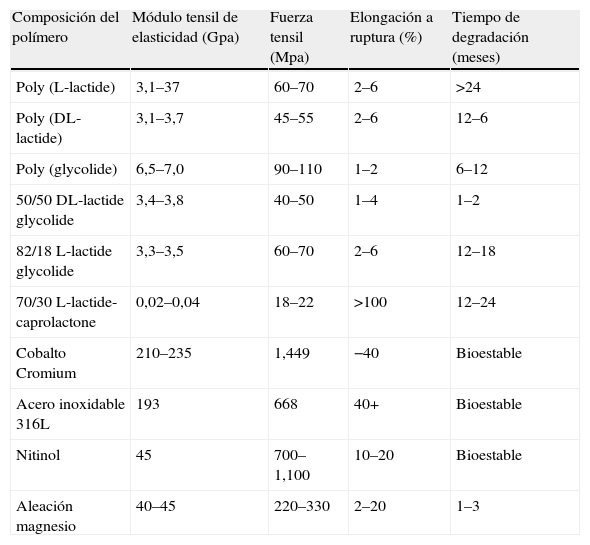
Hace varias décadas, vienen utilizándose materiales biorreabsorbibles principalmente en procedimientos quirúrgicos (tabla 3)15. Se han estudiado profundamente los diferentes tipos de biomateriales para identificar sus características de biocompatibilidad y biofuncionalidad con el objetivo de lograr mejores resultados clínicos (tablas 4 y 5)16. Los cardiólogos intervencionistas han tratado de obtener un dispositivo endovascular como plataforma completamente biorreabsorbible que actúe como andamio o soporte en la pared («scaffold») y que permita salvaguardar la permeabilidad inicial de las arterias, liberando el medicamento antiproliferativo en forma local y luego desaparezca, a fin de que la arteria restaure su integridad funcional, anatómica y fisiológica17.
Biopolímeros encontrados en animales, vegetales y microorganismos
| Protemas |
| Colágeno |
| Fibrina |
| Poliésteres hechos por microorganismos |
| Poly(β-R-Hidroxybutirato) o PHB |
| Poly(β-R-Hidroxy alkanoatos) o PHAs |
| Poly(β-R-Hidroxybutirato) o PHBPoly (β-R-ácido málico) |
| Polisacáridos |
| Celulosa |
| Alginatos |
| Dextranos |
| Heparina |
| Ácido hialurónico |
Criterios para tener en cuenta en la selección de biopolímeros
| Biocompatibilidad | Biofuncionalidad |
| No tóxico | Propiedades relacionadas con material |
| No inmunogénico | Químicas - físicas |
| No cancerígeno | Físico-químicas - térmicas |
| No trombogénico | Mecánicas - biológicas |
| Propiedades relacionadas con la aplicación | |
| Fácil de manipular | |
| Esterilizable | |
| Almacenable | |
| Biorreabsorbible | |
| Aprobado por agencias regulatorias | |
Propiedades mecánicas y tiempo de degradación de diferentes tipos de polímeros y metales
| Composición del polímero | Módulo tensil de elasticidad (Gpa) | Fuerza tensil (Mpa) | Elongación a ruptura (%) | Tiempo de degradación (meses) |
| Poly (L-lactide) | 3,1–37 | 60–70 | 2–6 | >24 |
| Poly (DL-lactide) | 3,1–3,7 | 45–55 | 2–6 | 12–6 |
| Poly (glycolide) | 6,5–7,0 | 90–110 | 1–2 | 6–12 |
| 50/50 DL-lactide glycolide | 3,4–3,8 | 40–50 | 1–4 | 1–2 |
| 82/18 L-lactide glycolide | 3,3–3,5 | 60–70 | 2–6 | 12–18 |
| 70/30 L-lactide-caprolactone | 0,02–0,04 | 18–22 | >100 | 12–24 |
| Cobalto Cromium | 210–235 | 1,449 | −40 | Bioestable |
| Acero inoxidable 316L | 193 | 668 | 40+ | Bioestable |
| Nitinol | 45 | 700–1,100 | 10–20 | Bioestable |
| Aleación magnesio | 40–45 | 220–330 | 2–20 | 1–3 |
Recientemente, las plataformas biorreabsorbibles se han anunciado como la «cuarta revolución», con la prestación de un nuevo tratamiento denominado terapia de restauración vascular 18. En consecuencia, las plataformas biorreabsorbibles son teórica y potencialmente una terapia más óptima para el tratamiento de la enfermedad coronaria (tabla 6).
Ventajas de las plataformas biorreabsorbibles
| • Evitan el fenómeno: «full metal jacket» |
| • Permiten soporte mecánico («scaffoldings») en el periodo de recuperación del trauma vascular |
| • Evitan complicaciones del implante de stents permanentes: remodelación y reacción a cuerpo extraño |
| • Permiten restauración de motilidad y anatomía vascular |
| • No interfieren con técnicas de imágenes (TAC, RMN) |
| • Reducen o eliminan TS tardía |
| • Permiten nuevas y repetidas opciones terapéuticas locales |
En los últimos diez años los investigadores y los recursos económicos de muchas compañías se han enfocado en el desarrollo de nuevos dispositivos totalmente absorbibles. Hoy se cosechan los resultados de estos esfuerzos y la tecnología ha madurado, por lo que existe un número no despreciable de plataformas en desarrollo y algunas ya disponibles para ser sometidas a diferentes ensayos preclínicos y clínicos.
Para entender la terapia de restauración vascular, es preciso recordar los primeros dispositivos coronarios que usaron material con características biodegradables, los cuales incluían una capa de polímero sobrepuesto en una plataforma metálica. El primer prototipo polimérico (no bioabsorbible de polietileno-tereftalato) fue una malla trenzada diseñada en 199219. En 1996, van der Giessen et al., introdujeron la endoprótesis vascular Wiktor, revestida con cinco polímeros diferentes completamente bioabsorbibles20. El estudio experimental mostró una reacción inflamatoria excesiva de la pared del vaso y la consecuente proliferación neointimal y formación de trombos. Un año más tarde, Lincoff et al., informaron del primer stent recubierto de ácido-L-poliláctico (PLLA 321 kDa), que en contraste con el de bajo peso molecular (80 kDa), parecía ser bien tolerado por la pared arterial21. No obstante, Yamawaki et al., fueron los primeros en desarrollar una plataforma totalmente biorreabsorbible, conformada por ácido-L-polilactide (PLLA) y un inhibidor de la tirosina quinasa. La evaluación del dispositivo en modelos porcinos demostró la seguridad y eficacia del dispositivo y apoyó su implante en seres humanos en 1998.
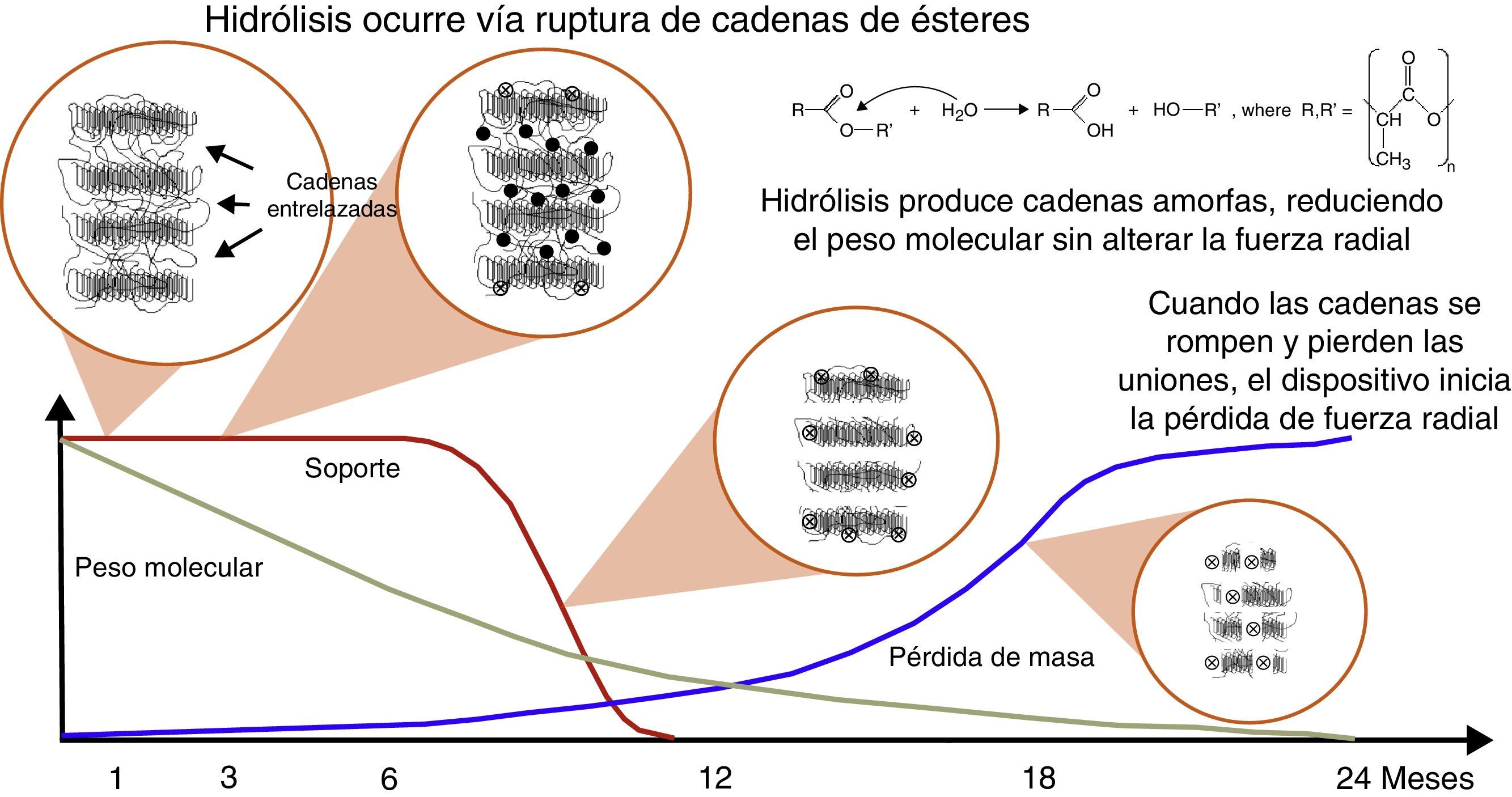
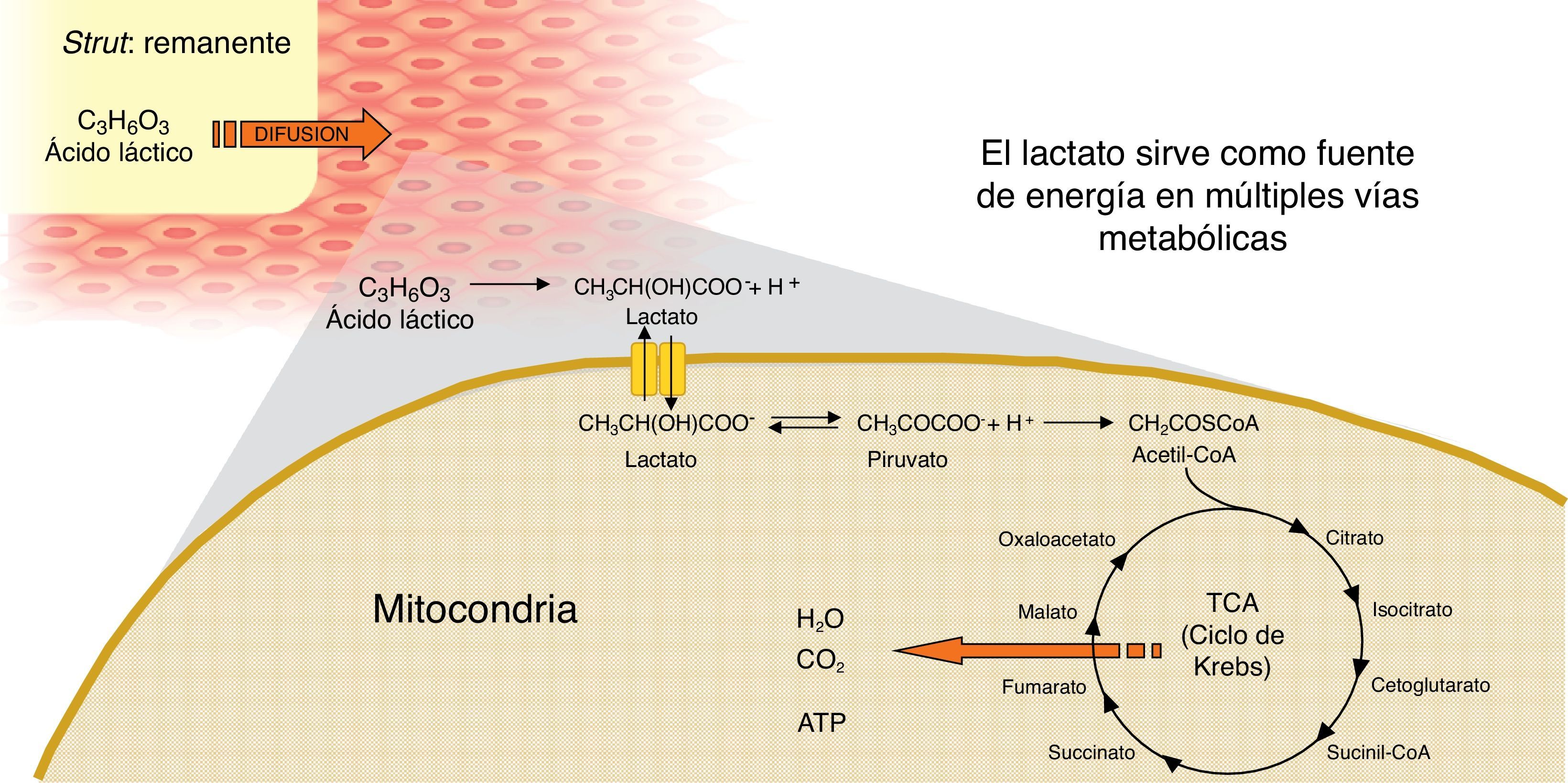
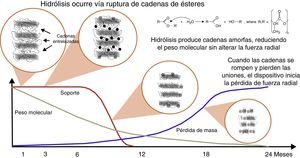
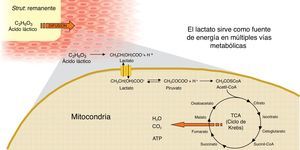
La mayoría de las plataformas biorreabsorbibles disponibles en la actualidad, por ejemplo la Igaki-Tamai Scaffold, y la Absorb bioreabsorbible vascular scaffold (BVS), se componen de PLLA, cuyo catabolismo se produce en cinco etapas, con el resultado final de la degradación total del polímero en dióxido de carbono y agua (fig. 1)15. La primera fase incluye la hidratación del polímero, con la absorción de agua de los tejidos circundantes. El agua cataliza la ruptura de cadenas en el enlace éster, lo cual conduce a la degradación del polímero (segunda etapa). Poco a poco, el polímero pierde su fuerza de cohesión y se forman fragmentos con un peso molecular inferior (tercera etapa). Las cadenas poliméricas se vuelven progresivamente hidrófilas a través de hidrólisis. Los resultados del proceso son monómeros hidrofílicos que pueden ser fagocitados por los macrófagos locales (cuarta fase). Después de la fagocitosis, el monómero soluble (L-lactato) se cataboliza en piruvato y en última instancia a dióxido de carbono y agua a través del ciclo de Krebs (quinta etapa) (fig. 2)22.
La tirosina policarbonato es otro polímero utilizado en la tecnología de plataformas biorreabsorbibles (BRS-REVA). Su catabolismo incluye la hidrólisis del polímero a dióxido de carbono y ésteres de etilo yodo-desaminotirosil-tirosina, que son hidrolizados a etanol y yodo-desaminotirosil-tirosina. La ruptura de los últimos componentes en moléculas de tirosina y yodo-desaminotirosina, que son catabolizadas en dióxido de carbono y agua a través del ciclo de Krebs.
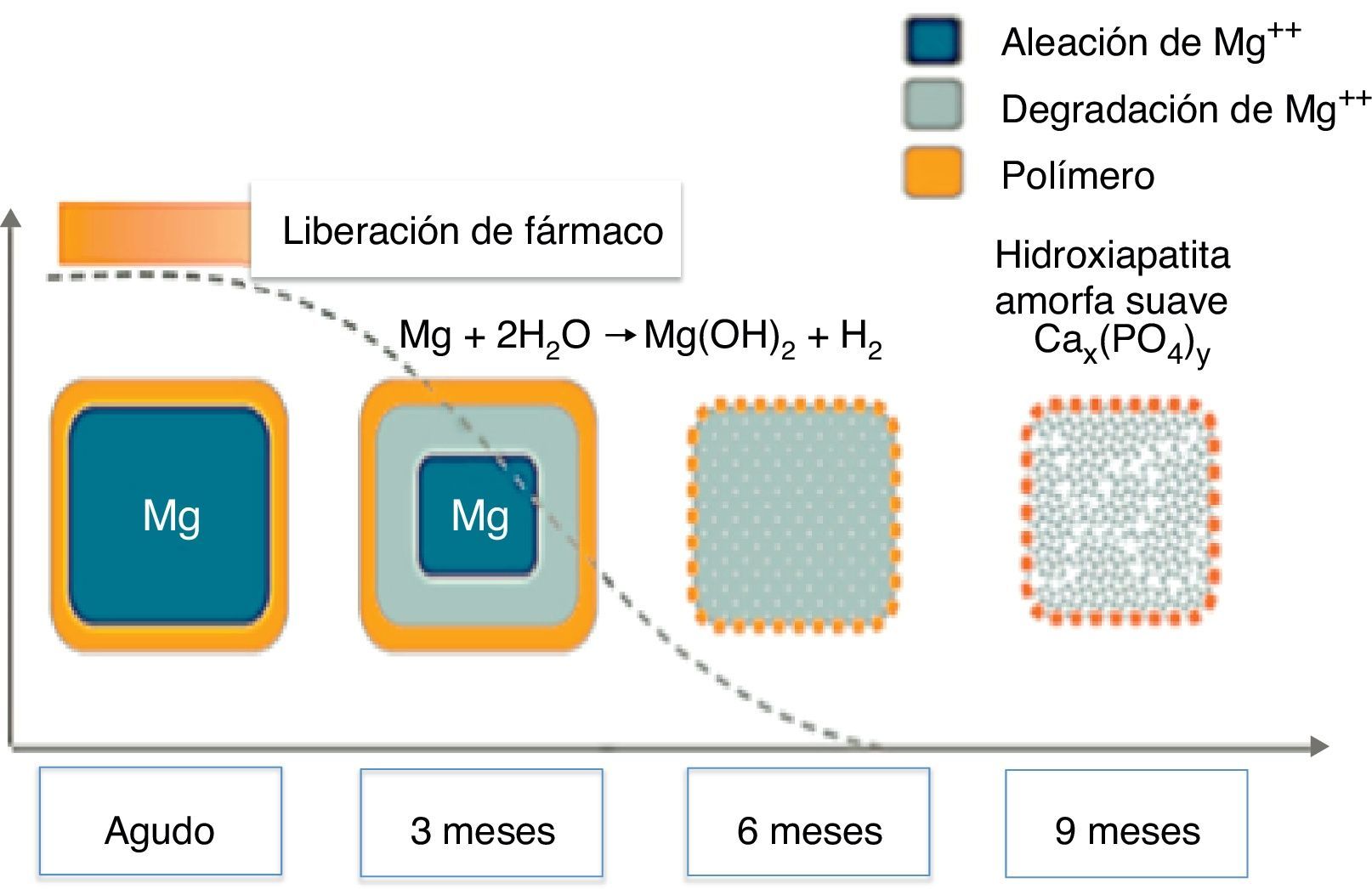
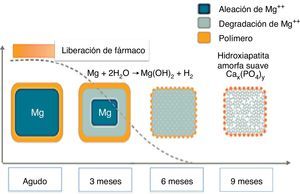
El magnesio es otro material utilizado en plataformas biorreabsorbibles. Es el único metal que se ha implementado con éxito en esta tecnología, conformando un stent metálico absorbible. Una limitación es su fragilidad, de ahí que haya sido mezclado con varios elementos, tales como circonio, itrio y otros metales raros que le proporcionan una resistencia radial adecuada. Una ventaja de las plataformas de magnesio es el hecho de que la degradación de la aleación a sales inorgánicas induce una respuesta inflamatoria menor y crea una carga electronegativa que tiene un efecto antitrombótico (fig. 3)23.
Plataformas biorreabsorbibles disponibles en la actualidadEn la actualidad hay más de catorce plataformas biorreabsorbibles disponibles (fig. 4). La mayoría se encuentran en evaluación preclínica o para ser examinadas en el contexto clínico. Sin embargo, dos de ellas ya han adquirido certificado de la Comunidad Europea (CE Mark), y se utilizan en la práctica clínica: Igaki-Tamai® para el tratamiento de la enfermedad vascular periférica y Absorb BVS® para enfermedad coronaria.
Plataforma biorreabsorbible Igaki-Tamai®Esta plataforma fue el primer dispositivo completamente biorreabsorbible implantado en seres humanos y compuesto de PLLA. La primera versión tenía un diseño en zigzag helicoidal, y se montó en un balón de angioplastia estándar. La expansión del dispositivo se llevaba a cabo con el uso de medio de contraste climatizado (hasta 70°C). El dispositivo continuaba expandiéndose después de su implante en un período de veinte a treinta minutos, hasta llegar a sus dimensiones finales.
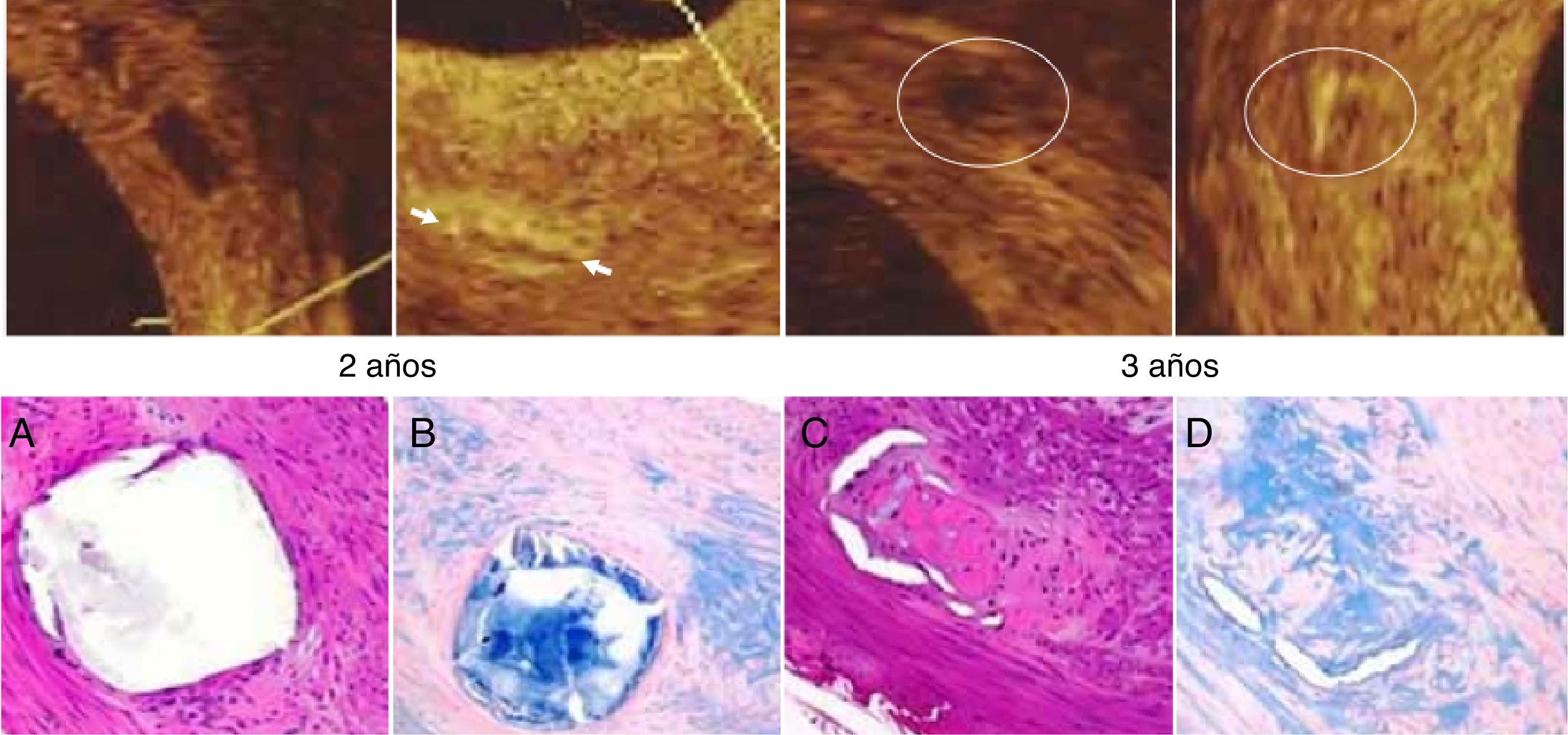
El primer estudio clínico (FIM) con la Igaki-Tamai® incluyó 15 pacientes tratados con 25 dispositivos, no mostró eventos adversos cardiovasculares mayores (MACE) en los primeros treinta días y solo un caso de TLR a seis meses de seguimiento24. En el seguimiento angiográfico a los tres meses, el diámetro luminal mínimo disminuyó (1,88±0,59mm), con una progresión mínima a partir de entonces, a los seis meses de seguimiento (1,84±0,66mm). Nishio et al., informaron el seguimiento a largo plazo (diez años) de un estudio prospectivo observacional en el que participaron 50 pacientes (63 lesiones), a quienes les implantaron 84 plataformas biorreabsorbibles Igaki-Tamai®25. Después de diez años las tasas de supervivencia libre de eventos de todas las causas de muerte, muerte cardíaca y MACE fueron 87, 98 y 50%, respectivamente, mientras que la tasa de TLR fue del 16, 18 y 28%, a uno, cinco y diez años, en su orden. Desde el punto de vista angiográfico, la pérdida luminal tardía (LLL) fue de 0,91±0,69mm a los seis meses, lo que mejoró a 0,67±0,45mm a un año, y se mantuvo a los tres años de seguimiento (0,59±0,50mm). El ultrasonido intravascular (IVUS) mostró una reducción en el área luminal mínima a los seis meses (a partir de 5,44±1,89mm2 después de la colocación de la plataforma a 3,64±1,68mm2), que comenzó a aumentar en uno (4,06±1,61mm2) y tres años (5,18±2,09mm2)26.
Aunque a corto y largo plazo los resultados de seguimiento fueron alentadores, este dispositivo no pudo progresar debido principalmente a la necesidad de catéteres guía con mayor diámetro (8F) para su implante, así como porque el contraste «climatizado» utilizado para el despliegue del dispositivo podía causar lesión vascular. La nueva generación Igaki-Tamai® disponible, supera potencialmente estas dificultades, ya que es compatible con catéter guía 6F sin necesidad de un agente de contraste climatizado. Hoy el dispositivo está en evaluación preclínica en Alemania.
Plataforma biorreabsorbible Absorb BVS®Absorb BVS® (Abbott Vascular, Santa Clara, EE. UU.) tiene una cadena principal compuesta por PLLA, y está recubierta con un polímero de poli-D-L-láctico (PDLA) que contiene everolimus, medicamento antiproliferativo y modulador de la respuesta inmune (fig. 5)27.
La primera generación de Absorb BVS® (1.0) fue examinada en la cohorte A del ABSORB Trial, cuyo objetivo fue evaluar su viabilidad y seguridad en pacientes con lesiones coronarias únicas de novo. Para ello se reclutaron treinta pacientes con angina estable, inestable o isquemia silente28. La incidencia acumulada estimada de MACE fue del 3,3%, con solo un paciente que tuvo infarto del miocardio sin onda Q y no TLR a un año de seguimiento. No se reportaron más eventos entre uno y cinco años de seguimiento.
Desde el punto de vista angiográfico, la pérdida luminal tardía no fue diferente entre el seguimiento de seis meses y dos años (0,44±0,35mm y 0,48±0,28mm, respectivamente). El IVUS mostró una reducción en el área de la luz entre el inicio y el seguimiento (6,04±1,12mm2 al comienzo del estudio en comparación con 5,19±1,33mm2 a los seis meses y 5,47±2,11mm2 a los dos años), que se atribuyó en parte a la contracción de la plataforma (6,94±1,70mm2 inmediatamente después del procedimiento y 6,29±1,47mm2 a los seis meses de seguimiento). Ante este inconveniente, el dispositivo fue rediseñado y la nueva versión tuvo una distribución más uniforme que proporcionaba mayor fuerza radial a la pared del vaso29.
La segunda generación de BVS, el Absorb BVS® (1.1) se puso a prueba en el ABSORB Cohort B Trial (fig. 6), en un total de 101 pacientes (102 lesiones) tratados con Absorb BVS 3,0mm x 18mm. En este estudio los Absorb BVS se dividieron en dos grupos: cohorte B1 y B230. La cohorte B1 tuvo exámenes invasivos de seguimiento (angiografía coronaria cuantitativa –QCA–, IVUS y OCT) a los seis meses y dos años, mientras que la cohorte B2 tuvo las mismas investigaciones en uno y tres años. La TAC multicorte coronaria se realizó en ambos grupos a los dieciocho meses de seguimiento. La tasa de MACE en los 101 pacientes fue de 9,0% (3 infartos del miocardio sin onda Q, 6 TLR guiada por isquemia) a los dos años de seguimiento. En la cohorte B1, el análisis de QCA demostró una pérdida luminal tardía de 0,19±0,18mm a seis meses, y de 0,27±0,20mm en dos años de seguimiento31. Los exámenes de IVUS realizados en 33 pacientes demostraron que el área luminal mínima se reducía a los seis meses (a partir de 5,45±1,08mm2 después del procedimiento a 5,12±1,01mm2), sin cambios a dos años (5,13±1,25mm2), mientras que el área de la luz media y la de la plataforma disminuyó a los seis meses (de 6,53±1,24mm2 posprocedimiento a 6,36±1,18mm2 y de 6,53±1,23mm2 posprocedimiento a 6,42±1,17mm2, respectivamente), y luego aumentaron a los dos años (6,85±1,78mm2 y 7,08±1,73mm2, respectivamente).
Hoy está en desarrollo el ABSORB II, un ensayo clínico aleatorizado, controlado, simple ciego y multicéntrico, cuyo objetivo es comparar las plataformas biorreabsorbibles Absorb BVS® de segunda generación con el stent XIENCE V® (SLF). Aproximadamente 501 sujetos de cuarenta centros de investigación de toda Europa y Nueva Zelanda, con lesiones en arterias coronarias nativas, con un diámetro luminal entre 2,25 y 3,8mm según QCA y longitud ≤48mm, serán reclutados de forma aleatoria. El seguimiento clínico se ha previsto a 30 y 180 días y en uno, dos y tres años. Todos los sujetos serán sometidos a una coronariografía, IVUS e histología IVUS-virtual y seguimiento angiográfico a dos años de seguimiento. El objetivo principal es demostrar la superioridad de esta plataforma biorreabsorbible sobre el XIENCE V® en términos de reactividad vascular del segmento tratado a los dos años, y el diámetro luminal mínimo evaluado por QCA, también a los dos años.
Aparte de las cohortes A y B del ABSORB en curso, están en marcha otros ensayos clínicos: ABSORB EXTEND, ABSORB II, ABSORB III, ABSORB Japón, ABSORB China y ABSORB First. Pretenden evaluar, en cerca de 15.000 pacientes, el comportamiento del BVS en diferentes condiciones clínicas del mundo real y condiciones étnicas alrededor del mundo.
Otros dispositivos en investigaciónPlataforma biorreabsorbible de magnesioEl AMS® (Biotronik, Berlín, Alemania) tiene un diseño tubular, expandible con balón, con ranuras en los struts, esculpidas por láser en un tubo de aleación de magnesio. El dispositivo tiene una resistencia mecánica similar a la de otros stents metálicos. En la primera generación de AMS 1.0, el proceso de resorción estaba casi terminado a los dos meses después del implante, lo que resultó en un retroceso del vaso. Para hacer frente a esta limitación, la plataforma fue rediseñada, y en la última versión (AMS, DREAM 2.0) el proceso de resorción se prolongó hasta los seis meses.
La eficacia de la primera generación del AMS fue validada en el estudio PROGRESS-AMS, un ensayo aleatorizado, multicéntrico que incluyó 63 pacientes con lesiones de novo con longitud de 10-15mm y diámetros de 3,0-3,5mm32. Durante un período de cuatro meses hubo una incidencia de TLR del 23,8%, asociada a pérdida luminal tardía alta (1,08±0,49mm). De cuatro a doce meses, solo un paciente sufrió TLR, lo que se tradujo en una incidencia acumulada de MACE a los doce meses del 26,7%. Estos resultados se atribuyeron a la proliferación neointimal y al retroceso del vaso, causados por la reducción prematura de la fuerza radial. Para superar estas limitaciones, la compañía agregó paclitaxel y cambió el diseño de la plataforma y la composición de la aleación de magnesio, a fin de proporcionar un aumento de la fuerza radial y una prolongación del proceso de resorción. La eficacia de los nuevos diseños se evaluó en el ensayo Biosolve-1, prospectivo, multicéntrico, en el que incluyeron 46 pacientes con lesión de arteria coronaria única de novo, y les fueron implantadas 47 plataformas biorreabsorbibles de magnesio33. A un año de seguimiento, la tasa de MACE fue del 7% (dos por TLR y uno por infarto del miocardio).
Los dispositivos de segunda generación (DREAMS 2.0) incorporan una plataforma biorreabsorbible de magnesio con liberación de sirolimus en lugar de paclitaxel. La evaluación preclínica del dispositivo reveló disminución de la inflamación y tasa de endotelización más alta en comparación con la versión anterior. Sin embargo, su evaluación está en curso con el fin confirmar estos resultados positivos en el ámbito clínico y examinar su seguridad y eficacia en el tratamiento de la enfermedad coronaria.
Plataforma biorreabsorbible REVA®REVA® (Reva Medical Inc., San Diego, CA, EE. UU.) se construye mediante un polímero de policarbonato derivado de tirosina. La primera plataforma biorreabsorbible REVA® tenía un mecanismo de deslizamiento y bloqueo distintivo que proporcionaba una fuerza radial robusta para el dispositivo una vez implantado34. El rendimiento a largo plazo (55 meses) de la primera generación se informó en un modelo porcino, en el que se mostró un aumento gradual en el área de la luz (86%±23% a cinco días, 94%±10% a doce meses y 114%±23% a 55 meses)35.
El rendimiento clínico de este dispositivo de primera generación se evaluó en el estudio RESORB, en el que se incluyeron 25 pacientes con lesiones individuales de novo. Desde el punto de vista angiográfico, el diámetro luminal mínimo aumentó de 0,88±0,39mm a 2,76±0,36mm después del despliegue del dispositivo, lo que significó una ganancia aguda similar a la reportada con los stents metálicos actuales. Sin embargo, se observó una tasa alta de TLR entre cuatro a seis meses de seguimiento, atribuida principalmente a fallas mecánicas centrales que condujeron al rediseño de la plataforma36.
El ReZolve es la segunda versión REVA®; tiene un diseño en tobogán con mecanismo en espiral y de bloqueo, y contiene además sirolimus. En la actualidad la nueva generación está en evaluación clínica en el estudio RESTORE (ReZolve sirolimus scaffold coronario bioabsorbible), que tiene como objetivo investigar su seguridad y eficacia en cincuenta pacientes. Los objetivos principales son TLR isquémica a seis meses, y mediciones cuantitativas (QCA e IVUS) a doce meses. Al mismo tiempo se ha iniciado un estudio piloto que pretende aplicar para la aprobación del marcado CE.
Plataforma biorreabsorbible DESolve®DESolve® (Elixir Medical Corporation, Sunnyvale, CA, EE. UU.) se compone de un polímero de PLLA y contiene dos fármacos antiproliferativos nuevos (novolimus y myolimus). La fuerza radial del dispositivo es comparable con la del stent metálico Elixir®, y su proceso de resorción tarda aproximadamente dos a tres años37.
Tanto la seguridad como la eficacia de esta plataforma se evaluaron en un ensayo clínico multicéntrico prospectivo que incluyó pacientes con lesiones únicas de novo, con un diámetro de referencia del vaso de 3mm y una longitud de 10mm. En la actualidad se han reclutado diecisés pacientes. Entre 30 días y 180 días de seguimiento ocurrió un TLR, mientras que no hubo muerte cardiaca, infarto del miocardio y trombosis del stent a seis meses; la QCA reveló una pérdida luminal tardía de 0,19±0,19mm a seis meses de seguimiento.
De otra parte, el ensayo Pivotal DESolve NX II ha sido diseñado para evaluar la eficacia del dispositivo en un mayor número de pacientes a fin de proporcionar evidencia suficiente para la aprobación del marcado CE y se espera que comience su fase de reclutamiento38.
Plataforma biorreabsorbible BioStent Ideal®El BioStent Ideal® (Xenogenics Corp., Canton, MA, EE. UU.) es totalmente biorreabsorbible, expandible con balón. Consta de una estructura de anhídrido poliláctido y un trímero de dos moléculas de ácido salicílico unidos por ácido sebácico, mientras que la parte de la capa superior se compone de salicilato y sirolimus. Los estudios preclínicos han demostrado las propiedades antiinflamatorias y antiplaquetarias del salicilato, que parecen reducir la restenosis y promover la curación del vaso durante la degradación del polímero39.
La primera generación (BTI) se examinó en el estudio WHISPER. La nueva versión del dispositivo (BioStent Ideal) tiene mayor dosis de fármacos y una cinética más lenta de liberación del medicamento. Esta nueva generación se encuentra actualmente en evaluación preclínica, y se planea el inicio de los ensayos clínicos en un futuro próximo.
Plataforma biorreabsorbible ART®ART® (Tecnologías de la remodelación arterial, Noisy le Roi, Francia), consiste en una plataforma totalmente hecha de un polímero amorfo de PLLA, sin ningún tipo de fármaco antiproliferativo. El nuevo dispositivo fue nombrado ART18Z. Más de 250 dispositivos han sido implantados en modelos porcinos, sin MACE reportados40. El desempeño de esta plataforma está actualmente en investigación en el ámbito clínico, en el estudio ARTDIVA, que se inició en cinco centros clínicos en el tercer trimestre del año 2012.
Plataforma biorreabsorbible Amaranto®Amaranto® (Amaranto Medical Inc, Mountain View, CA, EE. UU.) se fabricó de PLLA. Su integridad estructural dura de tres a seis meses, y el proceso de reabsorción requiere aproximadamente de uno a dos años41. Un informe reciente evaluó su desempeño en modelos porcinos en comparación con el stent Liberté® (Boston Scientific, Natick, MA, EE. UU.). Se reportó una pérdida luminal tardía similar en 28 y 90 días de seguimiento. Hoy la compañía diseña el estudio FIM, que reclutará treinta pacientes con el fin de evaluar la seguridad y eficacia de Amaranto®, con un plan para la realización de un estudio prospectivo, multicéntrico y la aprobación del marcado CE.
Plataforma biorreabsorbible Xinsorb®Xinsorb® (Hua Biotecnología Co, Ltd, Hangzhou, Zhejiang, República Popular de China) es una plataforma totalmente biorreabsorbible, liberadora de sirolimus, que consiste en poli (ácido aspártico-co-lactide), poli (¿-caprolactona) y poliglicólico. El dispositivo es expandible mediante balón, y tiene marcadores radioopacos para facilitar su despliegue. Su tamaño va desde 2,75 hasta 4,0mm de diámetro, y de 12 a 28mm de longitud. Se espera que el ensayo FIM se conduzca próximamente y se conozcan los resultados del mismo.
Tecnologías SB Acute®Las plataformas biorreabsorbibles Acute® (OrbusNeich, Fort Lauderdale, FL, EE. UU.) son un tubo en forma de cerradura y plataformas biorreabsorbibles expandibles con balón. El dispositivo consta de tres materiales poliméricos (poli-L-lactida-co-¿-caprolactona, PDLA y PLLA) e incorpora una tecnología de recubrimiento con particiones, que permite que sea cubierto por sirolimus en forma abluminal y capture células progenitoras del endotelio luminal (anticuerpos +CD34). Evaluaciones preclínicas preliminares demostraron el implante óptimo del dispositivo sin evidencia de fractura42. Se espera que en los próximos meses se presenten los datos actualizados.
Plataforma biorreabsorbible MeRes®MeRes® (Meril Life Sciences, Vapi, Gujarat, India) libera merilimus. El dispositivo se compone de una nueva formulación de PLA y tiene una estructura de geometría híbrida, lo que le da alta resistencia radial. Los resultados iníciales mostraron que la liberación de merilimus dura más de treinta días, sin evidencia de reacción inflamatoria durante la biodegradación41.
Plataforma biorreabsorbible FADES®FADES® (Zorion Médico, Indianapolis, IN, EE. UU.) es un dispositivo totalmente biorreabsorbible liberador de fármaco. El polímero consiste en un material híbrido de aleación de magnesio que incluye elementos raros y PLGA. Los estudios preclínicos demostraron que el dispositivo fue completamente absorbido con poca o ninguna respuesta inflamatoria del tejido dentro de noventa días41. Se requieren evaluaciones preclínicas antes de la conducción de un estudio FIM.
Otras plataformas biorreabsorbiblesExisten tres dispositivos en desarrollo preclínico: SS Avatar® (S3V Vascular Technologies, Bangalore, Karnataka, India), Sahajanand® (Tecnologías Sahajanand Médica, Surat, Gujarat, India) y Stanza® (480 Biomédica, Boston, Massachusetts, EE. UU.).
Ventajas y limitaciones de las plataformas biorreabsorbiblesCon la experiencia obtenida hasta el momento se ha logrado identificar una serie de ventajas de las plataformas biorreabsorbibles, útiles en la toma de decisiones en caso de ser consideradas como una opción terapéutica (tabla 6). Entre ellas sobresale que evitan el fenómeno de implante de varios stents metálicos en un segmento largo de una arteria coronaria («full metal jacket»), y permiten un soporte mecánico (scaffolding) durante el periodo de recuperación del trauma vascular y la restauración de la anatomía y motilidad vascular43.
De la misma manera, las plataformas biorreabsorbibles poseen limitaciones (tabla 7) que hacen que esta tecnología esté en un proceso de maduración y crecimiento. Entre ellas figuran la pérdida de fuerza radial en pocos meses, la pobre visibilidad a los rayos X durante el implante, la aposición incompleta de algunos struts y el uso frecuente de ayudas con imágenes intracoronarias como soporte para la optimización de su implante22.
Limitaciones de las plataformas biorreabsorbibles
| • Pérdida de acción mecánica temprana: permitiendo remodelación vascular negativa (6 meses) |
| • Pobre visibilidad a los rayos X |
| • Sensibilidad al calor y solventes: limitan adhesión de fármacos |
| • Struts delgados podrían perder la fuerza radial |
| • Mala aposición de struts es más frecuente |
| • Posible microembolización de partículas-efecto microvascular |
| • Riesgo de fractura de struts |
| • Reducida flexibilidad |
En vista de los grandes avances en la tecnología y el conocimiento de los materiales de las plataformas biorreabsorbibles y su comportamiento en el organismo humano, se abre un panorama enorme de posibilidades para desarrollar dispositivos endovasculares para la prevención y tratamiento de las enfermedades cardiovasculares, tales como nuevas plataformas para el tratamiento de lesiones complejas, estabilización y regresión de placa aterosclerótica de alto riesgo de ruptura, dispositivos para el tratamiento de la estenosis de la arteria pulmonar44, manejo de patologías benignas del esófago45 y tratamiento de la enfermedad vascular periférica24.
ConclusiónLas plataformas biorreabsorbibles introducen un potencial único en el tratamiento de lesiones coronarias, ya que proporcionan un soporte arterial temporal y luego desaparecen, permitiendo así la restauración de la fisiología de la pared del vaso y su función vasomotora. Resultados preclínicos y clínicos iniciales parecen prometedores. Sin embargo, se debe mencionar que los datos clínicos están limitados a lesiones simples y no hay evidencia contundente en el contexto de ensayos aleatorios de control que permita comparar la eficacia de dichas plataformas con la de la nueva generación de SLF. Por otra parte, la tecnología de las plataformas tiene limitaciones importantes, tales como la naturaleza voluminosa de los dispositivos, preocupaciones acerca de un mayor riesgo de restenosis, y riesgo de fractura del material, que limitan sus aplicaciones en la práctica clínica actual.
Las sociedades científicas, entre ellas el Colegio Colombiano de Hemodinamia e Intervencionismo Cardiovascular, trabajan en la realización de «consensos» para definir las posibles indicaciones, contraindicaciones y demás recomendaciones para el uso adecuado de «scaffolds» en nuestros pacientes, acordes con la evidencia científica disponible.
FinanciaciónLos autores expresan no haber recibido subsidios ni ayuda financiera de la industria o de cualquier otra fuente para la elaboración de este manuscrito.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.