La evidencia actual es limitada para determinar el impacto del uso de los inhibidores de la enzima convertidora de angiotensina (IECA) en la predisposición al empeoramiento de la enfermedad del coronavirus 2019 (COVID-19). Inicialmente se reportó que en los pacientes con progresión grave de la COVID-19 existía una mortalidad elevada, los cuales tenían antecedentes de hipertensión arterial, diabetes mellitus, enfermedad cardiovascular y enfermedad renal crónica. Parte de estos pacientes también tenía en común que utilizaban IECA, lo cual alertó a la comunidad médica sobre su riesgo potencial en coexistencia con COVID-19. Sin embargo, estudios más recientes de casos-controles encontraron que los inhibidores del sistema renina-angiotensina, incluyendo los IECA, no incrementan el riesgo de COVID-19 o de requerir admisión hospitalaria por esta causa. Diferentes revistas científicas han facilitado el acceso a reportes preliminares, dejando a discreción de la comunidad médica y científica hacer uso de dicha información para promover el desarrollo de estudios que confirmen experimentalmente dichos hallazgos, preclínicos y epidemiológicos, que finalmente impacten en las decisiones de la práctica clínica para beneficiar a los pacientes con COVID-19. En esta revisión de la literatura se exploran los diferentes efectos mediados por los IECA que podrían estar relacionados con la respuesta inmune durante la infección y la transmisión de COVID-19, compilando evidencia disponible que evalúa si en realidad representan un riesgo o si, por el contrario, confieren un efecto protector.
There is limited evidence for determining the impact of the use of angiotensin converting enzyme inhibitors (ACE-I) in the tendency to worsening of coronavirus-19 disease (COVID-19). It was initially reported that, in patients with serious progression of COVID-19, there was an increased mortality in those that had a history of suffering arterial hypertension, diabetes mellitus, cardiovascular disease, and chronic kidney disease. A proportion of these patients also had in common that they used ACE-I, which alerted the medical community on the potential risk in coexisting with COVID-19. However, in more recent case-control studies, they found that inhibitors of the renin-angiotensin system, including ACE-I, does not increase the risk of COVID-19 or require hospital admission due to this cause. Several scientific journals have provided access to preliminary reports, leaving the use of such information at the discretion of the medical and scientific community for promoting the development of studies that might confirm these preclinical and epidemiological findings experimentally. These may finally have an impact on the clinical practice decisions, in order to benefit patients with COVID-19. In this literature review, the different effects mediated by ACE-I that could be related to the immune response during the infection and transmission of COVID-19 are examined, gathering available evidence that evaluates whether, in reality, they represent a risk or if on the other hand, they confer a protector effect.
La evidencia actual es limitada para determinar el impacto del uso como antihipertensivo de los inhibidores de la enzima convertidora de angiotensina (IECA) en la predisposición al empeoramiento de la enfermedad del coronavirus 2019 (COVID-19)1, la cual es causada por el virus del síndrome respiratorio agudo coronavirus2 (SARS-CoV-2) o nuevo coronavirus (2019-nCoV)2. La actual pandemia asociada a COVID-19ha mostrado una tasa de mortalidad estimada cambiante que se asocia a la edad como principal factor de riesgo y como resultado del síndrome respiratorio agudo3. Al respecto, inicialmente se reportó que en los pacientes con progresión grave de la COVID-19 existía una tasa cruda de mortalidad elevada en quienes tenían antecedentes de sufrir de hipertensión arterial (HTA), diabetes mellitus tipo 2 (DB2), enfermedad cardiovascular (ECV) y enfermedad renal crónica (ERC)4. Parte de estos pacientes también tenían en común que para el tratamiento de dichas comorbilidades utilizaban IECA, lo cual alertó sobre su riesgo potencial en coexistencia con COVID-191. La principal variable de confusión a considerar en dichos estudios era el incremento de la prevalencia de estas comorbilidades en la edad avanzada5. A pesar de que estos estudios no tomaron en consideración esta y otras variables de confusión que pudieron contribuir a la predicción del riesgo de mortalidad, otros estudios sugieren que es plausible una relación entre el mecanismo fisiopatológico asociado a COVID-19 que pueda estar influenciada por el sistema renina-angiotensina-aldosterona (SRAA)1.
Las principales funciones del SRAA son el control de la presión arterial y la homeostasis vascular6. Adicionalmente, estudios recientes en el contexto de la respuesta del microambiente tumoral sugieren que el potencial efecto inmunomodulador de los IECA podría actuar de manera directa o indirecta sobre los componentes del eje convencional y alternativo del SRAA7. Por lo tanto, el objetivo de esta revisión de la literatura es explorar los diferentes efectos mediados por los IECA que podrían estar relacionados con la respuesta a la infección y transmisión de la COVID-19.
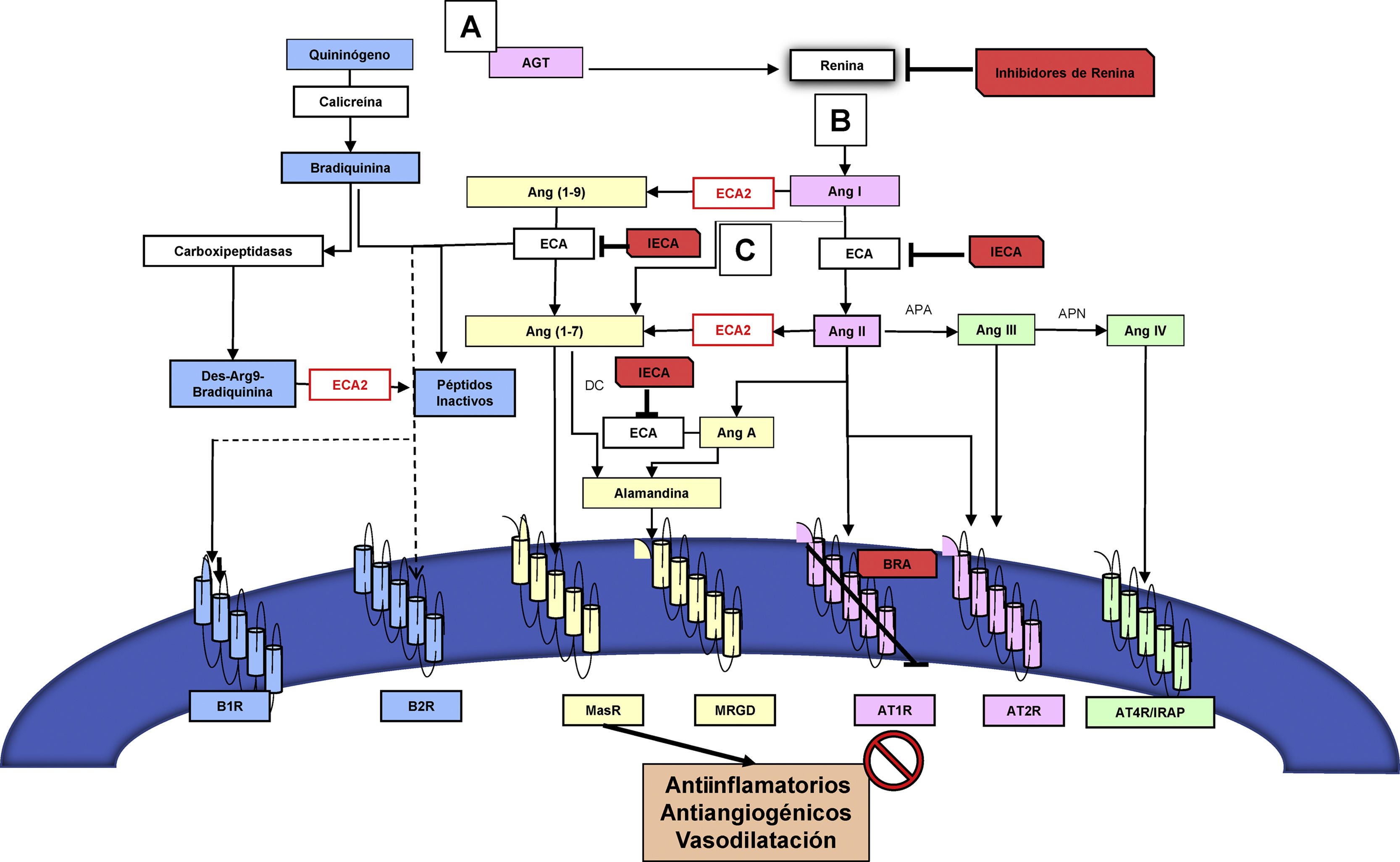
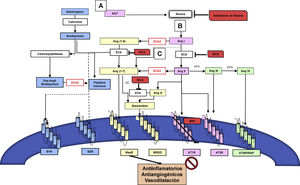
Interacción entre el eje convencional y alternativo del sistema renina-angiotensinaLos principales componentes del eje convencional del SRAA funcionan como una red intrincada de reacciones enzimáticas moduladas por la producción y degradación de péptidos, tales como: angiotensinógeno (AGT), renina, enzima convertidora de la angiotensina (ECA), angiotensina I (Ang I), angiotensina II (Ang II), a través de diversos receptores6. Dentro de la cascada de activación del eje convencional se encuentran el receptor de Ang II tipo 1 (AT1R) y el receptor de Ang II tipo 2 (AT2R)6. El AGT es producido por el hígado y liberado al torrente sanguíneo. Posteriormente, es hidrolizado por la renina, la cual es producida por las células yuxtaglomerulares del riñón para formar finalmente Ang I. Posteriormente, la Ang I es hidrolizada por la ECA que se encuentra en las células endoteliales pulmonares para producir Ang II. Este es el principal efector del SRA capaz de interactuar con los dos receptores previamente mencionados6. Otros péptidos biológicamente activos, como angiotensina III (Ang III)8, angiotensina IV (Ang IV)9 y angiotensina-(1-7) (Ang-(1-7))6, se consideran efectores secundarios de menor potencia comparados con Ang II. Por ejemplo, Ang III tiene afinidad por los mismos receptores que Ang II, y al remover el aminoácido arginina de su extremo N-terminal origina Ang IV9. Similar a la Ang II, el efecto mediado por la unión de Ang IV a su receptor de Ang IV (AT4R) se inicia en las células endoteliales del pulmón incrementando la liberación de óxido nítrico (NO)9. Además, la Ang II estimula la liberación de aldosterona por la corteza de la glándula suprarrenal10, y la ECA inactiva la bradiquinina (BK)10 (fig. 1).
Eje convencional y alternativo del SRA y sus interacciones con el sistema calicreína-cinina. El angiotensinógeno (AGT) es producido y liberado a la circulación por el hígado (A); luego es hidrolizado por la renina, la cual es producida por las células yuxtaglomerulares del riñón (B) para así formar la angiotensina I (Ang I). La Ang I es hidrolizada por la enzima convertidora de angiotensina (ECA) en las células endoteliales de los pulmones (C), para producir finalmente el péptido activo angiotensina II (Ang II). La Ang II interactúa con dos tipos de receptores: receptores de angiotensina II tipo 1 (AT1R) y tipo 2 (AT2R) (en rosado). La enzima convertidora de angiotensina 2 (en rojo) realiza el clivaje de Ang II generando tanto angiotensina-(1-7) (Ang-(1-7), como angiotensina (1-9) (Ang-(1-9). Ang-(1-7) comúnmente actúa vía del receptor de ensamblaje mitocondria (MasR). La alamandina generada como producto del clivaje Ang-(1-7) o angiotensina A (Ang A) tiene afinidad a MasR acoplado a proteína G (MRGD) (en amarillo). El sistema calicreína-cinina es interceptado por ECA y ECA2, los cuales metabolizan la bradicinina y Des-Arg9- Bradiquinina produciendo péptidos inactivos. Se ilustran los receptores de bradicinina tipos 1 (B1R) y 2 (B2R) (en celeste). Niveles de inhibición del SRA por IECA y ARAII ilustrados en rojo. Tanto la inhibición del eje convencional por los IECA/ARAII, como la activación del eje alternativo (Ang-(1-7) /ECA2), promueven efectos antiinflamatorios y antiangiogénicos, y causan vasodilatación.
Por otro lado, el eje alternativo contiene el propéptido Ang-(1-7) que es producto del clivaje de Ang II por la isoforma II de la ECA (ECA2)11. ECA2 es también conocida como homóloga de la ECA o enzima convertidora de angiotensina- carboxipeptidasa11. Esta enzima se encuentra principalmente en el endotelio de las arterias coronarias e intrarrenales y el epitelio renal tubular11. Asimismo, Ang-(1-7) puede ser producido y metabolizado por la ECA utilizando como substrato angiotensina (1-9) (Ang-(1-9)) y como metabolito inactivo Ang-(1-5), respectivamente. Ang-(1-7) actúa comúnmente a través del receptor de ensamblaje mitocondria (MasR)12. También se ha descrito recientemente otro péptido como producto del clivaje Ang-(1-7) o angiotensina A (Ang A) conocido como alamandina, el cual tiene afinidad a MasR acoplado a proteína G (MRGD)13 (fig. 1).
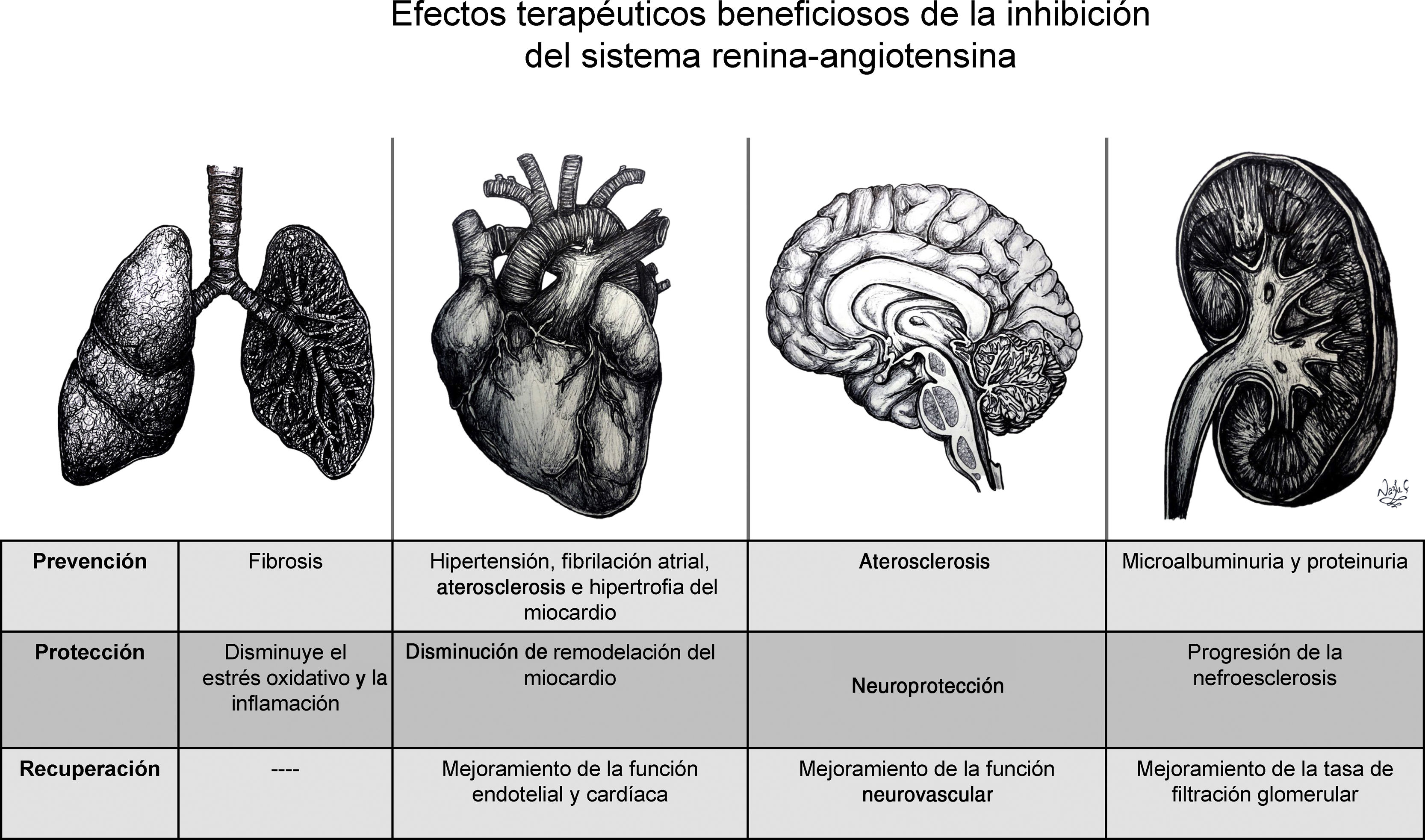
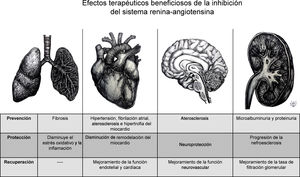
En general, la activación de cada eje de esta cascada hormonal se puede dar de manera endocrina, paracrina y autocrina, pero es la expresión de los receptores en los órganos diana y la presencia a nivel tisular de dichos componentes la que es capaz de modular la respuesta local a estímulos fisiológicos o fisiopatológicos14. Este principio ha sido implementado desde hace más de treinta años para inhibir farmacológicamente en diferentes niveles del eje convencional, utilizando ya sea los IECA15, o los bloqueadores del receptor de angiotensina (BRA), específicamente conocidos como antagonistas de los receptores de la angiotensina II (ARA II)16 o recientemente con el inhibidor de renina17 (fig. 2). Tanto la inhibición del eje convencional por los IECA/ARAII, como la activación del eje alternativo (Ang-(1-7) /ECA2), promueven efectos antiinflamatorios y antiangiogénicos, y causan vasodilatación, lo cual está reflejado en el mejoramiento de la función endotelial, en la prevención de la hipertrofia del miocardio, y, a nivel renal, en el aumento de la tasa de filtración glomerular18 (figs. 1 y 2). También se había propuesto modular el SRA utilizando el agente recombinante ECA2, el cual inactiva la Ang II e incrementa la producción de Ang-(1-7) y la estimulación directa del receptor MasR19.
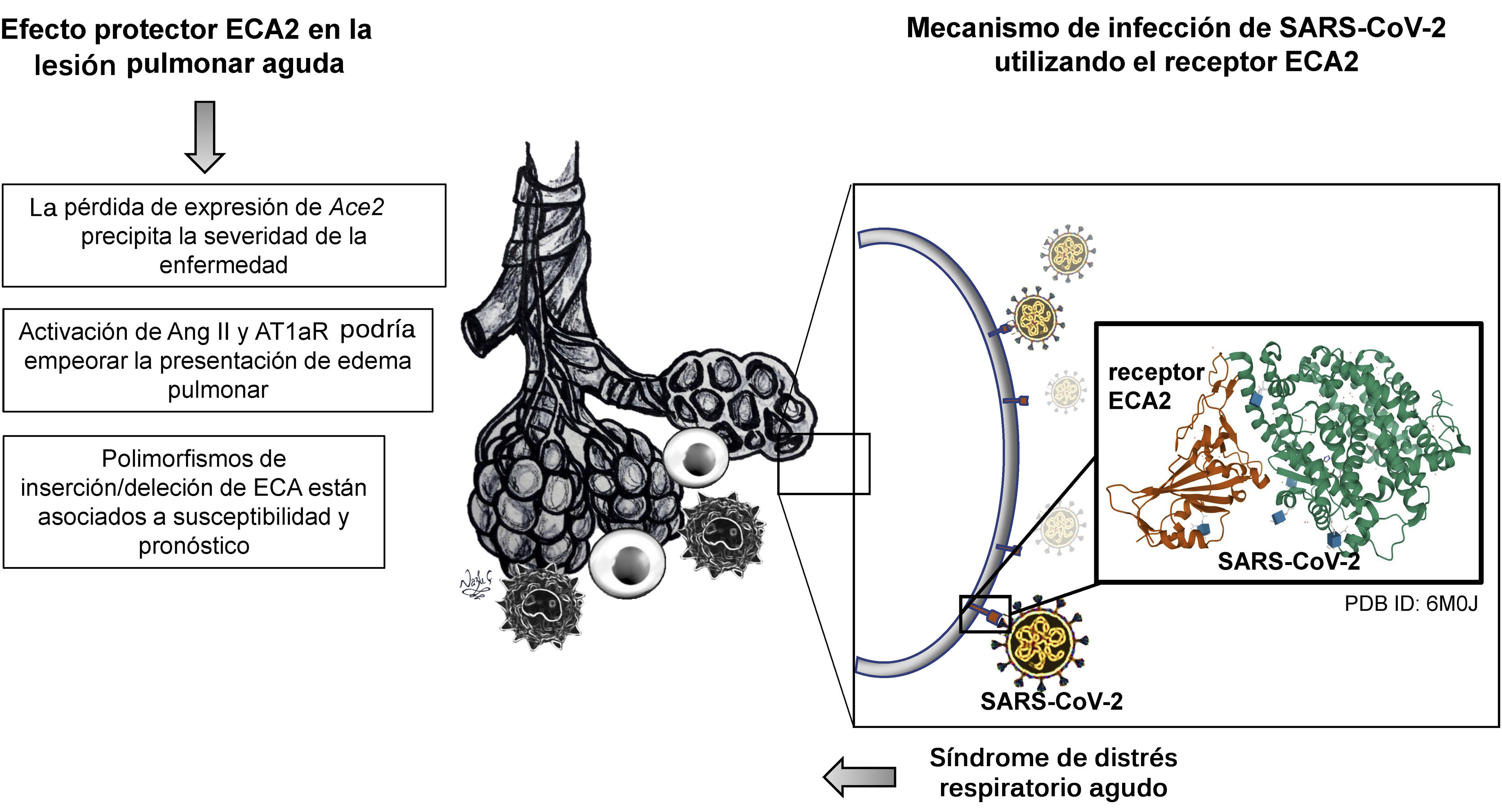
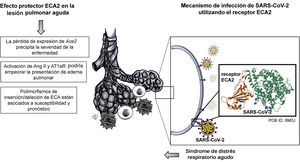
La ECA2 y el mecanismo de infección por SARS-CoV-2Estudios experimentales que utilizaron modelos animales para investigar acerca de la lesión pulmonar aguda (LPA) y el síndrome de distrés respiratorio agudo (SDRA) descubrieron una marcada reducción en la expresión de ECA220. Adicionalmente, otro estudio identificó que polimorfismos de inserción/deleción de ECA estaban asociados a susceptibilidad y pronóstico en estas enfermedades21. De igual manera, se sabía que la activación de otros componentes de SRA, como Ang II y AT1aR, podían empeorar la presentación del edema pulmonar20. Pero para entender el vínculo entre IECA y COVID-19, es necesario comprender, en primer lugar, el mecanismo de infección de este virus utilizando el receptor ECA2, el regulador negativo del SRA (fig. 3), y, en segundo lugar, esclarecer el potencial papel de los IECA en la expresión del receptor ECA2 en los pacientes con COVID-19.
En el 2002, emerge el coronavirus causante del síndrome respiratorio agudo (SARS-CoV)22, que comparado con SARS-CoV-2 tiene una tasa de transmisión significativamente menor3. Posteriormente, en el año 2005, un estudio in vivo buscaba elucidar el papel de la ECA2, que se expresa en los pulmones de humanos y de ratones, además de las implicaciones de la deficiencia del gen Ace2 en el modelo experimental que simulaba LPA en humanos20. Dicha enfermedad se puede presentar en caso de sepsis, broncoaspiración de ácido gástrico, neumonía por infección por SARS-CoV e influenza aviar tipo A24. La base fisiopatológica en la presentación más grave de LPA se caracteriza por edema pulmonar agudo, ocasionado por incremento de la permeabilidad vascular, aumento de infiltración de células inflamatorias e hipoxia severa24. Particularmente, sobre el curso de LPA y el nivel de afectación pulmonar se demostró que la pérdida de expresión de Ace2 precipita la severidad de la enfermedad20. Posteriormente, la respuesta a la inoculación por SARS-CoV fue evaluada en el modelo transgénico para Ace2 humano (hAce2), concluyendo que SARS-CoV se replicaba de manera más eficiente en los pulmones modelo transgénico, comparado con el grupo control a los días 3 y 7, tras la inoculación25. Este estudio reportó que los cambios observados en su modelo transgénico replicaban los observados en el SDRA humano, incluyendo hiperemia intersticial, infiltrado de monocitos y linfocitos, presencia de exudados proteicos, y proliferación y descamación del epitelio alveolar25.
En tan sólo cuatro meses, se ha descubierto la secuencia genómica del SARS-CoV22. Además, se ha caracterizado su origen filogenético y los posibles reservorios naturales23. Utilizando modelamiento computacional tridimensional ha sido posible comparar entre la estructura del dominio de unión al receptor de SARS-CoV-2 y SARS-CoV23, concluyendo que comparten un 76.5% de las secuencias de aminoácidos de la glicoproteína S en las espículas (spike), y un alto grado de homología en su secuencia genómica26. Previamente, estudios de cristalografía y de interacción bioquímica habían demostrado que la glicoproteína S en las espículas (spike) de SARS-CoV tiene una gran afinidad por el receptor ECA226. Para resumir, la replicación y la transmisión de célula a célula se da por la unión de la glicoproteína S en las espículas (spike) de SARS-CoV-2 al receptor ECA2, seguido por el clivaje proteolítico de la ECA2 por la proteasa transmembrana de serina 2 (TMPRSS2)27 (fig. 3).
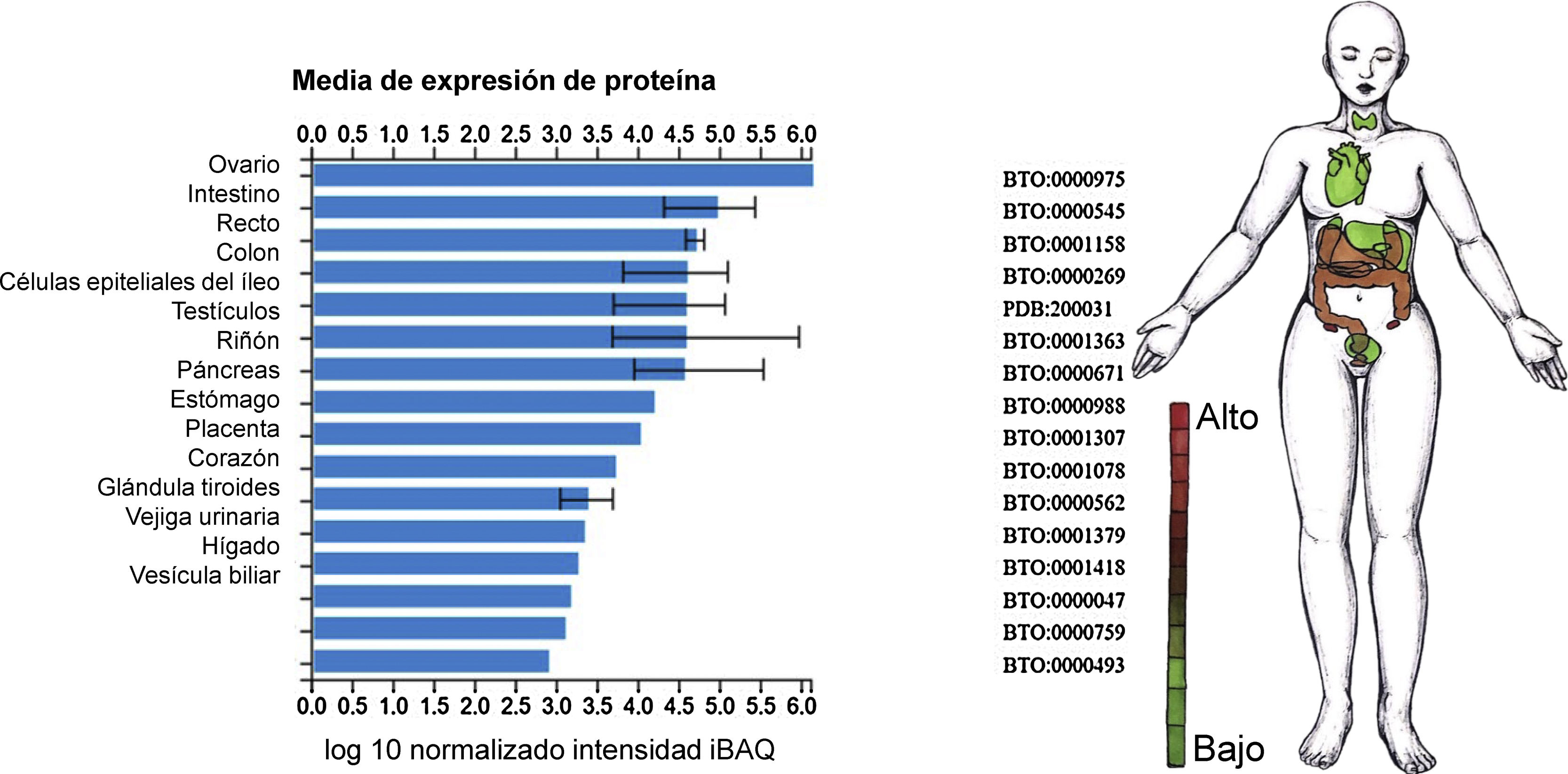
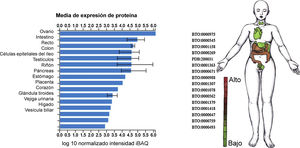
Ahora bien, reportes recientes especificaron que el dominio de unión a receptor de SARS-CoV-2 reconocido por el receptor ECA2 corresponde al residuo 394 (glutamina), e inclusive es más eficiente dicha afinidad comparada con SARS-CoV, lo cual incrementa la capacidad de SARS-CoV-2 para transmitirse28. Con el fin de confirmar si SARS-CoV-2 utilizaba a su vez receptor de entrada de ECA2, se realizaron estudios de infectividad viral in vitro utilizando células HeLa que expresaban el receptor ECA2 comparadas con aquellas que no. Este estudio indicó que, en el caso de humanos, murciélago horseshoe (de la China), civeta y cerdos, SARS-CoV-2 es capaz de utilizar ECA2 como receptor de entrada, como también se reportó que no utiliza otro tipo de receptores de coronavirus, tales como aminopeptidasa NnCoV (APN) y dipéptidil peptidasa 4 (DPP4)2. El reporte preliminar del perfil de expresión de la ECA2 en tejido pulmonar humano utilizando single-cell RNA seq identificó una alta concentración de este receptor en las células alveolares tipo II, lo cual sugiere un tropismo particular por SARS-CoV-229. Sin embargo, dicho estudio descubrió que esta población celular expresaba enriquecimiento en genes que favorecen la replicación viral29. Anteriormente se había determinado el nivel normal de expresión tisular de ECA2 predominantemente en ovario, intestino, riñón, corazón y testículos30 (fig. 4).
Nivel de expresión de ECA2 en tejidos y líneas celulares. Estudios de proteómica integrada (ProteomicDB)30 reportan un nivel de expresión tisular de ECA2 (Q9BYF1) predominante en ovario, intestino, testículo, riñón, páncreas, estómago, placenta, corazón, glándula tiroides, vejiga urinaria, hígado y vesícula biliar.
Finalmente, las hipótesis sobre el mecanismo fisiopatológico de infección de SARS-CoV-2, el uso terapéutico de los IECA y el potencial daño que podrían inducir en pacientes con COVID-19 han surgido, en gran parte, como extrapolación de resultados obtenidos en las investigaciones sobre SARS-CoV aplicados a COVID-1931, las cuales sugieren que el incremento de la actividad del eje convencional ECA/Ang II en relación con el eje alternativo ECA2/Ang-(1-7) puede promover LPA en COVID-1932.
Uso terapéutico de los IECA en pacientes con COVID-19En la actualidad, los IECA continúan siendo el grupo de medicamentos antihipertensivos más utilizados por millones de pacientes en todo el mundo33. Sin embargo, el uso terapéutico de esta medicación en pacientes que cursan con COVID-19 se ha tornado controversial1,32, a causa de evidencia contradictoria basada en las hipótesis sobre el papel de la ECA2 como puerta de entrada y replicación viral de SARS-CoV-231, y en los hallazgos de estudios observacionales que reportaron un aumento en la severidad de infección por SARS-CoV-2 en pacientes con múltiples comorbilidades, que adicionalmente usaban IECA4 (tabla suplementaria 1).
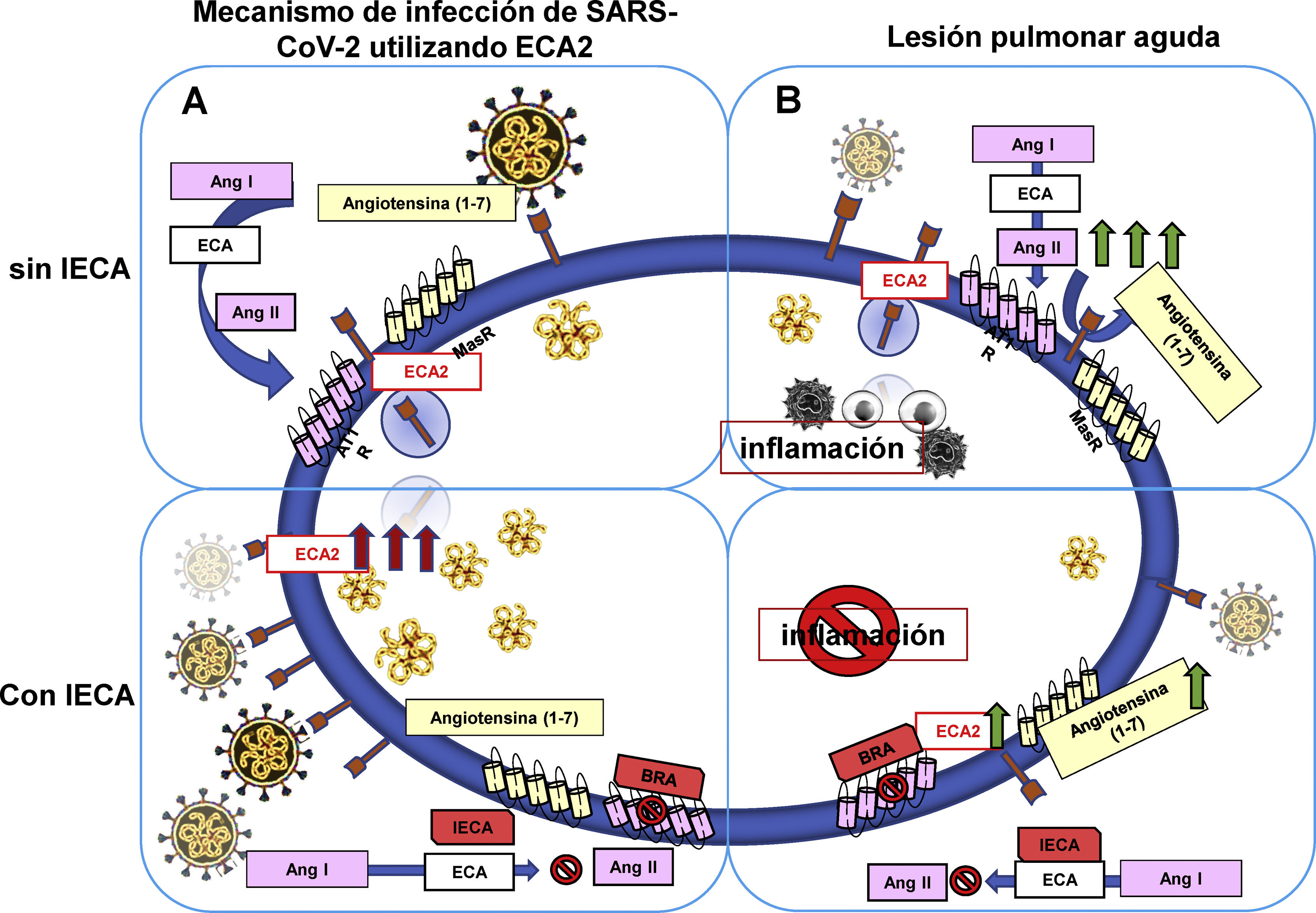
En primer lugar, la hipótesis que supone el uso de los IECA como deletéreo en pacientes con COVID-19 sugiere que SARS-CoV-2 ingresa a través del receptor ECA2, lo cual en presencia de los IECA puede incrementar los niveles de ECA2, promoviendo de esta manera la entrada y replicación viral28. Desde el punto de vista fisiológico, la supresión de la ECA2 acontece como parte del proceso de internalización del receptor desde la superficie celular, lo cual disminuye tanto la presencia tisular de ECA2 como la generación de Ang-(1-7). Por ende, esto incrementa los niveles de Ang II, y así mismo la Ang-(1-7) se convierte en sustrato disponible para la ECA convirtiéndolo en un péptido biológicamente menos activo12. En consecuencia, la activación del eje ECA/Ang II desencadena una respuesta inflamatoria mediada por AT1R, e incrementa la severidad de LPA32, así como es posible exista un incremento en la expresión y la actividad de ECA2, en órganos como riñón y corazón, que finalmente incremente el riesgo de susceptibilidad a la infección por SARS-CoV-2 en pacientes que utilizan regularmente IECA32 (fig. 5 A).
Uso terapéutico de los IECA en pacientes con COVID-19. Hipótesis (A): el uso de IECA en pacientes con COVID-19 aumenta la expresión del receptor ECA2 en la superficie celular; por ende, incrementa la replicación y transmisión viral. Hipótesis (B): la activación de angiotensina II (Ang II) y del receptor de angiotensina II tipo1 (AT1R) promueve la severidad de la lesión pulmonar aguda y la inflamación, la cual disminuye al adicionar IECA/ARAII. Esto promueve la generación de angiotensina (1-7) [Ang (1-7)] por la ECA2, lo cual finalmente disminuye la inflamación.
En segundo lugar, la hipótesis opuesta presume que Ang II como efector principal del SRA desencadena la activación AT1R induciendo vasoconstricción, angiogénesis e inflamación. Por lo tanto, el uso de IECA estaría indicado para contrarrestar dichos efectos en LPA, lo que al mismo tiempo podría contribuir al incremento de Ang-(1-7) por ECA2, y la activación de MasR12. De lo anterior, es preciso aclarar que los estudios disponibles no han esclarecido el efecto de los IECA en la expresión y actividad ECA2: además, no hay evidencia suficiente sobre sus implicaciones en el funcionamiento del tejido pulmonar25 (fig. 5B).
En tercer lugar, está la hipótesis sobre la relación directa entre la alta prevalencia de HTA en pacientes con COVID-19, quienes habían presentado un curso de enfermedad agravado. Series de caso provenientes de China indicaron una prevalencia estimada del 15%34 de HTA entre los pacientes con COVID-19 (tabla suplementaria 1)5. El hecho que estos pacientes mostraran un cuadro de enfermedad más severo que requería soporte ventilatorio, o que incluso morían, alertó a la comunidad médica sobre el riesgo potencial de esta condición coexistente, así como del uso de los IECA5. A pesar de que estos reportes no hicieron el ajuste riguroso de predicción de riesgo considerando variables de confusión, como la edad avanzada, ya se había demostrado en otras enfermedades infecciosas, que comorbilidades como la HTA son un factor determinante en el pronóstico5. Ahora, en cuanto al uso de IECA, en esta serie de casos se estimó que sólo entre un 25 a 30% de los pacientes con HTA fueron tratados con IECA35. Otras comorbilidades, ECV y ERC5, fueron reportadas en pacientes con COVID-19 y podrían estar relacionadas, a su vez, con el uso de IECA puesto que estarían indicados en caso de presentar falla cardíaca con impedimento funcional de ventrículo izquierdo y proteinuria severa, respectivamente. Tomando en consideración lo expuesto se puede concluir que el nivel de evidencia es insuficiente, y que, por lo tanto, decisiones sobre el manejo médico de pacientes con COVID-19, que sufren de hipertensión, ECV y ERC, y, al mismo tiempo, reciben IECA, requieren de un mejor soporte científico1,5. A pesar de esto, las diferentes sociedades científicas y médicas emitieron comunicados en los que no recomiendan la suspensión de los IECA en pacientes con COVID-19 por riesgo de descompensación de las comorbilidades tratadas, y, además, porque podrían prevenir lesiones cardiovasculares y reducir el daño pulmonar causado por COVID-1936.
En vista de la falta de estudios de base poblacional, en marzo del año en curso se realizó el primer estudio de casos y controles que investigó la asociación entre requerir admisión hospitalaria por COVID-19 y el uso de inhibidores del sistema renina-angiotensina-aldosterona (ISRAA) comparado con el uso de otros medicamentos antihipertensivos. Dicho estudio incluyó 1.139 casos y 10 controles por cada caso, los cuales fueron elegidos de manera aleatoria de la Base de datos para la Investigación Farmacoepidemiológica en Atención Primaria (BIFAP) de España (hasta el año 2018), y emparejados individualmente por edad, sexo, región y fecha de ingreso hospitalario. Este estudio concluye que, en el contexto de COVID-19, no se observó que ninguno de los ISRAA, IECA o ARAII aumenten el riesgo de necesitar ingreso hospitalario, incluyendo los casos fatales y aquellos que requirieron ingreso a unidades de cuidado intensivo. Esta asociación se mantuvo al ajustar por variables de confusión tales como edad, género y riesgo de enfermedad cardiovascular. Por el contrario, se observó que el uso de ISRAA se asoció con la reducción significativa en el riesgo para la necesidad de ingreso hospitalario en pacientes diabéticos con COVID-1937. Los hallazgos de este estudio fueron corroborados por otro más reciente, de base poblacional de casos-controles realizado en la región de Lombardía (Italia), incluyendo 6.272 casos confirmados de COVID-19 emparejados con 30.759 individuos beneficiarios del sistema regional de salud. Los resultados no mostraron ninguna asociación entre el uso de IECA (razón de disparidad (OR) ajustado, 0,95 [IC95%:0,86 – 1,05]) o ARAII (OR ajustado 0,96 [IC95%:0,87 – 1,07]) con riesgo de infección por COVID-1938, así como tampoco se encontró ninguna asociación entre IECA y casos con enfermedad de COVID-19 severa o casos fatales (OR ajustado 0,83 [IC95%:0,63– 1,10])38.
Efectos de los IECA podrían reprogramar la respuesta inmune en COVID-19Aún es limitada la evidencia disponible sobre cómo se realiza el proceso de presentación de antígeno y la activación de linfocitos T específicos en la respuesta viral de SARS-CoV-239, lo cual depende del complejo mayor de histocompatibilidad I [MHCI o complejo del antígeno leucocitario humano (HLA)]40. Previamente se había demostrado que diferentes polimorfismos de HLA podrían conferir riesgo o ser protectores en la infección por influenza A (H1N1) y SARS-CoV41. En cuanto a la inmunidad celular a SARS-CoV-2, se reportó que la proporción tanto de linfocitos T CD4+ como de CD8+ circulantes se encuentra reducida, pero en estatus de activación expresando HLA-DR y CD38, similar a los hallazgos de fase aguda en SARS-CoV42. Se supo que la memoria inmunológica basada en la respuesta de célula T específica permanece hasta seis años después de la infección por SARS-CoV en 14 de 23 pacientes43. El perfil de citocinas en COVID-19 se caracteriza por incremento en interleucina (IL)-2, IL-7, factor estimulante de granulocitos e interferón gamma inducible, entre otros44.
En un estudio retrospectivo de pacientes de Wuhan, se reportó que la ferritina elevada (promedio de 1.129.6 ng/ml no sobreviviente versus 614.0 ng/ml sobrevivientes) e IL-6 (promedio de 6.8 ng/ml sobreviviente versus 11.4 ng/ml no sobrevivientes), y la proporción neutrófilo-leucocito elevada podría incrementar el riesgo de mortalidad inducida por hiperinflamación45.
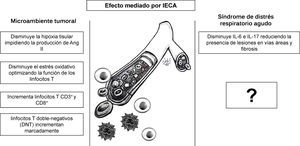
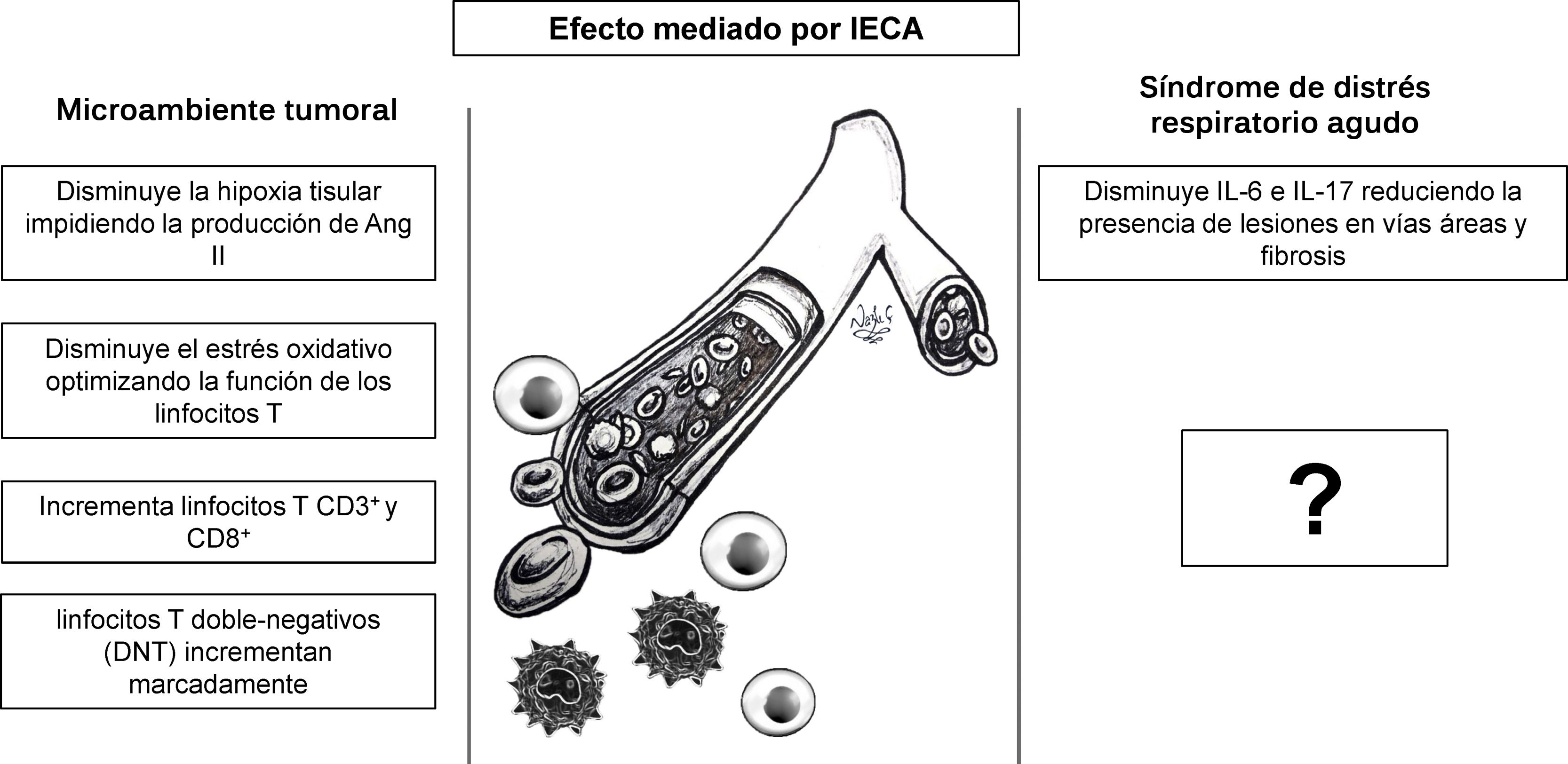
El papel regulador del SRA en varios procesos patológicos, tales como inflamación25 y proliferación tumoral, ha sido investigado en modelos animales7,46, contrario al efecto modulador del sistema inmune de los IECA7,46, el cual no ha sido ampliamente explorado y podría ser el punto de partida para nuevas propuestas de investigación en COVID-1947. Entre los efectos de los IECA que podrían reprogramar la respuesta inmune y que, además, se podrían extrapolar desde el campo de la inmunoterapia para el cáncer con el fin de desarrollar nuevas terapias para COVID-19 se encuentran la disminución de hipoxia y acidosis tisular, la regulación de la cascada inflamatoria, la disminución del estrés oxidativo7 y el efecto modulador de los linfocitos T46 (fig. 6).
El efecto mediado por los IECA reprograma la respuesta inmune en el microambiente tumoral. Estudios sobre el efecto inmunomodulador de los IECA en la respuesta antitumoral puede ser el punto de encuentro entre inmunoterapias para cáncer y nuevas estrategias terapéuticas para COVID-19.
La hipoxia y la acidosis tumoral inducen una cascada de factores transcripcionales, factores de crecimiento tumoral y citocinas proinflamatorias, como el factor inducible por hipoxia (FIH-1), el factor de crecimiento de transformación beta (TGF-β) y la IL-6, los cuales generan inmunosupresión local7. Los IECA impiden que se genere el estímulo inicial disminuyendo la hipoxia tisular e impidiendo la producción de Ang II. El estrés oxidativo, que impide el funcionamiento de linfocitos T, también es un efecto de la Ang II/AT1R, el cual puede ser contrarregulado selectivamente con ARAII48.
Recientemente se descubrió que los IECA producen un cambio dinámico temporal en subpoblaciones específicas de linfocitos T en el parénquima hepático peritumoral y en las metástasis hepáticas inducidas en el modelo murino de cáncer colorrectal, incrementando tanto la población de linfocitos CD3+ y CD8+, como disminuyendo significativamente46 los linfocitos CD4+ (fig. 6). Asimismo, reportes iniciales que examinaron el conteo absoluto de linfocitos T en pacientes con COVID-19, quienes habían recibido inhibidores del SRA (IECA/BRA), mostraron un conteo más elevado de linfocitos CD3+ y CD8+, mientras no se observaron cambios significativos en linfocitos CD4+ en sangre periférica, comparados con aquellos que recibieron otros medicamentos antihipertensivos49. Adicionalmente, este estudio indicó una tendencia hacia la disminución de los niveles de IL-6 en sangre periférica en pacientes con COVID-19 que recibieron IECA/BRA comparado con el grupo control49. Previamente estudios realizados en un modelo murino de obliteración de vías aéreas mostraron que después de administrar (10mg/kg/día) de IECA/ARAII por 5 días, la IL-6 y la IL-17 disminuyeron marcadamente reduciendo la presencia de lesiones en vías áreas y fibrosis50. Finalmente, se ha descrito que los linfocitos T doble-negativos (DNT) incrementan de manera significativa en respuesta a IECA46. Pese a que representan un porcentaje minúsculo (1-3%) de individuos saludables, se observó un marcado incremento en la respuesta a la influenza A, lo que demuestra su papel como regulador de la respuesta inmune en el parénquima pulmonar51. Ahora bien, ante la falta de información sobre la respuesta inmune humoral y celular se hace imperativo continuar investigando para comprender cómo se presenta el síndrome de liberación de citocinas en COVID-19, y si la administración de un agente bloqueador de IL-6, como tocilizumab o siltuximab, podría tener un efecto beneficioso en estos pacientes52.
Perspectivas e implicaciones clínicasSin duda, existe una relación entre el SRA y la COVID-19. En esta revisión de la literatura se exploraron algunos de los aspectos más relevantes sobre la ECA2 y el mecanismo de infección por SARS-CoV-2, controversias sobre el uso terapéutico de los IECA en pacientes con COVID-19 y los efectos de los IECA que podrían reprogramar la respuesta inmune en COVID-19.
Hoy día, las investigaciones son insuficientes para determinar con certeza si los estudios preclínicos sobre el aumento en la expresión de ECA2 causado por los IECA representan un riesgo en pacientes con COVID-19, o si, por el contrario, los IECA confieren efectos protectores en el manejo de la LPA. Al respecto, estudios más recientes de casos-controles encontraron que los inhibidores del SRAA, incluyendo los IECA, no incrementan el riesgo de COVID-19 o de requerir admisión hospitalaria por esta causa37,38. En la actualidad se desarrollan ensayos clínicos para evaluar la eficacia y la seguridad de los IECA en pacientes con COVID-19 (ClinicalTrials.gov identificador: NCT04311177 y NCT04312009) (tabla suplementaria 1).
Para concluir, es preciso señalar que desde el inicio de la pandemia ocasionada por COVID-19, un sinnúmero de revistas científicas han facilitado el acceso a resultados preliminares, que en muchos casos no han sido revisados por pares, dejando a discreción de la comunidad científica hacer uso de dichos resultados de manera responsable, para promover estudios que confirmen, de manera experimental, hallazgos preclínicos y epidemiológicos, que finalmente impacten en las decisiones de la práctica clínica para beneficiar al paciente. Aun se requieren ensayos clínicos prospectivos para investigar si el uso de IECA puede reducir la incidencia y la mortalidad asociada a la COVID-19 o a la LPA, tanto en pacientes con o sin indicación terapéutica de uso de IECA.
FinanciaciónEste trabajo es apoyado por el Departamento de Ciencia, Tecnología e Innovación (COLCIENCIAS- Colombia) Programa de Doctorados en el exterior 679 y la Universidad de Melbourne, Facultad de Medicina, odontología y ciencias de la Salud (Programa de becas 2018-2021), Australia.
Este trabajo es apoyado por el Departamento de Ciencia, Tecnología e Innovación (COLCIENCIAS- Colombia), Programa de Doctorados en el exterior 679 y la Universidad de Melbourne, Facultad de Medicina, odontología y ciencias de la Salud (Programa de becas 2018-2021). Un agradecimiento especial a José Leonardo Vallejo Ardila por la edición de la versión de artículo en español, y a Nazli Calik por las ilustraciones de los órganos.




![Uso terapéutico de los IECA en pacientes con COVID-19. Hipótesis (A): el uso de IECA en pacientes con COVID-19 aumenta la expresión del receptor ECA2 en la superficie celular; por ende, incrementa la replicación y transmisión viral. Hipótesis (B): la activación de angiotensina II (Ang II) y del receptor de angiotensina II tipo1 (AT1R) promueve la severidad de la lesión pulmonar aguda y la inflamación, la cual disminuye al adicionar IECA/ARAII. Esto promueve la generación de angiotensina (1-7) [Ang (1-7)] por la ECA2, lo cual finalmente disminuye la inflamación. Uso terapéutico de los IECA en pacientes con COVID-19. Hipótesis (A): el uso de IECA en pacientes con COVID-19 aumenta la expresión del receptor ECA2 en la superficie celular; por ende, incrementa la replicación y transmisión viral. Hipótesis (B): la activación de angiotensina II (Ang II) y del receptor de angiotensina II tipo1 (AT1R) promueve la severidad de la lesión pulmonar aguda y la inflamación, la cual disminuye al adicionar IECA/ARAII. Esto promueve la generación de angiotensina (1-7) [Ang (1-7)] por la ECA2, lo cual finalmente disminuye la inflamación.](https://static.elsevier.es/multimedia/01205633/0000002700000004/v2_202010100706/S0120563320300942/v2_202010100706/es/main.assets/thumbnail/gr5.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)