La evaluación de la función sistólica es fundamental para la toma de decisiones clínicas en cardiología. Los métodos actuales basados el cálculo de la Fracción de Eyección Ventricular Izquierda como parámetro de la función sistólica, se soportan en medidas volumétricas. Con el advenimiento de la ecocardiografía speckle tracking, se puede determinar el grado de deformación de la fibra miocárdica (Strain) y obtener una medida más directa de la función sistólica, lo cual ha despertado un interés creciente sobre su utilidad en la práctica clínica. Por tanto, en esta revisión se presenta evidencia actualizada sobre la aplicación de la ecocardiografía speckle tracking, en diferentes cardiopatías de origen no oncológico. Por ejemplo, el Strain Longitudinal Global, el parámetro mejor estudiado de la ecocardiografía speckle tracking, provee información pronóstica en enfermedades como la cardiomiopatía hipertrófica y cardiopatía isquémica. Un Strain Longitudinal Global alterado confiere un mayor riesgo de eventos cardiovasculares en pacientes con valvulopatías aórticas y mitral; incluso con Fracción de Eyección Ventricular Izquierda preservada, lo cual abre la posibilidad de anticipar el tiempo de intervención quirúrgica. La ecocardiografía speckle tracking, también permite cuantificar el strain auricular izquierdo, permitiendo evaluar con mayor precisión la función diastólica. Aunque para cada cardiopatía se presentan valores de referencia de Strain, esta técnica aún se encuentra en desarrollo; por tanto, aún no hay valores de corte estandarizados dado la amplia variabilidad inter-proveedores. Sin embargo, por los avances diarios en la técnica de ecocardiografía speckle tracking, se espera que su uso rutinario sea considerado en las guías de práctica clínica futuras como herramienta de decisión clínica.
The evaluation of systolic function is fundamental for clinical decision making in cardiology. The current methods based on the calculation of the Left Ventricular Ejection Fraction (LVEF) as a parameter of the systolic function are supported in volumetric measurements. With the advent of speckle tracking echocardiography (STE), the degree of deformation of the myocardial fiber (Strain) can be determined and a more direct measure of systolic function can be obtained, which has aroused a growing interest in its usefulness in clinical practice. Therefore, this review presents updated evidence on the application of STE in different heart diseases of non-oncological origin. For example, the Global Longitudinal Strain (GLS), the best-studied parameter of STE, provides prognostic information in diseases such as hypertrophic cardiomyopathy and ischemic heart disease. An altered GLS confers an increased risk of cardiovascular events in patients with aortic and mitral valve disease; even with preserved LVEF, which opens the possibility of anticipating the time of surgical intervention. The STE also allows the quantification of left atrial strain, allowing a more accurate assessment of diastolic function. Although reference values of Strain are presented for each cardiopathy, this technique is still in development; therefore, there are still no standardized cut-off values given the wide inter-vendor variability. However, due to the daily advances in the STE technique, it is expected that its routine use will be considered in future clinical practice guidelines as a clinical decision tool.
La evaluación de la función ventricular se basa en el uso y avance de varias técnicas, entre ellas la más conocida y ampliamente desarrollada es el cálculo de la fracción de eyección ventricular izquierda (FEVI) a partir del ecocardiograma transtorácico (ETT) en 2 dimensiones (2D). El método preferido para dicho cálculo es el biplano modificado de Simpson, que a partir de las proyecciones apical de dos y cuatro cámaras permite la cuantificación de los volúmenes finales sistodiastólicos y por ende de la FEVI1. Sin embargo, al ser 2D transforma áreas en volúmenes y deja de ser tan exacto, especialmente en pacientes con gran deformidad de la arquitectura ventricular izquierda o disfunción sistólica regional2. Lo anterior a su vez se ve especialmente influenciado por aspectos técnicos como una visualización correcta del endocardio y del ápex, el ciclo respiratorio, la posición y angulación tanto del transductor como del paciente, entre otros3. Por último, en el ETT existe una amplia variabilidad intra- e interobservador en la FEVI que puede ir desde un 8 hasta un 18% de acuerdo con la serie evaluada4.
Algunas limitaciones mencionadas han sido superadas parcialmente con el advenimiento de la ecografía en tres dimensiones (eco 3D) y la resonancia magnética nuclear (RMN) debido a una mayor precisión en el cálculo de volúmenes5,6. Sin embargo, estas continúan siendo medidas volumétricas, mas no indicadores directos del comportamiento y la función de la fibra muscular.
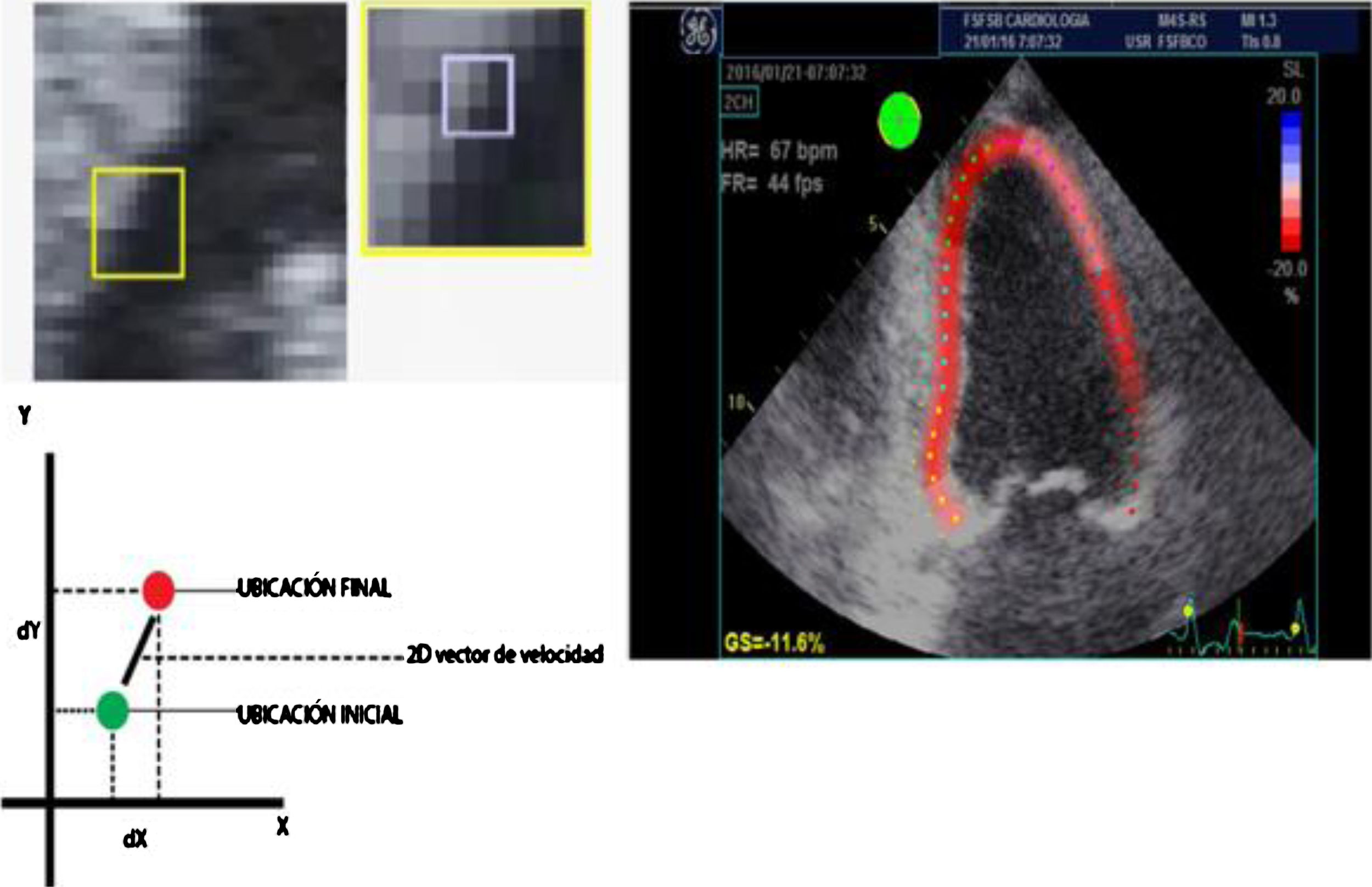
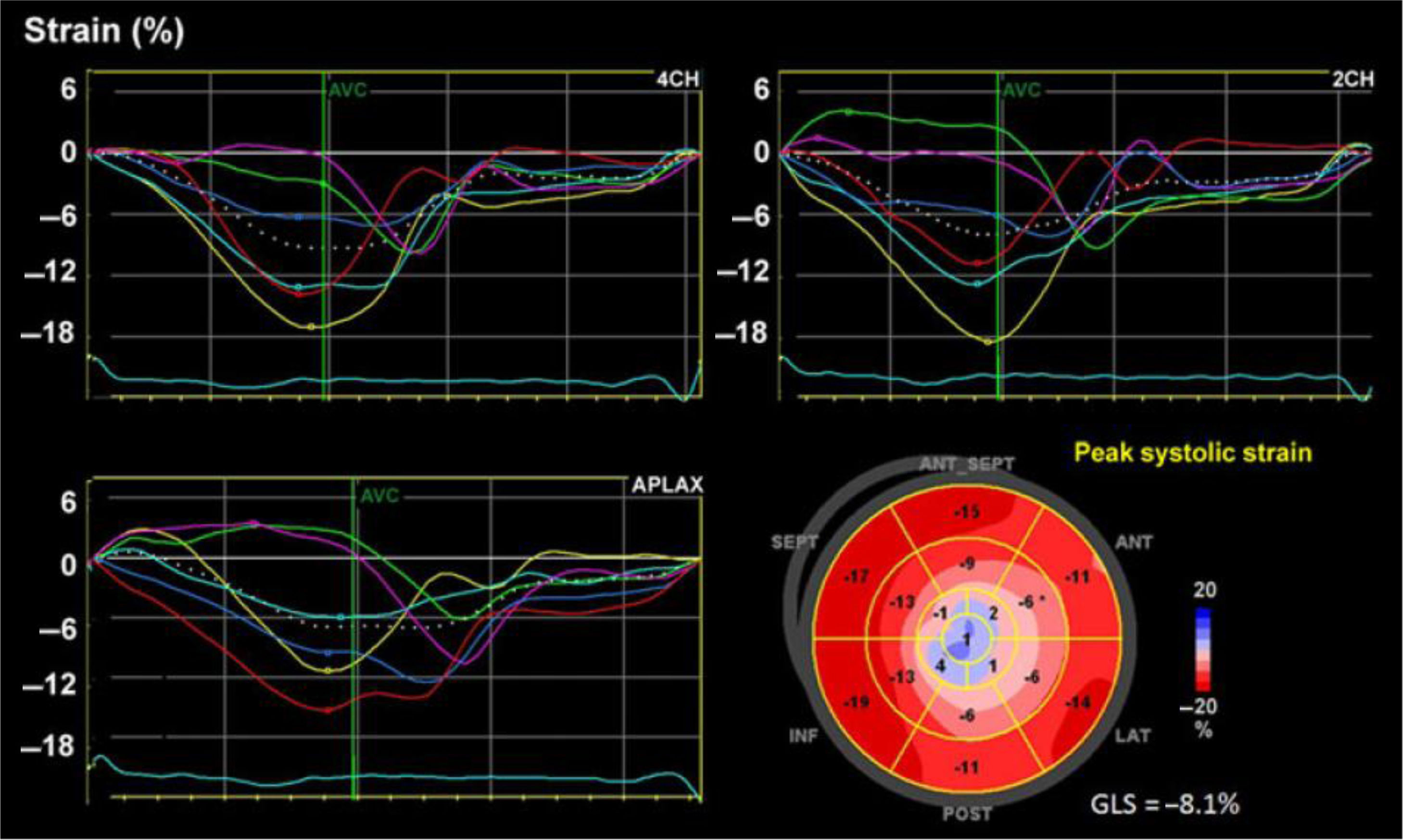
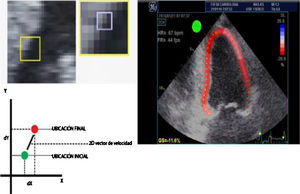
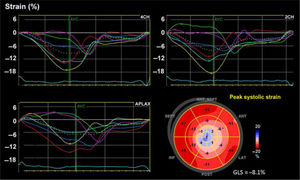
Desde finales del siglo xx, a partir del ecocardiograma 2D, el doppler tisular y el uso de algoritmos en el procesamiento de las imágenes se han podido identificar unidades acústicas (speckles) dentro de una región miocárdica de interés y seguir el desplazamiento temporo-espacial de las mismas (speckle tracking) de acuerdo con la magnitud de deformación (strain) de dicha región miocárdica (fig. 1) y por ende de su capacidad contráctil7,8 (fig. 2).
Desplazamiento de marcadores acústicos obtenidos de una escala de grises de las imágenes ecocardiográficas (izquierda). En la parte inferior izquierda: gráfica adecuada para ilustrar el comportamiento en un vector de velocidad de acuerdo con la ubicación final respecto a la inicial de la unidad acústica, lo cual permite el cálculo del porcentaje la deformidad de la fibra en la imagen 2D (imagen derecha).
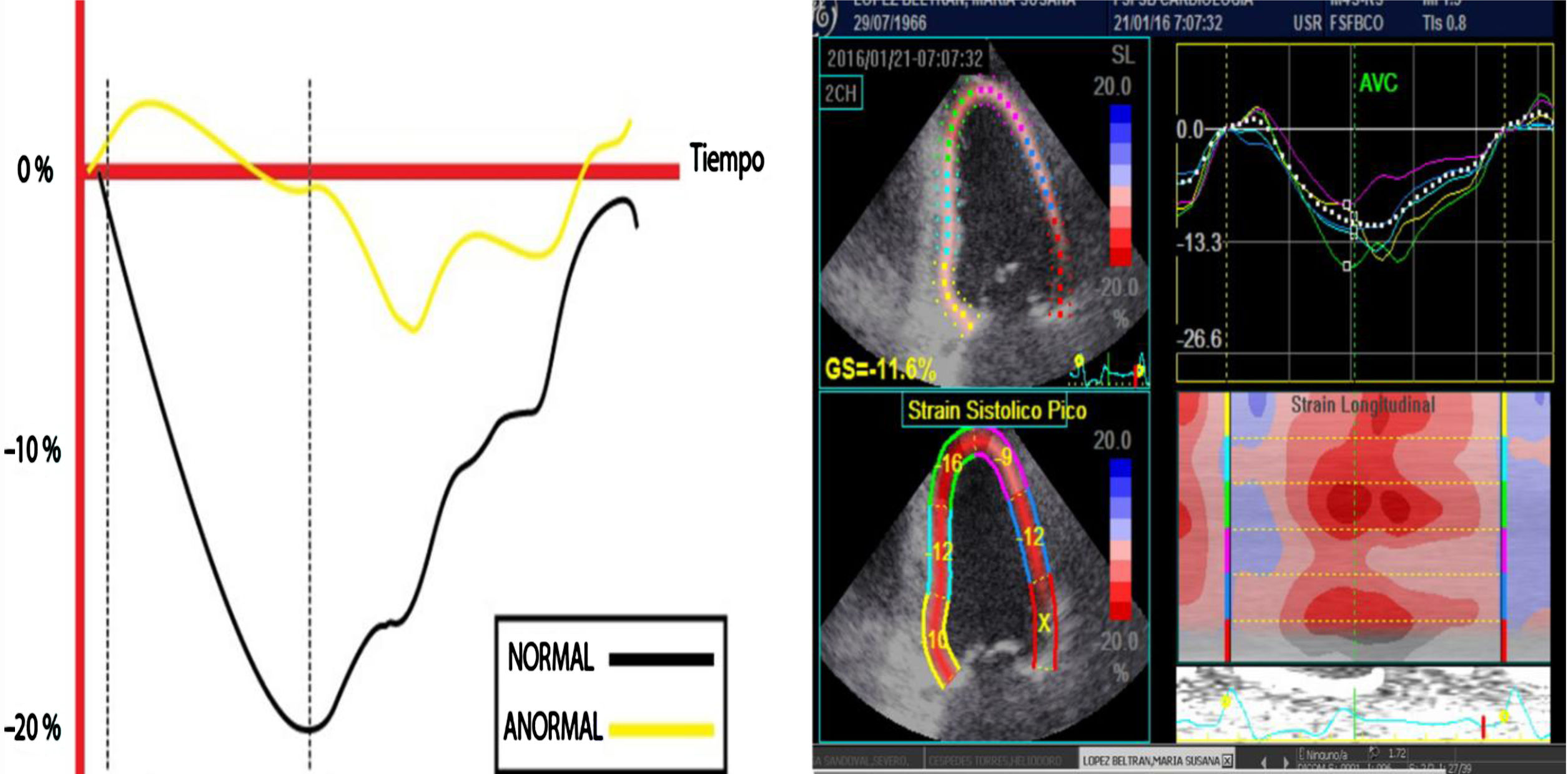
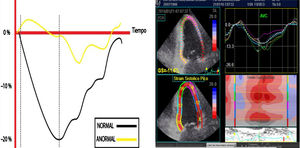
Esquema diseñado para ilustrar la magnitud de la deformación de la fibra en una escala negativa para el strain L longitudinal y la velocidad sobre una escala de tiempo. Los valores correspondientes a menor porcentaje de deformidad indican anormalidad y viceversa. A la derecha, imagen real en estudio del SL en paciente con afectación de la función ventricular izquierda; la línea punteada blanca corresponde al promedio del strain de todos los segmentos.
La técnica de la ecocardiografía speckle tracking (STE por su sigla en inglés) con el paso de los años se ha convertido en una ventana a través de la cual es posible asomarse con mayor exactitud a la mecánica ventricular y entender así la función sistólica, ya no sólo en términos de volúmenes y/o FEVI, sino de deformación de sus fibras miocárdicas9. Dicha deformación o strain se puede evaluar en las fibras que van desde el ápex a la base (strain longitudinal), así como las que van en dirección radial (strain radial) y circunferencial (strain circunferencial). No obstante, tanto el strain radial como el circunferencial tienen problemas de exactitud y reproducibilidad, por lo que el strain longitudinal es el que está mejor validado para la implementación rutinaria en la práctica clínica10. Cuando se obtiene un promedio del strain longitudinal de los 16 segmentos miocárdicos del ventrículo izquierdo (ventrículo izquierdo), se alude a strain longitudinal global (SLG).
Los valores de referencia de acuerdo con los diferentes metaanálisis para el SLG varían entre −15,9% y −22,1% con una media de −19,7% e intervalo de confianza (IC) del 95%11–13. Pese a que existen diferencias según las distintas marcas de equipos que tiene y han desarrollado la técnica, en la actualidad se considera que un valor de −20% con una desviación estándar (DE) de ±2 en el SLG, corresponde a una deformación normal. La reproducibilidad intra- e interobservador es buena e incluso superior con los otros parámetros ecocardiográficos que evalúan la función ventricular14.
En la actualidad se están estandarizando las medidas y se han encontrado factores demográficos y fisiológicos determinantes de estas15 como aquellos dependientes de raza, edad, sexo, condiciones hemodinámicas, uso de medicaciones y aun en situaciones de adaptaciones fisiológicas como en el caso de los atletas y las embarazadas.
Con base en lo anterior, el propósito de este capítulo es evaluar la utilidad y las aplicaciones clínicas de la STE y del SLG en condiciones patológicas diferentes a la evaluación de la cardiotoxicidad (que es motivo de otro capítulo en esta publicación), además de establecer, en la medida de lo posible, en cada caso, el valor pronóstico de esta herramienta diagnóstica. Se discutirá el papel del SLG en la miocardiopatía hipertrófica y la hipertrofia ventricular por otras causas y su diferenciación con el corazón de atleta o adaptación fisiológica al ejercicio; la enfermedad isquémica, la insuficiencia cardíaca con FEVI preservada, y valvulopatías tan relevantes y frecuentes como la estenosis aórtica y la insuficiencia mitral y su aplicación para la evaluación de la función de la aurícula izquierda.
Strain en miocardiopatía hipertrófica e hipertrofia ventricular izquierdaEn los pacientes con miocardiopatía hipertrófica existe un denominador común propio de esta entidad, que es la discrepancia entre los valores de la función ventricular y el comportamiento de la fibra muscular16. Varios estudios han mostrado que la alteración en la arquitectura de la cavidad ventricular en la disposición de los músculos papilares (la inserción de estos y su relación con las válvulas), la presencia de tractos fibrosos anómalos, sumados a la fibrosis y desorganización de las fibras musculares, contribuyen a una deformación anormal, la cual se hace evidente en el momento de practicar la cuantificación de strain longitudinal, radial y circunferencial. Así lo demostró un estudio de corte transversal que comparó a 150 pacientes con miocardiopatía hipertrófica vs. 50 pacientes sanos y encontró que, aunque ambos grupos de pacientes tuvieron una FEVI similar (61 ± 5% vs. 61 ± 8% p 0,77) sí hubo diferencia significativa en los valores basales del SLG (−15,7 ± 3,6% vs. −21,1 ±% p 0,001), lo que al final se relaciona con un porcentaje mayor de fibrosis miocárdica y un riesgo incrementado de arritmias ventriculares, especialmente si el SLG era menor a −14,7%17. Asimismo, otras cohortes de pacientes con diagnóstico de miocardiopatía hipertrófica han encontrado que valores de SLG menores a −16% confieren mayor riesgo de presentar eventos cardiovasculares y mayor mortalidad; especialmente en aquella mayor afectación del valor del SLG, tanto así que pacientes con SLG −10% tienen cuatro veces más riesgo de presentar un evento cardiovascular comparado con pacientes con miocardiopatía hipertrófica y un SLG de −16%18,19.
Lo mencionado tanto para la miocardiopatía hipertrófica como para ventrículos con engrosamiento de la pared por cualquier causa, está claramente reconocido como una limitación de la FEVI para la evaluación de la función ventricular y como predictor pronostico, y es ahí donde el strain adquiere una importancia clave en el reconocimiento de la disfunción sistólica incluso cuando la FEVI es normal20.
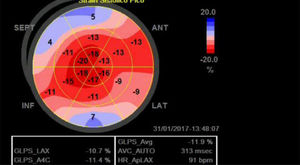
La relación que existe entre la fracción de eyección y los valores de strain en condiciones normales, permite establecer que el radio entre estos valores (FEVI/SLG) genera un valor cercano a 3 y que en la medida que se deteriora la deformación de la fibra este valor se incrementa, como lo que ocurre precozmente en los pacientes con amiloidosis cardiaca tanto para el strain longitudinal global como segmentario (mayor afectación en segmentos basales para esta enfermedad) con lo cual se establece un valor pronóstico en esta enfermedad y se hace posible diferenciarla de otras causas de hipertrofia ventricular izquierda21,22 (fig. 3).
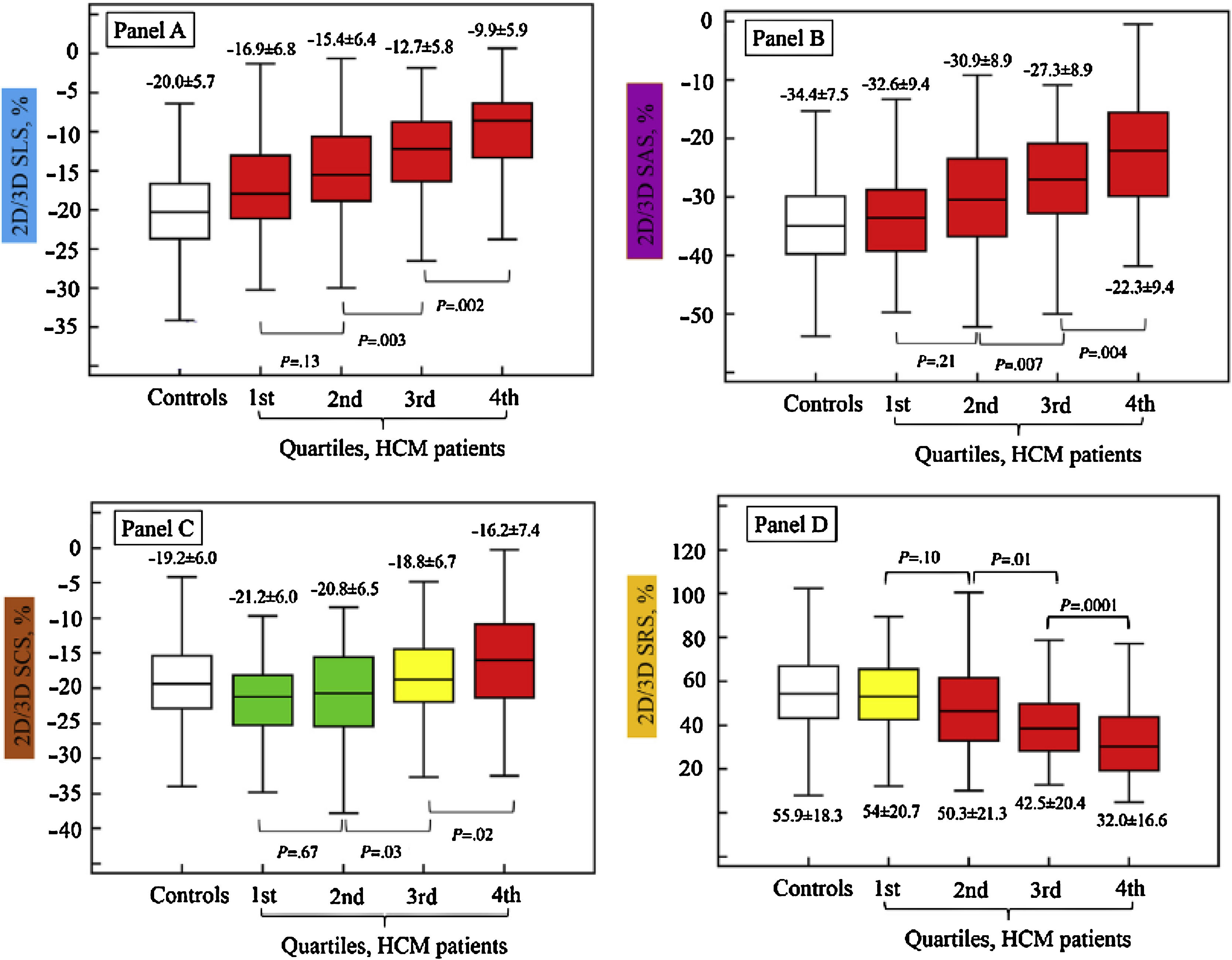
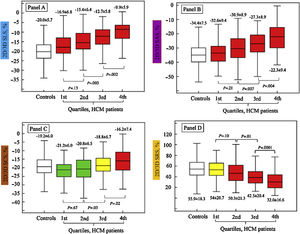
Tal vez la causa más frecuente de hipertrofia ventricular izquierda es la hipertensión arterial en la que los valores de strain longitudinal global están reducidos en forma significativa al compararlos con los de pacientes normales y mucho más deteriorados en aquellos pacientes hipertensos con falla cardiaca con FEVI preservada23. En la hipertrofia ventricular izquierda de igual manera existe un desarreglo de las fibras y en algunos casos fibrosis, lo cual genera una alteración global y regional bien conocida en los diferentes estudios que comparan el impacto de la hipertrofia en el strain de estos individuos respecto a los sujetos sanos, demostrándose así una asociación directa entre el incremento en la masa ventricular y la reducción en la deformidad en el strain longitudinal circunferencia y radial24. No obstante, la afectación más temprana en cuanto se refiere a la severidad de la hipertrofia ventricular izquierda se da en el SLG respecto a los otros dos (fig. 4).
El SLG se afecta en forma temprana en los pacientes con miocardiopatía hipertrófica aún con grados leves de hipertrofia (rectángulo superior izquierdo). El SCG y el SRG lo hacen de forma más tardía, manteniendo la función ventricular en las fases iniciales (rectángulos inferior izquierdo y derecho, respectivamente). Las gráficas de este estudio muestran la división por cuartiles de la severidad de la hipertrofia ventricular izquierda. Tomado de: J Am Soc Echocardiogr. 2015;28:1093-102.
Uno de los capítulos más interesantes en el contexto de la miocardiopatía hipertrófica y la hipertrofia ventricular izquierda es la diferenciación de estas condiciones con la hipertrofia adaptativa o fisiológica que desarrolla el atleta sometido a un entrenamiento continuo25. Pese a que existen condiciones asociadas a atletas de alto rendimiento como son el tamaño ventricular y auricular izquierdo (facilitándole al atleta un manejo más eficiente del volumen y el gasto cardiaco), el grosor del septum, que usualmente no supera los 15mm, y un patrón de llenado y relajación ventricular normales, existe una zona gris donde estos cambios no están plenamente establecidos y se sobreponen con casos de miocardiopatía hipertrófica con grosor de la pared menor a los 15mm. Por consiguiente es vital utilizar todos los recursos que permitan hacer la diferenciación entre estas entidades (por ejemplo dispersión mecánica). En la hipertrofia fisiológica o adaptativa del atleta los valores del SLG son mayores al compararlos con los casos de miocardiopatía hipertrófica (18 ± 2% vs. 15 ± 3%, p 0,0001), encontrándose asimismo que los valores de SLG son muy similares tanto en los atletas con hipertrofia fisiológica como en los controles normales (18 ± 2% vs. 19 ± 2% p 0,2)26,27.
Strain en estenosis aórticaLa ecocardiografía se ha considerado la técnica de elección para la valoración de la válvula aórtica. Sin embargo, la estenosis aórtica avanzada se acompaña de disfunción sistólica ventricular izquierda preclínica, difícilmente detectable mediante ecocardiografía convencional dada la importante proporción de pacientes con FEVI preservada28,29. No obstante, se ha demostrado que en los pacientes con estenosis aórtica severa la contractilidad medida por SLG mediante ecocardiografía puede mostrarse significativamente reducida a pesar de tener una FEVI normal 30,31, debido al importante proceso fibrótico secundario al desequilibrio crónico y progresivo entre la oferta de oxígeno (ej. perfusión coronaria insuficiente) y la demanda (ej. masa ventricular incrementada), lo que conduce finalmente a disfunción sistólica subclínica32,33. El grado y la extensión de la alteración del SLG también se ha asociado a la severidad de la hipertrofia ventricular concéntrica, apoyando así la teoría de relación directa entre el remodelado y la función del ventrículo izquierdo34,35. Con base en lo anterior se ha demostrado que cuanto más severa sea la estenosis aórtica, más bajo es el SLG36,37.
El STE surge entonces como una herramienta valiosa para la detección temprana de disfunción ventricular en pacientes con estenosis aórtica severa. En el escenario de la estenosis aórtica severa asintomática con FEVI preservada, varios estudios observacionales evidenciaron que valores bajos en el SLG (SLG < −15%) se han relacionado con mayor riesgo de desarrollo de síntomas, necesidad de cirugía de reemplazo valvular y muerte38,39. Incluso, en este grupo de pacientes una alteración en el SLG se ha asociado con riesgo incrementado de fibrilación auricular posoperatoria independientemente del tamaño auricular y de la edad40. Por otro lado, el strain longitudinal regional en la estenosis aórtica también adquiere importancia dado que un strain longitudinal basal menor a −13% tiene la asociación más fuerte con la aparición de síntomas en los pacientes previamente asintomáticos41.
Independientemente de la presencia o no de síntomas, en la estenosis aórtica de alto gradiente con FEVI preservada, diversos estudios de cohortes han demostrado que existe una relación inversamente proporcional entre el valor del SLG y mortalidad por todas las causas42–44. Ng ACT et al. publicaron el estudio más grande (688 pacientes) que ha demostrado el valor pronóstico independiente del SLG en estenosis aórtica severa; allí encontraron que los pacientes con disfunción miocárdica subclínica (FEVI normal y SLG < −14%) tuvieron una supervivencia acumulada menor que en los pacientes con SLG normal al término de un año (92,3% DE 4,4% vs. 77,7% DE 8,5% respectivamente, Long Rank p < 0,024), y no hubo diferencias en la sobrevida a un año entre aquellos pacientes con estenosis aórtica severa con FEVI disminuida y estenosis aórtica severa con FEVI preservada, pero un SLG alterado45. Por otra parte, en lo que se refiere a estenosis aórtica severa de bajo flujo – bajo gradiente con FEVI preservada, tener un SLG alterado se ha asociado con mayor riesgo de mortalidad por todas las causas46; de otra parte, en los pacientes con estenosis aórtica de bajo flujo-bajo gradiente con FEVI disminuida ningún estudio a la fecha ha evaluado el valor diagnóstico del SLG para diferenciar la estenosis aórtica de una pseudoestenosis.
Recientemente se ha generado gran interés en la valoración ventricular mediante técnica de strain antes y después del reemplazo valvular aórtico en pacientes con estenosis aórtica, tanto para su reconocimiento, como para su pronóstico y la predicción de recuperación funcional posoperatoria. Al parecer, el reemplazo valvular también se asocia con mejoría en el SLG y del strain circunferencial47,48. Dahl et al. en 2009 evaluaron 125 pacientes con estenosis aórtica severa y FEVI > 40% durante el preoperatorio y fueron separados en cuatro subgrupos de acuerdo con el valor del SLG y fueron seguidos a 4 años. Se encontró una tasa superior de eventos cardiovasculares mayores y hospitalizaciones por falla cardiaca en los pacientes con menor SLG, incluso demostrándose que este es un mejor predictor independiente de eventos cardiovasculares mayores y aun mejor que el Euroscore, en los pacientes con estenosis aórtica severa programados para reemplazo valvular49.
Todo lo anterior sugiere que incorporar el SLG en los modelos actuales de riesgo de estenosis aórtica puede en un futuro optimizar el tiempo para un reemplazo valvular aórtico, dado su capacidad de detectar precozmente disfunción sistólica comparado con la FEVI50. El SLG no se ha incluido aún en las Guías Internacionales para la evaluación de la estenosis aórtica severa; sin embargo, las guías recientes de valoración multi imagen aprueban con recomendación clase IIb el procedimiento quirúrgico para los pacientes con estenosis aórtica severa asintomática con gradientes tanto altos como paradójicamente bajos, que muestran valores de strain alterados51.
Respecto a los strain circunferencial (SC) y radial (SR) estos pueden estar reducidos, normales o aumentados, dado que evalúan también la deformación de las fibras epicárdicas y estas son las últimas en sufrir el proceso isquémico crónico de la hipertrofia ventricular izquierda. En consecuencia, y dado que el SLG valora fundamentalmente la deformación de las fibras endocárdicas (las que primero sufren alteración por ser la zona con menor irrigación de la pared miocárdica), está mejor relacionado con la severidad de la estenosis aórtica, fenómeno que explica que los valores de los SC y SR puedan estar normales o elevados en estadios iniciales de la estenosis aórtica como medida compensatoria, pero, así mismo, cuando la estenosis aórtica es muy severa, estos pueden estar globalmente disminuidos y conferir mayor riesgo de mortalidad en comparación con aquellos pacientes en quienes el SC y el SR no están alterados42,52,53.
Strain en insuficiencia mitralEl SLG también ha emergido como una estrategia no invasiva para detectar disfunción miocárdica subclínica en el contexto de una FEVI falsamente hiperdinámica en insuficiencia mitral severa primaria54. Witkowski et al. demostraron cómo los pacientes con insuficiencia mitral severa orgánica y FEVI mayor al 60% que desarrollaron disfunción del ventrículo (FEVI < 50%) luego de la reparación valvular, tenían mayor alteración de base del SLG en comparación con los pacientes con FEVI mayor al 50% en el posoperatorio, encontrándose así un valor de corte de −19,9% en el SLG con una sensibilidad del 90% y una especificidad del 79% para predecir disfunción ventricular izquierda a largo plazo55. Posteriores estudios han arrojado resultados similares, que confirman que un SLG basal alterado puede predecir disfunción del ventrículo izquierdo después de una cirugía de válvula mitral en pacientes con FEVI previamente normal56–58, e incluso que es un predictor independiente para mortalidad por todas las causas (cociente de riesgo 1,19 por cada unidad de disminución en el SLG, p<0,001)56.
En casos de insuficiencia mitral funcional, el SLG frecuentemente mostró peor función sistólica del ventrículo izquierdo y desenmascaró el verdadero daño a la contractilidad ventricular, fuera de que aportó información más allá de la FEVI, la cual como ya se había mencionado, representa sólo un cambio entre el volumen de fin de diástole y sístole y no en sí la calidad de contractilidad miocárdica, como sí lo evalúa el strain. Un estudio mostró que a pesar de una FEVI similar, los pacientes con miocardiopatía dilatada asociada a insuficiencia mitral funcional severa tuvieron peor SLG en comparación con aquellos sin insuficiencia mitral funcional (−9,78 ± 3,78% vs. −8,08 ± 3,33%; p 0,004)59.
Otros estudios también han evaluado el valor pronóstico incremental de la capacidad de ejercicio/reserva contráctil para predecir la sobrevida a largo plazo en infarto de miocardio primaria crónica. Por ejemplo, Kusunose et al. encontraron que la ausencia de incremento en el SLG durante el pico de ejercicio en pacientes con insuficiencia mitral moderada a severa orgánica asintomáticos, se asoció con aumento del punto compuesto de muerte cardiovascular, requerimiento de reemplazo valvular y hospitalización por falla cardiaca (HR:1,6; IC95%:1,1-2,3; p 0,01)60.
Strain en cardiopatía isquémicaEl desbalance entre la demanda y la oferta de oxígeno miocárdico conlleva alteración o pérdida de la función contráctil de la fibra miocárdica. Dicha disfunción puede presentarse durante horas a días luego del evento isquémico sin haber daño estructural o muerte celular de base (aturdimiento posisquémico). Puede manifestarse como disfunción contráctil por hipoperfusión crónica recuperable mediante revascularización apropiada y temprana (hibernación), o puede manifestarse como necrosis, cicatrización y remodelación cuando el proceso isquémico es persistente y produce muerte celular61. Pues bien, se ha demostrado que la STE tiene utilidad en todo el espectro de la cardiopatía isquémica tanto como herramienta diagnóstica de infarto del miocardio y pronóstica postinfarto miocárdico, que como método de estratificación no invasivo de enfermedad coronaria y como indicador de viabilidad miocárdica postinfarto miocárdico.
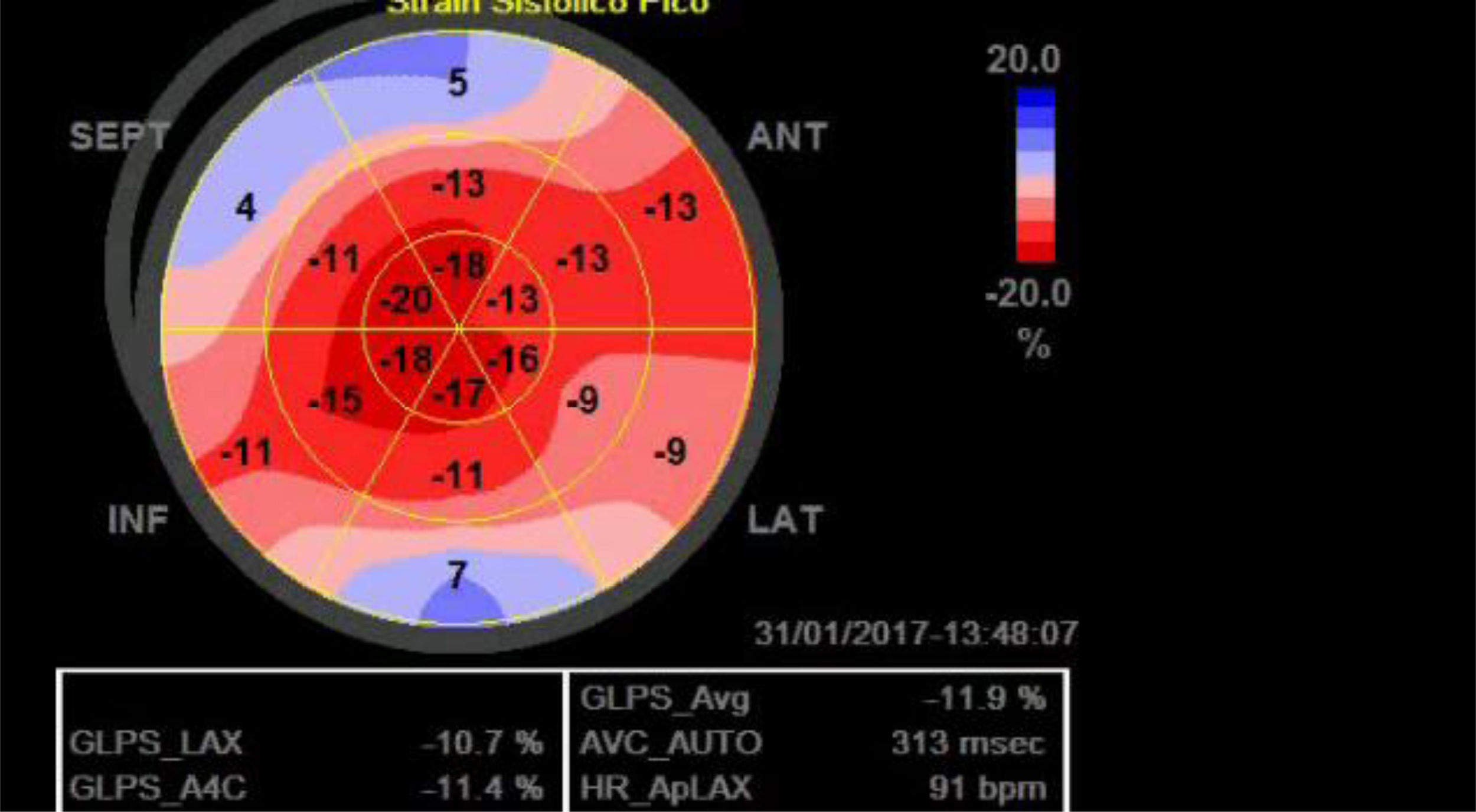
Se ha encontrado que la ecocardiografía strain es altamente sensible y específica en el diagnóstico de infarto de miocardio dada su buena capacidad de diferenciación entre la contracción activa del movimiento pasivo de la pared miocárdica (fig. 5)62. Leitman et al. en un estudio de 30 pacientes con enfermedad coronaria, hallaron que hasta el 80% de los segmentos verdaderamente infartados y 98% de los segmentos completamente normales, eran identificados adecuadamente mediante el uso de ecocardiografía strain63.
Paciente con infarto de miocardio anterior. Cada trazo representa un segmento del ventrículo izquierdo. Los segmentos apicales están disquinéticos (color azul en el mapa polar) mientras los otros segmentos están hipoquinéticos. Tomada de: Smiseth OA, Torp H, Opdahl A, Haugaa KH, Urheim S. Myocardial strain imaging: how useful is it in clinical decision making? Eur Heart J. 2016;37:1196–1207.
En la población general el SLG también provee información pronóstica en cuanto a morbilidad y mortalidad cardiovascular posterior a infarto de miocardio. Haugaa et al. encontraron que una combinación de la dispersión mecánica y el strain global muestran el mejor valor predictivo positivo para eventos arrítmicos (21%; IC95%: 6- 46%) en pacientes con FEVI residual >35% posterior a un síndrome coronario agudo (SCA), lo cual puede mejorar la selección de pacientes post infarto de miocardio para la terapia con cardiodesfribilador, particularmente en pacientes con FEVI >35% en quienes no se cumplen las indicaciones actuales para cardiodesfibrilador implantable64. Posteriormente, Biering-Sørensen et al. encontraron que un valor bajo de SLG post infarto de miocardio se asoció con alto riesgo del desenlace primario de falla cardiaca, nuevo infarto de miocardio o muerte cardiovascular (cociente de riesgo, 1,12; IC95%, 1,08–1,17; p<0,001 por cada 1% de descenso en el valor del SLG)65.
Respecto a la utilidad de la STE en el estudio de viabilidad miocárdica se ha encontrado una buena correlación entre el strain longitudinal y la extensión de la cicatrización pos infarto evaluada mediante resonancia magnética cardiaca. Se sabe que valores de strain longitudinal menores de −4,5% en regiones de miocardio con extensa cicatrización evidenciada por resonancia, tienen sensibilidad y especificidad del 81% para predicción de miocardio no viable66. Por tanto, la medición del strain puede convertirse en una herramienta fácil, rápida y económica para la evaluación de viabilidad de segmentos posinfarto, antes de la utilización de otros medios diagnósticos más complejos.
Otra promisoria aplicación de la STE es predecir la presencia y severidad de estenosis coronaria en pacientes con sospecha de angina estable, optimizando los métodos de estratificación no invasiva que existen en la actualidad67,68. Biering-Sørensen et al. encontraron que los pacientes con angina de pecho y enfermedad arterial coronaria (EAC) significativa (estenosis >70% en la luz de una arteria epicárdica), tenían un valor menor en el SLG comparado con los que no tenían EAC significativa (−17,1 ± 2,5% vs. −18,8 ± 2,6%; p<0,001) y el SLG permanece como un predictor independiente para EAC significativa (razón de probabilidades, 1,25 [p=0,016] por cada 1% de descenso en el SLG). Igualmente, se evidenció que adicionar la medición del SLG a una prueba de esfuerzo mejora las características operativas del test al aumentar el área bajo la curva (ABC) de 0,78 (prueba de esfuerzo sola) a 0,84 (prueba de esfuerzo más SLG) p 0,00767. Posteriormente, Radwan et al. hallaron un valor en el SLG de −15,6% [ABC 0,88, IC95% 0,78–0,96 p< 0,000], con sensibilidad, especificidad y exactitud del 93,1%; 81,8% y 90% respectivamente, para el diagnóstico de EAC significativa68. Por último, en ambos estudios, cuanto más severa fue la EAC menor el SLG.
En cuanto al SC este ha demostrado mejor capacidad de diferenciación entre infartos transmurales y no transmurales en comparación con los otros tipos de strain e incluso con los puntajes visuales ecocardiográficos de motilidad segmentaria, con sensibilidad y especificidad de hasta 75 y 78%, respectivamente69.
Las guías actuales aún no recomiendan la cuantificación del strain debido a la ausencia de rangos de referencia, baja reproducibilidad e importante variabilidad inter observador en el contexto del paciente con enfermedad coronaria.
Strain en falla cardiaca con fracción de eyección preservadaAunque todavía no se ha establecido la relación entre los síntomas por falla cardiaca (FC) y los hallazgos del strain, el strain del ventrículo izquierdo representa una herramienta de ayuda para diferenciar el origen de la disnea. El uso del SLG junto con otros parámetros de función diastólica como E/e’, E/A y biomarcadores como el NT-proBNP pueden ayudar a establecer el diagnóstico de falla cardiaca con FEVI preservada. Un estudio demostró correlaciones importantes entre los parámetros del speckle tracking y los índices convencionales de disfunción diastólica y presiones de llenado70.
Kosmala et al. realizaron test de ejercicio cardiopulmonar a 207 pacientes con falla cardiaca con FEVI preservada sintomáticos (NYHA II y III) y 60 asintomáticos con tolerancia normal al ejercicio, disfunción diastólica, hipertrofia ventricular izquierda y/o SLG reducido. Luego del ejercicio, la relación E/e’ disminuyó levemente en los pacientes asintomáticos con FC con FEVI preservada, mientras que en pacientes sintomáticos la relación aumentó significativamente. Por otra parte, el SLG incrementó luego del ejercicio en ambos grupos, principalmente en el grupo asintomático. Las curvas ROC demostraron que el comportamiento del SLG durante el ejercicio representa el mejor predictor de falla cardiaca con fracción de eyección preservada sintomática, mucho mejor que el comportamiento de la FEVI y la E/e’ durante el ejercicio71.
El estudio PARAMOUNT confirmó que el SLG es mucho más bajo en pacientes con falla cardiaca con fracción de eyección preservada que en los controles y pacientes hipertensos (−20,0 ± 2,1 vs. −17,07 ± 2,04 vs. −14,6 ± 3,3%, respectivamente, p < 0,001 para todos). De igual modo, menores valores de SLG se asociaron a mayores niveles de pro-BNP72.
El estudio TOPCAT no sólo mostró que el SLG era significativamente menor en pacientes con falla cardiaca con fracción de eyección preservada sino también que el SLG disminuido (definido como < −15,8%) era predictor del desenlace compuesto (muerte cardiovascular, hospitalización por falla cardiaca, o paro cardiaco abortado), muerte cardiovascular y hospitalización por falla cardiaca independientemente de parámetros clínicos o ecocardiográficos convencionales73.
Sin embargo, un metaanálisis reciente que analizó 2.284 pacientes con falla cardiaca con fracción de eyección preservada y 2.302 controles, confirma que, aunque el SLG del ventrículo izquierdo está significativamente alterado en una alta proporción de pacientes con falla cardiaca con fracción de eyección preservada, se necesitan más estudios multicéntricos de gran tamaño con el objetivo de confirmar la función pronóstica de la GLS anormal en falla cardiaca con fracción de eyección preservada, debido a la amplia variabilidad en los resultados de los estudios publicados a la fecha74.
Strain en la evaluación de la aurícula izquierdaLa aurícula izquierda desempeña un papel fundamental para mantener el llenado del ventrículo izquierdo, ya que funciona como reservorio para el flujo de las venas pulmonares durante la sístole, como conducto para el flujo de la sangre dentro del ventrículo izquierdo durante la diástole temprana y como una bomba durante la diástole tardía75. Así, cualquier alteración en la mecánica de la aurícula izquierda se verá reflejada en el llenado ventricular y en una disminución de la función cardiovascular total, asociándose a falla cardiaca con fracción de eyección preservada76. Por esta razón, en ausencia de fibrilación auricular (ventrículo izquierdo), valvulopatía mitral o gasto cardiaco incrementado, el tamaño y función de la aurícula izquierda sirve como un sustituto de la función diastólica del ventrículo izquierdo77.
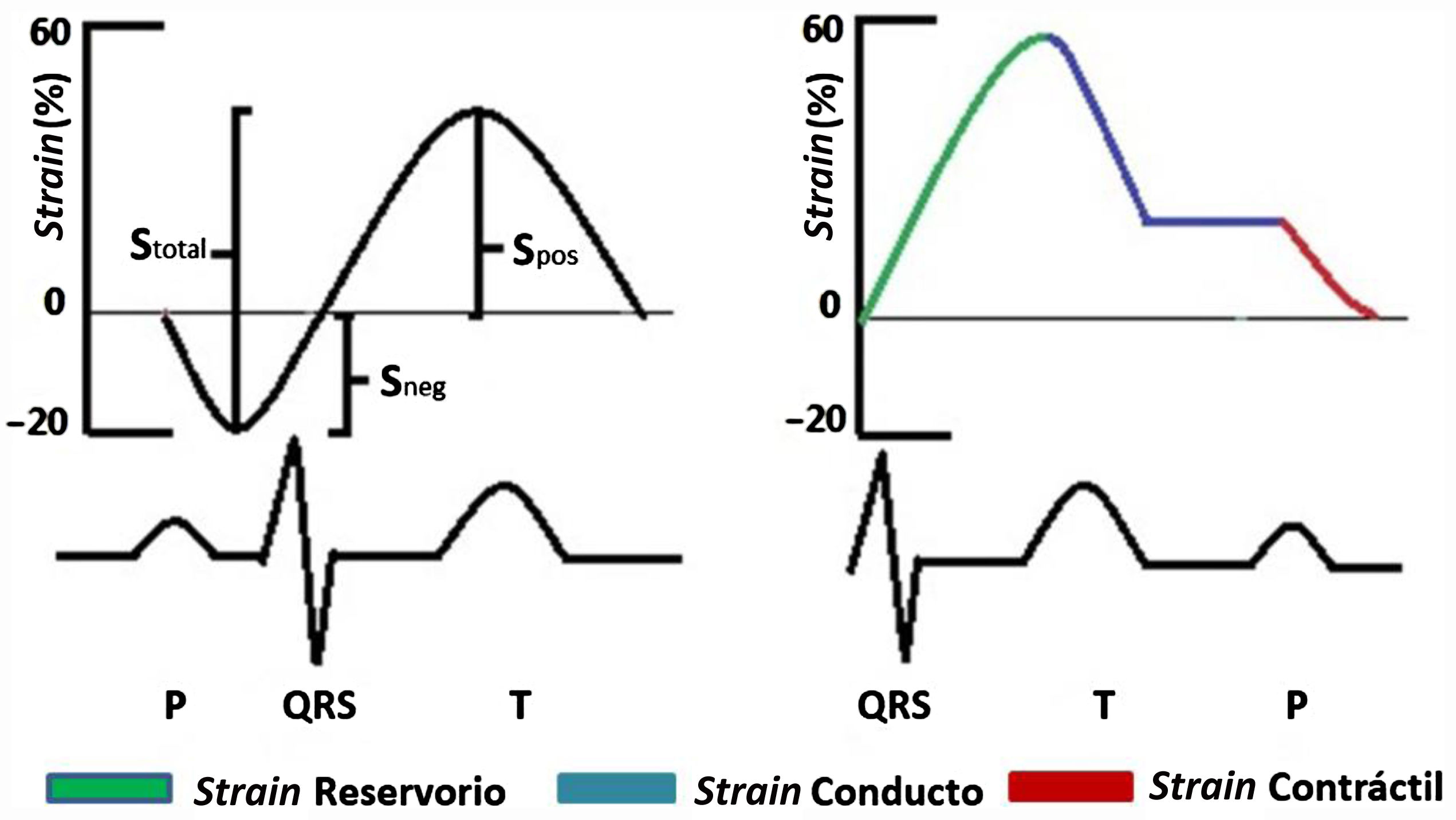
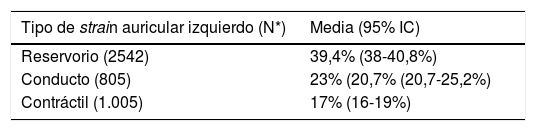
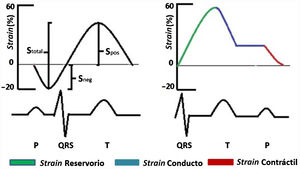
Teniendo en cuenta que las técnicas ecocardiográficas actuales para medir la función diastólica tienen diversas limitaciones (por ejemplo: dependencia del ángulo, calcificación del anillo mitral, disfunción regional, arritmias, entre otras), la STE surge como una alternativa de medición en tales casos77. Únicamente el strain longitudinal se mide en la aurícula izquierda debido a la orientación de las fibras y a la delgadez de la pared auricular. El strain longitudinal medido en la aurícula izquierda a su vez se puede dividir en tres fases: fase de reservorio durante la sístole ventricular, la cual obliga a la aurícula izquierda a distenderse para el llenado por las venas pulmonares por tal razón el valor es positivo; fase de conducto, cuando se abre la válvula mitral la aurícula vacía su contenido en el ventrículo izquierdo y el strain disminuye manteniéndose en forma de meseta lo cual corresponde a la diástasis y finalmente la fase contráctil en la cual la aurícula izquierda se contrae y la pared auricular se acorta y por consiguiente el strain será negativo (fig. 6). Pathan et al. publicaron un metaanálisis a partir del cual determinaron los valores de corte para el strain de reservorio, conducto y contráctil (tabla 1)78.
Valores normales del strain auricular izquierdo, Ecocardiografía speckle tracking
| Tipo de strain auricular izquierdo (N*) | Media (95% IC) |
|---|---|
| Reservorio (2542) | 39,4% (38-40,8%) |
| Conducto (805) | 23% (20,7% (20,7-25,2%) |
| Contráctil (1.005) | 17% (16-19%) |
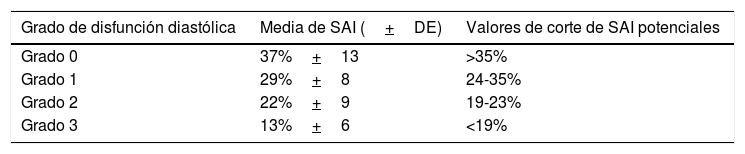
Hasta un 80% de los pacientes con falla cardiaca con fracción de eyección preservada tienen disfunción diastólica la cual se puede dividir en cuatro grados según el valor del strain pico (punto de máxima deformación) en la aurícula izquierda79 (tabla 2). A través de estudio hemodinámico el strain auricular izquierdo ha demostrado identificar mejor la disfunción diastólica que el volumen auricular izquierdo indexado dada su capacidad de predecir una presión de fin de diástole del ventrículo izquierdo elevada, un marcador de disfunción diastólica ampliamente utilizado80. Asimismo, el strain de reservorio ha demostrado ser un mejor predictor que la relación E/e’ de una presión de fin de diástole del ventrículo izquierdo mayor a 12mm Hg81.
Valores de strain pico auricular izquierdo y asociación con la disfunción diastólica
| Grado de disfunción diastólica | Media de SAI (+DE) | Valores de corte de SAI potenciales |
|---|---|---|
| Grado 0 | 37%+13 | >35% |
| Grado 1 | 29%+8 | 24-35% |
| Grado 2 | 22%+9 | 19-23% |
| Grado 3 | 13%+6 | <19% |
SAI: strain auricular izquierdo. DE: desviación estándar
Por otro lado, no todos los pacientes con disfunción diastólica tienen falla cardiaca con fracción de eyección preservada76. En una cohorte de 83 pacientes sintomáticos hospitalizados, un SLG de reservorio auricular <17% tuvo sensibilidad del 89% y especificidad deI 55% para el diagnóstico de falla cardiaca con fracción de eyección preservada82. Otro estudio encontró que el SLG de reservorio auricular comparado con otras variables ecocardiográficas de disfunción diastólica (E/A, E/e’ y volumen auricular izquierdo indexado) se relaciona más fuertemente con una presión de cuña pulmonar elevada, mientras que el strain contráctil no83. También, en pacientes con diagnóstico de falla cardiaca con fracción de eyección preservada, tanto el strain de reservorio, como conducto y contráctil están asociados con el desenlace compuesto de hospitalización cardiovascular o muerte y un strain de reservorio alterado se asocia a un volumen de aurícula izquierda y a una masa de ventrículo izquierdo incrementados, al igual que a péptidos natriuréticos elevados, presión de arteria pulmonar y resistencia vascular pulmonar elevada; y gasto cardiaco y consumo pico de oxígeno disminuidos84.
Aunque se requiere validación adicional, el strain de la aurícula izquierda puede ayudar en el diagnóstico de la falla cardiaca con fracción de eyección preservada, estimar con exactitud las presiones de llenado del ventrículo izquierdo, así como la capacidad funcional y proveer información pronóstica relevante76. Por el momento, el escaso grosor parietal auricular izquierdo, la presencia de la auriculilla y el flujo de las venas pulmonares generan limitación en la aplicación de este método, aunado a la ausencia de estandarización de medidas, lo cual requiere estudios prospectivos85.
Finalmente, en la actualidad se estudian otras múltiples y potenciales aplicaciones del strain de la aurícula izquierda, como por ejemplo la predicción de desarrollo del ventrículo izquierdo en enfermedad renal crónica, neumopatías y accidente cerebrovascular. De igual forma, se estudia el impacto para predecir recurrencia de ventrículo izquierdo postprocedimientos electrofisiológicos y el riesgo trombótico en pacientes con esta enfermedad. Recientemente el strain de aurícula izquierda también se ha asociado como indicador de la necesidad de cirugía cardíaca temprana en insuficiencia mitral moderada-severa.
FinanciaciónNinguna.