Se ha establecido que el plasma rico en plaquetas (PRP) autólogo, activado y suplementado con antibiótico conjuga los beneficios de un sistema biodegradable de liberación local y favorece la inhibición del crecimiento bacteriano y la acción osteoinductora proporcionada por los factores plaquetarios que activan la osteogénesis.
Materiales y métodosSe empleó para la preparación del gel PRP unidades de plaquetas de donantes sanos, el cual se activó con CaCl2 y se suplementó con diferentes concentraciones de 12 antibióticos. La capacidad de retención y liberación del antibiótico del PRP activado fue evaluado por inhibición del creamiento de la cepa Staphylococcus aureus (ATCC 29213) en diferentes tiempos de exposición (de 1 a 21 horas) mediante el uso del método de Kirby Bauer. La concentración inicial y final de oxacilina después del proceso de liberación del PRP activado se determinó por medio de cromatografía líquida de alta resolución (HPLC).
ResultadosAntibióticos como rifampicina, vancomicina, tetraciclina, tigeciclina, clindamicina y trimetoprim-sulfametoxazol presentaron una liberación in vitro más lenta (más de 21 horas) en comparación con gentamicina, eritromicina, ciprofloxacina, linezolid, oxacilina, cloranfenicol (menos de 21 horas), aunque todos son buenos candidatos para el posible uso en infecciones óseas. Antibióticos como vancomicina, tetraciclina trimetoprim-sulfametoxazol, eritromicina, ciprofloxacina, linezolid y cloranfenicol requieren una concentración mayor a 4 ug/ml para lograr la inhibición del crecimiento bacteriano de S. aureus in vitro. El gel de PRP activado tiene la capacidad de retener el 12,5% de oxacilina a las 21 horas.
DiscusiónEn general el gel de PRP tiene una buena capacidad de retención y liberación de todos los antibióticos evaluados.
Nivel de evidencia clínicaNivel III.
It has been theorized that antibiotic loaded autologous platelet rich plasma (PRP) gel inhibits in vitro growth of bacteria, resembling an antibiotic local delivery system.
Materials & methodsFresh PRP obtained from healthy donors was activated with CaCl2 and loaded with 12 different antibiotics (oxacillin, gentamicin, vancomycin, trimethoprim/sulfamethoxazole, clindamycin, erythromycin, linezolid, tigecycline, tetracycline, chloramphenicol, rifampicin, and ciprofloxacin). The ability of the PRP to retain and release antibiotics was evaluated by conventional S. aureus (ATCC 29213) bacterial growth inhibition through the Kirby Bauer method at several times (1 to 21hours). Initial and final antibiotic load of each PRP sample was evaluated by high-pressure liquid chromatography (HPLC).
ResultsWe had found out that rifampicin, tetracycline, vancomycin, tigecycline, clindamycin, and trimethoprim/sulfamethoxazole, showed a slow release rate (more than 21 hours), as well as gentamicin, erythromycin, ciprofloxacin, linezolid, oxacillin and chloramphenicol showed a fast release rate (less than 21 hours), all of them producing effectively bacterial growth inhibition. Vancomycin, tetracycline, trimethoprim/sulfamethoxazole, erythromycin, ciprofloxacin, linezolid, and chloramphenicol required a higher concentration (more than 4 mg/ml) on PRP gel to effectively achieve in vitro bacterial growth inhibition. PRP showed an ability to retain 12.5% of oxacillin at 21 hours.
DiscussionPRP gel showed a good retention and release ability with all the evaluated antibiotics.
Evidence LevelIII.
La mayoría de los algoritmos para el manejo de las infecciones osteomusculares comprende un régimen en el cual se realiza retirada del material de osteosíntesis, lavado más desbridamiento de la zona, seguido por una terapia antibiótica que generalmente tiene un tiempo de duración entre 4 y 6 semanas1,2.
El mecanismo de acción de los antibióticos sistémicos en las infecciones musculoesqueléticas se basa en la distribución del antibiótico a través de la circulación sanguínea hacia el tejido con el fin de alcanzar concentraciones adecuadas de antibiótico en el sitio de infección y así lograr inhibir el crecimiento bacteriano. Sin embargo, en la mayoría de las infecciones en ortopedia, las bacterias están aisladas dentro de un tejido necrótico o granular, en el cual es posible que la terapia sistémica no alcance las concentraciones adecuadas para evitar la proliferación y el crecimiento bacterianos. Estas bacterias adquieren un estado sésil una vez que han colonizado el tejido óseo o los implantes ortopédicos, y reducen su actividad metabólica, lo cual es favorecido por la película de polímero de glucocáliz denominada biopelícula, que ayuda a proteger a la población bacteriana de los agentes antimicrobianos y reduce la efectividad de procesos inmunológicos como la opsonización o la fagocitosis.
Para garantizar la muerte de las bacterias que están organizadas en una biopelícula, es necesario elevar las concentraciones de antibiótico con efecto bactericida entre 10 y 100 veces, pero dicha elevación no se puede alcanzar de manera segura por vía parenteral, dada su toxicidad3–5, por lo cual la erradicación bacteriana en el caso de las infecciones de tejidos musculoesqueléticos es poco exitosa. Por ello, todos los protocolos actuales de tratamiento de infecciones en tejidos musculoesqueléticos recomiendan el desbridamiento y el uso de antibióticos tanto locales como sistémicos.
Durante décadas se ha perseguido un sistema ideal de entrega local de antibiótico ya que este tipo de sistemas permite la liberación de antibiótico de forma local en concentraciones muy elevadas y evita los riesgos y las posibles reacciones adversas de una terapia antibiótica en dosis elevadas por vía sistémica. Este sistema ideal debería tener ciertas características, como estar formado por sustancias biocompatibles, con elución predecible, ser económico, capaz de liberar localmente niveles altos de antibióticos que eviten la proliferación bacteriana, ser seguro, de fácil implantación y que no requiera ser extraído.
A diferencia de los nuevos implantes o medicamentos que requieren una aprobación por la FDA (U.S. Food and Drug Administration), el plasma rico en plaquetas (PRP) es una producto autólogo y derivado sanguíneo que favorece la entrega de factores de crecimiento y tiene los beneficios de ser un sistema biodegradable. El PRP inicialmente se describió como un suplemento aplicado en forma tópica para la integración de injertos óseos dentales6 aunque actualmente está siendo utilizado para múltiples procedimientos en cirugía ortopédica, entre los cuales se incluye hemostasia en heridas, tendinopatías, coadyuvante en la integración de injertos óseos, úlceras asociadas con el pie diabético, en heridas traumáticas y en artroplastias para el manejo del dolor y la movilidad. También se están desarrollando estudios para determinar su efectividad en el manejo de falta de unión y retraso en la consolidación7–11.
El PRP es una fuente de factores de crecimiento y proteínas inductoras, entre los cuales se encuentran los factores de crecimiento derivados de las plaquetas, el factor de crecimiento transformante β, el factor de crecimiento insulínico, el factor de crecimiento epidérmico y el factor de crecimiento de los fibroblastos, entre otros12,13. Se cree que estos factores desempeñan un papel crítico en la regulación de procesos celulares como la osteogénesis, estimulación de quimiotaxis y diferenciación celular en el sitio de la intervención que favorece mayor velocidad de mineralización del colágeno en las reparaciones óseas de sitios de injerto, lo que promueve una integración más rápida de éstos y mejora la densidad del hueso trabecular en el 15-30%14. Debido a estas características se evalúa la capacidad in vitro del gel de PRP activado para retener y liberar localmente diferentes tipos de antibióticos.
Materiales y métodosPara determinar la liberación de antibióticos diferentes del gel de PRP (oxacilina [OXA], cloranfenicol [CHL], tetraciclina [TET], eritromicina [ERY], clindamicina [CLI], gentamicina [GEN], ciprofloxacina [CIP], linezolid [LNZ], trimetoprim/sulfametoxazol [STX], vancomicina [VAN] y rifampicina [RIF]), se realizó un estudio in vitro en que se evaluó la inhibición del crecimiento de una cepa conocida de Staphylococcus aureus mediante un estudio estandarizado, controlado con el método de difusión en Agar, según los parámetros establecidos por el Clinical and Laboratory Standards Institute (CLSI).
Obtención de plasma rico en plaquetasSe obtuvo de sangre total venosa con solución de citrato de sodio. Los tubos se centrifugaron a 3.000 rpm durante 5 minutos para permitir la obtención de capa leucocitaria o plasma rico en plaquetas libres de eritrocitos. También se emplearon unidades de concentrados de plaquetas obtenidas a partir de donaciones voluntarias de sangre total. La verificación del recuento plaquetario en sangre total y PRP se realizó con el analizador hematológico Advia 60 de Bayer®.
Gel de plasma rico en plaquetasEn placas de polietileno estériles de 24 pozos se adicionaron 500 ul del PRP y se suplementó con 13 μl de los siguientes antibióticos: OXA, CHL, TET, ERY, CLI, GEN, CIP, LNZ, STX, VAN y RIF en concentraciones de 1, 2, 4, 8 y 32 μg/ml y activado con 15 μl de solución de cloruro de calcio al 10%. Se incubó durante 30 minutos a temperatura ambiente hasta visualizar la formación del agregado plaquetario con consistencia y tamaño adecuados. Fue necesario estandarizar la cantidad de PRP, la solución de cloruro de calcio y el tiempo de incubación.
Susceptibilidad in vitro del gel de PRPSe determinó mediante el método de Kirby Bauer en agar Mueller-Hinton (Becton Dickinson). El gel de PRP suplementado con las diferentes concentraciones de antibióticos se adicionó a la superficie de las placas de agar inoculadas con la cepa de S. aureus (ATCC 29213) y se incubó durante 24 horas a 37 ˚C. La actividad antimicrobiana se evaluó teniendo en cuenta el diámetro del halo de inhibición.
Determinación del tiempo de liberación del antibióticoSe realizó por medio del método de Kirby Bauer, mediante la transferencia del gel de PRP suplementado con antibióticos a una nueva placa inoculada con la cepa de S. aureus (ATCC 29213) cada 2 horas hasta completar 21 horas. Todas las placas se incubaron durante 24 horas a 37 ˚C. Las concentraciones iniciales de antibióticos utilizadas fueron 65 μg/ml de VAN, TET, CLI, STX, GEN, ERY, LNZ y OXA; 130 μg/ml de CIP y 32 μg/ml de CHL. Como control interno se empleó un sensidisco comercial de cada antibiótico y se emplearon los criterios del CLSI.
Cromatografía liquida de alta presión (HPLC)La concentración inicial y final de oxacilina fue determinada con un cromatógrafo Perkin Elmer con módulo de selección para 4 disolventes con un detector UV-VIS y una columna RP18 (Merck). La fase móvil utilizada fue MeOH:H2O 60:40, a un flujo de 1 ml/min y a una temperatura de 30°C. La detección del antibiótico se realizó a 240 nm. Todos los volúmenes de inyección fueron 25 ul. Se evaluó la proporcionalidad de respuesta en un intervalo (rango) de concentraciones. Con los datos experimentales se realizó un tratamiento de mínimos cuadrados para obtener la recta de mejor ajuste (curva de calibración) a partir de un mínimo de 5 datos, cada uno de ellos por triplicado. Los intervalos de concentración del reactivo analítico fueron desde 0,6 ug/ml a 12 ug/ml. La extracción del antibiótico del plasma activado se realizó por fase solida utilizando cartuchos Sep Pack C18, previa precipitación de las proteínas con metanol.
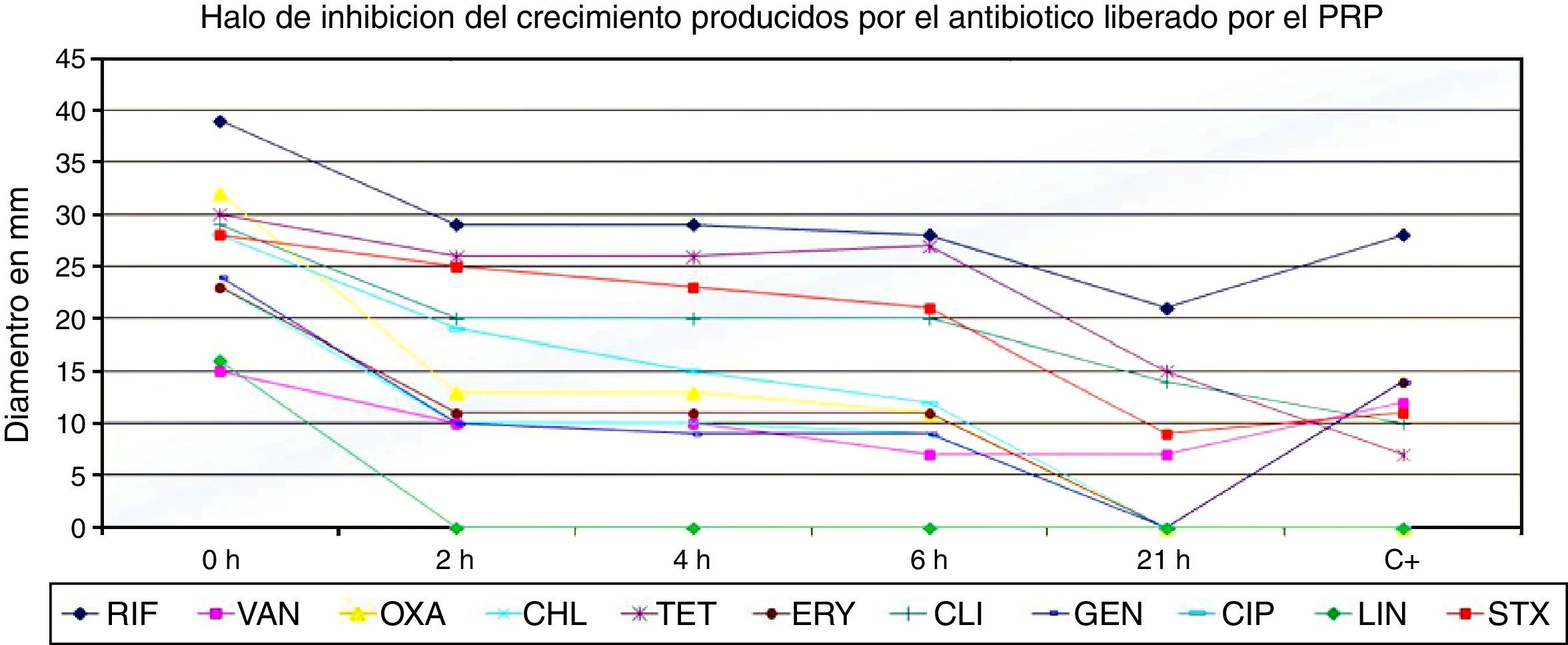
ResultadosSusceptibilidad in vitro del gel de PRPLos datos obtenidos de los halos de inhibición del gel de PRP indican que en general este sistema presenta un buen desempeño en la liberación de los antibióticos evaluados, excepto del LNZ, puesto que no se observa liberación de este antibiótico a partir de las 2 horas. En el caso de RIF, TET y CLI se observa la formación de halos de inhibición de un diámetro mayor de 15 mm después de las 21 horas de aplicación. Igualmente es notoria la capacidad de liberación que presenta el PRP suplementado con TET (15 mm) que supera al sensidisco de antibiótico comercial empleado como control que forma un halo de inhibición de 7 mm a las 21 horas de incubación (fig. 1).
Diámetro del halo de inhibición de la cepa de S. aureus (ATCC 29213) por el método Kilby Bauer producido por el plasma rico en plaquetas suplementado con diferentes antibióticos. CHL: cloranfenicol; CIP: ciprofloxacina; CLI: clindamicina; ERY: eritromicina; GEN: gentamicina; LNZ: linezolid; OXA: oxacilina; RIF: rifampicina; STX: trimetoprim/sulfametoxazol; TET: tetraciclina; VAN: vancomicina; C+: control positivo: sensidiscos comerciales marca Oxoid.
En general, el gel de PRP tiene una buena capacidad para la retención y liberación de los antibióticos evaluados, En la figura 1 se reportan los halos de inhibición de los diferentes antibióticos, a diferentes concentraciones, se ponen de manifiesto halos que se encuentran entre 5 y 39 mm, entre los cuales el halo de inhibición más bajo es el de la TET, a una concentración de 8 ug/ml y el mayor, el de la RIF, que generó halos de 39 mm a concentraciones de 32 ug/ml. Además se pone de manifiesto cómo antibióticos como VAN, TET, STX, ERY, CIP, LNZ y CHL requieren concentraciones mayores de 4 ug/ml para lograr una inhibición del crecimiento de S. aureus in vitro.
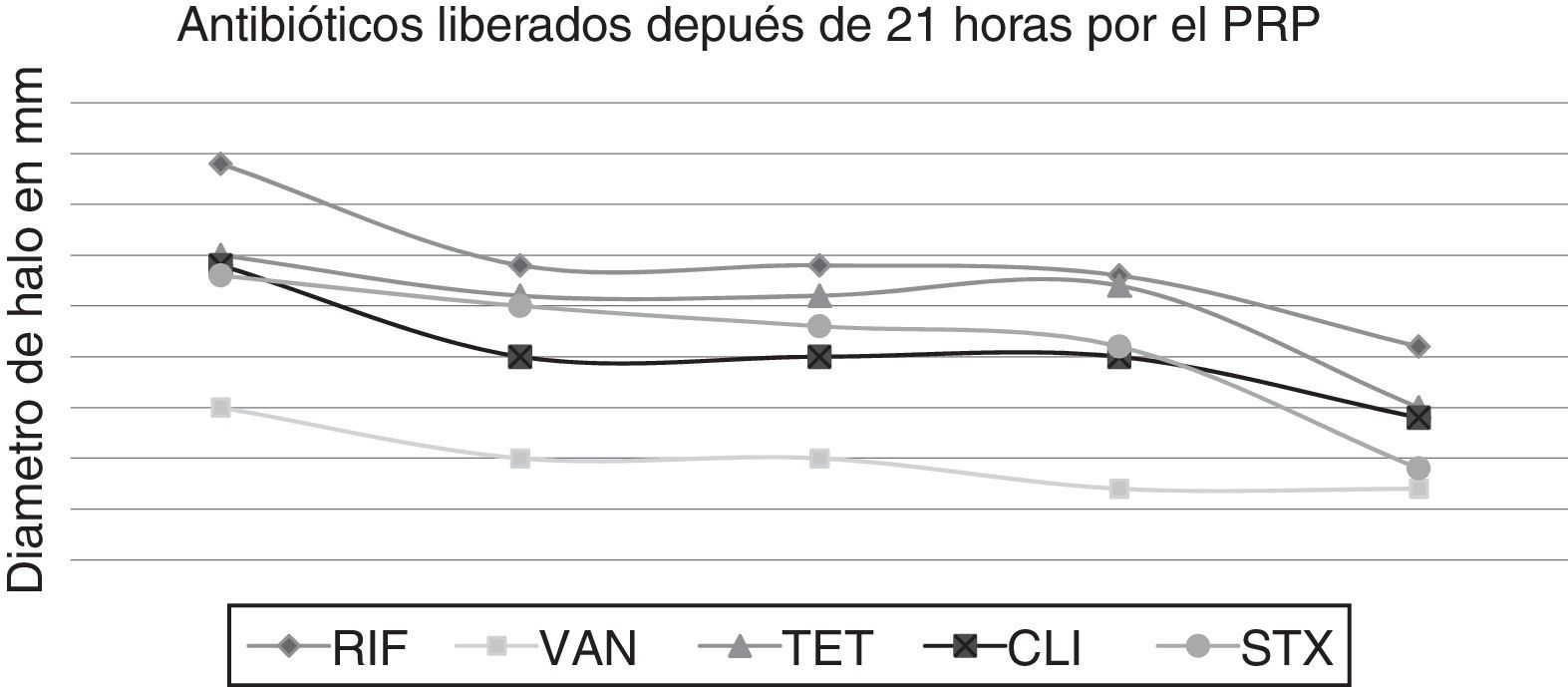
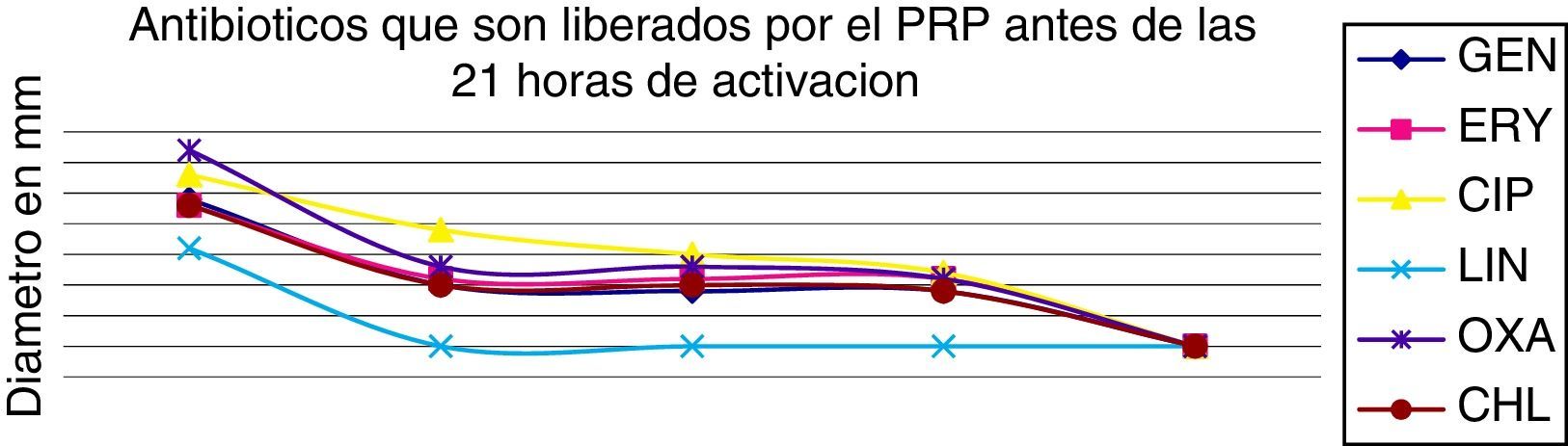
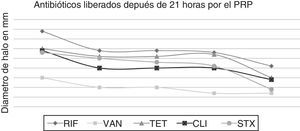
Tiempos de liberación de los antibióticosAntibióticos como RIF, VAN, TET, tigeciclina, CLI y STX presentaron una liberación más lenta durante más de 21 horas, como se pone de manifiesto en la figura 2, en comparación con GEN, ERY, CIP, LNZ, OXA y CHL, en los cuales la liberación fue de forma más rápida antes de 21 horas, como se pone de manifiesto en la figura 3.
A las 21 horas, el gel de PRP activado mantiene una concentración del 12,5% (dato obtenido por HPLC) de OXA respecto a la concentración inicial empleada (65 μg/ml). Esta retención del medicamento posiblemente aumenta la concentración local del antibiótico y potencia la actividad del tratamiento suministrado por vía intravenosa.
DiscusiónEl tratamiento y la profilaxis ideal en ortopedia continúan siendo un tema controvertido. Desde los sistemas de entrega local de antibióticos iniciales introducidos por Buchholz et al.15, se han diseñado múltiples sistemas, los cuales están ganando interés especial dada la capacidad que tienen de brindar altas concentraciones locales con un riesgo mínimo de toxicidad. El primer sistema de entrega local de antibiótico descrito y aprobado por la FDA fue el polimetilmetacrilato. A pesar de que ha se demostrado su efectividad en múltiples estudios16,17, el uso del PMMA genera también unas serias preocupaciones, como es el hecho de que, luego de liberar por completo el antibiótico o iniciar su liberación de forma subterapéutica, actúa como un cuerpo extraño en el organismo y se convierte en una superficie amigable para la proliferación y el crecimiento de las bacterias18–20, y genera una resistencia bacteriana por la liberación prolongada de antibiótico en rangos subterapéuticos, lo que ha hecho que de forma constante se estén estudiando materiales biodegradables alternativos.
El gel de plasma rico en plaquetas, como demostraron Camargo et al., en estudio in vitro actúa como un sistema de entrega local de antibióticos e inhibe el crecimiento bacteriano.
En la actualidad, no existe ningún sistema de entrega local de antibiótico biodegradable que haya sido aprobado por la FDA como manejo de infecciones musculoesqueléticas21. Debido al gran interés que genera el tema, se encuentran en un constante estudio materiales alternativos biodegradables, como injertos óseos, sustitutos óseos, compuestos a base de proteínas y polímeros sintéticos que buscan ese sistema de entrega local ideal.
Se cree que la adición de sistemas de entrega local de antibiótico como terapia coadyuvante en el manejo de ciertas patologías es altamente efectiva en la erradicación y prevención de la infección22,23.
Los sistemas actuales aprobados por la FDA, como los cementos precargados para su liberación de antibiótico, dependen de unas propiedades específicas, como la porosidad, el tamaño de la superficie y la concentración del antibiótico24–28.
La elección de los antibióticos en este tipo de sistemas está limitada a aquellos que son termoestables ya que la polimerización del cemento es una reacción exotérmica que genera gran cantidad de calor29, deben ser hidrosolubles para generar una difusión a los tejidos circundantes y permitir una liberación gradual a lo largo del tiempo para lograr un efecto bactericida sostenido. Los antibióticos más utilizados son vancomicina, gentamicina, tobramicina y cefalosporinas, los cuales pueden combinarse para mejorar el espectro en ciertas infecciones30,31.
Actualmente se ha establecido que los espaciadores de cemento precargados pueden liberar antibióticos hasta 4 meses luego de su implantación. Los niveles de antibiótico son mucho mayores a los conseguidos por la terapia sistémica; las concentraciones locales aumentan inmediatamente tras la implantación, y se mantienen por encima de las concentraciones inhibitorias mínimas para el manejo de la mayoría de las infecciones32–34 aunque sus concentraciones en suero y orina permanecen bajas con pocos efectos sistémicos35–37. Estas propiedades generan niveles altos de antibiótico en el sitio de infección que conducen a mejor efectividad antimicrobiana y posiblemente mejor resultado.
Se requieren estudios adicionales para ayudar a determinar un sinnúmero de variables desconocidas asociadas con el uso de los sistemas de entrega local de antibiótico, entre las cuales están el biomaterial ideal, la combinación de antibióticos adecuada que pueda utilizarse de forma eficaz y segura, establecer las características de elución que deben tener estos materiales para liberar de forma predecible la cantidad y la concentración deseada, definir efectos a nivel local de las altas concentraciones de antibiótico en cuanto a la cicatrización de los tejidos, proceso regenerativo óseo que forman parte fundamental del manejo de las infecciones musculoesqueléticas ya que en estudios animales se ha puesto de manifiesto el efecto adverso de las quinolonas en la regeneración ósea38, lo que genera anormalidades en la morfología del callo óseo, en el cartílago, con alteraciones en la osificación endocondral y disminuye el número de condorcitos comparados con los controles.
El PRP activado y mezclado con antibiótico forma redes de fibrina que absorben el antibiótico y lo liberan de forma controlada al medio. En estudios previos muestra cómo hay un comportamiento heterogéneo en cuanto a la elución de todos los antibióticos, lo que sugiere que cada antibiótico tiene una capacidad de difusión propia, la cual debe tenerse en cuenta si se quiere emplear el gel de PRP como transportador y sistema de entrega local de antibiótico.
Lo que muestra el estudio del gel de PRP es la capacidad de retención y liberación de todos los antibióticos evaluados, en los resultados se pone de manifiesto cómo antibióticos, como rifampicina, vancomicina, clindamicina y trimetoprim-sulfametoxazol presentaron una liberación más lenta (más de 21 horas), en comparación con gentamicina, ciprofloxacina, linezolid y oxacilina, cuya liberación se produjo en menos de 21 horas.
Antibióticos como vancomicina, tetraciclina, trimetoprim-sulfametoxazol, eritromicina, ciprofloxacina, linezolid y cloranfenicol requieren una concentración mayor de 4 ug/ml para lograr la inhibición del crecimiento de S. aureus in vitro, lo cual sugiere que para su uso en infecciones musculoesqueléticas sea necesario una concentración mayor de antibiótico para alcanzar la concentración inhibitoria mínima local.
El gel de PRP activado tiene la capacidad de retener el 12,5% de la oxacilina a las 21 horas. Esta retención del medicamento posiblemente aumente la concentración local del antibiótico y potencie la actividad de la terapia suministrada por vía intravenosa.
El sistema de entrega local de antibiótico ideal todavía está lejos de alcanzarse. Sin embargo, las investigaciones en este campo están creciendo de manera acelerada. Dada su ausencia, genera que en la actualidad se utilicen sistemas que vienen precargados de antibiótico, los cuales no necesariamente se asocian con la sensibilidad de los cultivos tomados en cirugía, con lo que se espera que en el futuro los sistemas de entrega local de antibiótico biodegradables, en los cuales se pueden utilizar los antibióticos de acuerdo con la sensibilidad dada, en los antibiogramas reemplacen los sistemas clásicos utilizados para la misma función y eviten la morbilidad de los pacientes dada la necesidad de intervenciones adicionales para el retiro de éstos.
Responsabilidades éticasDerecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Protección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Conflicto de interesesNinguno de los autores presenta conflicto de intereses.