La fascitis necrotizante es una infección grave de tejidos blandos caracterizada por compromiso local y sistémico asociado a altas tasas de mortalidad. La Aeromona hydrophila como agente etiológico de esta patología no es frecuente; usualmente se presenta en pacientes inmunocomprometidos y conlleva altas tasas de mortalidad. Se presenta el caso de un niño de 8 años de edad, sin antecedente de enfermedades sistémicas, con diagnóstico clínico e histopatológico de fascitis necrotizante con asilamiento microbiológico de A. hydrophila que fue tratado satisfactoriamente con desbridamiento quirúrgico extenso y tratamiento antibiótico.
Necrotizing fasciitis is a severe infection of soft tissues characterized by local and systemic involvement and associated with high mortality rates. Episodes of infection by Aeromona hydrophila as etiological agent of the disease are rare, usually in immunocompromised patients, and with high mortality rates. The cases reported in the pediatric population are even rarer. The case is presented of an 8–year-old with no history of underlying systemic disease with clinical and histopathology diagnosis of necrotizing fasciitis with microbiological isolation of A. hydrophila, with successful treatment secondary to extensive surgical debridement and initiation of antibiotic therapy.
El término fascitis necrotizante, propuesto por Wilson en 1952, describe la necrosis de la fascia por infección1. Se trata de una enfermedad potencialmente mortal, dado el compromiso multisistémico secundario a la rápida progresión de la necrosis en el tejido celular subcutáneo y el músculo. En pacientes inmunocompetentes esta infección se asocia con bacilos gramnegativos (Escherichia coli, Pseudomona aeruginosa), cocos grampositivos (Staphylococcus o Streptococcus) o gérmenes anaerobios (Bacterioides, Clostridium, Peptostreptococcus)2. En pacientes sin comorbilidades que supriman el sistema inmunológico, las fascitis necrotizantes por Aeromona hydrophila son raras, pero por lo general su desenlace es fatal, a pesar de los grandes esfuerzos terapéuticos3.
En niños, la mayoría de las infecciones de piel, tejido celular subcutáneo y músculo secundarias a la infección por A. hydrophila han ocurrido en pacientes con factores de riesgo y compromiso inmunológico: anemia aplásica, talasemia, leucemia o enfermedades hepatobiliares4. Son muy escasos los reportes de fascitis necrotizante en niños inmunocompetentes5.
Las infecciones necrotizantes de los tejidos blandos son clasificadas según la profundidad del tejido comprometido, la gravedad de la infección o la microbiología de la misma. Cuando las infecciones necrotizantes son clasificadas según los gérmenes involucrados, se describen tres tipos: a) Tipo I, en el cual se incluyen infecciones mixtas por aerobios y anaerobios, grampositivos y gramnegativos, b) Tipo II, para las infecciones por Staphylococcus aureus, y c) Tipo III, para las infecciones por Clostridium. Sin embargo, las infecciones asociadas a bacterias acuáticas, entre las que se incluyen generalmente las infecciones por Vibrio vulnificus o Aeromona hydrophila no se pueden incluir acertadamente en ninguno de los grupos de clasificación dadas sus características microbiológicas.
Caso clínicoNiño de 8 años, previamente sano, quien ingresa al servicio de urgencias por cuadro clínico de 30 horas de evolución dado por trauma en el dorso del pie derecho mientras se encontraba nadando en aguas termales azufradas, ocasionando un área de escoriación. Doce horas previas a la valoración inicial en urgencias presenta dolor en el área lesionada, cuya intensidad aumenta de forma progresiva, asociado a limitación funcional, eritema, fiebre cuantificada de 39,5 °C y malestar general. Al examen físico inicial se encuentra el paciente alerta, en regular estado general, con frecuencia cardiaca de 132 latidos por minuto y frecuencia respiratoria de 26 por minuto. Se observa edema en todo el dorso del pie derecho hasta la región maleolar, asociado a calor, rubor, dolor intenso a la movilidad y escoriaciones en el antepié. No se documenta crepitación. Los exámenes de laboratorio muestran leucocitosis de 27 260, neutrófilos 84,4%, plaquetas 309 000, Hb 14,5g/dl, proteína C reactiva 24,7mg/l y VSG 22mm/h. Se toman hemocultivos.
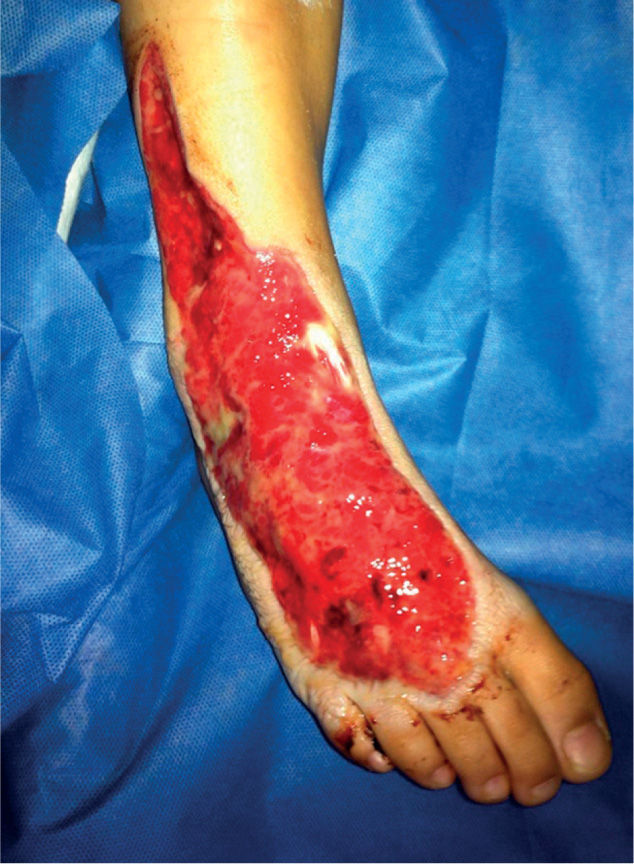
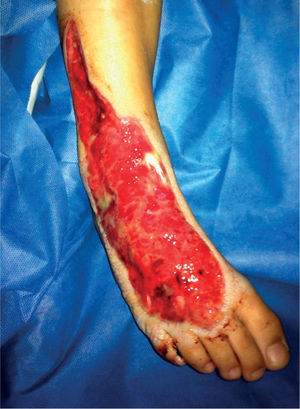
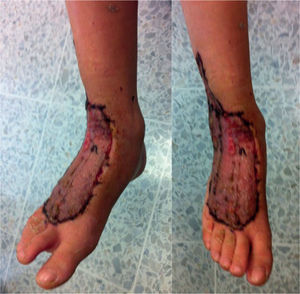
El niño es llevado a cirugía por sospecha de artritis séptica en el tobillo. Se realiza punción articular obteniendo líquido sinovial no sugestivo de infección, sin pérdida de la filancia, con cultivo negativo. Durante el procedimiento quirúrgico, se realiza incisión sobre el área traumática encontrando necrosis de la grasa y fascia de todo el dorso del pie hasta el tercio distal de la pierna, con olor fétido. Se realiza desbridamiento extensivo del dorso del pie (fig. 1). Se toman muestras adecuadas de piel, tejido celular subcutáneo y fascia para estudio histopatológico y cultivo microbiológico de gérmenes aerobios y anaerobios. Se considera diagnóstico intraoperatorio de fascitis necrotizante y se inicia tratamiento antibiótico con clindamicina, piperazilina y tazobactam (7 días).
El paciente es trasladado a la unidad de cuidado intensivo por riesgo de deterioro hemodinámico durante 7 días. Se realiza lavado y desbridamiento quirúrgico en dos oportunidades adicionales. El reporte del cultivo fue positivo para Aeromona hydrophila (abundante crecimiento) —resistente a cefalosporinas de primera generación (cefoxitina), ampicilina sulbactam y ampicilina— y Streptococcus pyogenes —con sensibilidad adecuada para amikacina, aztreonam, cefepime, ceftriaxona, ciprofloxacina, imipenem, meropenem, ácido nalidixico, tigeciclina, piperacilina y tazobactam—. El cultivo para anaerobios y el hemocultivo fueron negativos. El reporte de patología evidenció una hipodermitis supurativa de predominio septal, necrosis grasa y necrosis de licuefacción de la porción profunda y de la fascia; no se identificaron gérmenes en la muestra evaluada.
El paciente es valorado por el servicio de infectología, donde se considera un cambio del esquema antibiótico a ertapenem (por 14 días) y trimetroprim sulfa (por 21 días). Se solicita gammagrafía ósea y resonancia nuclear magnética que descarta compromiso óseo. La evolución clínica fue favorable.
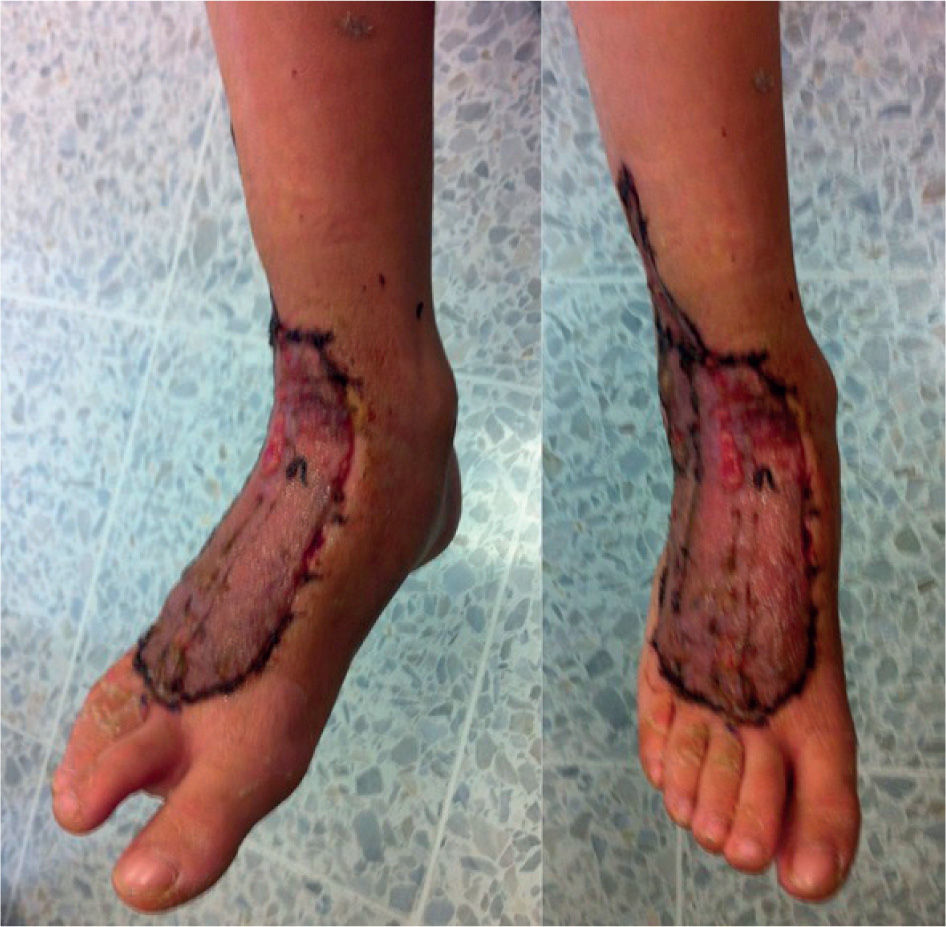
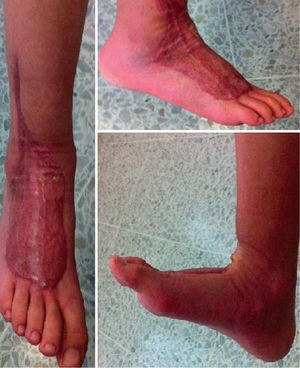
Quince días después del primer desbridamiento, se realizan injertos de piel libre en el área cruenta obteniendo una adecuada integración (fig. 2).
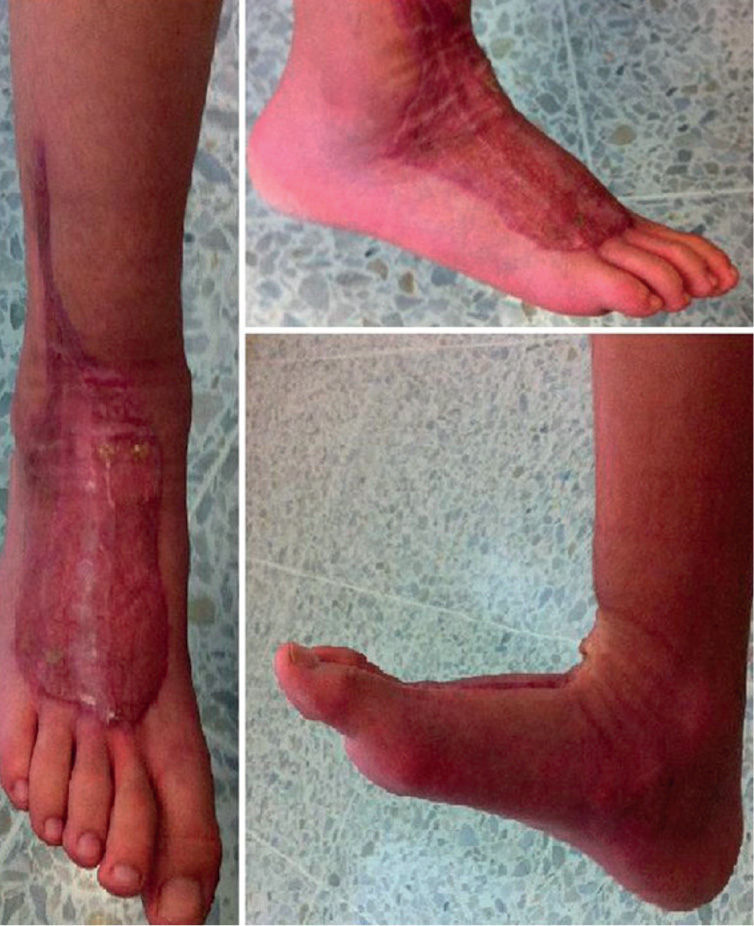
Se inicia plan de rehabilitación ambulatorio con adecuada recuperación de la función de la extremidad, sin dolor y con arco de movilidad articular completo a nivel del tobillo al control realizado un mes después del egreso (fig. 3).
DiscusiónLas bacterias del género Aeromona, previamente incluidas dentro de la familia Vibrionaceae, actualmente se clasifican dentro de la familia Aeromonadaceae de la clase de gamma-proteobacterias, a la que también pertenecen las bacterias del género Oceanimona y Tolumonas6. Las aeromonas son gérmenes gramnegativos flagelados con extremos ovalados que miden aproximadamente entre 1 y 35 micras de diámetro. Son anaerobios facultativos citocromo-oxidasa, catalasa e indol positivos, capaces también de fermentar maltosa, d-galactosa y trehalosa. Las aeromonas también producen un número de factores de virulencia que son foco de investigación microbiológica, entre los que se incluyen aerolisinas, proteasas, adhesinas, enterotoxinas (toxina shiga), fosfolipasa y lipasa. Algunos autores han asociado la producción de enzimas y exotoxinas proteolíticas (hemolisina, enterotoxina) al síndrome tóxico caracterizado por necrosis repentina de los tejidos, de rápida progresión7.
Las aeromonas están presentes en el agua, con la habilidad de formar biofilms y de colonizar sistemas acuáticos; se calcula que las aeromonas hacen parte del 1–27% del total de bacterias del agua potable, con implicaciones como posible fuente de infección8. Adicionalmente, son frecuentemente aisladas en aguas estancadas y también se encuentran en los alimentos, pescado, mascotas domésticas, invertebrados, reptiles y pájaros. Sin embargo, es importante destacar que en muchas especies aisladas no se ha encontrado transmisión hacia los humanos. Se describen actualmente 21 especies de aeromonas, de las cuales A. hydrophila, A. cavidae y A. vernoii son las más frecuentemente aisladas y revisten la mayor importancia clínica.
En humanos, las bacterias del género Aeromona son conocidas por causar principalmente infecciones gastrointestinales, describiéndose en algunos casos avanzados de infección peritonitis, colitis y colangitis8–10. En individuos inmunocomprometidos se han descrito episodios de síndrome hemolítico urémico asociado a cepas productoras de toxina semejante a Shiga.
El segundo lugar más frecuente de infección asociada a aeromonas son los tejidos blandos, encontrándose casos de infección de individuos previamente sanos asociada con lesiones ocurridas en ambientes acuáticos. La infección por aeromonas se produce con mayor frecuencia en agua dulce que en agua de mar. La infección puede ocasionar celulitis, mionecrosis, ectima gangrenoso y osteomielitis. En un pequeño grupo de pacientes, generalmente asociado a estados de inmunosupresión, puede conllevar a septicemia y fascitis necrotizante. Los episodios de septicemia y de infecciones graves usualmente comprometen pacientes con patologías crónicas como: cirrosis, enfermedades malignas, falla renal crónica, diabetes mellitus y uso de esteroides. En pacientes que tienen alguna herida, o la tenían previamente, mientras se bañan en aguas infectadas por este germen, la infección suele ser delimitada y responden de forma adecuada a la cirugía o al tratamiento antibiótico; los episodios sépticos tienen una baja incidencia y son contados los reportes de fascitis necrotizante secundaria en población pediátrica. Sin embargo, los pacientes inmunodeprimidos pueden desarrollar una fascitis necrotizante que les puede comprometer la vida, aun sin observarse una puerta de entrada. En pacientes con quemaduras se ha descrito la infección de tejidos blandos por aeromonas identificando como posible fuente de contaminación al agua utilizada para la realización de las curaciones, generalmente asociada a Enterococcus, Clostridium, Bacillus entéricos y Bacteroides11.
Diferentes estudios han evaluado el perfil microbiológico de la fascitis necrotizante en niños12,13, encontrando predominancia de infecciones polimicrobianas (71% de los casos). En ninguna de estas series se describen infecciones por A. hydrophila; sin embargo, sí resaltan la asociación entre los estados nutricionales deficientes y las patologías concomitantes —como la varicela— y la instauración de patologías sépticas graves de tejidos blandos. La serie de Gold14, en la cual se incluyen únicamente infecciones de tejidos blandos por aeromonas, con un total de 11 pacientes adultos durante un periodo de aproximadamente un año, encuentra en el 27% de los casos antecedente de enfermedad sistémica y en el 78%, antecedente de exposición a agua fresca. En 10 de los 11 pacientes se requirió tratamiento quirúrgico y la incidencia de infección polimicrobiana fue del 82%. Se ha reportado que la tasa de mortalidad de las infecciones por A. hydrophila en este contexto de infección de tejidos blandos oscila entre 56 y 75%15,16.
Dos mecanismos se han propuesto para explicar la aparición de una infección en tejidos blandos por A. hydrophila. El primer mecanismo postula que la bacteria invade a través de áreas de trauma y causa infección primaria de los tejidos blandos con posterior desarrollo de sepsis17, mecanismo documentado en nuestro caso. En el segundo mecanismo, descrito en menos casos y asociado más con otras bacterias gramnegativas, la sepsis es inducida primero por el patógeno ocasionando posteriores metástasis a tejidos blandos con la infección secundaria18,19.
Los diferentes reportes de infecciones necrotizantes por A. hydrophila describen una rápida instauración y progresión del proceso inflamatorio local, generalmente antecedido por el evento traumático. En algunos casos se describe crepitación; sin embargo, no es el común de todos los eventos publicados en la actualidad. En nuestro paciente, en efecto, no se documentó la presencia de crepitación. En la mayoría de episodios descritos en pacientes inmunocompetentes y pacientes inmunodeprimidos, la infección de tejidos blandos y la sepsis suelen resistirse al tratamiento quirúrgico —incluso a la amputación y la terapia antimicrobiana—, y siguen un curso grave. Generalmente, los reportes de casos en pacientes con fascitis necrotizante secundaria a aeromonas conllevan a la muerte del paciente, aún si no están inmunodeprimidos.
En el estudio de Ko et al., adelantado en Taiwán entre 1989 y 1998, en una serie de 104 casos registrados de bacteremia por A. hydrofila, se estudiaron los factores pronóstico de infecciones monomicrobianas por dicho germen20. Del total de casos, 54% ocurrieron en pacientes con cirrosis hepática y 21%, en pacientes con patología tumoral; 74% de las infecciones fueron adquiridas en la comunidad. Infecciones graves concomitantes a la bacteremia como peritonitis, celulitis, fascitis necrotizante, colangitis o infecciones en pacientes quemados se encontraron en el 43% de la población estudiada. La mortalidad fue del 30% en las dos primeras semanas de instaurada la infección, siendo la cirrosis y el cáncer los factores asociados de peor pronóstico.
Walid y Burger resaltan la importancia de considerar la Aeromona hydrophila entre las causas de fascitis necrotizante, especialmente en eventos asociados a entornos acuáticos, entre los que se incluyen mordeduras o heridas al contacto con peces. A diferencia del Clostridium perfringens, el Streptococcus del grupo A β-hemolíticos y el Vibrio vulnificus, los organismos del género Aeromona son generalmente resistentes a las penicilinas. Se ha descrito como probable etiología de la resistencia antimicrobiana de esta bacteria a la transferencia de plásmidos de otras enterobacterias21. Sin embargo, más del 90% de las cepas permanecen sensibles a las cefalosporinas de tercera generación, aztreonam, carbapenémicos, fluoroquinolonas, aminoglucósidos, cloranfenicol, clotrimoxazol y tetraciclinas. Por lo tanto, uno de estos antibióticos debe ser incluido en el esquema terapéutico para pacientes con historia compatible con infección por A. hydrophila hasta que se obtenga el aislamiento bacteriano y el estudio bacteriológico complementario.
Aunque la presentación de fascitis necrotizante por Aeromona hydrophila es rara y aún menos frecuente en población infantil, la posibilidad diagnóstica de la patología debe tenerse en cuenta en pacientes con sospecha de fascitis necrotizante asociada a traumas en entornos acuáticos, casos en los cuales el espectro antibiótico debe ampliarse teniendo en cuenta la posibilidad de resistencia bacteriológica de la bacteria a las penicilinas. En población pediátrica inmunocompetente, si se realiza un diagnóstico y tratamiento tempranos, se pueden obtener resultados terapéuticos satisfactorios.