El Hallux Rigidus es una patología asociada a cambios degenerativos de la articulación metatarsofalangica (MTF) del Hallux, que se caracteriza por ser una condición dolorosa, con restricción en los arcos de movilidad (principalmente en el plano sagital), sensación de rigidez y usualmente formación progresiva de un osteofito dorsal. La articulación se encuentra limitada en carga / apoyo y no en descarga, por lo cual mejoran a los síntomas.
Se ha descrito en la literatura también como Hallux Flexus, Hallux Limitus, Metatarsus Elevatus, dorsal bunion. Esta asociada a otras osteoartrosis del pie y es la segunda patología más frecuente del Hallux. Afecta el 3% de los adultos, la edad promedio esta por encima de los 50 años. Tiene una relación 2:1 de mujeres versus hombres.
Descrito inicialmente por Devis – Colley en el año 1887 como “Hallux Flexus” y posteriormente Cotterill lo denomino como Hallux Rigidus en 1888. Desde entonces se han investigado varios factores anatómicos, radiológicos e históricos para desarrollar sus factores etiológicos.
La movilidad de la MTF depende de estructuras proximales como el sistema Aquileo Calcáneo Plantar (ACP) y el arco interno, que dan soporte antero medial en la fase de propulsión o la tercer rocker. Para esto es necesario una adecuada movilidad de la MTF del Hallux, para verticalizar el primer metatarsiano y cargar el sistema hallux- sesamoideo. La articulación MTF soporta hasta el 90% del peso del cuerpo en la fase de despegue.
Hallux Rigidus is a disorder associated with degenerative changes of the metatarsophalangeal joint (MTF) of Hallux, which is a painful condition with restriction in the mobility arcs (mainly in the sagittal plane), a feeling of stiffness and usually with a progressive formation of a dorsal osteophyte. The joint is limited in load / support, but not in discharge, thus improving the symptoms.
It has also been described in the literature as Hallux Flexus, Hallux Limitus, Metatarsus Elevatus, and dorsal bunion. It is associated with other osteoarthrosis of the foot and is the second most common disorder of the Hallux. It affects 3% of adults, and the average age is above 50 years. It has a 2: 1 ratio of women versus men.
Initially described by Davis Colley in 1887 as “Hallux Flexus” and later called Hallux Rigidus by Cotterill in 1888. Since then, several anatomical, radiological and historical factors have been investigated to develop its aetiological factors.
The mobility of the MTF depends on the neighbouring structures, such as the Achilles-calcaneal-plantar (ACP) system and the internal arch, which support the medial anterior in the propulsion phase or the third rocker. For this, adequate mobility of the Hallux MTF is necessary to vertically align the first metatarsal and load the hallux-sesamoid system. The MTF joint supports up to 90% of the body weight in the take-off phase.
El Hallux Rigidus (HR) es una patología asociada a cambios degenerativos de la articulación metatarsofalangica (MTF) del Hallux, que se caracteriza por ser una condición dolorosa, con restricción en los arcos de movilidad (principalmente en el plano sagital), sensación de rigidez y usualmente formación progresiva de un osteofito dorsal. La articulación se encuentra limitada en carga / apoyo y no en descarga, por lo cual mejoran a los síntomas.
Se ha descrito en la literatura también como Hallux Flexus, Hallux Limitus, Metatarsus Elevatus, dorsal bunion1. Esta asociada a otras osteoartrosis del pie y es la segunda patología más frecuente del Hallux. Afecta el 3% de los adultos, la edad promedio esta por encima de los 50 años2. Tiene una relación 2:1 de mujeres versus hombres3.
Descrito inicialmente por Devis – Colley en el año 1887 como “Hallux Flexus” y posteriormente Cotterill lo denomino como Hallux Rigidus en 18884. Desde entonces se han investigado varios factores anatómicos, radiológicos e históricos para desarrollar sus factores etiológicos.
La movilidad de la MTF depende de estructuras proximales como el sistema Aquileo Calcáneo Plantar (ACP) y el arco interno, que dan soporte antero medial en la fase de propulsión o la tercer rocker. Para esto es necesario una adecuada movilidad de la MTF del Hallux, para verticalizar el primer metatarsiano y cargar el sistema hallux- sesamoideo. La articulación MTF soporta hasta el 90% del peso del cuerpo en la fase de despegue.
Una falla en esto pone en tensión del sistema ACP, limita la dorsiflexión de la MTF en su transición de la 2 a la 3 mecedora, esto impide el deslizamiento ideal, y produce contacto en rotación anómalo en el área dorsal de la articulación. Esto ocasiona un contacto interfacetario inadecuado de la articulación en la fase de despegue.
AnatomíaLa anatomía de la articulación MTF juega un papel significativo, donde la cabeza del primer metatarsiano es mas grande en el plano transverso, con estructura cuadrada plana. Se divide la superficie articular es continua en dos: superior e inferior., la superior es cónvexa y su porción inferior es mas pequeña. La base de la falange proximal es cóncava, en el sentido transverso para adaptarse ala cabeza del metatarsiano. En la planta esta cresta, que forma las facetas articulares para los sesamoideos, normalmente de mayor tamaño el tibial que el lateral. La placa plantar provee de estabilidad ala articulación MTF.
En el HR, dorsalmente se extiende el osteofito, que disminuye el espacio articular. El arco de movilidad en plano sagital cursa entre 76° -11° de dorsiflexion y 15° en el plano transverso. En estudios cinemáticos en un grupo de casos y controles, los casos mostraban una disminución en el arcos de movilidad de 49°-69° en plano sagital y menos de la mitad en grados en el plano tranverso. Cursa con engrosamiento de la capsula articular y una alteración en el eje de rotación
Se debe considerar la anatomía asociado a una modificación genética como primera causa.
Los microtraumas a repetición es la segunda causa de esta patología, con posibles cambios postraumáticos. Frecuente en atletas principalmente corredores5.
Dentro de sus principales Factores de Riesgo se encuentran: hipermobilidad del primer radio, Metatarso Primus Elevatus, hipermovilidad del primer radio. Menos frecuentes Hallux Valgus, Hallux Interfalangico.
El objetivo del tratamiento inicial es controlar el dolor y la estabilidad; mantener los arcos de movilidad, siendo mas fácil n estadio iniciales de la enfermedad. El manejo no quirúrgico incluye manejar los síntomas con AINES, infiltración con corticoide y ortesis (planillas de suela rígida), rocker bottom shoes o zapatos de puntera ancha. Cuando esto no cumple la satisfacción del paciente, debe considerarse manejo quirúrgico o al considerar en estadios 2 y 3 de HR6.
Varias técnicas han sido descritas pada su tratamiento, así mismo el desarrollo de nuevos implantes, esto ha optimizado su manejo y ha facilitado el tratamiento para el personal medico, teniendo como base un conocimiento amplio en la anatomía, fisiopatología, factores de riesgo que contribuyen al HR.
Dentro de ellas la queilectomia, asociada o no la osteotomia dorsal de Moberg.
Artrodesis para casos avanzados, y el uso de implantes es controvertido en la actualidad, debido a su baja sobrevida7.
EtiologíaNo existe consenso acerca de cual es la verdadera causa de esta enfermedad8. Puede ser ocasionado como consecuencia de una enfermedad artrósica generalizada. Múltiples factores de riesgo se describen, la mayoría de estos carece de evidencia que lo soporte. Los factores de riesgo descritos son:
Desórdenes metabólicosVarias enfermedades como la artritis reumatoidea, artropatía seronegativas y metabólicas como la hiperuricemia pueden considerarse como factores causales de HR. La gota es una entidad que simula los síntomas de HR, y en estadios avanzados genera artrosis importante de la articulación9.
EdadSe describe que la edad de presentación oscila en la 4 a 5 década de la vida. Coughlin no recomienda diferenciar entre HR adolescente y adulto dado que en su cohorte la incidencia en adolescentes es mínima10.
GéneroTeniendo en cuenta otros 18 estudios y el realizado por Coughlin y Shumas se considera que hasta el 68% de los casos son en el sexo femenino. No observan asociación entre género y edad, excepto que las mujeres predominan en todos los grupos etarios.
Historia familiarEn la cohorte de Coughlin y Shumas se reporta un 67% de incidencia en pacientes con HR y de estos el 95% se presenta de forma bilateral. Además, concluyen que el antecedente familiar no tiene relación con la edad de presentación.
TraumaSe sugiere que un evento traumático único o múltiples microtraumas repetitivos, es el factor más importante para desarrollar esta enfermedad. A pesar de lo anterior se reporta en la literatura una incidencia de apenas el 12 al 14% de relación de único trauma o microtrauma repetitivo. Lo anterior se explica por un sesgo de recordación de los pacientes11. Coughlin y Shumas en su serie encuentran el trauma único en la mayoría de sus pacientes adolescentes. Describen que el 78% de los sujetos con antecedente traumático presentan enfermedad unilateral, sin importar la edad. Por lo que se considera que, en caso de enfermedad unilateral, el origen más probable es el traumático único o el microtrauma repetitivo.
Hipermovilidad del primer rayoHa sido propuesta por Jack, como factor etiológico, la hipermovilidad del primer rayo. A pesar de esto Coughlin y Shumas no encuentra asociación significativa entre HR e hipermovilidad, no encontrando diferencia en la movilidad del primer rayo entre personas con la enfermedad y personas sanas (el promedio de movilidad fue de 5mm).
Metatarso primo elevatusEn 1938 Lambrinudi sugiere esta condición como factor causal. Históricamente se ha considerado el metatarso primo elevatus como una patología primaria que relacionada con HR, tiene indicación para osteotomía realineadora. Horton y Myerson y Meyer y colaboradores de manera independiente consideran que el metatarso primo elevatus es un hallazgo normal y que no hay mayor incidencia en pacientes con HR. Horton y Myerson consideran que la osteotomía plantiflexora no es adecuada para el tratamiento de HR12.
Opiniones recientes consideran que la elevación del primer metatarso es ocasionada por la limitación de la movilidad de la articulación afectada, por lo que es más frecuente observarla en grados avanzados del HR (grado 3 y 4). Incluso consideran que los tratamientos tipo Queilectomía pueden ayudar a mejorar el metatarso primo elevatus sin necesidad de realizar osteotomías en el metatarso.
Pie plano y equinoSi bien se postula como factor de riesgo, no se ha podido corroborar esta teoría. En efecto Coughlin y Shumas no encuentran mayor incidencia de pie plano o equino en los pacientes de su cohorte en comparación con pacientes que no tienen la enfermedad.
Hallux ValgusNilsonne propone que el hallux valgus termina transformándose en HR. Se reportan incidencias variables que van desde el 15 al 100% de los casos. Coughlin y Shumas en su serie observan una concomitancia del 12%. De todas formas, se recomienda tener en cuenta en el momento de la decisión de un tratamiento quirúrgico.
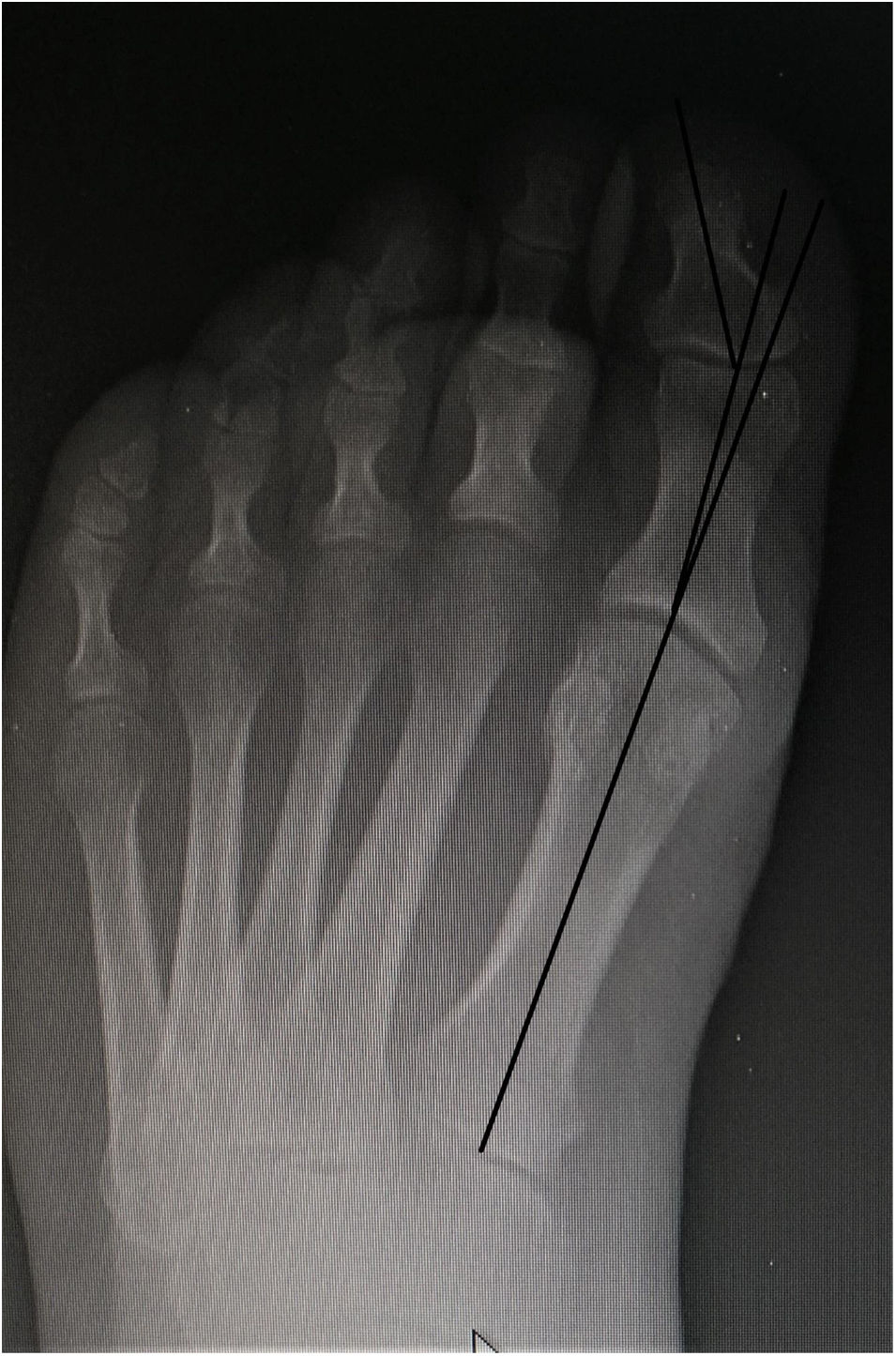
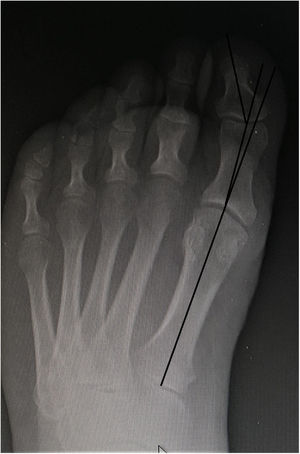
Hallux Valgus interfalángicoTeniendo en cuenta que el ángulo interfalángico del hallux normal es de 5°, en pacientes con HR se encuentra un promedio de ángulo interfalángico del hallux de 15° hasta en el 90% de casos (fig. 1). Posiblemente esto está explicado por la resistencia a la deformidad en el plano transverso que desarrolla la articulación metatarsofalángica en el HR, lo que genera sobrecarga y aumento de la angulación de la articulación interfalángica.
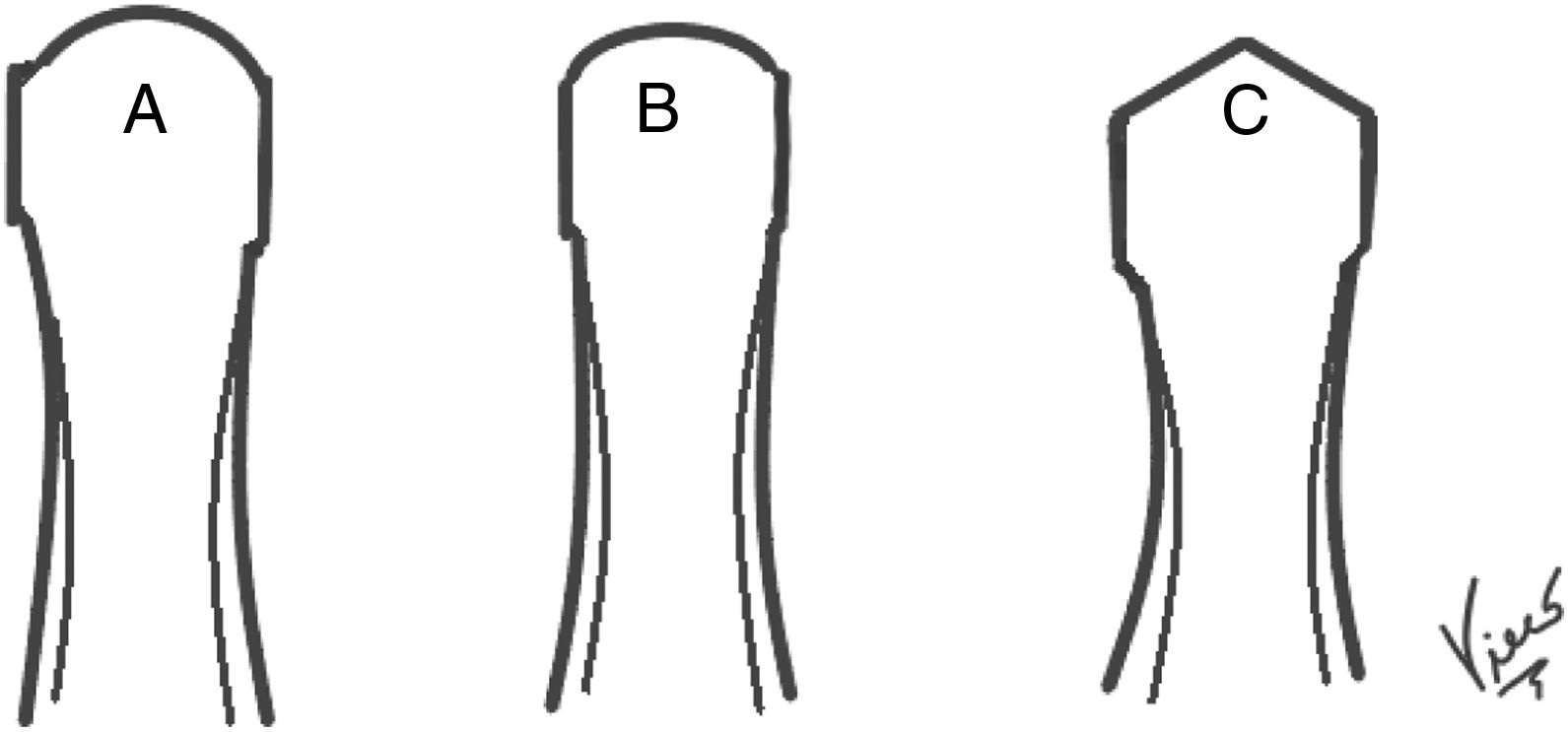
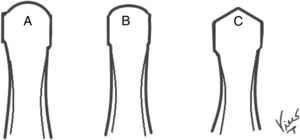
Morfología de la cabeza del primer metatarsoLa morfología no esférica de la cabeza del primer metatarso se asocia al HR. Coughlin y Shumas demuestran hasta un 74% de cabezas aplanadas, cuadrangulares y tipo Chevron en sus pacientes con HR (fig. 2). Estos hallazgos son soportados por Hunt y Anderson, quienes encuentran una incidencia del 79% de cabezas aplanadas o tipo Chevron en sus estudios.
Osteocondritis disecanteA pesar de no tener muy clara su causa, es muy frecuente encontrar signos de osteocondritis disecante en el HR. McMaster demuestra en su cohorte joven (edad promedio 21 años) osteocondritis disecante en el 100% de los casos. Concluyó que el 100% de los casos estaba precedido por trauma único o microtrauma repetitivo. Goodfellow describió la transición de osteocondritis disecante a HR, postulando que la remodelación ósea durante la cicatrización de una osteocondritis disecante resulta en una cabeza plana o tipo Chevron13.
Longitud del metatarsoSe cree que un metatarso muy largo o muy corto puede ocasionar carga excesiva en la articulación y por ende generar HR. En 1999 un estudio con resonancia magnética en especímenes cadavéricos refuta esta idea.
Metatarso aductoNo se encuentra asociación estadísticamente significativa entre metatarso aducto y HR (Coughlin y Shumas) a pesar de que se considera como un factor de riesgo.
ClasificaciónEs el mayor causante de dolor y limitación funcional a nivel de la articulación metatarso-falángica del hallux.
Las clasificaciones deberían ser fáciles de entender, usar y no requerir herramientas o entrenamiento especiales14.
Desde el año 1930 se empezaron a describir las primeras15.
Se han basado predominantemente en los estudios radiológicos y/o clínicos para calificar la magnitud del daño articular16.
En 1988 se realiza la primera clasificación radiológica por Hattrup and Johnson, en la que se tiene como objetivo evaluar con imágenes el compromiso osteoarticular17.
Grado 1- Leves cambios con preservación del espacio articular y pocos osteofitos.
Grado 2- Cambios moderados, disminución del espacio articular, prominencia a nivel de la cabeza del metatarsiano y falange proximal, esclerosis subcondral o quistes.
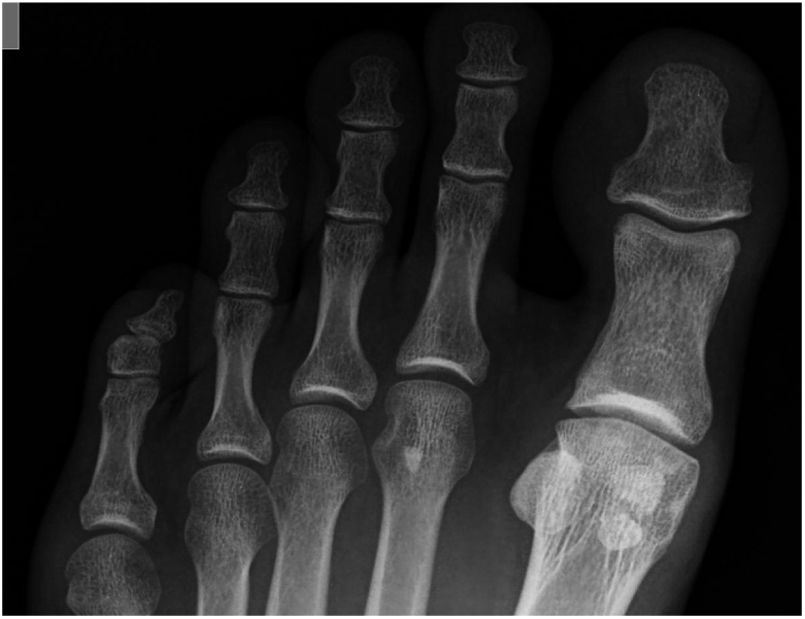
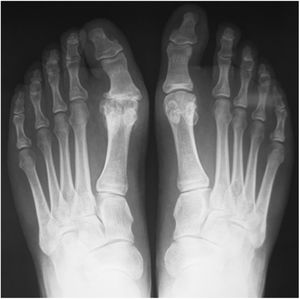
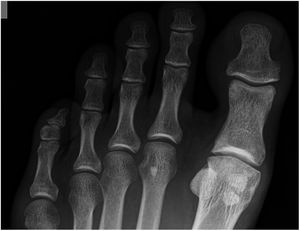
Grado 3- Cambios severos, con disminución del espacio articular moderado a severo, osteofito extenso y cuerpo libre u osiculo dorsal. (figs. 3 y 4).
Coughlin and Shurnas, realizan en 1999 la clasificación clínica y radiológica teniendo en cuenta las imágenes, funcionalidad articular y sintomatología (tabla 1)18. Esta clasificación es esencial para definir el tratamiento. Aunque no se encontró relación de la clasificacion clinico-radiologica con la Foot and Ankle Ability Measure (FAAM) scores.
Clasificación de Coughlin y Shurnas
| Clasificacion Clinica Y Radiologica De Hallux Rigidus | |
|---|---|
| Grado 0 | Dorsoflexión de 40°-60° (20% menos de la movilidad normal), radiografía normal y ausencia de dolor. |
| Grado 1 | Dorsiflexión de 30°-40°, osteofito dorsal, cambios mínimos o ningún cambio articular. |
| Grado 2. | Dorsiflexión de 30°-40°, aplanamiento leve de la articulación MTP, leve a moderada disminución del espacio articular o esclerosis y osteofitos. |
| Grado 3. | Dorsiflexión menor a 10°, plantiflexión menor a 10°, cambios radiológicos severos con quistes subcondrales o erosiones o con sesomideos irregulares, constante dolor moderado a severo y al finalizar los arcos de movimiento. |
| Grado 4. | Articulación rígida, se observan en las radiografías cuerpos libres o defectos osteocondrales y dolor durante todos los arcos de movilidad. |
Beeson and col. realizaron una revisión de la literatura encontrando 18 tipos de sistemas de clasificaciones19.
El propósito de estas clasificaciones es informar, ayudar a la decisión quirúrgica y categorizar adecuadamente a los pacientes pero no pronostican el resultado. la predicción finalmente depende de otros factores como la técnica quirúrgica, la experiencia y motivación del paciente.
Tratamiento conservador (manejo no quirúrgico)Existen numerosas intervenciones no quirúrgicas propuestas como opciones de tratamiento para el hallux rígidus que incluyen: el manejo farmacológico, la terapia física y las intervenciones mecánicas como Ortesis o plantillas, taping, férulas y modificaciones en el calzado. Sin embargo, muy pocas de estas opciones han sido sometidas a evaluaciones científicas.
El tratamiento conservador de esta patología es sintomático y debe adaptarse a cada paciente según el compromiso articular. En general, la mayoría de pacientes pueden tolerar su dolor con el uso de un zapato espacioso con suela dura20. Otros autores han reportado hasta un 60% de buenos resultados del tratamiento no quirúrgico durante 1 a 7 años de seguimiento modificando el calzado, haciendo uso de Ortesis y taping e infiltraciones articulares21.
Las respuestas al manejo conservador son variables, debido a los muchos factores que influyen en ella; no existen ensayos clínicos de buena calidad científica que aborden el tratamiento del hallux rígidus, quirúrgico y no quirúrgico, que permitan modificar las decisiones en el tratamiento basadas en la evidencia disponible22.
Tratamiento farmacológicoEn la literatura no existe ningún artículo que relacione específicamente la eficacia en el alivio de los síntomas en pacientes con hallux rígidus, por lo cual no hay una recomendación sistemática de su uso23.
InfiltracionesLa infiltración intra-articular de cortico esteroides es ampliamente usado como manejo paliativo de la osteoartrosis, la triamcinolona proporciona alivio de dolor por semanas o meses, debido a la eliminación del ciclo inflamatorio, pero no existe evidencia que se modifique la progresión de la degeneración del cartílago articular. Por su parte, la terapia con ácido hialurónico se ha utilizado como manejo de artropatías degenerativas, y se ha sugerido que produce efectos benéficos sobre la protección del cartílago articular, sin embargo la mayoría de estos estudios han sido en la articulación de la rodilla, mostrando aumento en la densidad de condrocitos, disminución de la sinovitis, aumento de la reparación sinovial y disminución de la extensión y grado de las lesiones condrales a los 6 meses de seguimiento24.
Solan y colaboradores observaron pacientes con hallux rígidus en grados leves a moderados, a quienes manejaron con infiltraciones intra-articulares de esteroides y movilización de la articulación metatarsofalángica con mejoría clínica durante 6 meses; sin embargo en grados más avanzados el beneficio fue limitado (Nivel IV). Smith y colaboradores, realizaron un seguimiento a largo plazo (14 años promedio) de 22 pacientes (24 pies) manejados no quirúrgicamente, reportando que el 75% de los pacientes continuaron eligiendo el manejo conservador25,26.
Pons y colaboradores realizaron un ensayo clínico aleatorio prospectivo que comparaba la efectividad de inyecciones intra-articulares de hialuronato de sodio y cortico esteroide en pacientes con hallux rígidus; este dio como resultado una disminución del dolor y una mejora en el funcionamiento a los 3 meses posterior a la infiltración, aunque la diferencia en el alivio de dolor fue significativamente mejor en el grupo del hialuronato de sodio. Al evaluar el resultado al año de seguimiento demostraron que un alto porcentaje de ambos grupos había requerido cirugía por el dolor persistente y la reducción de la función (triamcinolona 52.9%, hialuronato de sodio 46.6%) (Nivel II)27.
OrtesisInvestigadores de la Universidad de Rochester en N.Y descubrieron que usar una extensión de Morton, una Ortesis de carbono rígida que se extiende hasta la punta distal del hallux, reducía el dolor del hallux rígidus y modificaba los patrones de apoyo plantar, lo que daba como resultado una mejor distribución de la carga. Al parecer reduce la velocidad y la magnitud de los últimos grados de dorsiflexión de la articulación MF del hallux durante la fase de propulsión de la marcha que son los responsables del pinzamiento de los osteofitos dorsales del 1 metatarsiano y la falange proximal del hallux, sin embargo no existen estudios que comprueben esta hipótesis y que midan los efectos de las plantillas en la cinemática de la articulación MF del primer rayo, pero definitivamente es una opción de manejo antes de la cirugía28.
Un estudio de prueba de concepto realizado por Jerilyn y col. busco determinar la viabilidad de plantillas rígidas en el calzado para reducir el dolor de la articulación metatarsofalángica del hallux artrosica; con seguimientos a corto plazo, observaron mejoras estadísticamente significativas en el dolor y la función del pie, con una efectividad en el 78% de los pacientes dada por la buena tolerancia a los 3 meses, un 4% de los pacientes usaron medicamentos adicionales para aliviar el dolor y el 30% reportaron efectos adversos menores como talalgia y dolor en la rodilla29.
CalzadoDiversos estudios han demostrado que las Ortesis y el calzado en suela en balancín fueron igualmente efectivos en la reducción de dolor asociado con la artrosis de la MF del 1er rayo. Sin embargo el grupo del calzado tuvo una menor adherencia. Biomecánicamente el calzado reduce la presión bajo las cabezas de los metatarsianos por la suela oscilante, pero los estudios disponibles no han hecho diferencia entre múltiples factores como: la edad, el género, el IMC, la severidad y duración del dolor, la estructura del pie y el rango de movilidad, que pueden influenciar en la respuesta al tratamiento de esta patología30–32.
Terapia fisicaLas intervenciones de terapia física para el manejo del hallux rígidus no son muy comunes, además, la calidad de la evidencia disponible no se ha analizado hasta la fecha. La razón principal de esta limitación es que los estudios previos difieren entre sí de manera significativa en cuanto a los parámetros de evaluación, la gravedad de la patología, la frecuencia y la naturaleza de las intervenciones.
Se han descrito ejercicios de tracción del eje del primer dedo, movilización del complejo sesamoideo, fortalecimiento del flexor hallucis longus y de la musculatura intrínseca del pie, pero su nivel de evidencia es bajo. La revisión sistemática Cochrane del año 2010 solo encuentra un estudio aleatorizado y controlado de dos diferentes terapias físicas en 20 pacientes con hallux rígidus, aunque con un nivel de evidencia C (débil).
La terapia física involucra la movilidad articular, mejorar los rangos de movimiento, la reeducación muscular, el estiramiento del flexor hallucis longus y de la musculatura intrínseca del pie para mejorar la estabilidad de la articulación metatarsofalangica del hallux.
Terapia experimentalExisten numerosos tratamientos experimentales para patologías ortopédicas que se han propuesto como parte del arsenal terapéutico de hallux rígidus. La terapia extracorpórea con ondas de choque ha sido descrita como una opción de manejo, los estudios en animales han demostrado la liberación de angiogénicos y factores de crecimiento osteogénico en respuesta a esta terapia, lo que resulta en regeneración y reparación del tejido musculo esquelético.
El uso de visco suplementación oral como sulfato de glucosamina y sulfato de condroitina también se ha sugerido, aunque no hay evidencia para apoyar su uso específico en el tratamiento de hallux rígidus. La iontoforesis, que utiliza corrientes eléctricas para aumentar la absorción de medicamentos tópicos dentro de los tejidos blandos, es otra opción. La terapia de ultrasonografía con alta frecuencia de ondas sonoras también se usa ampliamente en la fisioterapia para desintegrar el tejido cicatricial y las adherencias, controlar el proceso inflamatorio y aumentar flexibilidad de los tejidos blandos antes de estirar y ejercitar.
La aplicación de cualquiera de estas modalidades experimentales, aunque cada vez más populares, no se han demostrado como una práctica basada en la evidencia en el tratamiento de hallux rígidus.
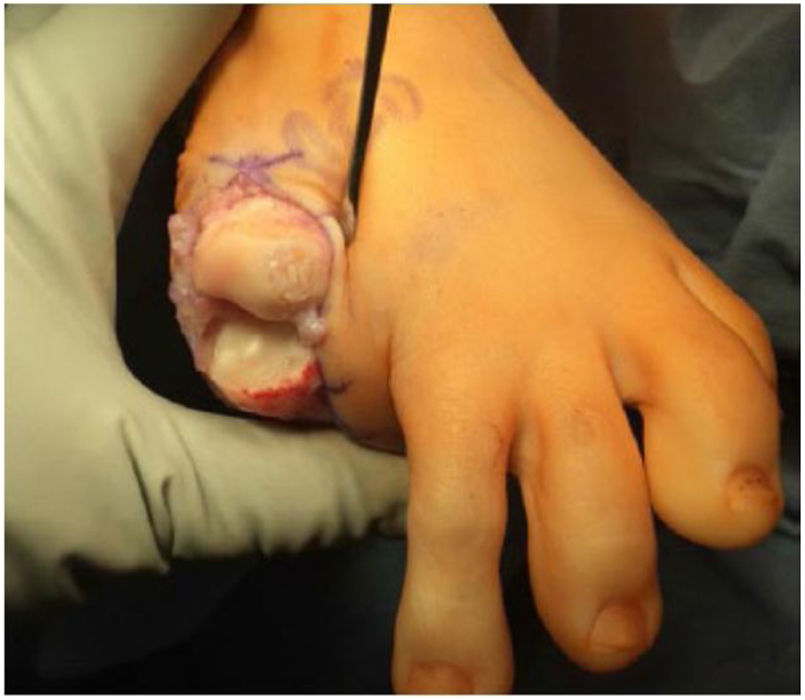
Queilectomia como tratamiento del Hallux RigidusHistoriaDiversidad de procedimientos se han descrito para el manejo quirúrgico del HR, la queilectomía pudiendo ser considerada el tratamiento de elección en el tratamiento quirúrgico de las primeras fases de HR indicado cuando se encuentra osteofito dorsal, pudiendo combinarse con otros procedimientos que en conjunto pertenecen a la categoría de salvamento articular, descrita por primer vez por Nilsonne en 1930 para manejo de hallux flexus en 2 casos pero consideró que se trataba de manejo paliativo porque no resolvía el problema de forma permanente32–35.
Posteriormente fue descrita por por DuVries en 1959 como la resección parcial del osteofito dorsal y la porción degenerativa de la superficie articular de la cabeza del primer metatatarsiano con buenos resultados aunque no tuvo un seguimiento a largo plazo36. Finalmente se describen la técnica completa con seguimiento en 1979 Mann, Couglhin y DuVries con el primer reporte de seguimiento a largo plazo.
IndicacionesLa principal indicación para la realización de la queilectomía es el dolor con disminución de la movilidad articular en flexión dorsal de la primera articulación metatarsofalángica en pacientes que no han mejorado a tratamiento conservador como lo son cambios de calzado, infiltración articular, administración de antiinflamatorios y corticoides. Aparición de exostosis dorsal de primer metatarsiano y falange proximal del hallux y cambios de enfermedad degenerativa leve radiológicos.
Deben considerarse varios factores del paciente para su realización como edad, nivel de actividad y severidad de la enfermedad tanto clínica como radiológica, además de las coomorbilidades del paciente ya que de esto depende el pronóstico a largo plazo. Aunque no se puede preveer que los cambios degenerativos avancen en el tiempo la queilectomía es el procedimiento de elección en las primeras fases del HR.
Procedimiento quirúrgicoEn 1979 Mann, Coughlin y Duvries describieron la técnica y fueron los primeros en publicar sus resultados a largo plazo, confirmando buenos y excelentes resultados en 17 de 20 pacientes tras el procedimiento en seguimiento a 68 meses37. Múltiples estudios han apoyado los resultados de mejoría de dolor y movilidad y de la misma manera se han citado múltiples controversias con respecto a los resultados por edad y actividad encontrando por ejemplo reportado por Feltham y colaboradores mejor resultado en escala AOFAS en pacientes mayores de 60 años en su grupo de seguimiento, contrario a lo encontrado por Mulier que reportó mejoría en el 95% de excelentes resultados en 22 pies de 20 atletas jóvenes de alto nivel38.
Diferentes técnicas quirúrgicas han sido descritas como la abierta, artroscópica y percutánea, el procedimiento incluye resección de osteofito dorsal de la cabeza del primer metatarsiano, resección de osteofito de la base dorsal de la falange proximal, extracción de cuerpos libres, sinovectomía y liberación de capsula medial y lateral39,40. Para revisar una lesión osteocondral central o si no se correlacionan los síntomas con los hallazgos radiológicos se considera como mejor alternativa el abordaje artroscópico. La queilectomía percutánea con guía fluoroscopica ha permitido disminuir los tiempos de recuperación, satisfacción de los pacientes con un buen resultado cosmético41,42.
Entre las ventajas del procedimiento están: procedimiento simple, deja articulación estable, baja morbilidad, conserva fuerza y movilidad articular, además permite otros procedimientos a futuro43.
Como contraindicaciones se puede considerar no realizar el procedimiento si hay un proceso infeccioso local, dolor predominantemente plantar, hallazgos clínicos y radiológicos de compromiso degenerativo moderado y severo y/ o compromiso de más del 50% de cabeza del metatarsiano.
ComplicacionesLas complicaciones reportadas aunque su incidencia es baja 0-3% se conocen infección, formación de neuroma, parestesia transitoria del hallux, distrofia simpática refleja, engrosamiento crónico capsular o tumefacción. Se ha reportado reaparición de osteofito dorsal hasta en el 31% de los casos, no siempre relacionado con reaparición de síntomas44. También se tienen en cuenta las inherentes a cualquier procedimiento quirúrgico sobre todo teniendo en cuenta las comorbilidades del paciente. Con el seguimiento se puede iniciar manejo con esteroides en caso de rigidez postquirúrgica por cicatrización o cambios en el proceso de rehabilitación para obtener los mejores resultados.
En la revisión de la literatura Roukis realizó una revisión sistemática de la queilectomía aislada, identificando los datos de 706 pies en 23 estudios clínicos para el análisis, la tasa general para la cirugía de revisión fue de 8,8 confirmando que es el procedimiento de elección a pesar de no se tenga aún buena evidencia que tenga mejores resultados que otros procedimientos revisando estudios nivel III.
PosquirúrgicoLa idea es que tras la queilectomía el paciente inicie una rehabilitación precoz, iniciando ejercicio a los 7 a 10 días posquirúrgicos, uso de zapato pop, apoyo parcial a tolerancia, uso de soporte externo e inicio de movilidad articular precoz en un proceso de rehabilitación activo permanente. Se espera que el paciente a los 2 a 3 meses esté en el máximo de mejoría de sintomatología.
Oats y sintéticosLa artritis metatarsofalángica del hallux puede ocasionarse por un HR en donde la zona de sufrimiento del cartílago se localiza en el tercio distal superior de la cabeza del primer metatarsiano45. Bonney y Macnab encontraron que un metatarsiano largo y una falange proximal corta pueden causar degeneración traumática de la primera articulación metatarsofalángica46. También se puede lesionar en forma focal y en una localización más baja (tercio medio e inferior) de la cabeza del primer metatarsiano, asociada a trauma directo o micro trauma repetitivo presentando una lesión osteocondral47. Llamada defecto osteocondral, es una lesión focal del cartílago que puede causar dolor y limitación del movimiento de la articulación metatarsofalángica del primer rayo.
De acuerdo con la clasificación del HR se llevará a cabo el manejo. Las lesiones en el tercio superior de la cabeza del primer metatarsiano se lleva a cabo con la queilectomía. En algunos casos se hace necesario el uso de osteotomías de acortamiento del primer metatarsiano y en casos avanzado de artrosis está indicada la artrodesis metatarsofalángica. Los defectos más centrales o bajos pueden ocurrir después de traumas directos a nivel del hallux en actividades deportivas, o por micro traumas repetitivos. Estas no son susceptibles de manejo con los métodos convencionales de manejo del HR por su localización baja en la cabeza del primer metatarsiano y se hacen necesarios otros métodos entre los cuales se cuenta el injerto osteocondral y la aplicación de sintéticos.
El cartílago dañado tiene poco potencial de cicatrización y el cartílago en adultos no tiene aporte sanguíneo, ni drenaje linfático, ni elementos neurales. Solo hasta que se compromete el hueso subcondral, se observa una respuesta inflamatoria en la superficie articular.
Con este concepto en consideración desde el punto de vista terapéutico, se pueden beneficiar con microfracturas de hueso subcondral, sin embargo, los resultados de este tratamiento son variables. Se propone entonces el manejo con injerto osteocondral autólogo. En este caso se reemplaza cartílago hialino con cartílago hialino que posee ventajas sobre el fibrocartílago obtenido con el manejo con desbridamiento y microfracturas.
En 2006 Title y colaboradores publicaron el manejo de lesiones osteocondrales del primer metatarsiano con injerto osteocondral autólogo tomado del dorso de la cabeza del metatarsiano ipsilateral. Las experiencias obtenidas con el método de injerto osteocondral en el talo, llevaron a los autores a explorar la posibilidad de manejo con esta técnica en el primer metatarsiano. En la literatura se presentan experiencias satisfactorias con injertos osteocondrales en talo y primer metatarsiano48,49.
Un estudio retrospectivo comparando microfracturas e injerto osteocondral autólogo con un seguimiento de 25.1 meses mostró mejoría en las evaluaciones en las escalas de AOFAS y en la escala visual análoga. No se obtuvo diferencia en la mejoría en los dos grupos, pero los autores notaron un impacto del tamaño de las lesiones en el resultado. Esta diferencia en los resultados fue en el grupo de microfracturas con defectos de más de 50mm2 y lesiones con evidencia de quistes subcondrales donde mostraron los peores resultados en este grupo. Los pacientes con injertos osteocondrales no mostraron resultados significativos de empeoramiento con mayor tamaño o quistes subcondrales50.
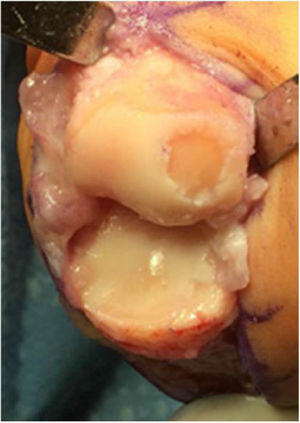
La indicación del uso de los injertos osteocondrales incluye lesiones de mayor tamaño (6mm o más) localizadas en el centro de la cabeza del primer metatarsiano con cartílago circundante sano, de características focales, no susceptibles de manejo con desbridamiento, microfracturas y queilectomía. (fig. 5.)
Las lesiones menores de 2 a 6mm de diámetro evolucionan bien con desbridamiento y microfracturas, pero aquellas de mayor tamaño están indicadas para el tratamiento con injerto osteocondral. Las contraindicaciones para esta técnica son la infección activa, el compromiso articular global avanzado de la cabeza del metatarsiano y los problemas asociados a malalineación y requieren procedimientos adicionales concomitantes.
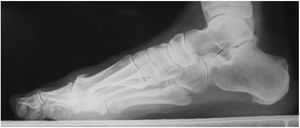
Es mandatorio la evaluación radiológica del pie con proyecciones AP y lateral de ambos pies con apoyo, para definir la presencia de osteofitos, pérdida del espacio articular de la articulación metatarso falángica y patología de sesamoideos. (fig. 6) La tomografía axial y la resonancia definirán el tamaño, localización, lesiones asociadas y grado de la lesión osteocondral.
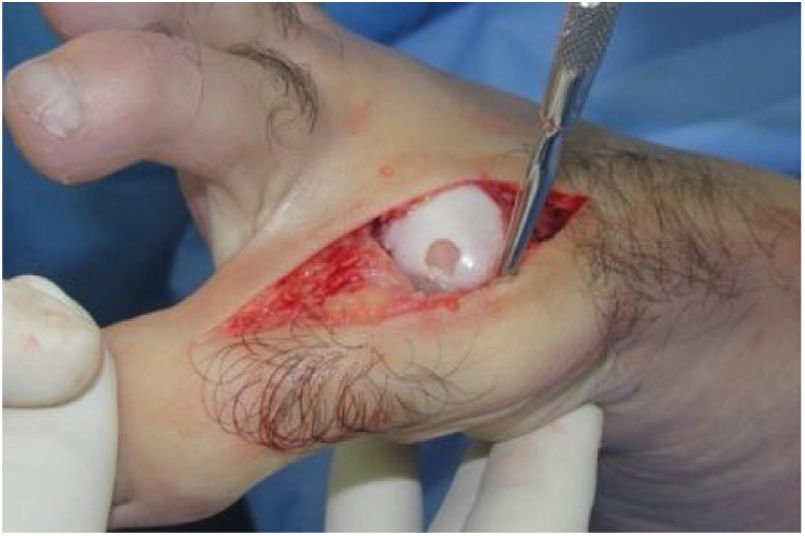
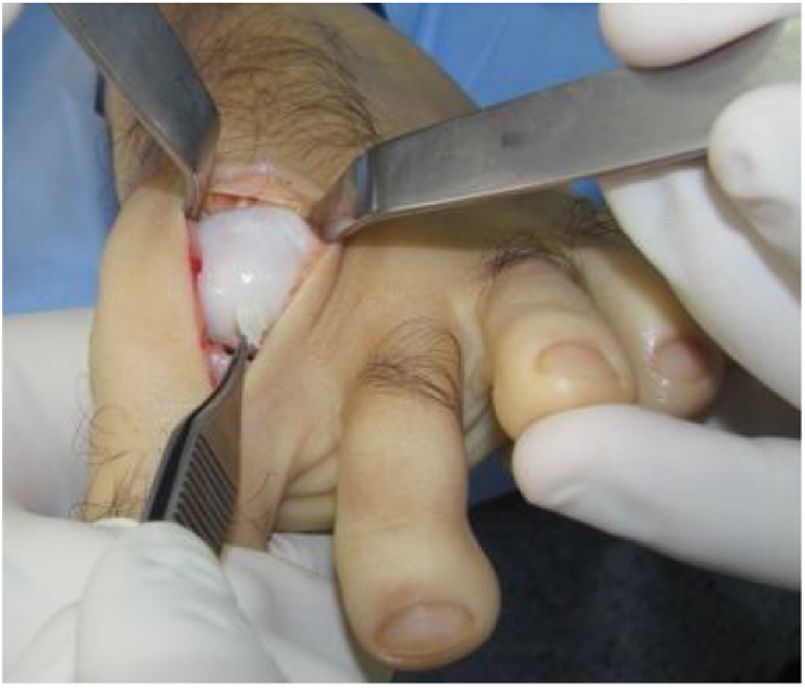
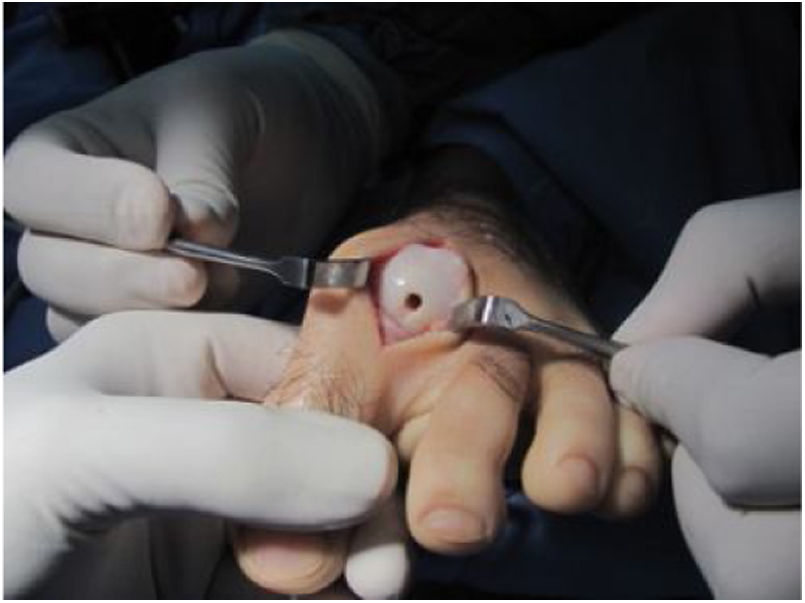
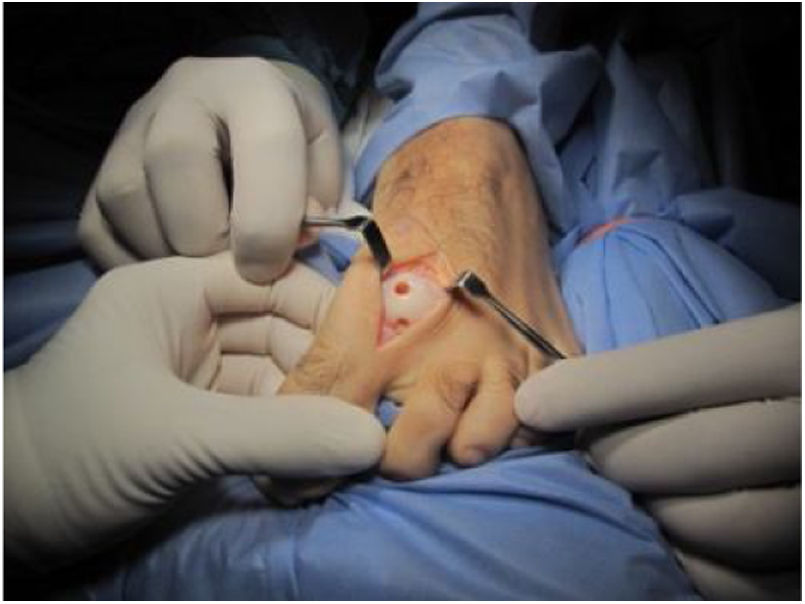
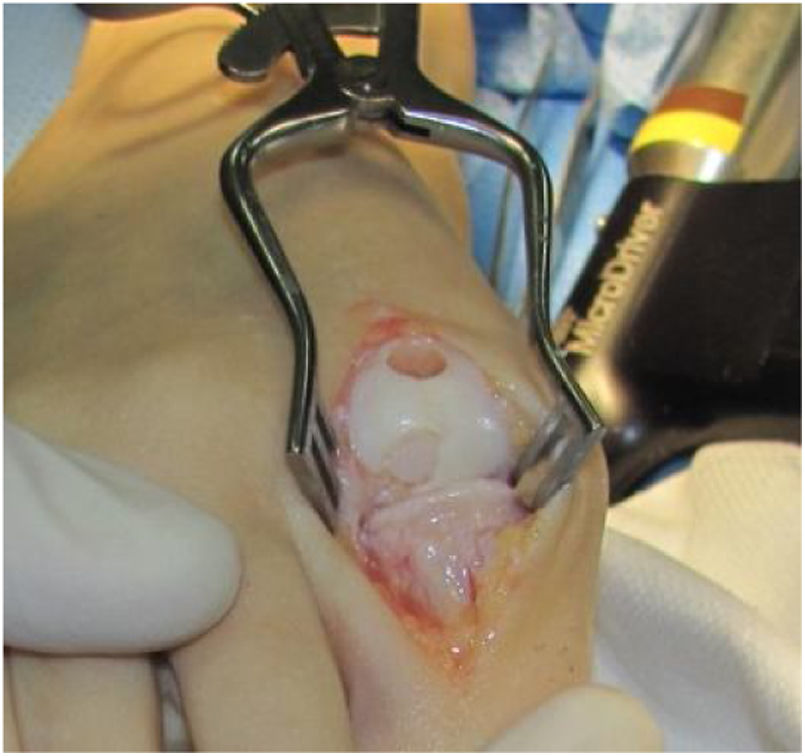
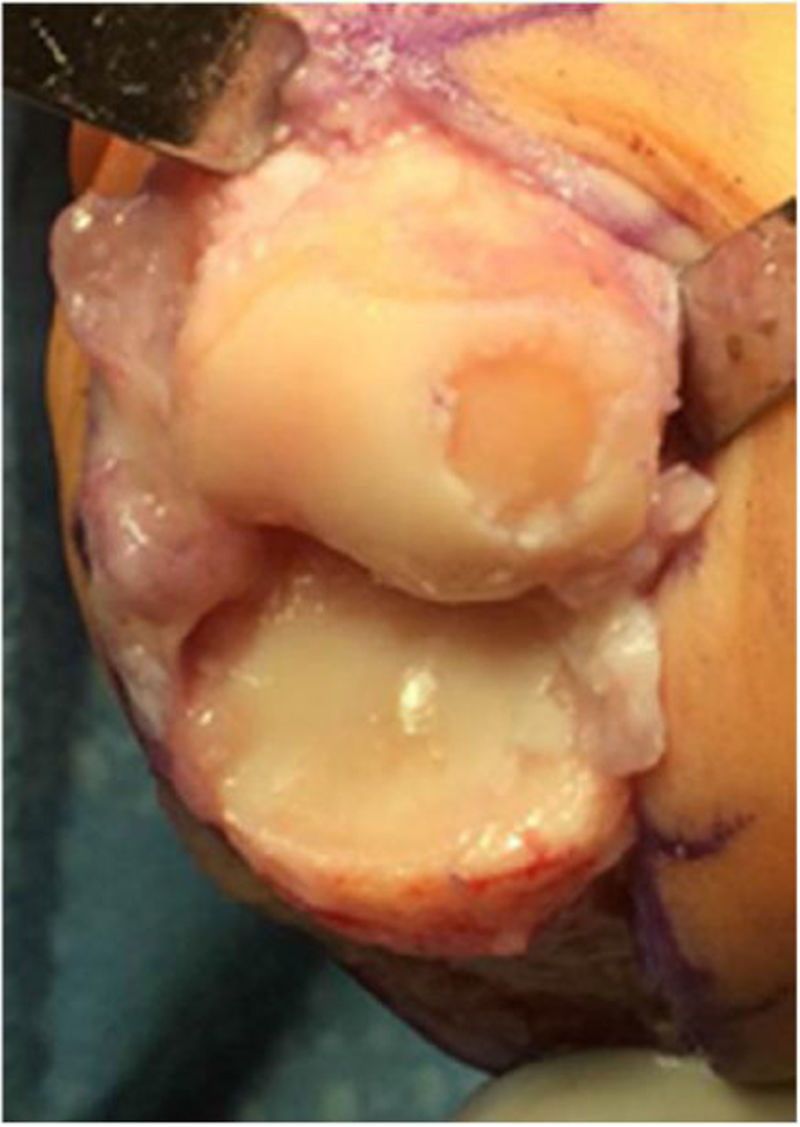
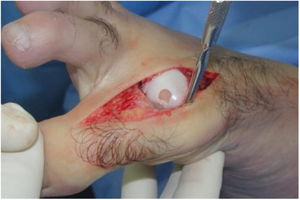
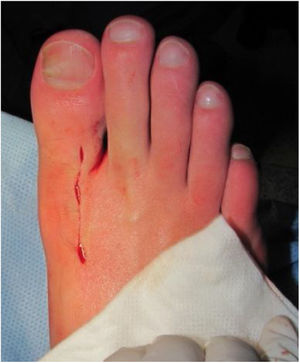
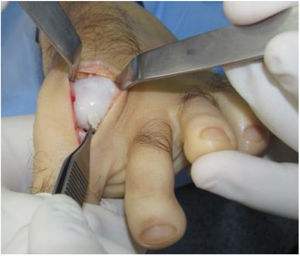
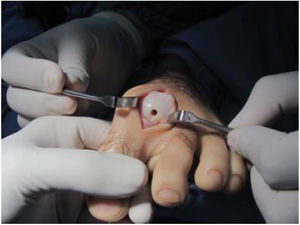
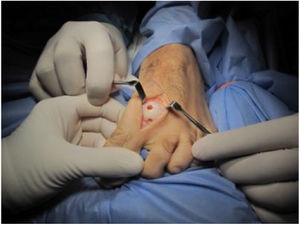
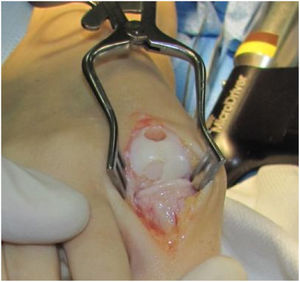
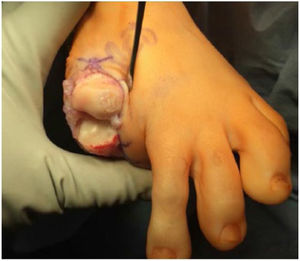
El procedimiento una vez definido para cada caso, se lleva a cabo bajo anestesia local de tobillo asistida por sedación. El paciente es colocado en decúbito dorsal con rollo debajo de la región glútea ipsilateral para mantener el pie en posición neutra. Se lleva a cabo una incisión dorso medial o dorso lateral sobre la articulación MTF del hallux igual a la incisión utilizada en el manejo del HR en la queilectomía. (fig. 7) Se expone ampliamente la articulación incluída la base de la falange proximal y la cabeza del metatarsiano. (fig. 8) Revisión de las condiciones de la base de la falange proximal, la cabeza del metatarsiano y el complejo sesamoideo. Identificación del tamaño de la lesión y su localización en la cabeza del metatarsiano y las condiciones del cartílago circundante. Desbridamiento del cartílago comprometido hasta la zona de cartílago sano y medición del defecto para escogencia del tamaño del injerto. Se lleva a cabo una perforación en el centro del defecto con la broca previamente definida de acuerdo con el tamaño de la lesión a corregir, hasta una profundidad de 12mm. (fig. 9) Toma del cilindro de injerto del dorso de la cabeza del metatarsiano ipsilateral en caso de encontrarse el cartílago en la zona donante en buenas condiciones, con la trefina correspondiente a la broca que se utilizo para llevar a cabo el orificio en el lecho receptor. (fig. 10) En caso de no encontrarse cartílago en buenas condiciones a dicho nivel se podrá obtener el injerto de la porción antero medial e inferior de la cabeza del talo. Una vez obtenido el injerto del dorso de la cabeza del metatarsiano se procede a llevar a cabo la queilectomía de la manera convencional. Mediante el uso del equipo elegido para este procedimiento, se coloca el injerto de la zona donante en el lecho receptor, impactándolo hasta quedar idealmente 1mm por encima del nivel del cartílago de la zona receptora. (fig. 11) La ventaja de esta técnica es que el injerto donante, al ser tomado del mismo sitio, tiene un cartílago de igual espesor al lecho receptor. Una vez colocado el injerto, se procede a movilizar del hallux impactando la falange contra la cabeza del metatarsiano para terminar de impactar el injerto. Se procede al lavado articular y al cierre de la herida en la manera convencional. El vendaje en este caso es igual al utilizado en la queilectomía. Se coloca el pie en un zapato postoperatorio y se permite la deambulación con apoyo de acuerdo a tolerancia. El paciente es evaluado a los 12 días para retiro de vendajes y suturas y remitido a fisioterapia para recuperación de arcos y marcha. Evaluación con controles radiológicos a las 6 semanas, 3 y 6 meses. La reanudación de actividades deportivas se debe evitar por tres meses y el dolor puede persistir hasta los 6 meses postoperatorios.
Existen otras técnicas recientes de manejo de la misma patología descrita anteriormente, consistentes en trasplante de aloinjerto de cartílago articular juvenil particulado51,52. Los condrocitos inmaduros han demostrado tener mayor potencial de cicatrización comparado con condrocitos adultos. Formar cartílago hialino en vez de fibrocartílago generado por procedimientos de estimulación de medula ósea es un avance importante en el tratamiento de defectos de cartílago. El cartílago en fragmentos de menor tamaño también ha demostrado mayor habilidad para formar nuevo cartílago53,54.
Las indicaciones para el uso de esta técnica son las mismas descritas para el injerto osteocondral. El abordaje y la identificación de la lesión en la cabeza del primer metatarsiano se lleva a cabo de la misma manera al método anterior y una vez definida y cureteada la lesión hasta el cartílago sano, se procede a hacer este procedimiento. (fig. 12) En algunos casos se efectúan microfracturas en la zona expuesta de hueso, aunque no en todos los casos. Se procede a secar la superficie desprovista de cartílago y se coloca pegante de fibrina cubriendo el defecto y antes de secar se coloca encima el aloinjerto de cartílago particulado cubriendo toda el área. (fig. 13) Nuevamente se aplica una nueva capa de pegante de fibrina y se deja secar por 5 minutos. Movilización de la articulación con reproducción del arco de la MTF del hallux pasivamente y revisión de la reparación para descartar delaminación de los componentes. Cierre por planos e inmovilización con vendaje en bota tipo Walker sin apoyo, permitiendo apoyo en la bota después del retiro de las suturas a los 12 días y deambulando en la bota hasta las 4 semanas, tiempo después del cual al paciente se le permitió uso de calzado convencional.
Este estudio en conclusión demostró que pacientes con lesión osteocondral de la cabeza del primer metatarsiano manejados con trasplante de aloinjerto de cartílago juvenil particulado después de un seguimiento de 3.3 años generalmente mejoraron del dolor, no mostraron progresión significativa de la degeneración articular de la MTF del hallux y estaban satisfechos con los resultados. Sin embargo, se requiere de estudios adicionales para comparar esta técnica con otros métodos de tratamiento para los defectos focales del cartílago. El método descrito es útil para tratar defectos articulares en los cuales han fallado los tratamientos con las microfracturas osteocondrales55.
Algunas otras nuevas técnicas de manejo de lesiones del cartílago de la cabeza del primer metatarsiano se enfocan en mantener el movimiento y permitir el apoyo inmediato después de cirugía, alejándose de la artrodesis como método de tratamiento definitivo. Se ha desarrollado un implante de hidrogel de alcohol polivinílico(Cartiva)56. Este es un material sintético tiene un contenido de agua con un módulo compresivo y tensil similar al cartílago articular humano. Esto lo hace un material ideal para uso en hemiartroplastias metatarsofalángicas del hallux. Hay un estudio clínico prospectivo randomizado llevado a cabo en 12 centros en Canadá y el Reino Unido con un seguimiento a 2 años demostrando mejoría del dolor y resultados funcionales equivalentes de la hemiartroplastias y la artrodesis del hallux sin casos de fragmentación o desgaste del implante o pérdida ósea. A los 5 años se llevó a cabo una nueva evaluación a 27 pacientes. La sobrevida del implante a 5.4 años fue del 96%. En conclusión, este implante mantuvo la función y la dorsiflexión después de 5 años de seguimiento. El implante demostró excelente sobrevida y una satisfacción global de los pacientes de volverse a practicar la misma cirugía. De esta manera los resultados prometen ser una alternativa a la fusión de la articulación metatarsofalángica en el manejo de HR moderado o severo.
Artrosis y artroplastias en el Hallux rigidusLas prótesis en cirugía ortopédica son dispositivos médicos que tienen como fin sustituir los componentes articulares lesionados, permitiendo restablecer la movilidad articular, eliminando el dolor producto de la mayor rigidez y fricción propias de la artrosis.57 El reemplazo articular suele considerarse un tratamiento efectivo para tratar la artrosis severa. Los resultados definitivos van a depender, como en cualquier plastia articular, de varios factores como por ejemplo: la edad del paciente, el nivel de actividad física, la calidad ósea, la enfermedad de base, el tipo de implante usado y el compromiso asociado de otras articulaciones58,59.
En el HR con estadio grado III y IV de Coghlin y Shurhas, el gold standar es la artrodesis, sin embargo existen algunas situaciones en las que existe artrosis concomitante en varias articulaciones, así por ejemplo al estar comprometida la articulación interfalángica distal del hallux, la artrodesis se constituye en una alternativa poco viable para restaurar la función global del pie60–62.
Surgen entonces varias preguntas: ¿la protesis articular tiene lugar en el antepie?, ¿en que tipo de pacientes podemos indicar una prótesis metatarsofalángica ?, ¿que tipo de protesis existen?, ¿que resultados existen en la literatura?, a continuación desarrollaré el tema esperando responder estas inquietudes.
Existen en el mundo varias clases de protesis metatarsofalángicas y se pueden clasificar dependiendo del segmento articular reemplazado, según el material del que este fabricado, según la interfase usada (hueso, cemento, implante), según la generación del implante aplicado. A continuación se explican las clasificaciones y sus subgrupos.
Clasificación por el segmentoa. Parciales: a.1 hemiartroplastia de la falange.
a.2 hemiartroplastia del metatarsiano.
b. Totales: b.1 Inserto de polietelino.
b.2 Menisco móvil.
Clasificación por el material:
a. Silicona.
b. Metálicas b.1 cromo cobalto.
b.2 Titanio.
Clasificación por la interfase:
a. Cementadas.
b. No cementadas.
Clasificación por generaciones:
a. primera generación: Silicona.
b. Segunda generación:Silicona con anillos
c. Tercera Generación: Protesis con inserto de polietileno
Protesis con menisco móvil.
Existen varias indicaciones para aplicar el implante metatarsofalángico siendo la mas importante la artrosis dolorosa avanzada primaria o secundaria de la primera articulación metatarsofalángica del hallux asociado a artrosis interfalángica asociada a la revisión de otro tipo de procedimientos realizados con anterioridad y que hallan fallado como después de artroscopia, osteotomías periarticulares, implantación de autoinjertos, artroplastias de interposición con capsula o tendones, membranas amnióticas o con la aplicación de cartílago sintético. La elección del paciente es muy importante debe cumplir con algunos requisitos como lo son nivel de actividad física bajo, adecuado peso, adecuada alineación del retropie, mediopie, angulación en valgo menor de 12 grados, calidad osea del metatarsiano sin osteopenia o necrosis avascular, piel y estado neurovascular satisfactorio, además es muy importante tener un paciente educado en este tipo de procedimientos que pueda elegir de una manera consciente el mismo, el cirujano debe estar muy entrenado en la técnica quirúrgica así como en la realización de las revisiones protésicas que puedan surgir63–70.
Indicaciones generales:
- a.
HR (Artrosis) grado III y IV de Couglin y Shurhas.
- b.
Artrosis de la articulación interfalángica distal.
- c.
Rescate de otros procedimientos (artroscopia, Osteotomías; artroplastia de resección)
- d.
Revisión protésica de hemiartroplastia a artroplastia total.
Indicaciones particulares:
- 1.
Bajas demandas funcionales.
- 2.
Mayor de 65 años.
- 3.
Sin comorbilidades significativas.
- 4.
Índice de masa corporal medio o bajo.
- 5.
Adecuada calidad ósea.
- 6.
Retropié alineado y estable.
- 7.
Buenas condiciones de tejidos blandos.
- 8.
Adecuado estado neurovascular.
- 9.
Consentimiento del paciente.
- 10.
Conocimiento del cirujano de la técnica y de la solución ante el fracaso de la cirugía.
Indicaciones para la cirugía de revisión de otros procedimientos con prótesis
- 1.
Buena calidad ósea
- 2.
El aparato estabilizador articular funcional.
- 3.
Alineación metatarso-falángica normla. Angulo intermetatarsiano menor de 12 grados.
- 4.
Tamaño de la falange suficiente.
- 5.
Baja demanda funcional.
- 6.
Ausencia de antecedentes osteomielíticos.
Contraindicaciones:
Relativas
- 1.
Osteoporosis.
- 2.
Antecedentes de osteomielitis.
- 3.
Osteonecrosis o defecto óseo significativo.
- 4.
Tratamientos de largo plazo con esteroides o inmunosupresores pueden reducir la calidad ósea y peligrar la osteointegración de la prótesis.
- 5.
Alto índice de masa corporal.
- 6.
Diabetes y tabaquismo.
- 7.
Actividad laboral con alto impacto.
- 8.
Inestabilidad de la columna medial.
- 9.
Mal alineamiento tridimensional.(requiere corrección previa).
Absolutas:
- 1.
Neuroartropatía. (Charcot).
- 2.
La mala alineación del retropié o mediopie no manejable.
- 3.
Laxitud articular masiva. (Ej: Enfermedad de Marfan).
- 4.
Tejidos blandos periarticulares altamente comprometidos (por ejemplo, en pacientes con artrosis postraumática que se sometieron a varias cirugías previas).
- 5.
Disfunción sensomotor severa de pie / tobillo.
- 6.
Infección activa de hueso o tejidos blandos.
- 7.
Alto nivel de demanda funcional. (Ej: deportes de contacto)
- 8.
Alergia conocida al metal del implante
- 9.
Desviaciones severas del primer radio (ángulo intermetatarsiano superior a 12 grados).
- 10.
Osteoporosis.
- 11.
Pérdidas o defectos óseos graves.
- 12.
Alteraciones vasculares severas.
Ventajas del uso de prótesis metatarsofalángicas:
- 1.
Conservar movimiento lo que permite una propulsión más adecuada del pie durante la marcha evitando la sobrecarga y posterior degeneración de la articulación interfalángica del hallux.
- 2.
Mantener la longitud del 1 dedo, lo que proporciona un mejor aspecto estético del pie y permite una mejor dinámica de la marcha.
- 3.
Mantiene la biomecánica del apoyo del antepié lo cual disminuye las metatarsalgias de transferencia.
- 4.
Si existe fallo de la prótesis se puede revisar con otro tipo de prótesis o con artrodesis71,72.
Complicaciones:
1. Lesiónes de herida a. Dehiscencia.
b. Necrosis de los bordes de la herida.
c. Infección superficial.
2. Necrosis avascular metatarsal.
3. Imbalance periarticular (cápsula, músculo y tendón)
4. Artrofibrosis.
5. Fracturas periprotésicas.
6. Infección profunda.
7. Implante en mala posición.
8. Osteolisis.
9. Sinovitis.73
Con respecto a los implantes existen muchas publicaciones las primeras se realizaron con silicona concluyendo en falla con osteolísis periprotésica según el artículo publicado por Granberry en el año 1.991, posteriormente se mejoró el diseño además la calidad del implante de silástico adicionándole dos anillos de titanio en cada extremo según reporta Sebold en su trabajo con estos dispositivos en su artículo del año 1.996 implantaron 32 pacientes (47 pies) con un promedio de edad de 57 años y un seguimiento promedio de 51 meses, encontrando 30 pies satisfechos, 10 pies con molestias menores en los dedos laterales, 1 pie con infección profunda y revisión, radiológicamente no evidenciaron falla de la prótesis ni osteolísis, en el año 2008 Yee y Lau, anotan que a pesar de haberse mejorado el implante preocupan los efectos del debris de silicona y lo que puede llevar a producir tanto local (reacción a cuerpo extraño, osteolisis, sinovitis) como sistémicamente afectando el sistema linfático, por lo tanto no recomiendan el uso de estos implantes74,75.
Las hemiartoplastias se describen desde 1952, en 1994 Townley y Taranow informaron un 93% de buenos o excelentes resultados en 279 implantes con un seguimiento máximo de 33 años utilizando el implante de BioPro (BioPro, Inc, Port Huron, MI, EE. UU.) (fig. 14). Encontraron que 13 de los 279 implantes fallaron produciéndose en su mayoría a pacientes que poseían además de artrosis hallux valgus o artritis reumatoide. En el 2.010 Giza y colegas, revisaron los resultados de 22 hemiartroplastias BioPro realizadas en 20 pacientes. Los puntajes de dolor en escala analógica visual (EVA) mejoraron de 5 a 2.5 a las 6 semanas con marcha sin dolor. Con mejoría en la función. Taranow et al. informaron mejores puntajes del Índice de Función asociado a una alta tasa de satisfacción después de una hemiartroplastia metálica de la falange proximal. En el 2.008 Sorbie y Saunders demostraron resultados favorables a largo plazo con el uso de hemiartroplastia, mejorando en las puntuaciones promedio de la escala AOFAS de 57 a 88 en un seguimiento promedio de 68 meses. Descubrieron que el procedimiento cumplía con varios objetivos a la vez que aliviaba la rigidez y el dolor permitía conservar la movilidad, la fuerza y la alineación articular.
Existen trabajos comparando la artrodesis metatarsofalángica vs la hemiartroplastia Kim y col. examinaron los resultados de la artrodesis, la artroplastia de resección y el hemimplante y no encontraron diferencias estadísticamente significativas en los puntajes AOFAS en un seguimiento postoperatorio medio de 159 semanas. Las complicaciones para el grupo de hemimplante incluyeron osificación, radiolucencia y quístes alrededor del implante; desviación dorsal del hallux y metatarsalgia. Raikin y col. encontraron que el 57% de los procedimientos realizados con hemiartroplastia metálica obtuvieron buenos o excelentes resultados versus el 81% de los procedimientos de artrodesis. El grupo de hemiartroplastia tuvo una tasa de falla del 24%, 5 de estas requirieron revisión. El puntaje AOFAS posoperatorio fue del 93.1% para la artrodesis versus 71.8% de la hemiartroplastia76.
Ghalambor y col. analizaron los hallazgos histológicos en 2 casos en los que se reviso la hemiartroplastia con artrodesis metatarsofalángica observando la presencia de fibrosis y debris metálico localizados en la interfaz implante-hueso. También se detectaron células mononucleares, lo que indicó aflojamiento del implante de osteólisis en cada uno de los casos77.
En 2010, Carpentier et al. reportaron 32 hemiartroplastias de resuperfialización de la cabeza metatarsal (hemicap) (fig. 15). el seguimiento fue realizado durante 27 meses evidenciando mejoría en las escalas de AOFAS y VAS, no se realizó cirugía de revisión en ningún paciente, concluyen que este tipo de implante proporciona beneficios y excelentes resultados después del seguimiento a dos años78.
Existen prótesis de cerámica diseñadas en el Reino Unido Dawson S. Y col. En el 2012 publican su experiencia utilizando una prótesis de cerámica cerámica denominada MOJE, este trabajo se realizó con los datos de los pacientes intervenidos desde el año 2000 al 2007 en el Reino Unido con un seguimiento de 2 a 8 años de 31 procedimientos. Se realizaron 32 artroplastias MOJE para hallux rígidus doloroso en 30 pacientes (nueve hombres, 21 mujeres) durante 6 años (edad media 61,9, rango, 37 a 76). En el seguimiento de los pacientes, los síntomas, los niveles de función y las radiografías se utilizaron las escalas SF-36, Kitaoka modificado y AOFAS. El seguimiento fue del 97%, durante 58 meses (rango, 28 a 97). Describe que las puntuaciones medias fueron: Kitaoka 53.8 (15 a 75), AOFAS 61.3 / 100 (rango, 18 a 100), SF-36 combinado físico 48.6 (27.6 a 58.7) SF-36 puntuación 52.2 (19.5 a 62.2). 16 implantes mostraron evidencia radiológica de aflojamiento de los componentes (radiolucencia, hundimiento o ambos) y en un caso una fractura del componente. 8 implantes fueron revisados. No existieron infecciones. Los autores concluyen que aunque existen estudios anteriores con resultados iniciales favorables con la prótesis MOJE, todos se han centrado solo en los primeros resultados. En la serie que presentan la tasa de reoperación fue del 26% en los 8 años siendo preocupantemente alta y el principal hallazgo fue en especial el aflojamiento protésico que fue encontrado en 16 implantes(52%)79.
Con respecto a las prótesis totales de tercera y cuarta generación en el año 2.005 el Instituto Nacional de salud y excelencia clínica del Reino Unido (NICE) aceptó la aplicación de este tipo de implantes describiéndolos como seguros y eficaces, sin embargo anota que se necesitan mas estudios a largo plazo para continuar con el análisis de estos sistemas, plantearon una revisión en el año 2.012 pero aún no han realizado ninguna publicación nueva manteniendo vigente la anterior80.
C. Tunstall y col. En el año 2017 publicaron un estudio estudio multicèntrico intervinieron 30 pacientes (33 pies) con una prótesis de menisco móvil (ROTO-glide) (fig. 16) en 7 sitios dentro del Reino Unido. El paciente evaluó pre y postoperatoriamente las puntuaciones de AOFAS y radiografías simples encontrando lo siguiente, la edad promedio fue de 58.6 años, el promedio de seguimiento fue de 16.9 meses, la escala AOFAS prequirúrgica fue de 41.4 y posquirúrgica 76 (29-100), el rango de movilidad total promedio antes fue de 32 y después de la cirugía fue de 61. Existieron 2 complicaciones postoperatorias. En este trabajo concluyen que recomiendan el uso de este implante pero anotan que deben continuar con el seguimiento de los pacientes.
En el 2017 Kofoed H. Reporta el seguimiento de 90 implantes de 3 generación (Rotoglide) seguidos durante 15 años aplicados a 80 pacientes (53 mujeres y 27 hombres) con promedio de edad de 58, describen que 6 pacientes que representan siete prótesis habían fallecido por motivos no relacionados. La escala AOFAS prequirúrgica aumentó significativamente de 40 a 95 en el posquirúrgico. Extrajeron 4 reemplazos (4,4%) por otras razones distintas al aflojamiento. No se registraron aflojamientos asépticos. La tasa de supervivencia del implante a los 15 años fue del 91.5% (83-100), según esto concluyen que esta prótesis ha resistido la prueba del tiempo y anotan que los resultados justifican el uso de este implante.
También en el 2.018 karpe en el reino unido publica un estudio prospectivo para evaluar los resultados funcionales y radiológicos con una artroplastia no cementada de 3 generación. Intervinieron 28 pacientes (34 pies) seguimiento de 2 años, La edad promedio fue 60.5 años (rango 45-77 años). Encontraron mejoría en la escala AOFAS de 41.2 en el prequirúrgico a 89.1 en el posquirúrgico. El rango medio de movimiento metatarsofalángico (MTP) mejoró de 29.5° preoperatoriamente a 68.2° postoperatoriamente, los puntajes de dolor promedio de AOFAS mejoraron de 8.8 antes de la cirugía a 35.0 en el postoperatorio, realizaron 3 cirugías de revisión. No se observaron complicaciones radiológicas en ningún paciente. Concluyen los autores que observan una mejoría clínica y estadísticamente significativa en los resultados funcionales, con una baja tasa de complicaciones tempranas y altos niveles de satisfacción del paciente.
S. Wassink y col. Publican del el año 2017 un estudio prospectivo de 2 años de seguimiento desarrollado en varios 4 países de Europa para evaluar los resultados después de la artroplastia total de la primera articulación metatarsofalángica, utilizando una prótesis de ajuste modular de tres componentes (metis). Describen 55 implantes con seguimiento, 2 implantes fueron removidos durante el estudio. 6 prótesis más tuvieron revisión debido a rigidez o mala alineación. Los puntajes posoperatorios de AOFAS mejoraron significativamente en 32.4 puntos a los dos años de seguimiento (p <0.001). La escala visual analógica para el dolor mejoró significativamente de 6.8 (std 1,6) preoperatoriamente a 1.6 (std 1,9) postoperatoriamente (p <0.0001). La dorsiflexión media mejoró de 12,6 (estándar 10,1) grados preoperatoriamente a 31,2 (estándar 16,8) grados postoperatorios. El 87%de los pacientes estaban satisfechos con el resultado final. 18 prótesis mostraron radiolucencia a los 24 meses. Los autores concluyen que la implantación de una prótesis de ajuste modular de tres componentes Metis (fig. 17) para la articulación metatarsofalángica en hallux rígidus muestra una mejora significativa en los puntajes de AOFAS y una disminución en el dolor. Anotan que sigue existiendo preocupación con respecto a la tasa de reoperación temprana (14.5%) y la supervivencia a largo plazo del implante. Recomiendas que estudios posteriores se enfoquen es estos aspectos.
La artroplastía de hallux es un procedimiento quirúrgico dinámico y en evolución. La tecnología moderna e instrumentación junto con los métodos quirúrgicos estandarizados permiten tenerlo en cuenta en algunos pacientes con HR en estadios III y IV con bajas demandas funcionales.
La prótesis metatarsofalángica se puede usar como alternativa de revisiòn de otras cirugías realizadas previamente y que hallan fallado como después de artroscopia, osteotomias, hemiartroplastias que posean compromiso artrósico de la articulación interfalángica distal, proporcionando un rango de movilidad muy aceptable, disminuyendo el dolor y proporcionando una correcta distribución de las cargas trasmitidas al antepié.
Los últimos artículos publicados en el Reino Unido nos permiten pensar en que a futuro podamos recomendar el uso de la protesis total de la primera articulación metatarsofalángica en nuestros pacientes.
ComplicacionesQueilectomiaA pesar que la literatura demuestra consistente buen pronóstico con este procedimiento, la mayoría de los estudios que soportan la queilectomia son de Nivel III – IV de evidencia. Aunque la satisfacción en los pacientes alcanza el 72% - 100% con Queilectomia para HR Coughlin I –II, existe una tasa del 7%-9% de conversión a Artrodesis en los siguientes 10 años posterior al procedimiento. La recurrencia de osteofitos dorsales es hasta del 31% y se acompaña generalmente de dolor en los arcos medios de movilidad lo que sugiere un proceso artrítico de la articulación MF81. Por último, estudios de análisis de marcha demostraron que la mejoría en los arcos de movilidad es de 12°-17° lo que contrasta con los hallazgos intraoperatorios en los que se consiguen arcos de movilidad hasta de 80-90 82,83.
Osteotomia de MobergL a osteotomía dorsal de la falange proximal puede ser realizada en conjunto con la queilectomia con el fin de mejorar los arcos de movilidad y disminuir el área de presión sobre la cabeza del primer metatarsiano, esta alteración de la morfología de la falange puede ser un factor de dificultad en los casos en que es necesario la conversión a artrodesis84.
Artroplastia de resección de KellerAunque algunos estudios han demostrado mejoría del dolor hasta en el 91% de los casos con la artroplastia, la metatarsalgia de transferencia, debilidad para el despegue y la deformidad en cock-up (41%) han sido reportadas con este procedimeinto85,86.
Artroplastia de interposiciónLas complicaciones son similares a las que se presentan con la artroplastia de Keller, sin embargo debido a las modificaciones recientes con la técnica de interposición los puntajes de AOFAS, VAS Y SF-36 han mostrado mejoría cuando se compara con Artrodesis o Queilectomía.
Protesis o implante metatarsofalángicoAltas tasas de osteolisis, aflojamientos, subsidencias ya fallas del implante han sido reportadas87–89. Por esta razón los implantes de Silastic, utilizados inicialmente tiene un uso restringido en la actualidad. Los implantes métalicos muestran resultados variables tanto para el reemplazo total como para la hemiartroplastia de la MF con tasas de revisión hasta del 24.1%. La cirugía de salvamento generalmente requiere de Artrodesis con injerto de bloque de hueso (auto o aloinjerto) para restituir la longitud del primer metatarsiano. El tiempo y la tasa de consolidación en estos casos es relativamente menor en estos casos al compararlos con la artrodesis primaria.(90)
Artrodesis metatarsofalángicaLa artrodesis continúa siendo el Gold Standard de tratamiento en el manejo de la artrosis avanzada de la MF. Dependiendo la técnica utilizada puede presentarse acortamiento del primer metatarsiano. El posicionamiento de la artrodesis es fundamental teniendo en cuenta que de no conseguir una fijación con neutro de rotación, 5-15° de valgo y 5-10° de dorsiflexion con respecto al suelo, puede terminar ocasionando una metatarsalgia de transferencia, zonas de presión y falla de la fijación. Mútiples estudios han demostrado resultados satisfactorios con la artrodesis y baja tasa de complicaciones, siendo la NO unión la mas frecuente con tasa del 1%-4% luego de 1.3 años de la cirugía.