La cirugía de reconstrucción articular de cadera y rodilla ha logrado grandes avances en los últimos años. Sin embargo, las infecciones periprotésicas (IPP) han permanecido con una incidencia relativamente constante, lo que representa un gran problema tanto para el paciente como para el cirujano, con altísimos costos económicos y emocionales. De esto se deriva que el ortopedista debe tener absoluta certeza en cuanto al diagnóstico y manejo. En la presente revisión presentamos las diferentes estrategias y conceptos en cuanto al diagnóstico y manejo de las IPP de cadera y rodilla.
Nivel de evidencia clínicaNivel IV.
Hip and knee reconstruction surgery has evolved in many aspects within the last few years. Nevertheless, the incidence of peri-prosthetic joint infection (PJI) has also remained constant in this period, generating a serious problem, not only for the patient but also for the surgeon, with high economic and emotional costs. Due to this, the orthopaedic surgeon must have absolute clarity of the diagnosis and management of PJI. In the present review, a description is given of the different and available strategies for the diagnosis and management of hip and knee PJI.
Evidence levelIV.
El reemplazo articular, de cadera y rodilla, es uno de los procedimientos programados más exitosos en ortopedia. Ofrece mejora en cuanto a la calidad de vida de los pacientes, incrementa la función y reduce el dolor. Se ha llegado a denominar al reemplazo total de cadera (RTC) como el procedimiento de la década según Mark Coventry1. El éxito de este procedimiento se llega a encontrar reportado en el 90% de los pacientes2. Para el año 2030 se espera un aumento considerable en el número de procedimientos realizados, en el 174% para la artroplastia de cadera y en el 673% para la de rodilla3.
No obstante, una de las complicaciones más temidas y de difícil manejo en los reemplazos articulares es la infección periprotésica (IPP). La incidencia en los siguientes 2 años tras el postoperatorio de dicha complicación por término medio se encuentra reportada entre el 2,0 y el 2,4% en el reemplazo total de rodilla (RTR) y RTC, respectivamente4,5. Económicamente, la cirugía de revisión por infección presenta el más alto costo e implica un aumento considerable para el sistema de salud6. En Estados Unidos, el costo de las cirugías de revisión pasó de 320 millones de dólares en 2001 a 566 millones de dólares en 2009 y se piensa que superará los 1.620 millones de dólares en el año 2020 dado el aumento de número de procedimientos primarios. Esta entidad ofrece un gran reto tanto para el cirujano como para el paciente e incluso puede comprometer la vida de este último. Por lo anterior, es importante conocer las estrategias diagnósticas y terapéuticas en el manejo de las IPP, las cuales se tratan en esta revisión.
DiagnósticoEl diagnóstico de la IPP representa un desafío clínico dada la ausencia de una prueba única o método de referencia que permita su diagnóstico con una alta sensibilidad y especificidad. No obstante, se han realizado varios esfuerzos para establecer un consenso para el diagnóstico. El síntoma inicial y más frecuente de la IPP puede ser el dolor7. En un RTC, este puede estar localizado en la región inguinal y ocasionalmente irradiarse a la región glútea. En un RTR puede manifestarse como un dolor global, inespecífico, alrededor de la rodilla8. Generalmente, el dolor es constante y no cede ni se modifica con el reposo o la actividad. Es posible que los síntomas locales de inflamación en el sitio de herida quirúrgica no estén presentes y no sean indispensables para plantear una sospecha diagnóstica de IPP9. La fiebre o signos de respuesta inflamatoria sistémica, aun cuando son comunes, también pueden estar ausentes. Como contraparte, hay otros signos que son patognomónicos de la IPP. La existencia de una fístula, por ejemplo, es adicionalmente un criterio principal en el diagnóstico en varios consensos10. Los síntomas o signos ante los cuales se debe sospechar IPP son la existencia de una fístula, una herida quirúrgica con secreción prolongada en el postoperatorio, dolor agudo no explicado o una prótesis dolorosa en cualquier momento del postoperatorio, especialmente si existe antecedente de problemas en la cicatrización11.
En aquellos pacientes que presenten dolor a la altura de una prótesis articular está indicada la toma de radiografía para evaluar signos de aflojamiento, malposición u osteólisis12. Las imágenes por tomografía computarizada y resonancia magnética tienen una utilidad limitada y no están recomendadas para el diagnóstico de IPP13. Las imágenes de medicina nuclear, como la gammagrafía de 3 fases, podrían tener utilidad si el diagnóstico no está claro aunque son poco específicas y no son recomendadas14.
La primera estandarización de la definición de IPP fue planteada en 2011 por la Sociedad de Infecciones Musculoesqueléticas de Norteamérica (Musculoskeletal Infection Society, MSIS), que reunió a cirujanos ortopédicos e infectólogos para definir una serie de criterios principales y secundarios para el diagnóstico de infección. Estos criterios posteriormente se revisaron en 2013 en la Reunión de Consenso Internacional (International Consensus Meeting, ICM) sobre IPP15. Se confirma entonces el diagnóstico al cumplir un criterio principal o 3 secundarios (tabla 1).
Definición de infección periprotésica de acuerdo con el ICM
| Criterios principales • Dos cultivos periprotésicos positivos con microorganismos fenotípicamente idénticos • Fístula que comunica con la articulación |
| Criterios secundarios • PCR > 10 mg/dl y VSG > 30 mm/min • Recuento leucocitario >3.000 en IPP aguda y >2.000 en IPP crónica en líquido sinovial o cambio de ++ en la prueba de esterasa leucocitaria • Neutrófilos en líquido sinovial >80% en crónica y >90% en aguda • >5 neutrófilos por campo en 5 campos de alto poder • Solo 1 cultivo positivo |
IPP presente con 1 criterio principal o 3 criterios secundarios.
PCR, proteína C-reactiva; VSG, velocidad de sedimentación globular.
Tomada de Parvizi J, Gehrke T; International Consensus Group on Periprosthetic Joint Infection. Definition of periprosthetic infection. J Artrhoplasty. 2014;29:1331.
En cuanto a las IPP agudas, es decir, de presentación de menos de 6 semanas del reemplazo primario, la ICM plantea que la velocidad de sedimentación globular (VSG) no es fiable; el recuento de leucocitos en el líquido sinovial debe ser superior a 10.000 y el recuento de neutrófilos, mayor al 90%16.
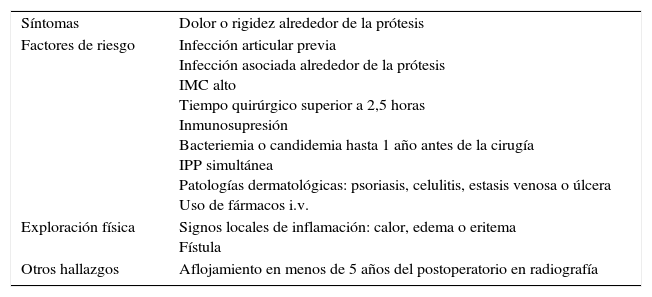
La Academia Americana de Cirujanos Ortopédicos (AAOS) desarrolló una guía de práctica clínica para el diagnóstico de IPP. El primer paso consiste en determinar si el paciente presenta un riesgo alto o bajo de IPP (tabla 2). Este riesgo se establece con una combinación de historia clínica, síntomas, hallazgos en la exploración física y radiografías (tabla 3).
Determinación del riesgo de IPP del paciente
| Baja probabilidad de infección • Dolor o rigidez • Sin factores de riesgo • Sin hallazgos en la exploración física • Sin signos de aflojamiento | Alta probabilidad de infección • Dolor o rigidez • Uno o más factores de riesgo • Inflamación local en la exploración física • Aflojamiento en radiografía |
Establecimiento del riesgo de IPP del paciente
| Síntomas | Dolor o rigidez alrededor de la prótesis |
| Factores de riesgo | Infección articular previa Infección asociada alrededor de la prótesis IMC alto Tiempo quirúrgico superior a 2,5 horas Inmunosupresión Bacteriemia o candidemia hasta 1 año antes de la cirugía IPP simultánea Patologías dermatológicas: psoriasis, celulitis, estasis venosa o úlcera Uso de fármacos i.v. |
| Exploración física | Signos locales de inflamación: calor, edema o eritema Fístula |
| Otros hallazgos | Aflojamiento en menos de 5 años del postoperatorio en radiografía |
IMC, índice de masa corporal; IPP, infección periprotésica.
Si se define que el paciente se encuentra en riesgo alto de IPP, el siguiente paso consiste en evaluar reactantes de inflamación en laboratorio. La leucocitosis y neutrofilia en el hemograma no han demostrado tener un valor en el diagnóstico de la IPP según la AAOS y no se recomiendan como criterio diagnóstico17. La VSG y la proteína C-reactiva (PCR) se han estudiado como marcadores de la IPP al ser rentables, tener una buena sensibilidad para el diagnóstico y ser técnicamente sencillos18. Los valores de referencia según el ICM son >30 mm/s para la VSG y >10 mg/l para la PCR en IPP crónica. La sensibilidad y la especificidad de la VSG son del 75% y el 70%, respectivamente. La PCR tiene una sensibilidad y especificidad del 71-94% y el 71-86%, respectivamente19. Estas pruebas se utilizan por su alto valor predictivo negativo, lo que implica que, al resultar negativas, la IPP podría ser desacertada. Sin embargo, una IPP puede estar presente en el contexto de marcadores de inflamación negativos, como es el caso de infección por Propionibacterium acnes, estafilococo coagulasa-negativo, Candida, Corynebacterium, Mycobacterium y Actinomyces20. Al ser positivas y si el paciente se encuentra en riesgo alto de IPP, se amerita mayor estudio.
El siguiente estudio consiste en la evaluación del líquido sinovial. Este análisis se realiza mediante una punción articular, que debe tomarse tras 2 semanas de suspender cualquier manejo antibiótico. Se debe evaluar el recuento de leucocitos y el diferencial para hallar el porcentaje de neutrófilos. La tinción de Gram es poco sensible y específica, y por ello no se recomienda como método habitual21. El líquido debe enviarse a cultivo para la tipificación del agente causal y definir el manejo antibiótico adecuado. Es importante recordar que los cultivos pueden ser negativos hasta en el 20% de las prótesis infectadas22.
En el momento del diagnóstico inicial o de la sospecha diagnóstica, no se recomienda el inicio de antibiótico empírico dado que este puede provocar un cultivo falsamente negativo, obstaculizar posteriormente el diagnóstico y dificultar más la instauración del manejo antibiótico adecuado.
El uso de la esterasa leucocitaria (EL) en el líquido sinovial también ha demostrado ser una herramienta útil en el diagnóstico de IPP23. Esta enzima se encuentra en los neutrófilos activados y constituye una prueba poco costosa y fácil que ha demostrado una sensibilidad del 93,3% y una especificidad del 77%24.
Otro de los criterios diagnósticos planteados en el ICM es el uso de biopsias por congelación intraoperatorias. Aunque existe controversia en el punto de corte, se considera que entre 5 y 10 neutrófilos por campo de alto poder es el umbral para diagnóstico de IPP25. La AAOS en las guías de práctica clínica para el diagnóstico de IPP recomienda el uso de biopsia por congelación de tejidos periprotésicos en las cirugías de revisión de rodilla y cadera cuando no se ha excluido una IPP; teniendo en cuenta que su realización exige anatomopatólogos entrenados.
El estudio de marcadores séricos y en líquido sinovial para diagnosticar IPP es un área en desarrollo en la investigación en ortopedia26. Uno de los biomarcadores en líquido sinovial es la alfa-defensina, un péptido antimicrobiano producido por los neutrófilos en respuesta a una bacteria. Se ha demostrado que un nivel de alfa-defensina mayor a 5,2 μg/ml tiene una sensibilidad del 97% y una especificidad del 96%27. Hasta la fecha, este es el único marcador que se encuentra disponible a nivel comercial para el diagnóstico de IPP28. De hecho, se ha planteado que la alfa-defensina podría tener mejor rendimiento que la esterasa leucocitaria en el diagnóstico29.
Entre los marcadores séricos en estudio de encuentra la interleucina 6 (IL-6). Esta es secretada por diferentes células del sistema inmunitario, como monocitos, macrófagos y linfocitos T2, entre otras, y activa la liberación de PCR por parte de los hepatocitos. Por este motivo, puede elevarse más tempranamente que la PCR y puede ser un marcador diagnóstico de IPP30,31. Sin embargo, los monocitos liberan esta interleucina ante la existencia de polietileno, aun cuando el implante se encuentra aséptico, lo que puede llevar a falsos positivos32. El rendimiento diagnóstico de la IL-6 continúa en estudio y aún no se encuentra disponible comercialmente.
Otros métodos diagnósticos en estudio son los métodos moleculares, como las técnicas de reacción de cadena de polimerasa (RCP) para la identificación del genoma bacteriano en líquido sinovial. Estas tendrían la ventaja de no requerir el tiempo de crecimiento del cultivo para la identificación del agente etiológico y permitirían identificar genes asociados con resistencia antibiótica33. Aunque su rendimiento diagnóstico aún no es conocido y su aplicabilidad clínica es limitada por su alto costo, este método puede tener un impacto significativo en el manejo futuro de las IPP.
TratamientoTratamiento médicoIdealmente, el tratamiento de la IPP debe ser instaurado por un equipo multidisciplinario, en que el cirujano debe apoyarse en uno o más especialistas en infección ya que muchas de las IPP requieren en ocasiones manejos con antibiótico-terapias prolongadas con uso de líneas o catéteres centrales insertados periféricamente al igual que se debe requerir el soporte de internistas o nefrólogos ya que existe la posibilidad de desarrollar lesión aguda renal con el uso prolongado de algunos antibióticos.
Tratamiento quirúrgicoEl lavado y desbridamiento, en combinación con cubrimiento antibiótico para el manejo de IPP, permiten conservar la prótesis y evitar una cirugía extensa de revisión. El DAIR por sus siglas en inglés (desbridamiento + antibiótico + lavado + retención de prótesis) presenta tasas de erradicación que varían del 21 al 90%34. Este manejo estaría indicado en pacientes con IPP aguda (inferior a 4-6 semanas de instauración) o en infecciones agudas de origen hematógeno con inicio de síntomas inferior a 3 semanas35. Las tasas de éxito varían desde el 14 hasta el 100% dependiendo de las características de los grupos de pacientes evaluados36. En general, el manejo con DAIR es utilizado en infecciones agudas en pacientes, sin comorbilidades considerables o signos de aflojamiento37. Frecuentemente deben tenerse en cuenta varios factores para decidir este manejo. El éxito del lavado y desbridamiento disminuye, por ejemplo, si el microorganismo causal es gramnegativo de alta virulencia, si es una infección polimicrobiana o si se trata de un Staphylococcus aureus resistente a meticilina (SARM)38. Está contraindicado en pacientes con signos radiológicos de aflojamiento de la prótesis, osteomielitis o si existe una fístula, por su alto riesgo de falla39.
Aunque algunos estudios indican que el lavado y desbridamiento conllevaría un resultado peor en caso de realizarse posteriormente a una revisión en 2 tiempos, un estudio reciente indica que no existiría un aumento en las tasa de fallo de una revisión, con lo que aumenta de esta manera la controversia de su uso40. En conclusión, en una IPP el lavado y desbridamiento puede considerarse una opción en pacientes jóvenes, con infección aguda y microorganismos de baja virulencia41.
Cirugía de revisiónExiste controversia acerca del manejo quirúrgico de infecciones periprotésicas ante la posibilidad de manejo en uno o en dos tiempos quirúrgicos. Hasta el momento, no existe un estudio con nivel de evidencia 1 que apoye o indique el uso de una sobre la otra42.
La revisión en un tiempo es de uso frecuente en Europa. Aquellos que la favorecen abogan por menor morbilidad, mejor resultado funcional, menor estancia hospitalaria y menores costos para el sistema43. Aunque hay algunas revisiones que apoyan estos datos, no existe una muestra de estudios de distribución aleatoria lo suficientemente amplia para favorecer una revisión de un tiempo para todos los pacientes con IPP. Algunas contraindicaciones planteadas para una revisión de un tiempo serían: sepsis donde la IPP es el origen sospechado, IPP polimicrobiana o por microorganismos resistentes, existencia de fístula y cubrimiento inadecuado de tejidos blandos44. Asimismo, la realización exige la retirada minuciosa de todo el material, el uso de prótesis cementadas y el desbridamiento agresivo de los tejidos blandos comprometidos45.
Además, la revisión quirúrgica en dos tiempos implica un primer tiempo quirúrgico donde se realiza un extenso lavado y desbridamiento, se retira todo el tejido, la prótesis y las estructuras infectadas. Posteriormente se implanta un espaciador de cemento durante un tiempo establecido, por lo general, 6 semanas, y posteriormente se lleva al paciente a un segundo tiempo quirúrgico para retirada del espaciador y reimplantación más reconstrucción protésica de la articulación. Existen diferencias en cuanto al tipo de espaciadores que pueden ser utilizados46, pues existen espaciadores dinámicos o estáticos, diferentes tipos de antibiótico utilizados y diferencias de tiempo entre las dos etapas quirúrgicas. Algunos estudios indican que los espaciadores dinámicos brindan mayor rango de movimiento posterior a la reimplantación, además de permitir cierto rango de movilidad durante el período entre los dos procedimientos. Sin embargo, este tipo de espaciador implica un costo mayor sin traducirse en una mejoría significativa en cuanto a puntuaciones de funcionalidad47.
Existen estudios que indican superioridad de una cirugía en dos tiempos en cuanto a una menor tasa de reinfección aunque, como se ha comentado previamente, no existe una indicación clara para su uso. También, quienes practican revisión en dos tiempos, como es el caso de los centros de Estados Unidos, resaltan que la revisión en un tiempo tiene pobre evidencia que la apoye, pues esta procede de estudios retrospectivos de un solo centro, sin tiempo suficiente de seguimiento de los desenlaces48. En este momento se encuentra en curso el estudio INFORM en Reino Unido, el primer estudio multicéntrico de distribución aleatoria que intenta evaluar la superioridad de la revisión en un tiempo frente a la revisión en dos tiempos de la IPP en artroplastia de cadera49. Hasta la fecha no se han publicado resultados.
Cuando las opciones ya mencionadas no son viables, como cuando el paciente no es candidato a una intervención quirúrgica o rechace el procedimiento, puede plantearse la supresión con antibiótico y retención de la prótesis50–53. Las tasas de éxito varían entre el 23 y el 86% en algunos pacientes seleccionados. La efectividad de este manejo varía según las características de los grupos de pacientes evaluados y las características del agente causal. Aún no existe consenso sobre el tiempo óptimo de duración del tratamiento.
En caso de falla de estas opciones terapéuticas o cuando la infección es complicada por características microbiológicas de los microorganismos, la reimplantación de una prótesis o se ve limitada por una pobre reserva ósea, las opciones se limitan a artroplastia de resección, artrodesis, o, en algunos casos, amputación54.
ConclusionesAnte el aumento de frecuencia en la realización de reemplazos articulares, las infecciones periprotésicas continuarán siendo una complicación temida en cirugía ortopédica. Su diagnóstico y los estándares de manejo definitivos se encuentran aún en desarrollo. Por todo ello, es importante que los ortopedistas y los médicos de atención primaria se familiaricen con este proceso para así brindar un manejo integral y oportuno a los pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.