Aún existen dudas sobre la conectividad cerebral en el trastorno bipolar tipo I (TBI) y son necesarios estudios con resonancia magnética funcional en estado de reposo (RMf-ER) durante la eutimia para identificar alteraciones funcionales del trastorno.
ObjetivoEvaluar con RMf-ER la diferencias de activación cerebral entre los pacientes eutímicos con TBI y los sujetos de control y explorar el efecto del litio en esta activación.
MétodosEstudio transversal de 21 pacientes eutímicos con TBI y 12 controles, usando RMf-ER y un análisis de componentes independientes. En el grupo con TBI, también se realizó una comparación entre 10 pacientes con TBI en monoterapia con litio y 11 sin medicación.
ResultadosSe encontró mayor activación en el hipocampo derecho (p=0,049) y el cíngulo posterior (p=0,040) en la Default Mode Network (DMN) del grupo TBI frente a los controles. No hubo diferencias estadísticamente significativas entre el grupo de TBI con litio y los pacientes con TBI sin medicación.
ConclusionesLos resultados indican alteraciones en la activación y la conectividad cerebral en el TBI durante la eutimia y principalmente en el cíngulo posterior y el hipocampo dentro de la DMN, la cual podría tener relevancia en la regulación afectiva.
As there are still doubts about brain connectivity in type I bipolar disorder (BID), resting-state functional magnetic resonance imaging (RS-fMRI) studies are necessary during euthymia for a better control of confounding factors.
ObjectiveTo evaluate the differences in brain activation between euthymic BID patients and control subjects using resting state- functional-magnetic resonance imaging (RS-fMRI), and to identify the lithium effect in these activations.
MethodsA cross-sectional study was conducted on 21 BID patients (10 receiving lithium only, and 11 non-medicated) and 12 healthy control subjects, using RS fMRI and independent component analysis (ICA).
ResultsIncreased activation was found in the right hippocampus (P=.049) and posterior cingulate (P=.040) within the Default Mode Network (DMN) when BID and control group were compared. No statistically significant differences were identified between BID on lithium only therapy and non-medicated BID patients.
ConclusionsThe results suggest that there are changes in brain activation and connectivity in BID even during euthymic phase and mainly within the DMN network, which could be relevant in affect regulation.
El trastorno bipolar (TB) es una de las principales causas de discapacidad en el mundo1 y existen muchos interrogantes sobre su etiología, su fisiopatología y sus biomarcadores2. Las investigaciones con resonancia magnética funcional (RMf) han sido relevantes para aclarar estas dudas, pues permiten observar no solo las estructuras anatómicas, sino también los patrones de activación del cerebro, en los cuales se identifican los cambios en la señal dependiente del nivel de oxigenación sanguínea o señal BOLD (del inglés blood oxygenation level dependent), que está relacionada con el consumo de oxígeno y la función neuronal3,4.
Los estudios de RMf que utilizan una actividad cognitiva o paradigma neuropsicológico pueden limitar las observaciones a las regiones que solo se activan según la función evaluada, por lo que se ha intentado explorar la activación cerebral en estado de reposo3,5. Recientemente se demostró que cuando los individuos se encontraban en reposo sin realizar ninguna actividad cognitiva, una señal BOLD de menor frecuencia mostraba un patrón de ondas regulares y permitía construir redes de activación cerebral, lo que se denominó redes en estado de reposo o Resting State Network. En los últimos 5 años, el número de estudios con este método en el TBI se ha incrementado6–12 y sus resultados han mostrado cambios en la conectividad entre la corteza prefrontal (CPF) y el cíngulo anterior con otras estructuras límbicas y diferencias en una red conocida como Default Mode Network (DMN), la cual se activa en estado de reposo y se inactiva con tareas cognitivas dirigidas al espacio externo7,9.
Existen muchas limitaciones a la hora de resumir e interpretar estos resultados en el TBI, como la presencia de varios subtipos del trastorno12, distintas metodologías6,7,11,12, múltiples comorbilidades y medicamentos6,10,13 y la ausencia de control de lateralidad9,13,14. Además, hay muy pocos estudios disponibles durante la etapa de eutimia10,11, en la cual se podría evaluar el funcionamiento cerebral basal aislando los cambios agudos de los episodios afectivos15.
Nuestro estudio tiene como objetivo principal identificar y describir las diferencias de activación y conectividad cerebral en estado de reposo entre los pacientes eutímicos con TBI y los sujetos de control y evaluar estas diferencias entre un subgrupo de pacientes con TBI en monoterapia con litio y otro sin medicación con el fin de explorar su efecto en la activación cerebral.
Materiales y métodosParticipantesEste es un estudio de corte transversal sobre 33 sujetos del área metropolitana de Medellín y municipios del oriente antioqueño realizado por el Grupo de Investigación en Psiquiatría de la Universidad de Antioquia (GIPSI) y el Instituto de Alta Tecnología de Antioquia (IATM); el Comité de Ética de la facultad de medicina y de la Fundación Instituto de Alta Tecnología Médica aprobaron en estudio. Los participantes fueron convocados por teléfono a partir de una base de datos del programa de TB de la Universidad de Antioquia, y quienes aceptaban eran valorados según los criterios de inclusión. La población seleccionada se dividió en tres grupos: 10 pacientes con TBI eutímicos en monoterapia con litio, 11 pacientes con TBI eutímicos sin medicación y 12 sujetos de control. La recolección de la muestra inició en 2009 y finalizó en 2012.
Los criterios generales de inclusión en el grupo de control y el de TBI fueron: edad entre 18 y 60 años, escolaridad entre los 5 y 16 años y lateralidad diestra, y específicamente para el grupo control, no tener antecedentes de trastorno psiquiátrico o neurológico. Los criterios generales de exclusión de ambos grupos de estudio fueron: historia de lesiones neurológicas estructurales o degenerativas, epilepsia, diagnóstico de trastornos psiquiátricos diferentes del TBI, antecedentes de terapia electroconvulsiva a lo largo de la vida, tener marcapasos o prótesis metálicas, embarazo o estar en tratamiento con psicofármacos diferentes del litio en los 6 meses previos. Los pacientes en monoterapia con litio debían estar en tratamiento por un periodo no inferior a 2 meses y asegurar su adherencia durante este tiempo.
InstrumentosEl diagnóstico de TBI y la exclusión de las principales comorbilidades psiquiátricas se hicieron según criterios del Manual Diagnóstico y Estadístico de Trastornos Mentales, Cuarta Edición, Texto Revisado (DSM-IV-TR) empleando la entrevista diagnóstica para estudios genéticos (DIGS) traducida y validada para Colombia16. Las dudas sobre la lateralidad ambidiestra se resolvieron con la escala de lateralidad de Edimburgo (Edinburgh Handedness Inventory), por la cual se calificó como diestro a quien tuviera una puntuación <–4017. Se utilizó la escala de depresión de Hamilton (HDRS) de 17 ítems y la escala de manía de Young (YMRS), ambas validadas al español18, con el objetivo de comprobar los criterios de eutimia por puntuaciones <7 en HDRS y <6 en YMRS.
ProcedimientosAntes de iniciar las evaluaciones se firmó un consentimiento informado donde se explicaba el objetivo y las condiciones de participación. Posteriormente, un residente de Psiquiatría con previo entrenamiento aplicó a los pacientes las escalas HDRS, YMRS y de lateralidad de Edimburgo. Antes de la RMf, se tomaron muestras sanguíneas para evaluar las litemias de los sujetos del grupo en monoterapia con litio. Estos procedimientos se realizaron en un mismo día y dentro de un ambiente hospitalario, pero la entrevista DIGS se hizo otro día y antes de la RMf para evitar la fatiga durante la evaluación. Todos los datos se tomaron en entrevista directa con el paciente.
Adquisición de las imágenesDurante la resonancia en reposo, se indicó a los sujetos que permanecieran quietos, relajados, sin pensar en nada en particular y con los ojos abiertos para garantizar que estuvieran despiertos. Las imágenes se adquirieron con un resonador Philips Achieva Nova Dual de 1,5 T. Se realizaron adquisiciones de eco planar (EPI) sensibles al efecto BOLD con 150 dinámicos por serie, de 16 y 23 imágenes axiales de 7 y 5 mm de espesor respectivamente (gap 1; TR, 2.000 ms; TE, 50 ms; FOV, 240 mm; matriz, 128×128). Además se realizaron adquisiciones volumétricas de todo el cerebro para la localización posterior de las activaciones cerebrales.
Procesamiento de las imágenesPara la obtención de las redes en estado de reposo se utilizó el método de análisis de componentes independientes (independent component analysis [ICA]) y el enfoque de concatenación temporal de la herramienta multivariate exploratory linear decomposition into independent components (MELODIC) de la librería FSL, disponible en: www.fmrib.ox.ac.uk/fsl. Se realizó un preprocesamiento de todas las imágenes, que consistió en realineación de los volúmenes de la serie del sujeto para corregir los efectos de movimiento durante el estudio, extracción del cerebro y eliminación del cráneo, suavizado espacial con un kernel gaussiano, con amplitud total de media altura de 6 mm y un filtro temporal pasa altos de 100 s (0,01 Hz). Además, se registraron todos los volúmenes y se normalizaron por el cerebro estándar del atlas MNI-152 (Montreal Neurological Institute, Montreal, Quebec, Canadá).
Del análisis ICA se obtuvieron 31 componentes independientes, de los que 8 fueron identificados como relevantes en este estudio y se clasificaron como redes en estado de reposo. Los criterios de identificación fueron: señales de baja frecuencia en la gama de 0,01-0,1 Hz y patrones de conectividad localizados en las sustancias gris y blanca. Se excluyeron los componentes que tuvieron aportes en frecuencia >0,3Hz relacionadas con oscilaciones cardiacas o respiratorias y activaciones en líquido cefalorraquídeo o fuera del cerebro.
Análisis de imágenesPara la comparación de las redes en estado de reposo entre diferentes grupos de sujetos se utilizó el método de regresión dual, que identifica para cada uno las dinámicas temporales y los mapas espaciales específicos de activación asociados a las redes encontradas por ICA. Finalmente, los mapas espaciales de cada sujeto que corresponden a una red se recolectan en un volumen (uno por cada grupo y cada componente de ICA) y se ejecuta la comparación de los vóxeles entre las redes de los grupos de sujetos mediante la función «aleatorizar» de la regresión dual, la cual utiliza la información del modelo lineal general para seleccionar los diferentes contrastes entre grupos y encontrar las diferencias entre ellos mediante una prueba de la t de Student, donde un valor de p<0,05 se considera estadísticamente significativo y se corrige para múltiples comparaciones restringiendo el número máximo de falsos positivos con la tasa de descubrimientos falsos (False-Discovery Rate [FDR]). Estos resultados en los mapas espaciales representan las diferencias de las redes entre los grupos de estudio.
Análisis estadísticoPara el análisis estadístico se incluyeron las variables sociodemográficas edad, sexo y años de escolaridad y las variables clínicas edad al primer episodio, duración del trastorno, número de episodios depresivos y número de episodios maniacos/mixtos o hipomanías. Para el análisis descriptivo de las variables, se utilizaron medidas de resumen como media±desviación estándar, mediana (intervalo), frecuencia y porcentaje. Se evaluó el criterio de normalidad de las variables demográficas de los tres grupos por medio de la prueba de Shapiro-Wilk, y con base en esta se aplicó análisis de varianza (ANOVA) cuando la distribución era normal o, de lo contrario, prueba de Kruskal-Wallis. Para las variables clínicas de los dos grupos con TBI (en monoterapia con litio y sin medicación), también se evaluó el criterio de normalidad con la prueba Shapiro-Wilk, y según los resultados se aplicó la prueba de la t cuando la distribución de las variables era normal y la prueba no paramétrica de la U de Mann-Whitney cuando no. Un valor de p<0,05 se consideró estadísticamente significativo. El procesamiento de la información se hizo con el programa IBM SPSS Statistics 19.
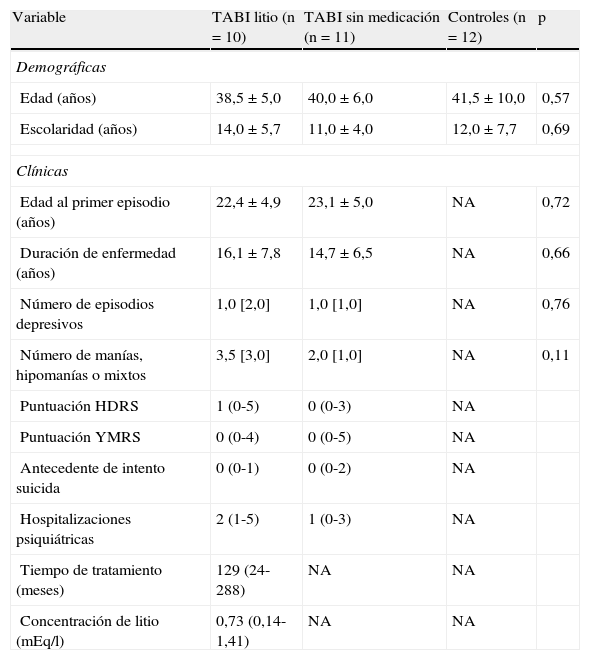
ResultadosCuando se compararon las principales variables demográficas entre el grupo TBI en monoterapia con litio, TBI sin medicación y controles, no se encontraron diferencias estadísticamente significativas en edad ni escolaridad. La mayoría de los participantes del estudio eran mujeres (el 60% en el grupo de litio, el 58% en el grupo control y el 54% en el grupo sin medicación). Al comparar las variables de gravedad clínica entre los grupos TBI con litio y de TBI sin medicación, no hubo diferencias estadísticamente significativas en el número de episodios depresivos, maniacos/hipomaniacos y mixtos, tiempo de evolución de la enfermedad y edad al primer episodio. No se observaron diferencias en el número de intentos suicidas previos o el número de hospitalizaciones psiquiátricas entre los grupos de pacientes (tabla 1).
Variables demográficas y clínicas de los sujetos
| Variable | TABI litio (n=10) | TABI sin medicación (n=11) | Controles (n=12) | p |
| Demográficas | ||||
| Edad (años) | 38,5±5,0 | 40,0±6,0 | 41,5±10,0 | 0,57 |
| Escolaridad (años) | 14,0±5,7 | 11,0±4,0 | 12,0±7,7 | 0,69 |
| Clínicas | ||||
| Edad al primer episodio (años) | 22,4±4,9 | 23,1±5,0 | NA | 0,72 |
| Duración de enfermedad (años) | 16,1±7,8 | 14,7±6,5 | NA | 0,66 |
| Número de episodios depresivos | 1,0 [2,0] | 1,0 [1,0] | NA | 0,76 |
| Número de manías, hipomanías o mixtos | 3,5 [3,0] | 2,0 [1,0] | NA | 0,11 |
| Puntuación HDRS | 1 (0-5) | 0 (0-3) | NA | |
| Puntuación YMRS | 0 (0-4) | 0 (0-5) | NA | |
| Antecedente de intento suicida | 0 (0-1) | 0 (0-2) | NA | |
| Hospitalizaciones psiquiátricas | 2 (1-5) | 1 (0-3) | NA | |
| Tiempo de tratamiento (meses) | 129 (24-288) | NA | NA | |
| Concentración de litio (mEq/l) | 0,73 (0,14-1,41) | NA | NA | |
NA: no aplica.
Los valores expresan mediana [intervalo intercuartílico], media±desviación estándar o medi (intervalo).
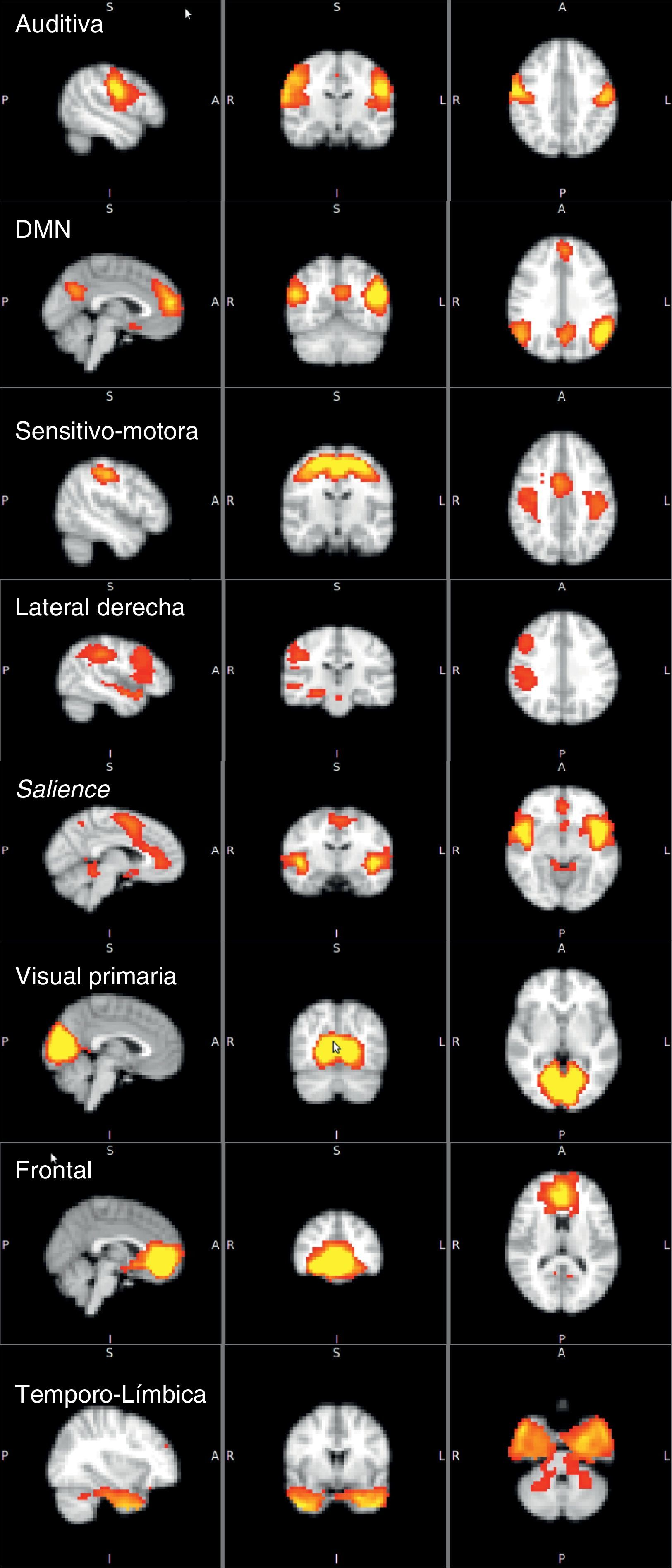
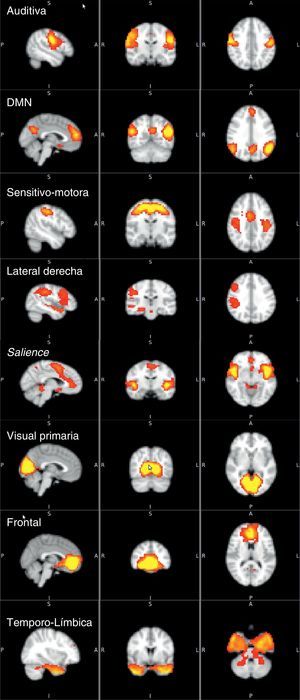
Las ocho redes de activación identificadas fueron auditiva, Default Mode Network (DMN)7,19, sensitivo-motora, lateral derecha, salience network20, visual primaria, frontal y temporolimbica (fig. 1). Muchas de estas redes han sido descritas en estudios previos usando metodología similar. No son redes elegidas de manera subjetiva, sino que son las redes que se forman por activaciones sincrónicas en un intervalo específico. De las ocho redes principales, se seleccionaron las cuatro que estaban más relacionadas con el procesamiento afectivo para hacer la comparación entre los diferentes grupos de estudio. Las cuatro redes seleccionadas y sus regiones cerebrales fueron: DMN (lóbulo temporal medial, corteza prefrontal medial, cíngulo posterior, precuneus y corteza parietal medial, lateral e inferior)7,19,21, temporolímbica (lóbulo temporal, giro parahipocampal, lóbulo límbico, hipocampo y amígdala), frontal y salience network (cíngulo anterior e ínsula anterior)20. Fueron las escogidas porque, según la literatura, han mostrado cambios en la activación cuando se ofrece a los pacientes y sujetos de control paradigmas o estímulos de procesamiento emocional.
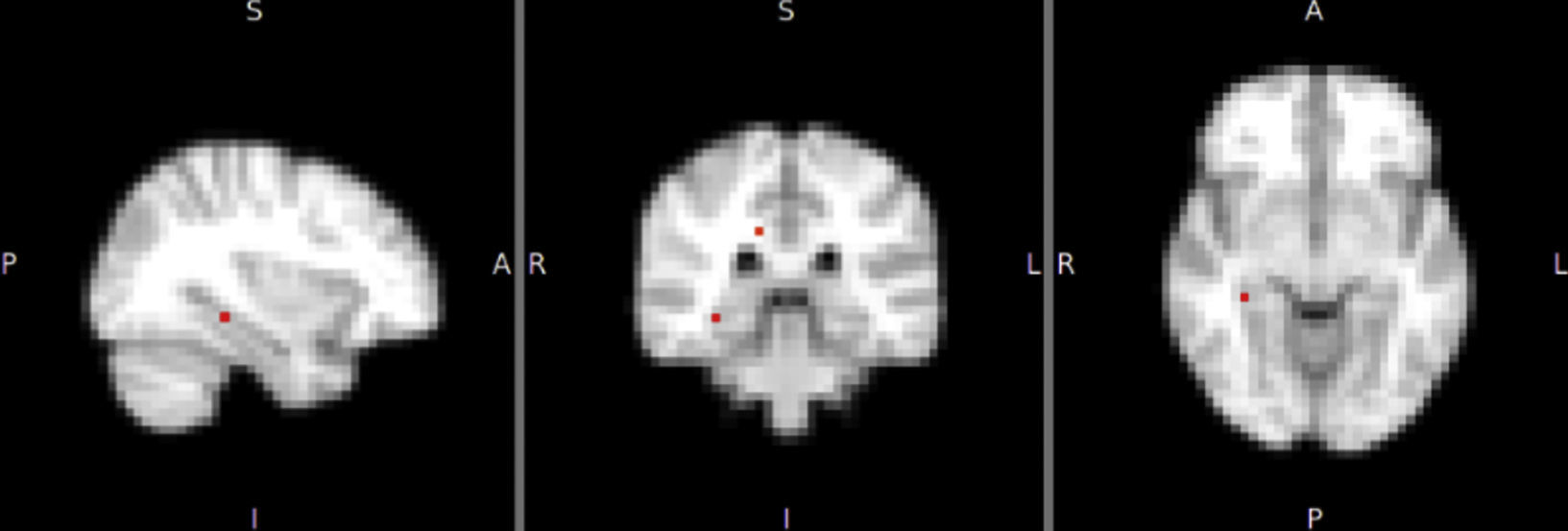
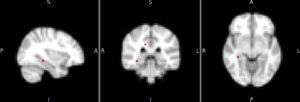
Diferencias de activación cerebral en reposo entre los gruposTrastorno bipolar I comparado con sujetos de controlEl patrón de activación cerebral de la red DMN en todos los sujetos con TBI frente a los controles mostró mayor activación en el grupo con TBI en el hipocampo (Hc) derecho y el cíngulo posterior derecho, con diferencia estadísticamente significativa (fig. 2). En esta misma red, la activación de otras áreas, como el cíngulo anterior, la CPF medial y el tálamo derecho, se mostró mayor en los sujetos con TBI, pero las diferencias no fueron estadísticamente significativas (tabla 2). En las otras tres redes (temporolímbica, frontal y salience), los sujetos con TBI no mostraron diferencias en el patrón de activación cerebral en comparación con los controles.
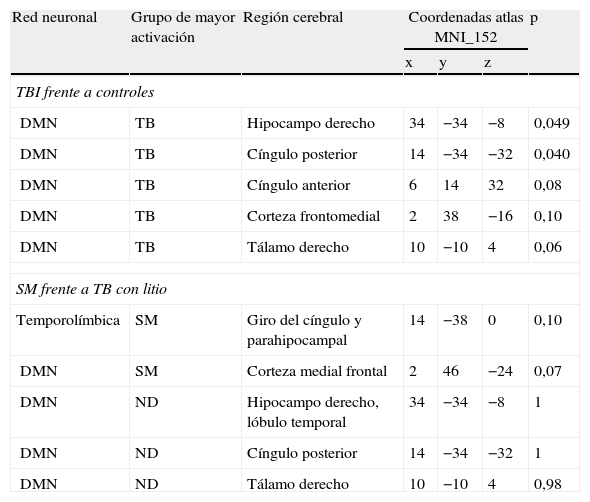
Diferencias de activación cerebral en las principales regiones cerebrales
| Red neuronal | Grupo de mayor activación | Región cerebral | Coordenadas atlas MNI_152 | p | ||
| x | y | z | ||||
| TBI frente a controles | ||||||
| DMN | TB | Hipocampo derecho | 34 | −34 | −8 | 0,049 |
| DMN | TB | Cíngulo posterior | 14 | −34 | −32 | 0,040 |
| DMN | TB | Cíngulo anterior | 6 | 14 | 32 | 0,08 |
| DMN | TB | Corteza frontomedial | 2 | 38 | −16 | 0,10 |
| DMN | TB | Tálamo derecho | 10 | −10 | 4 | 0,06 |
| SM frente a TB con litio | ||||||
| Temporolímbica | SM | Giro del cíngulo y parahipocampal | 14 | −38 | 0 | 0,10 |
| DMN | SM | Corteza medial frontal | 2 | 46 | −24 | 0,07 |
| DMN | ND | Hipocampo derecho, lóbulo temporal | 34 | −34 | −8 | 1 |
| DMN | ND | Cíngulo posterior | 14 | −34 | −32 | 1 |
| DMN | ND | Tálamo derecho | 10 | −10 | 4 | 0,98 |
DMN: Default Mode Network; ND: ninguna diferencia; SM: sin medicación; TB: trastorno bipolar.
Umbral de significación, p<0,05.
Se encontró mayor activación cerebral en el giro cíngulo, el Hc derecho y el giro parahipocampal dentro de la red temporolímbica, y en la corteza frontomedial en la red DMN de los sujetos con TBI sin medicación en comparación con los que estaban en monoterapia con litio, pero la diferencia no fue estadísticamente significativa. Las comparaciones de activación entre los dos grupos de pacientes en las otras tres redes no mostraron diferencias en los patrones de activación cerebral (tabla 2).
DiscusiónA partir de los resultados del estudio, se plantea que el funcionamiento cerebral en estado de reposo de los pacientes eutímicos con TBI tiene mayor activación dentro de la red DMN en áreas como el cíngulo posterior y el Hc derecho, y que posiblemente no hay efecto del litio en estos patrones de activación. Los resultados muestran que no se identificaron diferencias en las áreas reportadas previamente por estudios de conectividad en reposo, como la amígdala, la CPF y el cíngulo anterior (CA)10,12,22 y en otras redes como la frontal y la temporolímbica.
Una de las discusiones que aún está vigente cuando se habla de conectividad en estado de reposo y RMf en TBI es que a la fecha no se conoce si las diferencias en la activación cerebral son dependientes de «estado» o de «rasgo»23, es decir, si es posible que algunas se presenten durante los episodios y que otras persistan durante los periodos de eutimia y se puedan considerar biomarcadores2. Las limitaciones para aclarar esta duda son la ausencia de estudios con pacientes eutímicos11 y la presencia de múltiples medicamentos en las muestras estudiadas10,14,22, lo que puede estar arrojando falsos positivos en las diferencias de activación o conectividad. Nuestro estudio mostró que hay áreas que podrían permanecer afectadas incluso en etapas de remisión en TBI y que podrían acercarnos a entender mejor la fisiopatología del trastorno; además, aportan datos a la hipótesis de que muchas de las alteraciones en la conectividad cerebral de sujetos con TBI no se observan durante la eutimia porque posiblemente estén más relacionadas con el episodio afectivo y con la desregulación entre CPF y estructuras límbicas como la amígdala12,22.
Un estudio previo con pacientes eutímicos también mostró alteraciones en la conectividad entre la CPF y la amígdala y en la conectividad intrarregional entre la CPF medial y el resto de las subregiones de la CPF, lo cual respaldaba la idea de que las alteraciones funcionales persisten incluso en fase latente11 aunque, a diferencia de nuestro estudio, sus hallazgos fueron con el método ROI y no con ICA, por lo que no serían totalmente comparables11. En nuestro estudio no se encontraron diferencias significativas en la CPF ni en la amígdala, que tradicionalmente hacen parte de la modulación afectiva14,19, pero sí se identificaron áreas que pertenecen y están conectadas con el sistema límbico, como el Hc y el giro del cíngulo. El Hc ha cobrado relevancia en los trastornos afectivos, y hay investigaciones que muestran el efecto neurotrópico de litio sobre este y discusiones que proponen que la conexión entre Hc y CPF medial tiene un papel relevante en la regulación afectiva, y no solamente en la función cognitiva y de la memoria24.
Una variable relevante a tener en cuenta a la hora de discutir los resultados de conectividad en estado en reposo y compararlos con la literatura es la metodología utilizada con las imágenes cerebrales6,8,12,14. En nuestro estudio se decidió utilizar el método ICA con el objetivo de hacer una valoración general del cerebro e identificar las principales redes de activación, y no se utilizó el método ROI con el fin de no restringir la exploración a áreas cerebrales escogidas a priori. Como ventaja principal del método ICA, está la evaluación general de todas las redes cerebrales y como desventaja, una interpretación de los hallazgos más compleja.
Los estudios disponibles a la fecha con el método ICA en estado de reposo son escasos7,14,19, y la mayoría de ellos incluyen a pacientes durante episodios afectivos7,19 y usan metodologías variables. Por ejemplo, un estudio utilizó ICA para identificar la red DMN y hacer comparaciones entre pacientes con esquizofrenia y controles19, otro decidió estudiar la homogeneidad regional dentro de esa misma red7 y un tercero buscó diferencias en cinco redes funcionales y encontró un aumento generalizado de la conectividad mesoparalímbica y frontotemporolímbica en el TBI14. Como se observa, los estudios disponibles con ICA, al evaluar objetivos tan diferentes, limitan la comparación de sus resultados.
El aumento de la activación del Hc y el cíngulo posterior derecho fueron dentro de la red DMN, lo que se podría interpretar como un aumento de la activación de estas dos áreas con las otras regiones de la red, como el lóbulo temporal medial, la CPF medial, el precuneus y la corteza parietal medial, lateral e inferior4. La mayoría de las diferencias con tendencia a la significación estadística se encontraron también en esta misma red, y no en redes como la insular o la temporolímbica. Este hallazgo descriptivo en conjunto con estudios previos7,19 indica un papel relevante de la red DMN en el TBI, como también se ha propuesto en la depresión mayor y la esquizofrenia25,26.
Esta red ya se ha estudiado previamente y sigue siendo atractiva tanto por sus regiones mediales y temporales, de gran relevancia en la regulación afectiva, como por su correlación con variables clínicas como el nivel de introspección27. Los estudios en TBI con DMN en estado de reposo muestran diferencias en la homogeneidad cerebral en la CPF medial y el lóbulo parietal inferior de pacientes depresivos7 y diferencias en la coherencia de la corteza prefrontal, parietal y fusiforme izquierda en manía y episodios mixtos, pero no se pueden comparar directamente con los resultados de este estudio porque ambos fueron durante episodios afectivos7,19. Incluso ya se ha reportado que cambios en el CPF medial y el giro parahipocampal en DMN están correlacionados con las puntuaciones de HDRS y YMRS7,19, pero las alteraciones reportadas en la actual investigación en Hc y cíngulo posterior derecho serían independientes de los síntomas.
Los resultados de nuestro estudio también indican que no hay diferencias en la redes de activación cerebral en reposo entre los pacientes que toman litio y quienes no. Una variable de confusión reportada por estudios previos está relacionada con la ausencia de información sobre la posibilidad de falsos positivos que producen los medicamentos en la activación cerebral y así poder definir qué alteraciones son realmente del trastorno10,11. La mayoría de los estudios disponibles no controlan esta variable por las dificultades en la recolección de la muestra e incluyen a pacientes con benzodiacepinas, antipsicóticos y anticonvulsivos10,11,19,22. Algunos autores han reportado que no hay correlación entre concentraciones equivalentes de clorpromazina y las alteraciones en la conectividad7,19, pero los datos con el litio son escasos.
A pesar de que los resultados de este estudio indican que no hay efecto del litio en la conectividad cerebral y que esta hipótesis podría ser plausible, nuestro estudio tiene como gran limitación el tamaño de la muestra, lo que reduce la potencia para identificar diferencias realmente significativas, y que el diseño no fuera longitudinal, que sería necesario para establecer una relación causal. Además, los estudios actuales de litio han mostrado su efecto neuroprotector24, y aumento del factor neurotrófico derivado del cerebro (BDNF)28 y del tamaño de algunas áreas cerebrales, incluso de marcadores indirectos de funcionalidad neuronal como el N-acetil-aspartato29, que desde el punto vista teórico deberían estar reflejados en un cambio en la activación funcional de las neuronas.
Algunas razones de que no se pudiera identificar las diferencias en la activación incluyen el uso de un resonador de 1,5 T y un número de 16 a 21 cortes axiales, cuando otros estudios utilizan 3 T y 31 cortes, con lo que aumenta la probabilidad de no perder activaciones en todas las regiones cerebrales. El modelo de evaluación en estado de reposo aún es difícil de garantizar, pues es complejo el cumplimiento de la orden de permanecer sin ninguna tarea cognitiva durante la toma de las imágenes, y se puede observar activaciones cerebrales de funciones cognitivas internas como recuerdo, imaginación o abstracción. Además, es conocido que la adherencia de los pacientes al tratamiento médico es generalmente pobre; por lo tanto, la falta de medición seriada de concentraciones séricas de litio no nos permite garantizar un efecto continuo del litio. Además, tener pacientes en monoterapia o aún sin medicación solo nos permitiría la extrapolación de resultados a un subtipo de TBI de presentación leve o moderada, a diferencia de los pacientes que necesitan combinaciones de medicamentos y con síntomas subumbrales que hacen parte de la población clínica cotidiana. Los autores también reconocen que es posible que los resultados se hayan visto alterados por variables no incluidas, como el antecedente de síntomas psicóticos o el efecto de otros medicamentos no psicotrópicos en la señal BOLD (p. ej., antihipertensivos).
Las principales ventajas del estudio son el procesamiento general tipo ICA, que evita restringir el análisis de regiones especificas y evalúa el cerebro en general, y tomar a sujetos con un solo subtipo de TB (TBI) que estuvieran eutímicos y excluir características que pudieran alterar la conectividad cerebral, como la terapia electroconvulsiva, los trastornos neurológicos y el uso de medicamentos como las benzodiacepinas o los anticonvulsivos.
Es necesario, en estudios posteriores, utilizar metodologías en RMf que permitan que varios grupos de investigación repliquen los hallazgos, idealmente con tamaños de muestra mayores, adecuado control de los síntomas y los medicamentos y con ajuste de los resultados según las diferentes variables demográficas y clínicas. Esto permitiría aclarar las características de la conectividad basal del TBI y cómo se diferenciarían de las presentadas en episodios afectivos.
ConclusionesEste estudio indica que, a pesar de la ausencia de síntomas (eutimia) y el control de la comorbilidad, existen diferencias en la conectividad y la activación cerebral en estado de reposo en áreas y redes vinculadas con la regulación afectiva, como la red DMN. Aún existen dudas del papel de los medicamentos como el litio en dichos patrones de conectividad. Se deberá realizar nuevos estudios en TBI con la red DMN para aclarar el patrón de conectividad entre las áreas que la componen y su relevancia en las diferentes etapas del trastorno.
FinanciaciónColciencias y sostenibilidad, Universidad de Antioquia, 2013-2014.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A todos los pacientes y controles que participaron en el estudio, GIPSI, IATM, y Lina María Ramírez y Diana Ortiz, quienes participaron en la evaluación psiquiátrica de los participantes en la investigación.