Se ha señalado que el deterioro cognitivo comienza 20 años antes del diagnóstico de la demencia. Además de la edad, diversos factores médicos, socioeconómicos y conductuales pueden estar asociados al declive cognitivo. El objetivo de esta revisión sistemática es resumir la evidencia de factores de riesgo o protectores relacionados con el declive cognitivo en población menor de 65 años.
MétodosSe realizó una revisión sistemática mediante una estrategia de búsqueda en bases de datos MEDLINE y Embase, incluyendo estudios con diseño longitudinal que analizaran el efecto de factores protectores o de riesgo en el declive cognitivo de población adulta menor de 65 años.
ResultadosSe incluyeron 22 estudios en la presente revisión. Factores como diabetes mellitus, hiperinsulinemia, sobrepeso u obesidad, síndrome metabólico, nivel educativo, actividad física, estimulación cognitiva, estado civil y calidad de la dieta podrían estar relacionados con el declive cognitivo antes de los 65 años.
ConclusionesFactores de riesgo cardiovasculares y de estilos de vida pueden estar asociados al declive cognitivo en menores de 65 años. Sin embargo, la calidad de la evidencia es baja.
Cognitive decline could begin 20 years before the diagnosis of dementia. Besides age, several factors related to medical, socioeconomic, and behavioral and genetic condition may be associated with cognitive decline. The aim of this systematic review was to summarize evidence on the risk and protective factors for cognitive decline in people under 65 years old.
MethodsA systematic review was conducted using a search strategy in MEDLINE and Embase, including longitudinal studies to analyze the effect of protective or risk factors on cognitive decline in a population under 65 years old.
ResultsA total of 22 studies were included in this review. Factors such as diabetes, hyperinsulinemia, overweight or obesity, metabolic syndrome, education, physical activity, cognitive stimulation, marital status and diet, could be related to cognitive decline before 65 years of age.
ConclusionsCardiovascular risk factors and lifestyle conditions may be associated with cognitive decline before 65 years of age. However, the quality of the evidence was low.
Se ha señalado que el declive cognitivo comienza 20 años antes del diagnóstico de la demencia1,2. Los individuos con declive cognitivo, a su vez, tienen mayor riesgo de demencia3. Se ha sugerido que factores de riesgo cardiovascular presentes antes de los 65 años estarían asociados con mayor riesgo de demencia4. Más allá del efecto de la edad, la evidencia acerca de la relación entre otros factores de riesgo y el declive cognitivo no es consistente y la calidad de los estudios es escasa5. Por otro lado, estudios transversales6,7 y longitudinales8–11 han indicado que factores cardiovasculares y genéticos podrían estar relacionados con el declive cognitivo antes de los 65 años. Esto es importante, dado que cerca de la mitad de los casos de enfermedad de Alzheimer (EA) podrían ser atribuibles a factores de riesgo cardiovascular presentes varios años antes del diagnóstico12, y se podrían modificar con cambios en los estilos de vida o nuevas terapias preventivas. Aún no existe un tratamiento efectivo que disminuya el declive cognitivo; por esta razón, los estudios sobre factores asociados a dicho declive en población menor de 65 años son importantes por la oportunidad de desarrollar o implementar intervenciones preventivas farmacológicas o no farmacológicas13. No se han reportado revisiones sistemáticas de estudios sobre factores asociados al declive cognitivo en poblaciones diferentes de adultos mayores. Por lo tanto, esta revisión sistemática tiene como objetivo determinar qué factores médicos, sociales o conductuales y genéticos están relacionados con el declive cognitivo en población menor de 65 años.
Material y métodosCriterios de elegibilidadSe diseñó un protocolo siguiendo las guías de Cochrane para revisiones sistemáticas y se utilizó la guía de PRISMA14 para el actual reporte de resultados.
Se incluyeron estudios longitudinales realizados en población menor de 65 años que evaluaran las siguientes exposiciones, siguiendo la clasificación propuesta por Plassman en 20103: a) médicos: diabetes mellitus (DM), síndrome metabólico (SM), hipertensión arterial (HTA), accidente cerebrovascular (ACV), hiperlipemia, homocisteína, trastornos del sueño, obesidad/índice de masa corporal (IMC), traumatismo craneoencefálico (TEC), depresión, ansiedad y resiliencia; b) socioeconómicos y del comportamiento: factores en la infancia (residencia rural/urbana y factores ambientales), nivel educativo, ocupación, coeficiente intelectual (CI), tabaquismo, alcohol, apoyo y redes sociales, estado civil y actividad física; c) exposiciones a agentes tóxicos como pesticidas o polución; d) genéticos: APOE¿4 y otros potenciales identificados en la búsqueda; e) nutricionales y dietarios: vitamina B, folato, otras vitaminas potenciales identificadas en la búsqueda, gingko-biloba, omega 3, consumo de frutas y vegetales, calorías, hidratos de carbono, grasas y proteínas, y f) medicamentos: estatinas, antihipertensivos, antiinflamatorios, esteroides gonadales, inhibidores de la colinesterasa y memantina.
Se incluyeron estudios en humanos menores de 65 años, de cohortes prospectiva o retrospectiva y que evaluaran como desenlace la medición de una función cognitiva específica o general.
Se excluyeron los estudios realizados en pacientes con condiciones específicas como DM, enfermedad renal, esquizofrenia, síndrome de Down, trastornos psicóticos relacionados con abuso de sustancias, epilepsia y Parkinson, diseños de estudios transversales, desenlaces diferentes de las mediciones cognitivas y resúmenes de congresos donde no se pudiera tener información completa y detallada de las características del estudio.
Fuentes de información y estrategia de búsquedaSe realizaron búsquedas en bases de datos hasta octubre de 2013; en MEDLINE desde 1966 y en EMBASE desde 1974. La estrategia de búsqueda utilizada fue: cogni* AND (Decline OR impairment) AND Cohort study NOT ((schizophrenia[mesh] OR schizophrenia[all fields] OR “down syndrome”[mesh] OR “down syndrome”[all fields] OR “psychotic disorders”[mesh] OR “psychosis”[all fields] OR “substance-related disorders”[MeSH Terms] OR “substance abuse”[all fields] OR epilepsy[mesh] OR epilepsy[all fields] OR “seizure disorder”[all fields] OR “Parkinson disease”[mesh] OR “Parkinson disease”[all fields]) AND Limits: Humans, Adult: 19-44 years, Middle Aged: 45-64 years. En EMBASE la estrategia de búsqueda fue: cogni* AND (’decline’/de OR impairment) AND (cohort OR longitudinal) NOT (’schizophrenia’/de OR Parkinson) AND [adult]/lim AND [humans]/lim.
Procedimientos de selecciónLa selección y el análisis de los estudios las realizaron en tres etapas cuatro revisores con formación en Neuropsicología (VT, CM, EH, DG) y un bioestadístico con formación en Epidemiología (DC). En la primera etapa, se revisaron los títulos y los resúmenes; en la segunda, los artículos completos y en la tercera, se realizaron la extracción de los datos y la evaluación de la calidad de los artículos elegidos. Llevaron a cabo todas las etapas al menos dos revisores de manera independiente y se verificaron los resultados de cada etapa en reuniones de conjunto. Las discrepancias se resolvieron por consenso y/o por un revisor adicional.
Procedimientos de recolección de la informaciónLos siguientes datos de los estudios se extrajeron a un formulario prediseñado: número de identificación MEDLINE/Embase, primer autor, año, localización geográfica, diseño, número de participantes, criterios de inclusión/exclusión, edad, sexo, nivel educativo, estado cognitivo basal, factor de riesgo estudiado, desenlace, tiempo desde la evaluación de la exposición hasta la medición final del desenlace, control de variables de confusión, porcentaje de datos perdidos durante el seguimiento y resultados principales/secundarios.
Riesgo de sesgo en los estudios individualesDada la heterogeneidad de criterios para evaluar artículos observacionales con diseños longitudinales, y ante la carencia de guías claras sobre estudios de deterioro cognitivo, se adaptó la guía utilizada en la revisión de Plassman3.
Medidas de resumen y síntesis de los datosLos estudios sobre deterioro cognitivo son heterogéneos con relación a las poblaciones estudiadas, la medición de las exposiciones y los desenlaces que pueden ser categóricos (p. ej., DCL o demencia o estar por encima o por debajo de un punto de corte en la prueba neuropsicológica específica) o continuos usando las puntuaciones brutas o estandarizadas (puntuaciones z). Además, los estudios son heterogéneos con relación a si se midió una función cognitiva específica o en general y con relación a los instrumentos de medición. Por tal razón, en este trabajo no se intentó realizar una síntesis cuantitativa de los resultados.
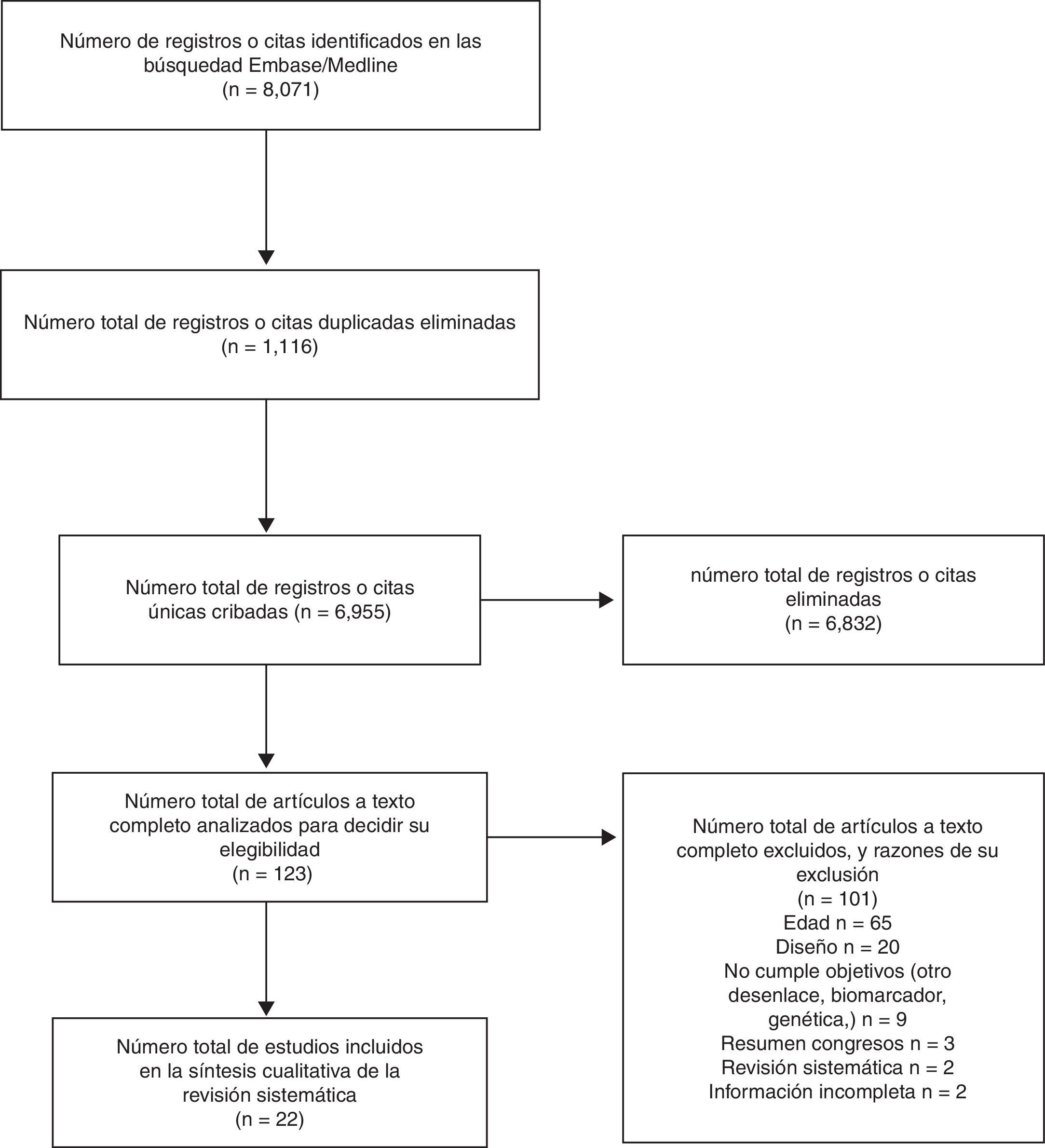
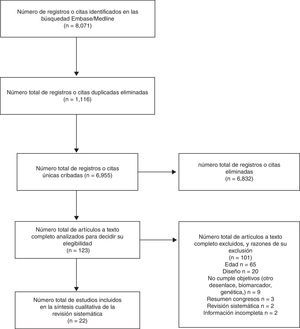
ResultadosSelección artículosSe identificaron 8.071 registros, 4.163 en MEDLINE y 3.908 en Embase, de los que 1.116 estaban duplicados. Se hizo lectura completa de 123 estudios y, de estos, se inclueron 22 en la revisión (fig. 1).
Características de los estudiosLocalización y tiempo de seguimientoTodos los estudios tenían un diseño longitudinal con al menos dos mediciones de las funciones cognitivas. Los países de origen de las investigaciones son Estados Unidos8,11,15–18, Países Bajos9,10,19–24, Reino Unido25–29 y Australia30,31. La mediana de seguimiento desde la primera hasta la última evaluación cognitiva fue 6 (2-20) años.
ParticipantesLa mediana de participantes por estudio fue de 2.214 (180-11.380). Todos los estudios excepto uno16 provenían de cohortes ensambladas previamente: cuatro estudios de la cohorte ARIC8,11,17,18; cuatro de la Cohorte Whitehall II9,10,23,24; tres del Doetinchem Cohort Study19,21,22; dos del Maastricht Aging Study (MAAS)20,31; dos de la cohorte VISAT28,29; dos de la British 1946 Birth Cohort25,26, uno del Longitudinal Assessment of Ageing in Women30; uno del Study of Women's Health Across the Nation (SWAN)15, y uno de The Medical Research Council National Survey of Health and Development (NSHD)27. La mediana de los promedios de edad en los estudios fue 49,5 (35–60) años; la mediana del porcentaje de mujeres incluidas fue del 51% (23%-61%) y la del porcentaje de escolaridad alta fue del 33,4% (19,4%-58%).
ExposicionesSe encontraron 12 estudios que evaluaron factores de tipo médico: DM8,18,22, hiperinsulinemia17, HTA8,18, hiperlipemia8, IMC24,28, ACV18, riesgo de ACV9, SM9,18,24, migraña31 y terapia de remplazo hormonal30, y un estudio evaluó el estado de salud general y su interacción con la educación20. De los factores sociales, económicos o conductuales, los estudios evaluaron el efecto de la educación20, tabaquismo8,18,19,25,27, estado cognitivo en la adolescencia26, actividad laboral en horas laboradas23 y estimulación cognitiva en el trabajo29, estatus socioeconómico10, actividad física21,27 y dieta27. En los factores genéticos, tres estudios evaluaron el efecto de APOE11,16,18.
DesenlacesLos estudios fueron heterogéneos en cuanto a las pruebas utilizadas para la medición de las funciones cognitivas. Un estudio utilizó el Examen Mental Mínimo (MMSE) como medida general30 y cuatro utilizaron puntuaciones compuestas19,21,22,24. También se utilizaron pruebas que evaluaron memoria verbal32,33, memoria episódica, memoria visual34,35, lenguaje34,36–40, velocidad de procesamiento41,42, velocidad perceptual43, atención44–46, función ejecutiva46–48, habilidades espaciales41,49 y perceptuales50,51 e inteligencia verbal52 y no verbal53.
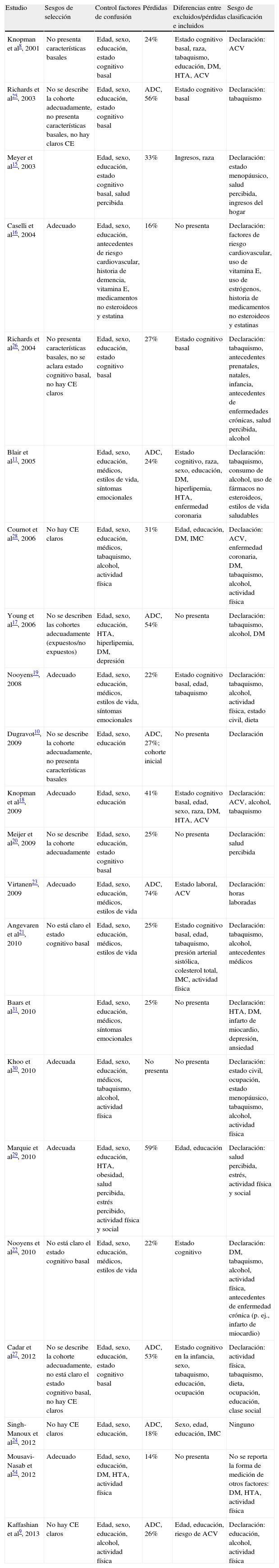
Riesgo de sesgos en los estudiosSe encontró potencial riesgo de sesgos de selección en seis estudios9,24–28 y control incompleto de variables de confusión en 178–11,17,19–28,30,31. La mediana de la pérdida de seguimiento fue del 25% (16%-74%) y nueve estudios incluyeron solo a los participantes con información completa en las dos mediciones (basal/final)9–11,17,23–25,27,30.También se presentaron sesgos de clasificación en las exposiciones medidas por declaración espontánea8–11,15–23,25–31,54 (tabla 1).
Riesgo de sesgos estudios individuales
| Estudio | Sesgos de selección | Control factores de confusión | Pérdidas | Diferencias entre excluidos/pérdidas e incluidos | Sesgo de clasificación |
| Knopman et al8, 2001 | No presenta características basales | Edad, sexo, educación, estado cognitivo basal | 24% | Estado cognitivo basal, raza, tabaquismo, educación, DM, HTA, ACV | Declaración: ACV |
| Richards et al25, 2003 | No se describe la cohorte adecuadamente, no presenta características basales, no hay claros CE | Edad, sexo, educación, estado cognitivo basal | ADC, 56% | Estado cognitivo basal | Declaración: tabaquismo |
| Meyer et al15, 2003 | Edad, sexo, educación, estado cognitivo basal, salud percibida | 33% | Ingresos, raza | Declaración: estado menopáusico, salud percibida, ingresos del hogar | |
| Caselli et al16, 2004 | Adecuado | Edad, sexo, educación, antecedentes de riesgo cardiovascular, historia de demencia, vitamina E, medicamentos no esteroideos y estatina | 16% | No presenta | Declaración: factores de riesgo cardiovascular, uso de vitamina E, uso de estrógenos, historia de medicamentos no esteroideos y estatinas |
| Richards et al26, 2004 | No presenta características basales, no se aclara estado cognitivo basal, no hay CE claros | Edad, sexo, educación, estado cognitivo basal | 27% | Estado cognitivo basal | Declaración: tabaquismo, antecedentes prenatales, natales, infancia, antecedentes de enfermedades crónicas, salud percibida, alcohol |
| Blair et al11, 2005 | Edad, sexo, educación, médicos, estilos de vida, síntomas emocionales | ADC, 24% | Estado cognitivo, raza, sexo, educación, DM, hiperlipemia, HTA, enfermedad coronaria | Declaración: tabaquismo, consumo de alcohol, uso de fármacos no esteroideos, estilos de vida saludables | |
| Cournot et al28, 2006 | No hay CE claros | Edad, sexo, educación, médicos, tabaquismo, alcohol, actividad física | 31% | Edad, educación, DM, IMC | Declaación: ACV, enfermedad coronaria, DM, tabaquismo, alcohol, actividad física |
| Young et al17, 2006 | No se describen las cohortes adecuadamente (expuestos/no expuestos) | Edad, sexo, educación, HTA, hiperlipemia, DM, depresión | ADC, 54% | No presenta | Declaración: tabaquismo, alcohol, DM |
| Nooyens19, 2008 | Adecuado | Edad, sexo, educación, médicos, estilos de vida, síntomas emocionales | 22% | Estado cognitivo basal, edad, tabaquismo | Declaración: tabaquismo, alcohol, actividad física, estado civil, dieta |
| Dugravot10, 2009 | No se describe la cohorte adecuadamente, no presenta características basales | Edad, sexo, educación | ADC, 27%; cohorte inicial | No presenta | Declaración |
| Knopman et al18, 2009 | Adecuado | Edad, sexo, educación | 41% | Estado cognitivo basal, edad, sexo, raza, DM, HTA, ACV | Declaración: ACV, alcohol, tabaquismo |
| Meijer et al20, 2009 | No se describe la cohorte adecuadamente | Edad, sexo, educación, estado cognitivo basal | 25% | No presenta | Declaración: salud percibida |
| Virtanen23, 2009 | Adecuado | Edad, sexo, educación, médicos, estilos de vida | ADC, 74% | Estado laboral, ACV | Declaración: horas laboradas |
| Angevaren et al21, 2010 | No está claro el estado cognitivo basal | Edad, sexo, educación, médicos, estilos de vida | 25% | Estado cognitivo basal, edad, tabaquismo, presión arterial sistólica, colesterol total, IMC, actividad física | Declaración: tabaquismo, alcohol, antecedentes médicos |
| Baars et al31, 2010 | Edad, sexo, educación, médicos, síntomas emocionales | 25% | No presenta | Declaración: HTA, DM, infarto de miocardio, depresión, ansiedad | |
| Khoo et al30, 2010 | Adecuada | Edad, sexo, educación, médicos, tabaquismo, alcohol, actividad física | No presenta | No presenta | Declaración: estado civil, ocupación, estado menopáusico, tabaquismo, alcohol, actividad física |
| Marquie et al29, 2010 | Adecuada | Edad, sexo, educación, HTA, obesidad, salud percibida, estrés percibido, actividad física y social | 59% | Edad, educación | Declaración: salud percibida, estrés, actividad física y social |
| Nooyens et al22, 2010 | No está claro el estado cognitivo basal | Edad, sexo, educación, médicos, estilos de vida | 22% | Estado cognitivo | Declaración: DM, tabaquismo, alcohol, actividad física, antecedentes de enfermedad crónica (p. ej., infarto de miocardio) |
| Cadar et al27, 2012 | No se describe la cohorte adecuadamente, no está claro el estado cognitivo basal, no hay CE claros | Edad, sexo, educación, estado cognitivo basal | ADC, 53% | Estado cognitivo en la infancia, sexo, tabaquismo, educación, ocupación | Declaración: actividad física, tabaquismo, dieta, ocupación, educación, clase social |
| Singh-Manoux et al24, 2012 | No hay CE claros | Edad, sexo, educación, | ADC, 18% | Sexo, edad, educación, IMC | Ninguno |
| Mousavi-Nasab et al54, 2012 | Adecuado | Edad, sexo, educación, DM, HTA, actividad física | 14% | No presenta | No se reporta la forma de medición de otros factores: DM, HTA, actividad física |
| Kaffashian et al9, 2013 | No hay CE claros | Edad, sexo, educación, alcohol, actividad física | ADC, 26% | Edad, educación, riesgo de ACV | Declaración: educación, alcohol, actividad física |
ACV: accidente cerebrovascular; ADC: análisis de datos completos en las dos mediciones; CE: criterios de exclusión; DM: diabetes mellitus; HTA: hipertensión arterial; IMC: índice de masa corporal.
Los estudios presentan heterogeneidad en la presentación del resultado del declive cognitivo: diferencia de medias absoluta8,11,17,23,27,54, estandarizada19,21,22,26, medición final ajustada por la medición basal20,25, pérdida anual en puntos9,16,18,24,29,31 y de manera categórica como aparición de desenlaces mediante puntos de corte predefinidos10,11,28,30.
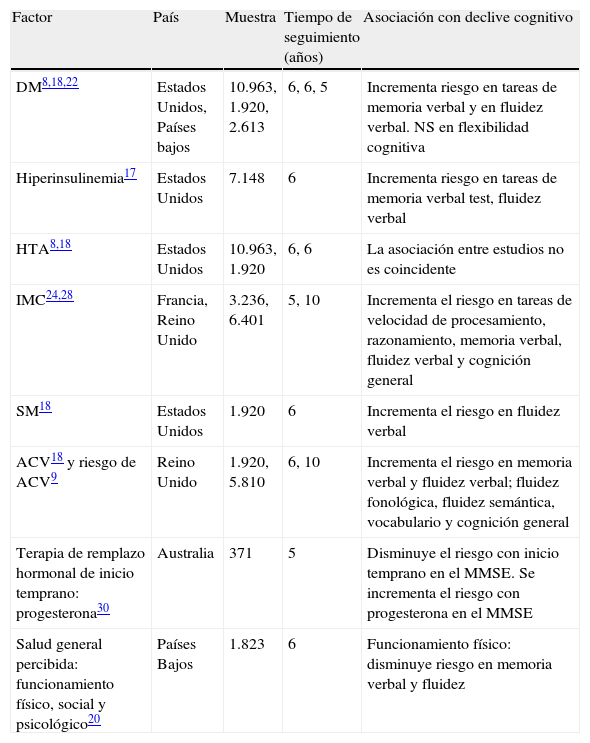
Resultados de los estudios individualesLa tabla 2 presenta los resultados generales de la asociación de los factores médicos y el declive cognitivo. Factores como DM8,18,22, hiperinsulinemia17, IMC24,28 y SM9,18 mostraron asociación con el declive en tareas de memoria verbal y lenguaje (fluidez verbal, fluidez fonológica, fluidez semántica y vocabulario). El inicio temprano de la terapia de remplazo30 y un adecuado funcionamiento físico20 tendrían un efecto protector contra el declive cognitivo.
Evidencia de factores médicos asociados al declive cognitivo en población menor de 65 años
| Factor | País | Muestra | Tiempo de seguimiento (años) | Asociación con declive cognitivo |
| DM8,18,22 | Estados Unidos, Países bajos | 10.963, 1.920, 2.613 | 6, 6, 5 | Incrementa riesgo en tareas de memoria verbal y en fluidez verbal. NS en flexibilidad cognitiva |
| Hiperinsulinemia17 | Estados Unidos | 7.148 | 6 | Incrementa riesgo en tareas de memoria verbal test, fluidez verbal |
| HTA8,18 | Estados Unidos | 10.963, 1.920 | 6, 6 | La asociación entre estudios no es coincidente |
| IMC24,28 | Francia, Reino Unido | 3.236, 6.401 | 5, 10 | Incrementa el riesgo en tareas de velocidad de procesamiento, razonamiento, memoria verbal, fluidez verbal y cognición general |
| SM18 | Estados Unidos | 1.920 | 6 | Incrementa el riesgo en fluidez verbal |
| ACV18 y riesgo de ACV9 | Reino Unido | 1.920, 5.810 | 6, 10 | Incrementa el riesgo en memoria verbal y fluidez verbal; fluidez fonológica, fluidez semántica, vocabulario y cognición general |
| Terapia de remplazo hormonal de inicio temprano: progesterona30 | Australia | 371 | 5 | Disminuye el riesgo con inicio temprano en el MMSE. Se incrementa el riesgo con progesterona en el MMSE |
| Salud general percibida: funcionamiento físico, social y psicológico20 | Países Bajos | 1.823 | 6 | Funcionamiento físico: disminuye riesgo en memoria verbal y fluidez |
ACV: accidente cerebrovascular; DM: diabetes mellitus; HTA: hipertensión arterial; IMC: índice de masa corporal; MMSE: Minimental State Examination; NS: diferencias no significativas; SM: síndrome metabólico.
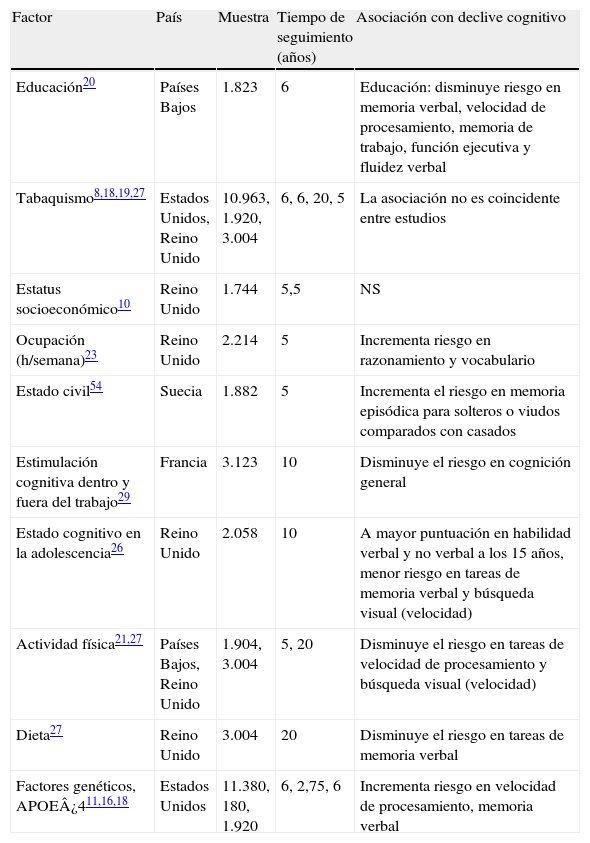
La tabla 3 presenta los resultados generales de la asociación de los factores sociales, económicos o conductuales y el declive cognitivo. Mayor nivel educativo20, mejor nivel cognitivo en la adolescencia26, actividad física21,27, estimulación cognitiva dentro y fuera del trabajo29, estado civil (casado)54 y dieta27 tendrían un efecto protector contra el declive en tareas de memoria verbal, lenguaje, velocidad de procesamiento y función ejecutiva. La APOE¿411,16,18 estaría asociada con el declive cognitivo en tareas de memoria verbal, lenguaje, habilidades espaciales y perceptuales y función ejecutiva.
Evidencia de factores sociales, económicos o conductuales y genéticos asociados al declive cognitivo en menores de 65 años
| Factor | País | Muestra | Tiempo de seguimiento (años) | Asociación con declive cognitivo |
| Educación20 | Países Bajos | 1.823 | 6 | Educación: disminuye riesgo en memoria verbal, velocidad de procesamiento, memoria de trabajo, función ejecutiva y fluidez verbal |
| Tabaquismo8,18,19,27 | Estados Unidos, Reino Unido | 10.963, 1.920, 3.004 | 6, 6, 20, 5 | La asociación no es coincidente entre estudios |
| Estatus socioeconómico10 | Reino Unido | 1.744 | 5,5 | NS |
| Ocupación (h/semana)23 | Reino Unido | 2.214 | 5 | Incrementa riesgo en razonamiento y vocabulario |
| Estado civil54 | Suecia | 1.882 | 5 | Incrementa el riesgo en memoria episódica para solteros o viudos comparados con casados |
| Estimulación cognitiva dentro y fuera del trabajo29 | Francia | 3.123 | 10 | Disminuye el riesgo en cognición general |
| Estado cognitivo en la adolescencia26 | Reino Unido | 2.058 | 10 | A mayor puntuación en habilidad verbal y no verbal a los 15 años, menor riesgo en tareas de memoria verbal y búsqueda visual (velocidad) |
| Actividad física21,27 | Países Bajos, Reino Unido | 1.904, 3.004 | 5, 20 | Disminuye el riesgo en tareas de velocidad de procesamiento y búsqueda visual (velocidad) |
| Dieta27 | Reino Unido | 3.004 | 20 | Disminuye el riesgo en tareas de memoria verbal |
| Factores genéticos, APOE¿411,16,18 | Estados Unidos | 11.380, 180, 1.920 | 6, 2,75, 6 | Incrementa riesgo en velocidad de procesamiento, memoria verbal |
No se encontraron estudios que evaluaran el efecto de los siguientes factores: homocisteína, depresión/ansiedad, TCE, trastornos del sueño, resiliencia, residencia rural/urbana, apoyo y redes sociales, alcohol o exposición a agentes tóxicos.
DiscusiónLa evidencia sobre factores asociados al declive cognitivo en población menor de 65 años es insuficiente. Hay pocos estudios que concluyan en la relación de factores de riesgo cardiovascular, factores sociales, económicos o comportamentales con el declive cognitivo en esta población. Algunas condiciones y antecedentes como la DM, la hiperinsulinemia, la obesidad, el SM, la enfermedad cerebrovascular, la educación, la ocupación, el estado civil y la presencia del polimorfismo APOE¿4 estarían asociados con un mayor declive cognitivo en tareas de memoria verbal, velocidad de procesamiento, función ejecutiva, atención, razonamiento y fluidez semántica y fonológica. Otros factores como la terapia de remplazo hormonal, la estimulación cognitiva, la salud física percibida, la actividad física y la calidad de la dieta podrían tener un efecto protector. No se encontraron estudios que evaluaran el efecto en el declive cognitivo antes de los 65 años de otros factores como homocisteína, depresión/ansiedad, TCE, trastornos del sueño, resiliencia, residencia rural/urbana, apoyo y redes sociales, alcohol o exposición a agentes tóxicos. La evidencia sobre el efecto de estos factores en otras poblaciones de estudio de más edad tampoco ha sido concluyente5.
A pesar de la escasa evidencia en población menor de 65 años, estudios recientes han mostrado la relación entre factores de riesgo cardiovascular evaluados en la etapa adulta joven o de mediana edad y el deterioro cognitivo o la demencia presentes en la etapa de adultos mayores (>65 años). Estos estudios muestran que factores de riesgo como DM55,56, obesidad24,55–57, HTA55,58, altas concentraciones de colesterol56,58, escasa actividad física55 y tabaquismo58 aumentan el riesgo de declive cognitivo o demencia. Hay varias razones potenciales de que la evidencia del declive cognitivo en población menor de 65 años sea escasa o no concluyente; algunas de ellas se han discutido previamente en el contexto metodológico de la investigación sobre factores de riesgo en esta condición59–61. Las características reales de la población en riesgo, o los sesgos de selección, estaban presentes o no se pudo evaluarlas en algunos estudios debido a la falta de claridad en los criterios de exclusión, la inadecuada descripción de las cohortes y la carencia de información acerca del estado cognitivo inicial y otras características basales. El sesgo de supervivencia también pudo darse en numerosos estudios, dado que las pérdidas de seguimiento estuvieron en entre el 14 y el 74%. Este efecto del «desgaste» de la cohorte presente en los estudios de declive cognitivo se ha estudiado anteriormente62–66 y se constituye en una importante debilidad metodológica; dado que se ha demostrado que los participantes que se retiran del estudio tienen un nivel cognitivo menor, menos educación, peor estado de salud (mayor frecuencia de factores de riesgo cardiovasculares), mayor frecuencia de tabaquismo y menos actividad física que los que terminan67–69, lo que subestimaría el declive cognitivo observado en la cohorte. Del mismo modo, se reportan estudios cuyos análisis fueron realizados únicamente con los participantes con información completa en las dos mediciones (basal/final) y que igualmente tenían mejor desempeño cognitivo basal o mejor estado de salud que los que no fueron incluidos. Los métodos de selección de los participantes también pueden estar asociados con las características demográficas y el nivel cognitivo basal, como apunta un estudio reciente70, en el que los participantes provenientes de una muestra seleccionada por conveniencia tenían mejor rendimiento cognitivo, más educación, mayor probabilidad de estar casado y menor probabilidad de historia familiar de demencia que aquellos cuya selección fue probabilística.
Por otro lado, la medición de la función cognitiva es un proceso complejo y con múltiples miradas potenciales. Algunos estudios utilizan medidas compuestas y otros, medidas de funciones cognitivas específicas, con variables continuas o categóricas. Las pruebas neuropsicológicas empleadas para el diagnóstico, la clasificación y el seguimiento de la demencia presentan efectos piso y techo en los extremos de menor y mayor expresión de manifestaciones clínicas y pueden no ser sensibles al declive cognitivo, es decir, ser incapaces de detectarlo, en periodos preclínicos. La utilización de puntuaciones compuestas59 puede ser útil para reducir los problemas de efecto piso o techo y el efecto del aprendizaje71. Sin embargo, la construcción de estas puntuaciones no es simple y pueden existir varias versiones o modelos; por ejemplo, en algunos casos se utiliza la suma ponderada o no ponderada de las pruebas que conforman la batería neuropsicológica.
Esta revisión tiene varias limitaciones: nuestro objetivo era establecer un declive cognitivo y sus factores asociados antes de los 65 años. Por lo tanto, no se incluyeron estudios que midieran la exposición antes de los 65 años, pero los desenlaces se midieron hasta la etapa adulta mayor. Dichos estudios muestran que la exposición a factores relacionados con estilos de vida, factores de riesgo cardiovascular o APOE¿4 incrementan el riesgo de declive cognitivo, deterioro cognitivo leve o demencia después de los 65 años. Estos estudios se habrían podido incluir si se asume que la pérdida cognitiva es lineal, es decir, constante a través de los años. Sin embargo, hay alguna evidencia de que dicha pérdida no es constante72,73 y que la velocidad del deterioro cognitivo puede cambiar años antes de presentarse los síntomas claros de demencia. Otra limitación estaría relacionada con un posible sesgo de publicación al no consultar otras fuentes como literatura gris, trabajos presentados en eventos o contacto con los autores.
ConclusionesAlgunos factores de riesgo relacionados con la salud cardiovascular y los estilos de vida pueden estar asociados al declive cognitivo en menores de 65 años. Sin embargo, se encontraron pocos estudios con diseño y conducción adecuados para sustentar la evidencia de cada uno de los factores reportados en la literatura. Entender cómo estos factores influyen en el riesgo de declive cognitivo es importante para intentar reducir el riesgo de demencia en la etapa adulta. Los estudios futuros se deben realizar considerando las limitaciones metodológicas que no permiten estimar el efecto subyacente de los factores protectores o de riesgo del declive cognitivo en la población general.
FinanciaciónEste estudio fue financiado por el comité para el desarrollo de la investigación. CODI-Proyecto: Tasa de pérdida cognitiva en la enfermedad de Alzheimer familiar por mutación E280A en PS1: Estudio longitudinal 1995-2013 Antioquia. Colombia, mediana Cuantía 2011-Universidad de Antioquia acta 609, Agosto de 2011. Beca programa doctorados nacionales No. 528 año 2011, Departamento Administrativo de Ciencia, Tecnología e Innovación, Colciencias.
Conflicto de interesesLos autores manifiestan que no tienen conflictos de intereses en este artículo.