Número especial: Avances y retos en la psiquiatría regional en Latinoamérica
Más datosLa psiconeuroinmunoendocrinología es una ciencia que documenta desde el plano fisiológico la comunicación bidireccional entre la mente y los sistemas nervioso, inmunitario y endocrino y centra su estudio en el efecto del estrés en estos sistemas. Diversas investigaciones han demostrado que el estrés y ciertas emociones como ira, ansiedad y depresión afectan a los resultados clínicos de condiciones tales como enfermedades cardiovasculares y autoinmunitarias, cáncer e infección por el virus de la inmunodeficiencia humana. El presente trabajo se enfoca en la artritis reumatoide como enfermedad autoinmunitaria paradigmática, y documenta las alteraciones que se presentan desde la visión de la psiconeuroinmunoendocrinología y los efectos del estrés en la actividad de la enfermedad.
MétodosSe revisó literatura indexada hasta la fecha que expusiera el efecto del estrés en la génesis o la evolución de la artritis reumatoide.
ResultadosEn el sistema de respuesta al estrés, los pacientes con artritis reumatoide presentan disfunción del eje hipotálamo-hipófiso-suprarrenal, predominio del sistema simpático, aumento de interleucinas proinflamatorias, disbiosis marcada y efectos inmunomoduladores duales de la melatonina.
ConclusionesEn una época en que la medicina se encuentra dividida en múltiples subespecialidades, es importante retomar el concepto de la salud como un estado complejo, sustentado por un equilibrio dinámico entre factores biopsicosociales, de interacción mente-cuerpo-medio ambiente en los procesos patológicos. Por ello el enfoque psiconeuroinmunoendocrinológico del individuo y su enfermedad es un desafío importante para el tratamiento de los pacientes con enfermedades autoinmunitarias.
Psychoneuroimmunoendocrinology is a field of science that documents bidirectional communication originating on a physiological level between the mind and the nervous, immune and endocrine systems, and centres on the effects of stress on these systems. Various studies have shown that stress and certain emotions such as anger, anxiety and depression affect clinical outcomes in conditions such as cardiovascular diseases, autoimmune diseases, cancer and human immunodeficiency virus infection. This paper focuses on rheumatoid arthritis as a paradigmatic autoimmune disease and documents the changes that occur from a psychoneuroimmunoendocrinology perspective and the effects of stress on the activity of the disease.
MethodsLiterature indexed to date describing the effects of stress on the onset or course of rheumatoid arthritis was reviewed.
ResultsIn the stress response system, patients with rheumatoid arthritis present dysfunction of the hypothalamic–pituitary–adrenal axis, predominance of the sympathetic nervous system, increased pro-inflammatory interleukins, marked dysbiosis and dual immunomodulatory effects of melatonin.
ConclusionsIn an era in which medicine is divided into multiple subspecialisations, it is important to return to the concept of health as a complex state based on a dynamic balance among biopsychosocial factors of mind/body/environment interaction in disease processes. For this reason, a psychoneuroimmunoendocrinological approach to individuals and their illnesses constitutes an important challenge in the treatment of patients with autoimmune diseases.
El modelo biomédico tradicionalmente ha abordado el proceso salud-enfermedad de manera fragmentada, lo cual se refleja en considerar los sistemas nervioso (SN), inmunitario (SI), endocrino (SE) y psíquico como entes independientes sin conexiones entre sí; sin embargo, desde la década de los setenta, estudios científicos comenzaron a evidenciar la relación existente entre dichos sistemas, lo que dio lugar al desarrollo de la psiconeuroimnuendocrinología (PNIE), como un nuevo campo de la ciencia que documenta desde el plano fisiológico el efecto bidireccional entre la mente, el SN, el SI y el SE1. En la literatura esta disciplina se conoce como psiconeuroinmunología (PNI), término acuñado por el psiquiatra Robert Ader y el inmunólogo Nicholas Cohen2.
Se ha demostrado en estudios que el estrés y ciertas emociones como ira, ansiedad y depresión afectan a los resultados clínicos (incluida la muerte)3 de condiciones como enfermedades cardiovasculares4 y autoinmunitarias5,6, cáncer7 e infección por el virus de la inmunodeficiencia humana8. A través del efecto que genera el estrés en el SN, el SI y el SE, se ha evidenciado que existe un circuito de retroalimentación entre dichos sistemas mediado por diferentes tipos de señalización molecular que conforman distintos lenguajes bioquímicos. Así, se tiene un idioma neuropsíquico, dado por neurotransmisores y neuromediadores, otro inmunitario, dado por citocinas e inmunomediadores, y otro endocrino, dado por hormonas y péptidos9. El desequilibrio en la comunicación de alguno de estos sistemas produce enfermedades que afectan al individuo física y psicológicamente. Cualquier enfermedad se expresa primordialmente en un sistema, pero conlleva alteraciones en todo el circuito. Hay evidencia del impacto del estrés en la susceptibilidad y la evolución de enfermedades agudas y crónicas cuando produce trastornos en la inmunorregulación10. Esto ha dado lugar al estudio de factores emocionales que influyen en el inicio y el curso de enfermedades autoinmunitarias como la artritis reumatoide (AR), el lupus eritematoso sistémico (LES), la tiroiditis y la esclerosis múltiple (EM)11,12.
La AR es una enfermedad reumática crónica de etiología desconocida en cuya patogénesis hay varios factores de riesgo involucrados, entre ellos factores genéticos, hormonales, ambientales e infecciosos y estrés. Actualmente se reconoce al estrés como un importante factor de riesgo de la aparición y, aún más, la modulación de la actividad de la enfermedad13.
Esta revisión se centra en la AR y documenta las alteraciones que se presentan desde la PNIE y los efectos del estrés en la actividad de la enfermedad.
MétodosEstudio cuantitativo de fuente secundaria y revisión de tema en 3 fases14.
Fase 1: en la definición del problema se establecen los tópicos de interés partiendo de la interrelación de los sistemas neurológico, endocrino e inmunitario ante el estrés, para profundizar en los avances científicos de estos sistemas en la AR.
Fase 2: búsqueda bibliográfica semiestructurada y abierta mediante las siguientes palabras clave: psiconeuroinmunología, estrés, microbiota, ciclo circadiano y cada una de ellas conectada con AR de manera condicionada. Las bases de datos utilizadas fueron PubMed, Biblioteca Virtual de Salud, Google Scholar, Ovid y Proquest. Dos investigadores seleccionaron los estudios básicos-clínicos de los temas de interés, sin restricción de idioma o fecha de publicación, y 2 expertos en el tema los validaron. Se eliminaron los artículos duplicados.
Fase 3: el producto fue sometido a 3 evaluaciones de contenido para garantizar la comprensión profunda y reflexiva de las interacciones de interés con la AR (tabla 1 del material adicional).
Interacciones psiconeuroinmunoendocrinas y estrésEl estrés es un estado de desarmonía o amenaza a la homeostasis, provocado por cualquier estímulo fisiológico, ambiental, psicológico o emocional15. El estrés comienza con un estímulo (estresor) que causa una reacción en el cerebro (percepción del estrés), que a su vez activa sistemas fisiológicos en el cuerpo (respuesta al estrés). El sistema de respuesta al estrés resulta en la liberación de neurohormonas, las cuales envían un mensaje eferente desde el cerebro a la periferia13.
El cerebro interpreta experiencias como amenazantes o no y a su vez determina la repuesta fisiológica y conductual a dichas situaciones.
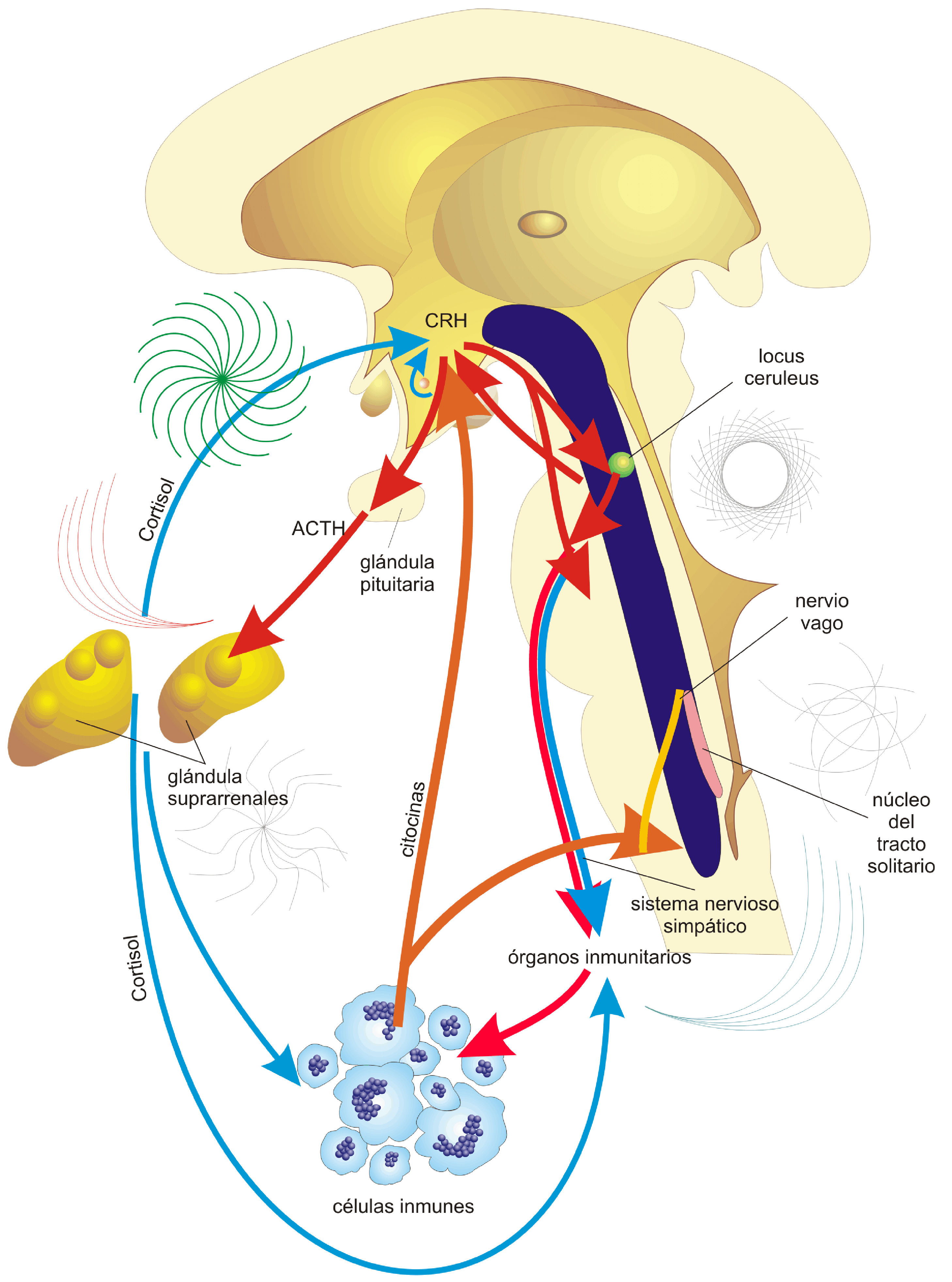
El sistema nervioso central (SNC) se comunica con el SI a través de fibras simpáticas del sistema nervioso autónomo (SNA) que inervan los órganos linfoides primarios y secundarios16. Estas fibras nerviosas liberan sustancias (endorfinas, sustancia P, péptido intestinal vasoactivo) que influyen en la respuesta inmunitaria mediante su unión a receptores en los leucocitos17. También, los ejes hipotálamo-hipófiso-adrenal (HHA), simpático-adreno-medular (SAM) e hipotálamo-hipófiso-gonadal (HHG) secretan hormonas que se unen a receptores específicos en los leucocitos y modulan su distribución y su función18,19 (fig. 1).
Comunicación psiconeuroinmunoendocrina. En respuesta a eventos estresantes, se produce corticotropina (CRH) en el hipotálamo y se induce en la hipófisis la adrenocorticotropina (ACTH), la cual en la glándula adrenal estimula la liberación de cortisol, que modula la respuesta del sistema inmunitario. La CRH, actuando en el tronco encefálico, estimula el sistema autónomo, que inerva los órganos inmunes y regula las respuestas inflamatorias en el cuerpo. La alteración de estas interacciones conduce o agrava procesos patológicos como en la AR. Las líneas rojas y naranjas indican estímulo y las azules, inhibición. Tomado y modificado de Sternberg et al.95.
La principal función del SI es la discriminación entre lo propio y lo extraño; para ello cuenta con capacidad de memoria y aprendizaje similar a la del SNC; además, durante el desarrollo ambos sistemas se regulan por apoptosis20. Las citocinas no solo se producen en el SI; se ha demostrado en estudios en modelos animales21 y humanos22 la síntesis en el cerebro, como las interleucinas (IL) 1 y 6, el factor de necrosis tumoral alfa (TNFα)23,24 por la microglía, los astrocitos, las neuronas y las células vasculares, que pueden sintetizarlas y producirlas, expresar receptores y amplificar su señal25,26.
Las citocinas tienen una función fisiológica en la regulación de la actividad del eje HHA27, pues tienen receptores en las estructuras que lo conforman28-30. Citocinas como IL-1, IL-2, IL-6 y TNFα afectan a la liberación de hormonas de la adenohipófisis por acción sobre el hipotálamo y/o la hipófisis; el efecto predominante de estas citocinas es estimular el eje HHA y aumentar las concentraciones de corticotropina (ACTH) en plasma debido a la estimulación de la secreción del factor liberador de corticotropina (CRF)31,32.
En la circulación sistémica la ACTH actúa sobre la zona fascicular de la corteza suprarrenal, la cual sintetiza y secreta glucocorticoides. Estos glucocorticoides ejercen una retroalimentación negativa, pues inhiben la síntesis y secreción de CRF desde el hipotálamo y ACTH en la hipófisis. Así, después de un estímulo que provoca la liberación de CRF y ACTH, la producción de glucocorticoides terminará esta liberación, lo que asegura que se mantenga la homeostasis33.
El estrés psicosocial o biológico, la disfunción del eje HHA y las anormalidades en la actividad inmunomoduladora de numerosos mediadores neuroendocrinos pueden contribuir al inicio, la progresión y la gravedad de enfermedades reumáticas autoinmunitarias, particularmente AR y LES5,6,34.
Sistema de respuesta al estrés en ARLa AR es una enfermedad inflamatoria crónica y progresiva, caracterizada por sinovitis persistente, inflamación sistémica y presencia de autoanticuerpos (particularmente anticuerpos del tipo factor reumatoide y anticuerpos contra los péptidos citrulinados), que lleva a daño articular, discapacidad física, disminución de la calidad de vida, enfermedades cardiovasculares y otras comorbilidades. Esta enfermedad causa una carga significativa en costos médicos, económicos y sociales35. La AR es frecuente en pacientes de 40 a 70 años y principalmente mujeres. Afecta aproximadamente a un 0,5-1% de los adultos de los países industrializados35,36 y a un 0,1-0,5% en los países en desarrollo37,38.
Varios factores de riesgo están involucrados en la patogénesis de la AR: factores genéticos, infecciones crónicas, hormonas sexuales, factores ambientales como el tabaquismo y el estrés39.
Se ha descrito que la exposición a estresores físicos y psicológicos se relaciona con un incremento en la utilización de servicios de salud, inicio de enfermedades específicas, resultados adversos para la salud y muerte prematura40. En la AR, se ha observado en clínica e investigación que el estrés y los eventos importantes en la vida del paciente influyen la actividad de la enfermedad41,42.
Varios factores son de relevancia para el efecto del estrés en la enfermedad reumática: a) duración del estrés; b) intensidad del estrés; c) integridad del sistema de respuesta al estrés de los pacientes con enfermedad reumática (HHA y sistema nervioso simpático [SNS]); d) capacidad de la persona para afrontar el estrés, y e) tipo de estrés (euestrés, disestrés)13,43.
La exposición prolongada a altas concentraciones de citocinas como IL-1β, TNFα e IL-6 en la AR afecta a las respuestas fisiológicas al estrés como las conductas de afrontamiento efectivas44, y resulta en depresión45, lo que conduce a un mal pronóstico a largo plazo46–48.
Estudios realizados en humanos y modelos animales respaldan la teoría de que en la AR el SI, el eje HHA, el SNA y los mecanismos inhibitorios de la inflamación en respuesta al estrés están alterados49. En un estudio realizado en ratas Lewis (LEW/N), que tienen predisposición a sufrir procesos inflamatorios debido a un defecto genético en la síntesis de CRH, se observó el desarrollo de AR aguda tras la inyección intraperitoneal de peptidoglucanos y polisacáridos derivados de la pared celular de estreptococos (SCW por sus siglas en inglés), seguida por una fase crónica que semeja la AR en humanos50. Esta susceptibilidad de las ratas Lewis a la artritis se ha relacionado con una respuesta defectuosa del eje HHA con bajas concentraciones de corticosterona, probablemente debido a una alteración hipotalámica relacionada con un defecto en la biosíntesis de CRH51. Mientras que en las ratas de la cepa Fisher (F334/N) la inyección de SCW no induce AR, en estas ratas se presenta una intensa reacción de AR cuando se les administra concomitantemente un antagonista de los glucocorticoides, lo cual demuestra que se requiere una respuesta intacta del eje HHA para una relativa resistencia a la AR50.
Hallazgos similares se han observado en humanos. Samant et al.52 evaluaron la integridad del eje HHA en pacientes con AR sometidos al test de hipoglucemia inducida por insulina; observaron que el 70% de los pacientes mostraban alguna anormalidad en la repuesta del eje HHA a este estrés fisiológico, lo cual indica que una anormalidad primaria del eje puede ser significativa en la patogénesis de la AR. Dekkers et al.53 compararon la respuesta del eje HHA a diferentes estresores en pacientes con AR reciente y controles sanos, y observaron una respuesta deficitaria de la ACTH para controlar el estrés, lo cual se refleja en una escasa secreción de cortisol en relación con el proceso inflamatorio. Se ha descrito también disminución en la secreción de cortisol frente al estrés inducido por ejercicio físico extenuante en pacientes con AR y LES en comparación con individuos sanos54.
Algunos estudios han respaldado la hipótesis de que hay interacción entre el SN y la inflamación en la artritis, como diferentes reportes de caso en los cuales pacientes hemipléjicos o con algún tipo de denervación que contrajeron artritis no la presentaban en el área denervada55,56. Se ha descrito además desequilibrio del SNA como hallazgo constante en pacientes con AR y otras enfermedades autoinmunitarias; varios estudios demuestran tono parasimpático reducido y un incremento del tono simpático basal57. Leden et al.58 llevaron a cabo un estudio en pacientes con AR de diferentes gravedades y controles sanos sometidos a pruebas de la respuesta autonómica; observaron que los pacientes con AR en reposo tienen incrementos de la frecuencia cardiaca y la presión arterial, lo cual se interpreta como un aumento del tono noradrenérgico central59. También se ha descrito que el bajo tono del sistema parasimpático lleva a una disminución en la actividad de vías colinérgicas antiinflamatorias que incrementa las citocinas que contribuyen al estado proinflamatorio60.
Además, se ha descrito que el tejido sinovial inflamatorio de pacientes con AR sufre pérdida de fibras nerviosas simpáticas acompañada de aumento en la concentración de sustancia P en fibras nerviosas sensoriales, lo que conduce a una situación proinflamatoria en la cual se estimula la producción de TNFα vía receptores de sustancia P y alfaadrenérgicos. El equilibrio entre el sistema nociceptivo (sustancia P) y el SNS (noradrenalina [NA]) está desplazado hacia un estado proinflamatorio49. Sumado a lo anterior, se han detallado otros hallazgos como la pérdida de los receptores betaadrenérgicos o defecto de la señalización de estos en mononucleares de sangre periférica e inmunocitos sinoviales61. Dados los defectos en los receptores beta, la NA no puede ejercer su actividad inmunosupresora típica en macrófagos, neutrófilos y células citolíticas. Este fenómeno, acompañado de la pérdida funcional de fibras nerviosas simpáticas en el tejido sinovial inflamatorio y la presencia de mayor innervación con fibras nerviosas sensoriales proinflamatorias, sostiene una situación proinflamatoria local49,62,63.
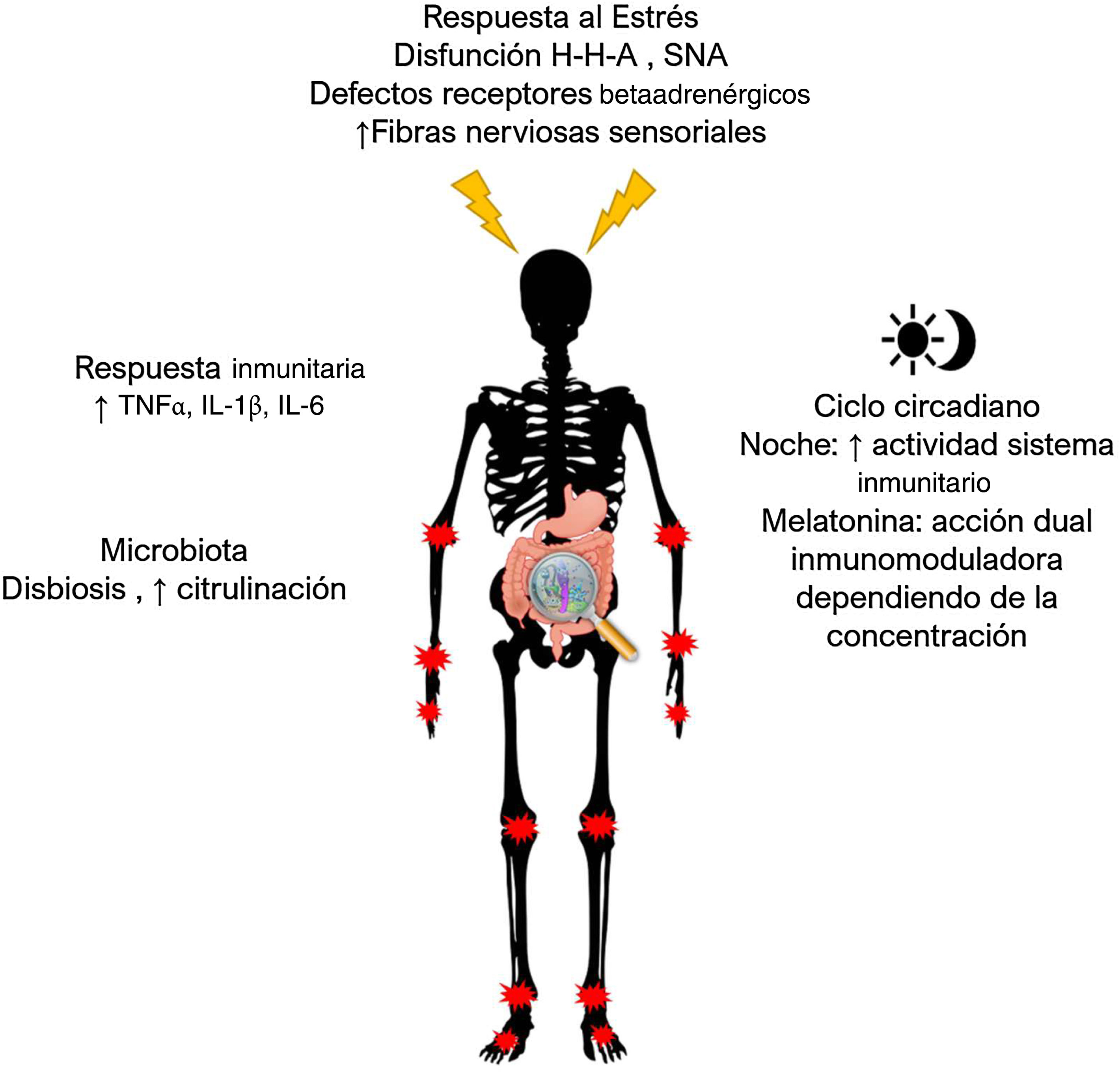
En una situación de estrés en la AR, la habitual influencia antiinflamatoria del eje HHA y el SNS ya no es funcional debido a la secreción de cortisol disminuida, la pérdida de fibras nerviosas simpáticas, los defectos en los receptores betaadrenérgicos y el aumento relativo de las fibras nerviosas sensoriales.
AR y ciclo circadianoLos ritmos circadianos se definen como la alternancia entre luz y oscuridad en periodos de aproximadamente 24 h que regulan la actividad biológica humana64. Estos ritmos se originan en el SNC, específicamente el núcleo supraquiasmático. Gracias a la relación estrecha entre este núcleo y las células ganglionares fotosensibles retinianas que contienen melanopsina, es posible regular una serie de actividades diarias como el sueño, la temperatura, los horarios de alimentación y las funciones metabólica, endocrina e inmunitaria65,66.
Entre los factores que perturban los ritmos circadianos se encuentran los turnos de trabajo nocturnos y el jet lag, que alteran los ciclos de sueño y vigilia, la secreción de hormonas y los horarios de alimentación y se asocian con trastornos como obesidad, alergias y afecciones autoinmunitarias66.
El SNC, a través del eje HHA, el SNA y hormonas como la melatonina, sincronizan los relojes biológicos periféricos, de modo que la luz estimula la secreción de cortisol, dopamina y serotonina, pero a su vez suprime la secreción de melatonina, acetilcolina y NA. En condiciones normales, la melatonina en suero es casi indetectable durante eldía65.
La melatonina, además de regular los ritmos circadianos, también tiene función antioxidante gracias a su efecto neutralizador de radicales libres, estimulación de enzimas antioxidantes e inhibición de enzimas prooxidantes67,68. Otra función es la que ejerce en el sistema inmunitario, pues aumenta la proliferación de linfocitos T (LT) CD4 y CD8 y citocinas proinflamatorias, pero también se le atribuye la estimulación decélulas Th2 y efectos antiproliferativos, lo que indica que puede regular el sistema inmunitario al alza o a la baja dependiendo del estado celular y la dosis69,70.
En pacientes con AR, se ha evidenciado una secreción de melatonina incrementada alrededor de la medianoche y la madrugada; combinada con la disfunción del eje HHA, se traduce en menor secreción de cortisol y, por ende, menor capacidad antiinflamatoria para contrarrestar las acciones proinflamatorias de las concentraciones de melatonina incrementadas71,72. Incluso se ha demostrado que los LT son capaces de sintetizar esta hormona73, lo cual podría indicar, en el contexto de la AR, que la autorreactividad que presentan estas células puede llevar a mayor producción de melatonina y contribuir a la patogenia.
La respuesta inmunitaria varía en el transcurso del día, y alcanza su pico de producción en la noche y la madrugada debido a genes del reloj circadiano (BMAL, CRY, DEC2) presentes en la mayoría de las células inmunitarias que, modulados por la melatonina, promueven la liberación de citocinas (interferón gamma, IL-1 e IL-6), actividad fagocítica, migración celular, proliferación y citolisis. La actividad proinflamatoria sinovial en estos pacientes se asocia con manifestaciones clínicas matutinas de la AR. Esta hiperactivación nocturna del SI produce un desequilibrio energético, lo que explica el menor aporte calórico a otros sistemas como el muscular y el cardiovascular e induce otras alteraciones como dislipemia, insulinorresistencia, hipertensión, osteopenia o anemia secundaria a la inflamación crónica66,74.
Entre los efectos de la melatonina en la AR, los adversos son los más conocidos (ya expuestos); sin embargo, es importante considerar los efectos neutros e incluso benéficos de la melatonina reportados recientemente, como la apoptosis de fibroblastos sinoviales y la acción antioxidante por aumento del glutatión y las enzimas antioxidantes69.
En modelos animales de AR, la melatonina reduce la expresión de TNFα e IL-1β por medio de la regulación positiva de la vía de señalización miR-3150a-3p e inhibición de vías NF-κB, ERK y PI3K/AKT en líquido sinovial. Estos posibles efectos benéficos podrían tenerse en cuenta para nuevos objetivos terapéuticos en las artritis inflamatorias75,76.
La intensidad y la duración de la exposición solar también se han relacionado con aumento de la incidencia de enfermedades autoinmunitarias y reumáticas en ciertas zonas geográficas, que es mayor en el norte (Dinamarca, Suecia, Finlandia) que en el sur (Grecia, Italia) del hemisferio norte. Esta relación se explica porque hay periodos de mayor oscuridad en invierno y menor exposición solar en verano del hemisferio norte, fenómeno estacional que se relaciona con menor síntesis de vitamina D, importante en la supresión de la respuesta inmunitaria adaptativa68.
También se han involucrado hormonas sexuales con los ritmos circadianos y los síntomas de pacientes con AR, y se ha observado más dolor y alteraciones en el sueño en la faselútea del ciclo, en la cual hay mayor concentración de estrógenos y progestágenos66. Mientras, la testosterona se ha implicado como un factor protector contra la AR, lo que podría explicar que esta enfermedad sea menos frecuente en los varones68.
Gracias al conocimiento de los mecanismos fisiopatológicos que involucran los ritmos circadianos y la PNIE con la AR, se han propuesto medidas terapéuticas que permitan una administración más fisiológica de los glucocorticoides, dado que no solo se trata de la dosis, sino también del momento de administrarlos, razón por la cual la cronoterapia con suministro nocturno de prednisona de liberación modificada ha mostrado mayor eficacia a menor dosis (< 5mg/día) sin aumentar los efectos adversos a largo plazo77.
AR y microbiotaEn los últimos años se ha considerado la participación de la microbiota en los procesos proinflamatorios, al tener asociación con el sistema inmunitario y la enfermedad del huésped78,79.
La mayoría de las células inmunitarias residen en sitios muy colonizados por microorganismos, como el tracto gastrointestinal80, donde se encuentra el tejido linfoide asociado al intestino, que representa alrededor del 70% del sistema inmunitario de los humanos81.
La microbiota intestinal humana es un ecosistema complejo, compuesto por más de 1.000 diferentes tipos de especies de bacterias, hongos, virus y arqueas82. Su composición depende en gran medida del tipo de parto (vaginal o cesárea), genética, edad, alimentación, actividad física, toma de antibióticos e infecciones, entre otros. Además, cuenta con la capacidad de sintetizar o imitar moléculas neuroactivas (como acetilcolina, catecolaminas, histaminas) que llegan al SNC ya sea por torrente sanguíneo o por estimulación del nervio vago, actuando sobre la actividad neuronal y de células gliales83.
Otra característica de la microbiota es que interviene activamente en la modulación de la respuesta inmunitaria innata y adquirida del huésped82, por lo que al alterarse puede afectar a la inmunidad no solo local, sino también sistémica, y promover fenómenos inflamatorios y autoinmunitarios79.
Diversos estudios han propuesto la relación entre el microbioma, especialmente intestinal y oral, y la AR, indicando la posible intervención en su patogénesis. Se ha propuesto a la mucosa oral como sitio primario para la citrulinación de proteínas debido a la disbiosis en el microbioma en la AR78. Asimismo se ha demostrado que anticuerpos tipo IgA contra proteínas citrulinadas son detectables antes de que se establezca clínicamente la artritis84. En general se ha reportado menor diversidad en la microbiota intestinal de pacientes con esta enfermedad85 (tabla 1).
Hallazgos de la microbiota en la artritis reumatoide
| Microorganismo | Hallazgos |
| Porphyromonas gingivalis | Se encuentra en mayor cantidad en pacientes con AR90Participa en la citrulinación de proteínas del hospedador, propicia la producción de anticuerpos específicos y media la inflamación sinovial91 |
| Prevotella copri | Mayor población en el microbioma intestinal de pacientes con AR de inicio reciente92 |
| Bacteroides fragilis | Disminuido en pacientes con AR. Participa regulando la función de los linfocitos Treg93 |
| Escherichia coli | La proteína de choque térmico DnaJ de E. coli contiene un motivo QKRAA, el cual también se encuentra en epítopos compartidos en el HLA-DRB190. La proteína DnaJ activa intensamente las células T sinoviales de los pacientes con AR94 |
Hay evidencia de disminución de las citocinas proinflamatorias y la inflamación articular mediante probióticos79. Por ejemplo, la administración de Lactobacillus helveticus HY7801ha logrado estimular la liberación de citocinas antiinflamatorias como IL-10, que contribuyen a disminuir la gravedad y la progresión de la enfermedad86. Sin embargo, son necesarios más estudios con el fin de esclarecer la relación entre microbiota y AR para generar nuevos enfoques terapéuticos.
ConclusionesA lo largo de la historia, el ser humano ha tratado de dar solución a los problemas de salud que lo aquejan, para lo cual ha creado abordajes terapéuticos y farmacológicos efectivos pero que no resuelven en definitiva los procesos de enfermedad. Esto conduce a retomar el concepto de la salud como un estado complejo que se sostiene en un equilibrio entre factores biopsicosociales y rescatar la interacción entre mente, cuerpo y medio ambiente en los procesos patológicos87,88.
El estrés es importante en el inicio y el curso de enfermedades reumáticas autoinmunitarias89 (fig. 2). El tratamiento de estas afecciones es principalmente con fármacos en combinación con fisioterapia. Si se toma en cuenta el papel del estrés como factor de provocación y modulación, además de la influencia de los ciclos circadianos y la microbiota, considerar medios que involucren un tratamiento integral podría ser de beneficio para los pacientes y lograr incluso una reducción de los medicamentos que toman. Aparte de los tratamientos farmacológicos dirigidos a reducir la actividad de la enfermedad con el propósito de normalizar los ejes de respuesta al estrés, se hace necesario implementar programas de entrenamiento para tratar el estrés psicológico y social y obtener un impacto favorable en la actividad de la enfermedad, síntomas como el dolor y otras comorbilidades como la depresión.
Respuesta al estrés, ciclo circadiano y microbiota en la artritis reumatoide. En situación de estrés en la artritis reumatoide, la habitual influencia antiinflamatoria del eje HHA y el SNS ya no es funcional debido a la disminución en la secreción de cortisol, la pérdida de fibras nerviosas simpáticas, los defectos en los receptores betaadrenérgicos y el aumento relativo de fibras nerviosas sensoriales. La melatonina podría regular al alza o a la baja el sistema inmunitario dependiendo del estado celular y la concentración; a concentraciones> 30μg/kg, los efectos se tornan proinflamatorios. Además, la respuesta inmunitaria varía en el transcurso del día y alcanza su pico de producción en la noche y la madrugada. En pacientes con AR se ha descrito importante disbiosis y aumento de la citrulinación de proteínas.
Ninguno.
A Marta Elena Cifuentes Arango, diseñadora industrial y diseñadora gráfica, por la elaboración de las imágenes utilizadas en la figura 1.