Establecer la validez y confiabilidad del Montreal Evaluación Cognitiva en Español (MoCA-E) para identificar deterioro cognitivo leve (DCL) y demencia en adultos mayores mexicanos.
Material y métodosSe incluyó a 168 participantes en una clínica de memoria de la ciudad de México, en 3 grupos: 59 cognitivamente sanos (GCS), 52 con DCL (criterios del DSM-V) y 57 con demencia (criterios NINCDS-ADRDA). Se aplicó el MoCA-E y el Mini-Mental State Evaluation al inicio y en los últimos meses, para establecer la confiabilidad intraobservador. Se construyeron curvas ROC y un modelo de regresión multinomial para evaluar el efecto de la edad y la escolaridad en el desempeño del MOCA-E.
ResultadosEl promedio de edad de los participantes era 76±8,1 años; la tasa de escolaridad, 10,7±5,2. Las puntuaciones de MoCA-E por grupo fueron: GCS, 27,3±1,9; DCL, 22,9±2,9, y demencia, 13,7±4,9 (p < 0,001). La confiabilidad del MoCA-E fue 0,89 con un coeficiente de correlación intraclase de 0,955. La sensibilidad fue del 80% y la especificidad, del 75% con el punto de corte de 26 puntos para DCL (área bajo la curva=0,886; p <0,001). Para demencia, la sensibilidad fue del 98% y la especificidad, del 93% con el punto de corte de 24puntos (área bajo la curva=0,998; p<0,001). La regresión multinomial no mostró asociación con la escolaridad y la edad tanto para DCL como para demencia.
ConclusionesEl MoCA-E es un instrumento con validez y confiabilidad para el cribado de DCL y demencia en la población mexicana, aun después de ajustar por edad y escolaridad.
To establish the validity and reliability of the Montreal Cognitive Assessment in Spanish (MoCA-S) to identify mild cognitive impairment (MCI) and dementia in the Mexican elderly population.
Material and methods168 participants from a memory clinic in Mexico City were enrolled and divided into 3 groups: 59 cognitively healthy (CHG), 52 with mild cognitive impairment (MCI) (DSM-5 criteria) and 57 with dementia (NINCDS-ADRDA criteria). The MoCA-S and Mini-Mental State Evaluation (MMSE) were applied at baseline and during the last months to establish intra-observer reliability. ROC curves and a multinomial regression model were constructed to evaluate the effect of age and education on MoCA-S performance.
ResultsThe mean age of the participants was 76±8.1 years and the education rate was 10.7±5.2. The MoCA-S scores by group were: CHG, 27.3±1.9; MCI, 22.9±2.9; and dementia, 13.7±4.9 (p<0.001). The reliability of the MoCA-S was 0.89 and the intraclass correlation coefficient was 0.955. Sensitivity was 80% and specificity was 75%, with a cut-off point of 26 points for MCI (area under the curve, 0.886; p<0.001). For the dementia group, the sensitivity was 98% and specificity was 93%, with a cut-off point of 24points (area under the curve, 0.998; p<0.001). The multinomial regression showed no association with education and age for both the MCI and dementia groups.
ConclusionsThe MoCA-S is a valid and reliable instrument for MCI and dementia screening in the Mexican population, even after adjusting for age and education.
El deterioro cognitivo es importante causa de morbimortalidad asociada con el envejecimiento poblacional en todo el mundo, incluidos los países en desarrollo como México1, donde la incidencia de demencia en mayores de 65 años es de 30,4/1.000 personas-año. Incluso se estima que en México el 8% de las personas mayores de 65 años podrían cursar con algún tipo de deterioro cognitivo2,3. Por otro lado, el concepto de deterioro cognitivo leve (DCL) surge de la necesidad de identificar a las personas que presentan un déficit de memoria o de otra capacidad cognitiva, pero que no es lo suficientemente grave para sustentar el diagnóstico de demencia4,5. La presencia de DCL se ha asociado con un mayor riesgo de demencia, principalmente la forma amnésica, que es la que más a menudo progresa a enfermedad de Alzheimer6,7. La evaluación neuropsicológica es fundamental para el diagnóstico del DCL. Sin embargo, muchas de las pruebas de cribado disponibles no discriminan esta forma de afección cognitiva, por lo que es importante y necesario tener pruebas que faciliten la identificación de personas con problemas de memoria en etapas subclínicas8.
El Montreal Cognitive Assessment (MoCA) es una breve prueba de cribado para evaluar la función cognitiva y explora 6 dominios: memoria (5 puntos), capacidad visuoespacial (4 puntos), función ejecutiva (4 puntos), atención/concentración/memoria de trabajo (5 puntos), lenguaje (5 puntos) y orientación (6 puntos). La puntuación tiene una gama de 0 a 30 puntos, y la puntuación más alta refleja una mejor función cognitiva. El tiempo de administración es de aproximadamente 10 min y se suma un 1 punto a los sujetos con escolaridad ≤ 12 años. Su sensibilidad y su especificidad para la detección de pacientes con enfermedad de Alzheimer son del 100 y el 87% respectivamente, mientras que para el diagnóstico de DCL son del 90 y el 87%9,10. Asimismo se ha demostrado que para el cribado de la función cognitiva en general tiene mejor desempeño que otras pruebas más comunes, como el Mini-Mental State Examination (MMSE)11. Se ha traducido a múltiples idiomas, y la versión en español (MoCA-E), ya ha sido validada en Colombia y España12-14. En nuestro conocimiento, no existe aún la validación del MoCA-E en población mexicana, por lo que el objetivo de nuestro estudio es establecer la validez y la confiabilidad del MoCA-E para el cribado de DCL y demencia en adultos mayores mexicanos.
Material y métodosEstudio transversal, de validación, que incluyó a 168 sujetos mayores de 60 años. Todos los participantes firmaron un consentimiento informado y se sometieron a una evaluación clínica y cognitiva en la clínica de memoria de un hospital de tercer nivel de atención en la Ciudad de México, en un periodo comprendido entre marzo y diciembre de 2015. La muestra calculada se estimó con el objetivo del estudio crítico del desempeño diagnóstico y de validación mediante la comparación del MoCA y el MMSE con una correlación moderada, un error α = 5% y un poder del 80%; se hacían necesarios al menos 51 pacientes por grupo para probar el desempeño diagnóstico y al menos 23 por grupo para la hipótesis de validación (grupos de cognitivamente sanos [GCS], de DCL y de demencia).
Evaluaron a los pacientes especialistas en geriatría y/o neurología, con base en los criterios propuestos por el National Institute of Neurological and Communicative Disorders and Stroke and the Alzheimer's Disease and Related Disorders Association (NINCDS/ADRDA)15; la Escala de Ponderación de la Demencia (CDR)16 clasificó a los sujetos con demencia; consiste en las categorías 0 (cognitivamente sano), 0,5 (DCL), y ≥ 1 (demencia). Por otro lado, se utilizaron los criterios del DSM-517 de trastorno neurocognitivo menor o DCL, que incluyen:
- 1.
Evidencia de deterioro cognitivo comparado con el nivel previo de rendimiento en uno o más dominios cognitivos: a) preocupación del propio individuo o de un informante o el médico que lo reconoce que ha habido un declive significativo en una función cognitiva; b) un discreto deterioro del rendimiento cognitivo, preferentemente documentado por un test neuropsicológico estandarizado o, en su defecto, por una evaluación clínica cuantitativa.
- 2.
Los déficit cognitivos no interfieren en la capacidad de independencia en las actividades cotidianas (p. ej., mantiene las actividades instrumentadas pero requiere mayor esfuerzo o necesita recurrir a estrategias de compensación o de adaptación).
- 3.
Los déficit cognitivos no ocurren exclusivamente en el contexto de un síndrome confusional.
d. Los déficit cognitivos no se explican mejor por otro trastorno mental.
En este estudio, para establecer la independencia funcional se consideró una puntuación <2,58 en la escala de actividades de la vida diaria de Bayer (B-ADL)18. Para completar la evaluación neuropsicológica, se utilizó el NEUROPSI19 (prueba neuropsicológica mexicana estandarizada por edad y escolaridad); se consideró que los sujetos que calificaron con una puntuación >1,5 desviaciones estándares cumplían criterio de DCL.
De la evaluación geriátrica integral, se obtuvieron variables sociodemográficas como sexo, edad, escolaridad e índice de Katz20 y Lawton21.
Se excluyó a los pacientes con enfermedades neurológicas graves o descontroladas, tóxicas, metabólicas, infecciosas o vasculares, trastornos psiquiátricos no controlados como depresión y/o esquizofrenia, enfermedades cardiacas, hepáticas, renales, cáncer u otro tipo de enfermedad sistémica descontrolada.
Análisis estadísticoLa validez de contenido del instrumento quedó ya establecida por los autores originales en 20059. Para este propósito, se utilizó el coeficiente de correlación de Spearman para determinar la validez de constructo (convergencia) al enfrentar el MoCA-E con el MMSE (estandarizado por escolaridad y edad)22. El análisis de varianza (ANOVA) se utilizó para evaluar las diferencias sociodemográficas, así como para establecer la validez de criterio al probar el rendimiento del MoCA-E frente al estándar de referencia (evaluación clínica) entre los 3 grupos.
La confiabilidad se analizó mediante prueba-reprueba a partir de estimar el coeficiente de correlacion intraclase, en un intervalo de 3 meses; 23 sujetos del GCS, 23 con DCL y 23 con demencia fueron revaluados por 2 observadores diferentes que desconocían el diagnóstico clínico (APG, SGAN).
Para determinar el índice de consistencia interna, se aplicó el coeficiente de Cronbach23, el cual se consideró como muy bueno si > 0,80; bueno de 0,70-0,80; moderado de 0,45-0,60, y malo si < 0,45. Para determinar la concordancia, se comparó el resultado obtenido en cada uno de los instrumentos con el diagnóstico clínico a través del índice kappa, y se consideró aceptable el grado de concordancia ≥ 0,4524,25.
Se construyeron curvas ROC (receiver operating characteristics) y se calculó el área bajo la curva para estimar la sensibilidad, la especificidad, el valor predictivo positivo (VPP) y el valor predictivo negativo (VPN) (intervalos de confianza del 95% [IC95%])26.
Finalmente se construyó un modelo de regresión multinomial para determinar la asociación de la edad y la escolaridad con el desempeño del MOCA-E tanto en el grupo DCL como en el de demencia.
Para el análisis estadístico se utilizó el paquete SPSS versión 20.0 para Windows (SPSS Inc.; Chicago, Illinois, Estados Unidos). El protocolo fue aprobado por el Comité de Ética Institucional (REF. 1158).
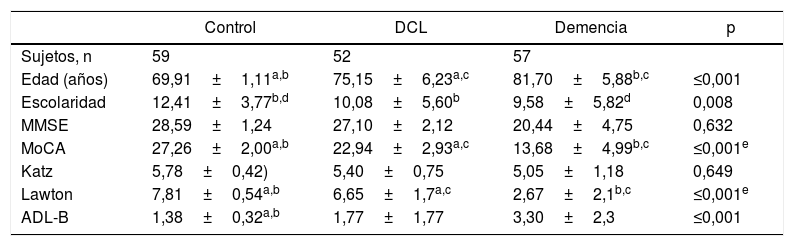
ResultadosLa media de edad era 70,0±1,1 años en el GCS, 75,0±6,2 en el de DCL y 82,0±5,8 en el de demencia (p < 0,001). El 80,4% eran mujeres y la media de escolaridad en el GCS era de 12,4±3,7 años; en el de DCL, 10,0±5,6, y en el de demencia, 9,5±5,8 (p = 0,008).
La tabla 1 muestra el análisis comparativo de las características sociodemográficas y el rendimiento psicométrico entre los participantes. La media del total de puntuación del MoCA-E fue 27,2±1,8 en el GCS, 22,9±2,9 en el de DCL y 13,6±4,9 en el de demencia (p < 0,001).
Características clínicas y cognitivas de los grupos
| Control | DCL | Demencia | p | |
|---|---|---|---|---|
| Sujetos, n | 59 | 52 | 57 | |
| Edad (años) | 69,91±1,11a,b | 75,15±6,23a,c | 81,70±5,88b,c | ≤0,001 |
| Escolaridad | 12,41±3,77b,d | 10,08±5,60b | 9,58±5,82d | 0,008 |
| MMSE | 28,59±1,24 | 27,10±2,12 | 20,44±4,75 | 0,632 |
| MoCA | 27,26±2,00a,b | 22,94±2,93a,c | 13,68±4,99b,c | ≤0,001e |
| Katz | 5,78±0,42) | 5,40±0,75 | 5,05±1,18 | 0,649 |
| Lawton | 7,81±0,54a,b | 6,65±1,7a,c | 2,67±2,1b,c | ≤0,001e |
| ADL-B | 1,38±0,32a,b | 1,77±1,77 | 3,30±2,3 | ≤0,001 |
DCL: deterioro cognitivo leve; MMSE: Mini-Mental State Examination; MoCA:Montreal Cognitive Assessment.
Los datos se presentan como media±desviación estándar. El análisis muestra las diferencias entre grupos empleando la prueba ANOVA, post-oc DSM.
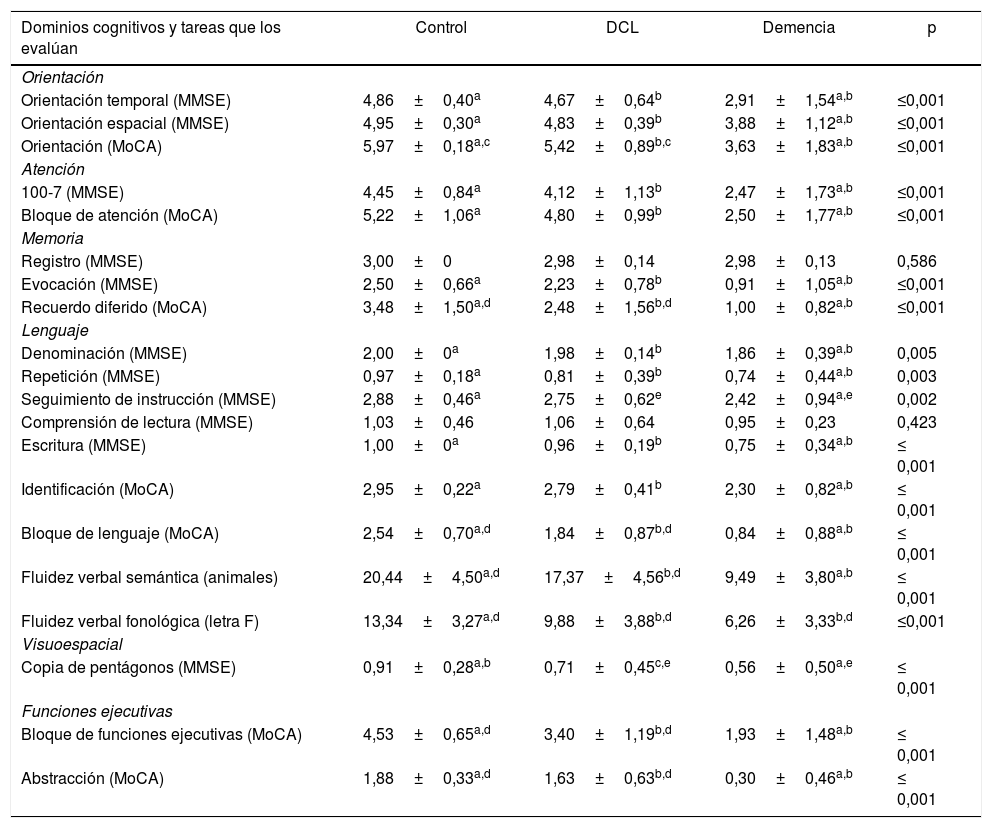
La tabla 2 muestra las características del desempeño por dominios cognitivos entre el MOCA-E y MMSE, y se observan diferencias estadísticamente significativas entre ambos grupos.
Desempeño en las pruebas cognitivas de los grupos de control, con deterioro cognitivo leve y demencia
| Dominios cognitivos y tareas que los evalúan | Control | DCL | Demencia | p |
|---|---|---|---|---|
| Orientación | ||||
| Orientación temporal (MMSE) | 4,86±0,40a | 4,67±0,64b | 2,91±1,54a,b | ≤0,001 |
| Orientación espacial (MMSE) | 4,95±0,30a | 4,83±0,39b | 3,88±1,12a,b | ≤0,001 |
| Orientación (MoCA) | 5,97±0,18a,c | 5,42±0,89b,c | 3,63±1,83a,b | ≤0,001 |
| Atención | ||||
| 100-7 (MMSE) | 4,45±0,84a | 4,12±1,13b | 2,47±1,73a,b | ≤0,001 |
| Bloque de atención (MoCA) | 5,22±1,06a | 4,80±0,99b | 2,50±1,77a,b | ≤0,001 |
| Memoria | ||||
| Registro (MMSE) | 3,00±0 | 2,98±0,14 | 2,98±0,13 | 0,586 |
| Evocación (MMSE) | 2,50±0,66a | 2,23±0,78b | 0,91±1,05a,b | ≤0,001 |
| Recuerdo diferido (MoCA) | 3,48±1,50a,d | 2,48±1,56b,d | 1,00±0,82a,b | ≤0,001 |
| Lenguaje | ||||
| Denominación (MMSE) | 2,00±0a | 1,98±0,14b | 1,86±0,39a,b | 0,005 |
| Repetición (MMSE) | 0,97±0,18a | 0,81±0,39b | 0,74±0,44a,b | 0,003 |
| Seguimiento de instrucción (MMSE) | 2,88±0,46a | 2,75±0,62e | 2,42±0,94a,e | 0,002 |
| Comprensión de lectura (MMSE) | 1,03±0,46 | 1,06±0,64 | 0,95±0,23 | 0,423 |
| Escritura (MMSE) | 1,00±0a | 0,96±0,19b | 0,75±0,34a,b | ≤ 0,001 |
| Identificación (MoCA) | 2,95±0,22a | 2,79±0,41b | 2,30±0,82a,b | ≤ 0,001 |
| Bloque de lenguaje (MoCA) | 2,54±0,70a,d | 1,84±0,87b,d | 0,84±0,88a,b | ≤ 0,001 |
| Fluidez verbal semántica (animales) | 20,44±4,50a,d | 17,37±4,56b,d | 9,49±3,80a,b | ≤ 0,001 |
| Fluidez verbal fonológica (letra F) | 13,34±3,27a,d | 9,88±3,88b,d | 6,26±3,33b,d | ≤0,001 |
| Visuoespacial | ||||
| Copia de pentágonos (MMSE) | 0,91±0,28a,b | 0,71±0,45c,e | 0,56±0,50a,e | ≤ 0,001 |
| Funciones ejecutivas | ||||
| Bloque de funciones ejecutivas (MoCA) | 4,53±0,65a,d | 3,40±1,19b,d | 1,93±1,48a,b | ≤ 0,001 |
| Abstracción (MoCA) | 1,88±0,33a,d | 1,63±0,63b,d | 0,30±0,46a,b | ≤ 0,001 |
DCL: deterioro cognitivo leve; MMSE: Mini-Mental State Examination; MoCA:Montreal Cognitive Assessment.
Los datos se presentan como media±desviación estándar. El análisis muestra las diferencias entre grupos empleando la prueba ANOVA, post-hoc DSM.
fp ≤ 0,05 entre control y demencia.
La validez de constructo al comparar el MoCA-E y el MMSE (utilizando la prueba de correlación de Spearman) fue de ρ=0,830 (p<0,001).
ConfiabilidadLa consistencia interna del MoCA-E estimada a través del índice alfa de Cronbach fue de α=0,891. El coeficiente de correlación intraclase fue de 0,955 (IC95%, 0,918-0,975; p<0,001).
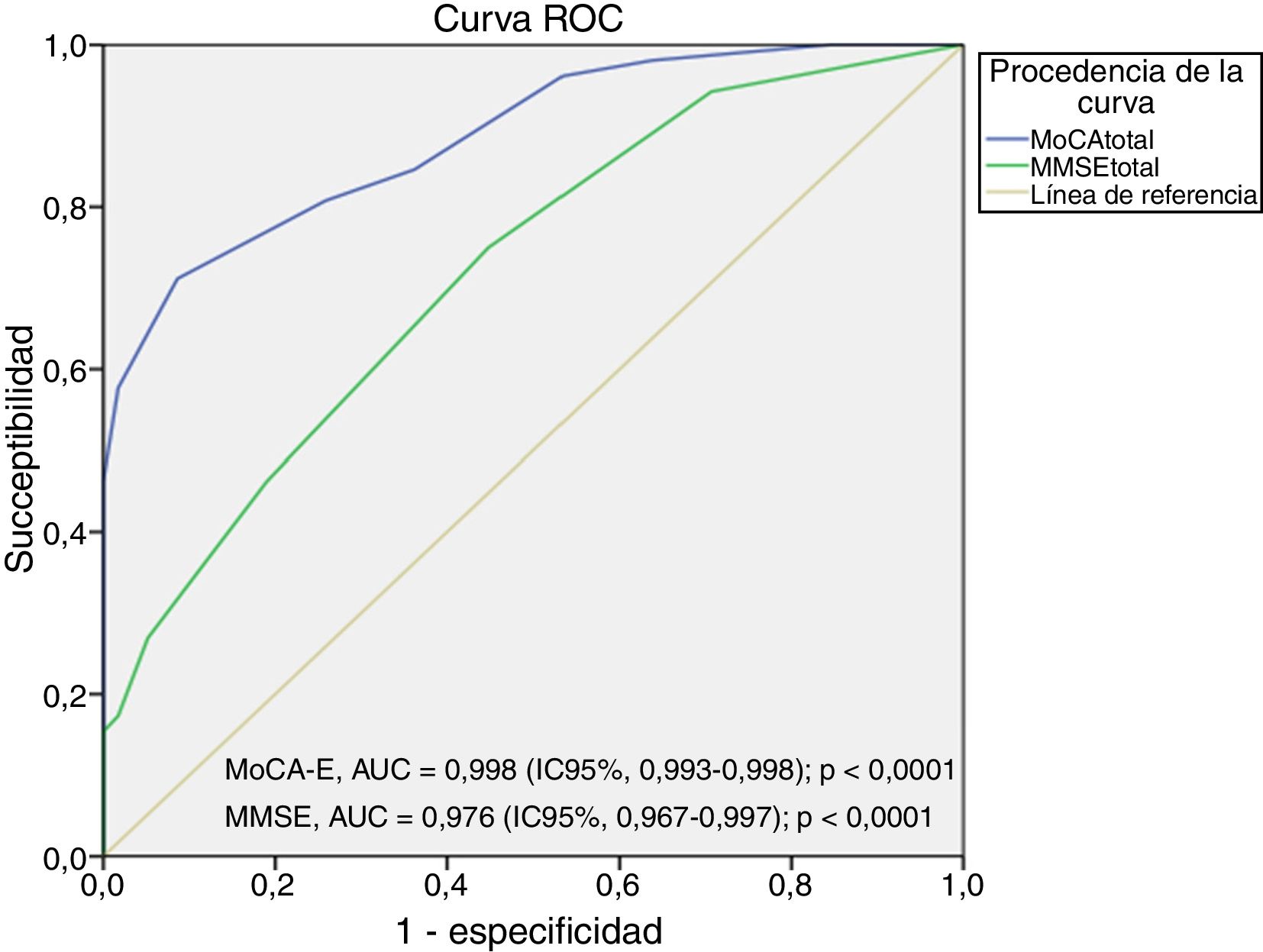
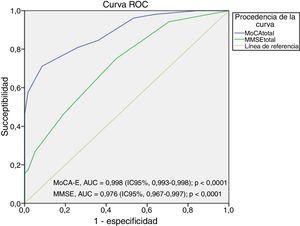
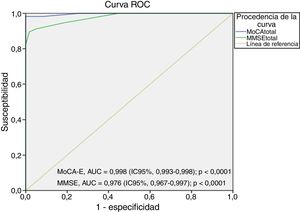
[1] Sensibilidad, especificidad y área bajo la curva ROC
El área bajo la curva del MoCA-E fue de 0,886 (IC95%, 0,826-0,947), con un valor de corte ≤26 puntos, con una sensibilidad del 80%, especificidad del 75%, VPP del 90% y VPN del 82%, mientras que el MMSE mostró un área bajo de la curva de 0,721 (IC95%, 0,627-0,818) con sensibilidad del 75% y especificidad del 60% para el diagnóstico de DCL (figura 1).
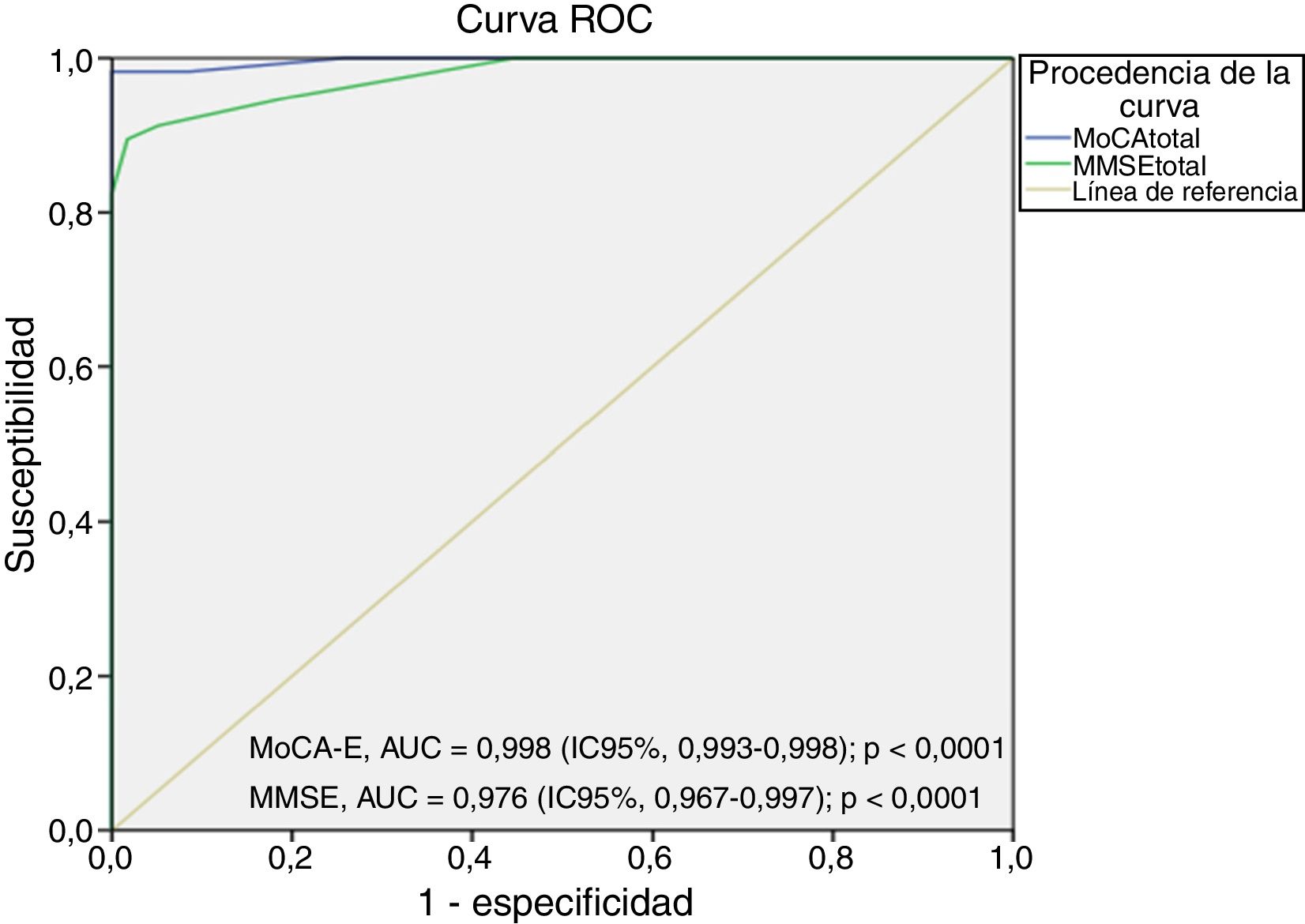
La figura 2 muestra el área bajo la curva del MOCA-E frente al estándar de referencia en el grupo con demencia, la cual fue de 0,997 (IC95%, 0,990-1) con sensibilidad del 98% y especificidad del 93%, con un valor de corte de 24 puntos. Respecto al MMSE, el área bajo la curva fue de 0,998 (IC95%, 0,993-1), con sensibilidad del 88% y especificidad del 100%.
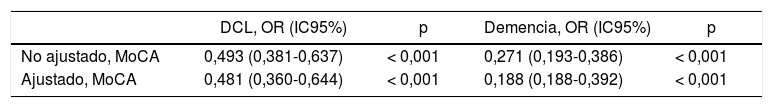
La tabla 3 muestra la asociación inversa entre la puntuación del MoCA-E en el grupo DCL (odds ratio [OR]=0,481; IC95%, 0,360-0,644; p<0,001) y el grupo de demencia (OR=0,265; IC95%, 0,188-0,392; p<0,001) después del ajuste por edad y escolaridad.
Modelo de regresión multinomial entre los 3 grupos que muestra la probalidad inversa de calificar entre GCS, DCL y demencia después de ajustar por edad y escolaridad
| DCL, OR (IC95%) | p | Demencia, OR (IC95%) | p | |
|---|---|---|---|---|
| No ajustado, MoCA | 0,493 (0,381-0,637) | < 0,001 | 0,271 (0,193-0,386) | < 0,001 |
| Ajustado, MoCA | 0,481 (0,360-0,644) | < 0,001 | 0,188 (0,188-0,392) | < 0,001 |
DCL: deterioro cognitivo leve; GCS: grupo cognitivamente sano (categoría de referencia).
El tiempo promedio de aplicación de la prueba fue 10 min.
DiscusiónEste estudio demuestra nuevamente que el MoCA en su versión 7.0 (traducida al español) es una prueba válida y confiable para la detección de demencia en una población de adultos mayores mexicanos. El instrumento mostró además adecuada confiabilidad intraobservador (0,95) y adecuada consistencia interna (0,89). Con un punto de corte ≤ 24, mostró sensibilidad del 98% y especificidad del 93% para el diagnóstico de demencia. Esto es compatible con lo previamente publicado10,27; sin embargo, consideramos que lo más sobresaliente de este estudio es mostrar la capacidad del MoCA-E para detectar DCL en mexicanos; la sensibilidad fue del 80% y la especificidad, del 75% con un punto de corte ≤26 puntos, lo que es superior al MMSE, como ya habían reportado previamente Costas et al.28 y Julayanont et al.29.
Gil et al. han estudiado el desempeño de la prueba en su traducción al español, y reportan sensibilidad del 89% y especificidad del 80% para detectar deterioro cognitivo leve, con un VPP del 85% y VPN del 85%, estableciendo como valor de corte ≥23 (la calificación ≤22 se consideró resultado anormal)13.
Por otra parte, algo que ha preocupado en el diseño del instrumento es el ajuste por escolaridad. Asumiendo que esta podría influir directamente en el desempeño de la prueba, Gómez et al. estudiaron la influencia de la escolaridad del MoCA-E en una muestra de sujetos colombianos con demencia y baja escolaridad (promedio, 4,8 años). Las puntuaciones promedio del MoCA-E fueron 16,1/30 puntos entre los sujetos analfabetos, 18,2/30 entre los que tenían primaria incompleta, y 20,3/30 entre los que tenían primaria completa (p<0,001). Los errores más frecuentes fueron: el cubo y el dibujo de reloj, la resta, la atención en serie, la fluidez verbal y la abstracción. La confiabilidad test-retest fue alta (CCI=0,86; IC95%, 0,76-0,93), y se concluyó que el punto de corte debería modificarse según la escolaridad12. Esto generó algunas contradicciones sobre la necesidad de ajuste por escolaridad y su pertinente adaptación cultural. Sin embargo, recientemente Parunyou et al. demostraron en sujetos asiáticos con baja escolaridad que, manteniendo el punto de corte de 26 puntos para DCL y 24 para demencia, la sensibilidad y la especificidad fueron >80%, y se resalta que el instrumento en sus diversas traducciones no requirió ninguna transformación ni adaptación cultural30.
Como se considera el MoCA un instrumento de cribado, se propone su estandarización también por edad. Específicamente en cuanto a MoCA, diversas publicaciones han considerado la influencia de la edad en el desempeño de la prueba y han mostrado una asociación lineal respecto a peor rendimiento cuanto más edad31-33. En este estudio, se pudo evaluar directamente el efecto de la edad y su correlación con la puntuación total del MoCA-E, y se encontró una correlación entre mayor edad y peor puntuación; sin embargo, fue posible discrimar entre el grupo de DCL y el de demencia.
Por otro lado, el MMSE se ha utilizado tradicionalmente como una prueba de cribado para la detección de cualquier tipo de deterioro cognitivo. El MMSE ha mostrado alta sensibilidad para la identificación de estadios moderados a severos de demencia20, pero esta popular prueba ha resultado poco útil para la identificación de etapas tempranas como el deterioro cognitivo leve. Esto es consecuencia de que se orienta a la evaluación de las funciones de memoria y lenguaje y no considera el funcionamiento ejecutivo, el cual está marcadamente implicado en los cuadros de enfermedad vascular, enfermedad de Parkinson34 y otras demencias de tipo no Alzheimer35. Por lo que se deberá considerar una de las principales virtudes del MoCA como prueba de cribado el que incorpore tareas más complejas pues, como ya se mencionó, incluye dominios no evaluados por el MMSE, como el funcionamiento ejecutivo, la atención y el recuerdo diferido, lo que permite identificar mejor estados preclínicos como, por ejemplo, el DCL36. La sensibilidad y la especificidad del MoCA también se han demostrado en la detección de DCL en pacientes con enfermedad de Parkinson37, deterioro cognitivo vascular38, esclerosis lateral amiotrófica, demencia frontotemporal, demencia asociada a sida, enfermedad de Huntington, demencia por cuerpos de Lewy, atrofia de sistemas múltiples y esclerosis múltiple39,40. Asimismo, de sus versiones en español y otros idiomas (francés, árabe, cantonés, alemán y portugués)41-43 también se ha demostrado que discriminan entre personas con deterioro cognitivo y con cognición normal44. Esto refleja la universalidad del instrumento y la facilidad para adaptarlo culturalmente, en general con mínimas o nulas modificaciones45.
Nuestro estudio tiene como principal limitación su población de pacientes provenientes de un hospital de tercer nivel, con un promedio de escolaridad de 11 años, lo que podría ocasionar un sesgo de selección. Haber utilizado una muestra representativa para evaluar el desempeño diagnóstico y la validación no garantiza la representatividad ni datos normativos en adultos mayores mexicanos; además, haber incluido únicamente a sujetos con demencia tipo Alzheimer y haber utilizado CDR como prueba de gravedad de la demencia. Sin embargo, en nuestro conocimiento, este es el primer estudio de validación del MoCA-E en una población mexicana. No obstante, son necesarios más estudios con mayor número de sujetos que incluyan esta prueba y demuestren que el MoCA-E puede ser fiable y válido en población de habla hispana y se puede aplicar en diferentes niveles de atención y/o en la comunidad con diversos niveles de educación y franjas de edad.
ConclusionesEl MoCA en su versión en español es un instrumento confiable y válido para el cribado del DCL. Este instrumento podría ser un buen recurso para cribar el DCL y discriminar correctamente entre personas con y sin esta afección. Por otro lado, discrimina bien a los pacientes con demencia de los cognitivamente sanos comparado con el MMSE. No obstante, son necesarios más estudios que demuestren que el MoCA-E puede ser fiable y válido en población de habla hispana y se puede utilizar en diferentes escenarios, en grupos con alta pero también baja escolaridad.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesNinguno.