El trastorno por estrés postraumático (TEPT) es una condición que afecta a un subgrupo de individuos que han sufrido un evento traumático con la capacidad de generar cambios psicológicos y conductuales. Estos cambios interfieren el entorno personal, familiar y social de los individuos. Diferentes genes se han identificado como marcadores de riesgo de esta enfermedad; sin embargo, la heterogeneidad poblacional y las diferencias individuales (genéticas y ambientales) han hecho difícil la identificación de marcadores genéticos válidos en los estudios realizados. Por tal motivo, han cobrado gran importancia en las ultimas dos décadas los estudios de relación entre gen y ambiente con la intención de identificar fenotipos propios de la enfermedad. Se han estudiado ampliamente genes como SLC64A, FKBP5 y ADCYAP1R1, entre otros. Poco se conoce de su interacción con las vías y los circuitos moleculares y neuronales que subyacen al TEPT, pero su identificación y asociación con estímulos y ambientes específicos condicionantes de la aparición del TEPT los hacen centro de interés para el estudio de identificación de variables genómicas en TEPT. A su vez, las modificaciones epigenéticas que regulan la expresión de genes vinculados en el eje hipotálamo-pituitario-adrenal y en el circuito amígdala-corteza prefrontal media-hipocampo son de gran interés para la identificación de biomarcadores y endofenotipos en TEPT. En esta revisión se podrá elucidar los avances en genética y epigenética que han acontecido en la comprensión genómica del TEPT.
Post-traumatic stress disorder, or PTSD, is a condition that affects a subgroup of individuals that have suffered a previous traumatic event capable of generating changes at a psychological and behavioural level. These changes affect the personal, family, and social environment of those who suffer from this condition. Different genes have been identified as risk markers for development of this disorder. The population heterogeneity and individual differences (genetic and environmental) of each subject have made it difficult to identify valid markers in previous studies. For this reason, studies of Gene x Environment (G×E) have gathered importance in the last two decades, with the aim of identifying of the phenotypes of a particular disease. These studies have included genes such as SLC64A, FKBP5, and ADCYAP1R1, among others. Little is known about the interaction between the genes, pathways, and the molecular and neural circuitry that underlie PTSD. However their identification and association with stimuli and specific environments that stimulate the development of PTSD makes it focus of interest for identify genomic variations in this disorder. In turn, the epigenetic modifications that regulate the expression of genes involved in the hypothalamic-pituitary-adrenal (HPA) axis and the amygdala- hippocampal-medial prefrontal cortex circuits play a role in the identification of biomarkers and endophenotypes in PTSD. In this review, the advances in genetic and epigenetic that have occurred in the genomic era in PTSD are presented.
Se considera evento traumático el suceso que tenga la capacidad de generar miedo, impotencia o terror ante la inminencia de lesión o muerte1. Aproximandamente 2 tercios de la población pueden sufrir un evento traumático a lo largo de la vida2. El trastorno por estrés postraumático (TEPT) es una condición que afecta a un subgrupo de personas que han sufrido un evento traumático que genera cambios psicológicos y conductuales, con síntomas desadaptativos para la salud mental y física de quien lo padece y limitaciones en el entorno social y familiar3–5. En Estados Unidos la prevalencia del TEPT a lo largo de la vida se estima en un 6,8%6. En Colombia, según la Encuesta de Salud Mental 2015, el 40,2% de los adultos de 18–44 años y el 41,4% de los mayores de 45 han sufrido por lo menos un evento traumático en su vida. La prevalencia para medir el indicador positivo de riesgo de TEPT es del 3,29% de los varones y el 3,84% de las mujeres7.
Poco se conoce acerca de las bases neurobiológicas implicadas en el desarrollo del TEPT. Los sistemas que regulan la respuesta al estrés incluyen componentes endocrinos y vías de neurotransmision en áreas cerebrales como la amígdala, implicadas en la respuesta al miedo y el estrés8. En relación con lo anterior, el eje hipotálamo-pituitario-adrenal (HPA) actúa como el principal organizador de la respuesta endocrina al estrés9–11. Diversos estudios han identificado disfunciones en el eje HPA en la respuesta al estrés12, ansiedad13 y TEPT14. En relación con los neurotransmisores, se han asociado alteraciones en catecolaminas, serotonina, glutamato y GABA, los cuales han sido implicados en los neurocircuitos que regulan la respuesta al miedo y el estrés8, por lo que se ha teorizado sobre ellos y posteriormente se los ha investigado en el desarrollo de TEPT.
A partir del avance en técnicas de secuenciación genómica, se han identificado diferentes genes que confieren riesgo de sufrir la enfermedad15–18. Sin embargo, muchos de los genes involucrados han perdido validez estadística, ya que su asociación ha sido débil en los estudios de secuenciación y en ocasiones no se han identificado en distintas poblaciones de estudio debido a la heterogeneidad poblacional que se presenta en el TEPT (niños maltratados, mujeres víctimas de abuso sexual, varones y mujeres combatientes en la guerra, etc.)19. Esto ha conllevado en las últimas 2 décadas una visión más traslacional para el abordaje genético de la enfermedad. Estudios de variaciones genéticas asociados a una condición ambiental determinada para identificar un fenotipo de interés han cobrado importancia en los estudios genético-poblacionales en enfermedades neuropsiquiátricas20. De igual manera, los estudios de secuenciación del genoma completo (Genome-wide Association Studies [GWAS]) y los de secuenciación exómica han vislumbrado nuevos marcadores genéticos vinculados al riesgo de padecer el TEPT19,21. Uno de los aspectos interesantes de este trastorno como modelo de estudio es que se desarrolla debido a una experiencia traumática previa, lo que ha conducido a grupos de investigación a plantearse preguntas en relación con las variaciones genéticas que confieren riesgo de enfermar, a las que condicionan la gravedad de los síntomas o a los cambios epigenéticos heredables que modifican la expresión de genes vinculados al desarrollo de la enfermedad sin generar cambios en la secuencia de estos genes.
El propósito de este estudio es dar a conocer los avances y nuevas perspectivas en la genética y la epigenética del TEPT. Se realizó una revisión narrativa de la literatura en la base de datos PubMed en mayo de 2016. Se seleccionaron artículos de revisión, estudios observacionales y estudios analíticos relacionados con el propósito de este trabajo. Se incluyeron en la búsqueda los siguientes términos MeSh: (“genetics” OR “gene” OR “epigenetic” OR “genetic advances”) AND (“post-traumatic stress disorder” OR “ptsd”). Se seleccionaron artículos desde el año 2000 hasta la fecha.
Estudios genéticos familiares y en gemelos idénticosEn estudios familiares se ha demostrado la vinculación de variaciones genéticas en familias de pacientes con TEPT. Un estudio realizado por Yehuda et al. demostró que los hijos de padres sobrevivientes al holocausto con TEPT tuvieron mayor riesgo de TEPT que los hijos de padres sobrevivientes al holocausto sin diagnóstico de TEPT (p < 0,0005)22. Sin embargo, estos estudios se enfrentan a la dificultad de que no se pueda diferenciar entre las exposiciones ambientales propias que cada miembro de la familia pueda tener o haber tenido y los riesgos genéticos inherentes a cada una de las familias.
Se han identificado factores genéticos asociados a riesgo de exposición a eventos traumáticos en estudios de gemelos idénticos15,16. Lyon et al. estudiaron una muestra de gemelos varones del registro de Vietnam para examinar factores genéticos y ambientales asociados a la exposición a eventos traumáticos durante el combate. La heredabilidad explicó entre el 35 y el 47% de la varianza en la exposición al evento traumático durante el combate, pero el ambiente familiar no mostró un efecto importante en la variable de interés17,18. Otros estudios, como la estimación de la heredabilidad de los síntomas de TEPT23, la comorbilidad24–29 y la condición física30–32, y estudios de interacción genes-ambiente33 se han realizado en gemelos monocigotos y dicigotos, con resultados positivos a la asociación o vinculación de genes. Sin embargo estos estudios, pese a indicar que hay un riesgo de heredabilidad en el desarrollo del TEPT, no pueden identificar qué gen es el vinculante directo que confiere el riesgo de TEPT debido al componente multifactorial y poligénico de este trastorno y, en general, las enfermedades neuropsiquiátricas.
Correlación multifactorial en el TEPT: estudios de genes×ambienteLa condición multifactorial presente en las enfermedades mentales ha permitido entender, durante la investigación en trastornos neuropsiquiátricos, que un solo gen no puede explicar el trastorno mental y más aún que esta interacción gen-ambiente va más allá de las simples suposiciones epistemológicas34. Por esta razón los estudios de interacción gen×ambiente (G×A) han cobrado gran interés en los últimos años. Los primeros estudios en psiquiatría que evaluaron la interacción de las condiciones genéticas en relación con la exposición a estímulos o ambientes que permitieran identificar diferentes fenotipos de enfermedad se realizaron en niños maltratados con un genotipo que confiere bajas concentraciones de la enzima monoaminooxidasa A (MAOA) en relación con la aparición de trastornos del comportamiento, conducta antisocial y violencia, comparados con niños maltratados que tenían altas concentraciones de esta enzima35.
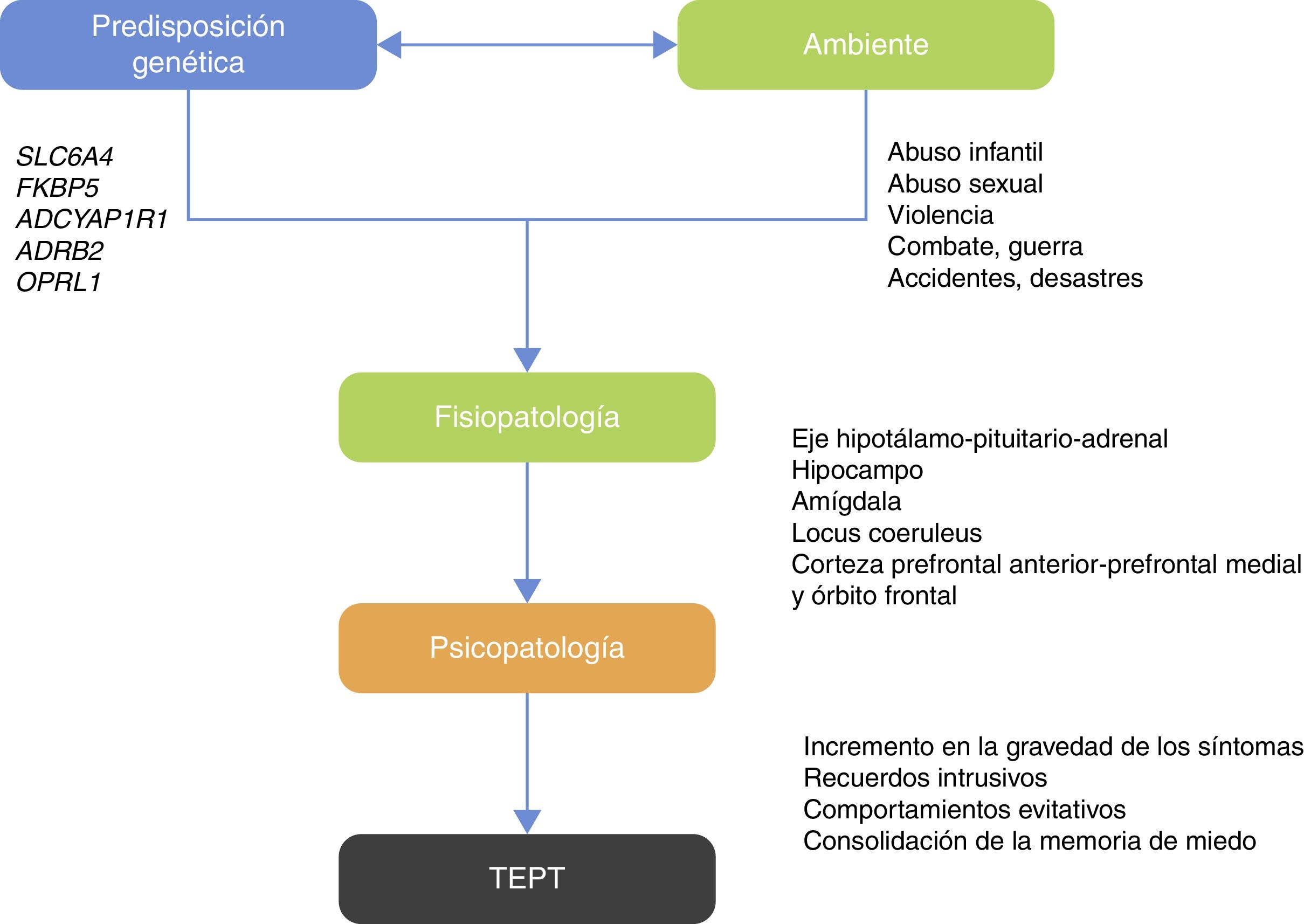
Lo anterior conduce a la pregunta: ¿qué enfermedades psiquiátricas permitirían una mejor aproximación a los estudios G×A? Respecto al TEPT, se puede considerar que esta entidad es un candidato ideal para los estudios G×A, ya que este trastorno requiere como criterio diagnóstico la previa exposición al evento traumático o la exposición a un ambiente hostil que facilite que se produzca el evento traumático20 (fig. 1).
De los estudios G×A, el realizado por Ressler et al. identifica una asociación de riesgo genético positiva entre el polimorfismo de nucleótido único (SNP) rs2267735 en mujeres afroamericanas con antecedentes de traumatismos de la niñez y la adultez, y el riesgo de sufrir TEPT36. Este estudio confiere la asociación de riesgo de TEPT en el receptor pituitary adenylate-cyclase 1 (PAC1), implicado en el desarrollo del sistema nervioso, la homeostasis endocrina, el metabolismo y la respuesta al estrés crónico36,37. Estos hallazgos indican que el sistema pituitary adenylate cyclase-activating polypeptide (PACAP)/PAC1 está involucrado en la respuesta psicológica y fisiológica al estrés debido a trauma.
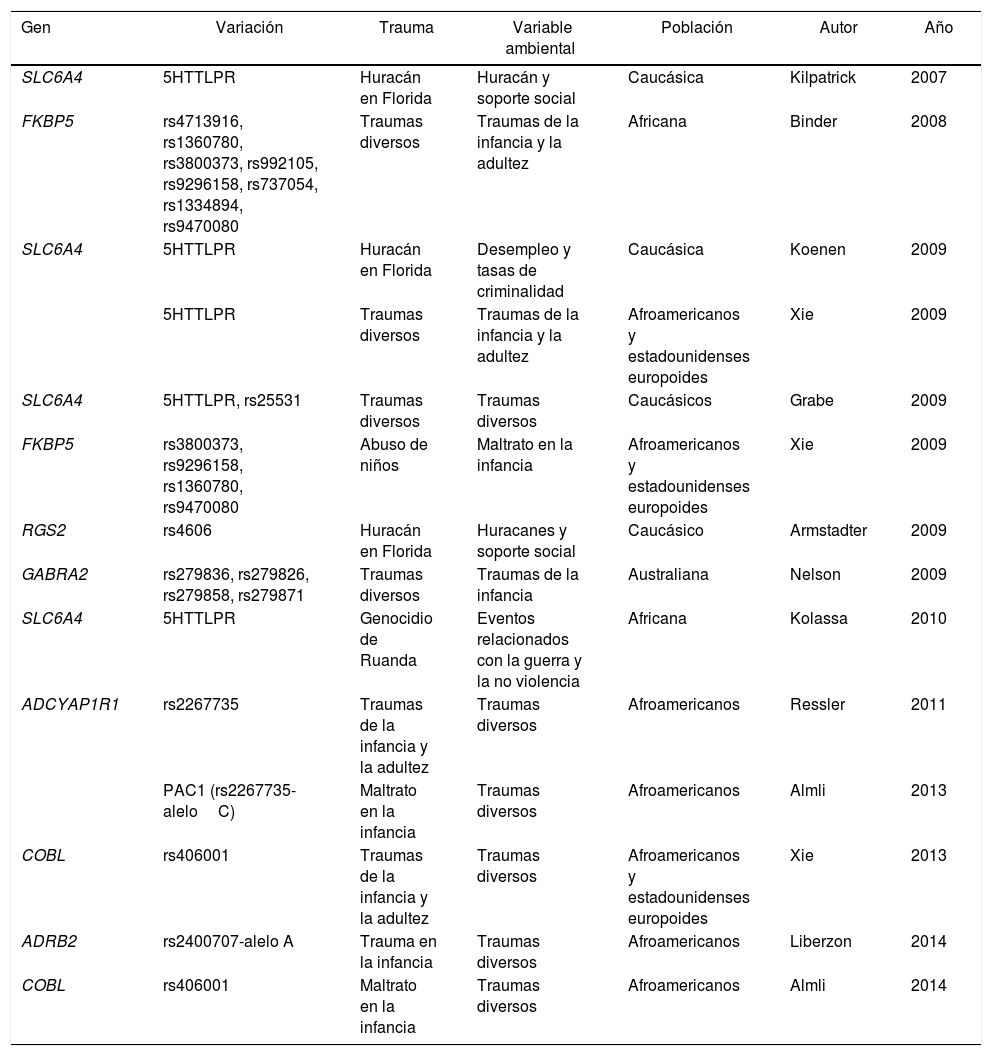
Otro estudio que encuentra asociación positiva entre un gen y el ambiente propicio a los eventos traumáticos es el realizado por Kolassa et al. en pacientes refugiados del genocidio en Ruanda, que analizó a 408 sujetos (218 varones y 190 mujeres) que vivían refugiados en un campo en el suroeste de Uganda. Todos los sujetos habían vivido múltiples situaciones traumáticas. Los resultados de este trabajo reportaron que el gen SLC6A4 que codifica el gen transportador de 5-hidroxitriptamina, implicado en estudios anteriores de depresión y respuesta a medicamentos38, confiere un riesgo de asociación a sufrir TEPT después de eventos traumáticos39. Otros estudios han asociado diferentes genes y polimorfismos vinculados a variables ambientales (tabla 1).
Estudios de interacción entre gen y ambiente en TEPT publicados
| Gen | Variación | Trauma | Variable ambiental | Población | Autor | Año |
|---|---|---|---|---|---|---|
| SLC6A4 | 5HTTLPR | Huracán en Florida | Huracán y soporte social | Caucásica | Kilpatrick | 2007 |
| FKBP5 | rs4713916, rs1360780, rs3800373, rs992105, rs9296158, rs737054, rs1334894, rs9470080 | Traumas diversos | Traumas de la infancia y la adultez | Africana | Binder | 2008 |
| SLC6A4 | 5HTTLPR | Huracán en Florida | Desempleo y tasas de criminalidad | Caucásica | Koenen | 2009 |
| 5HTTLPR | Traumas diversos | Traumas de la infancia y la adultez | Afroamericanos y estadounidenses europoides | Xie | 2009 | |
| SLC6A4 | 5HTTLPR, rs25531 | Traumas diversos | Traumas diversos | Caucásicos | Grabe | 2009 |
| FKBP5 | rs3800373, rs9296158, rs1360780, rs9470080 | Abuso de niños | Maltrato en la infancia | Afroamericanos y estadounidenses europoides | Xie | 2009 |
| RGS2 | rs4606 | Huracán en Florida | Huracanes y soporte social | Caucásico | Armstadter | 2009 |
| GABRA2 | rs279836, rs279826, rs279858, rs279871 | Traumas diversos | Traumas de la infancia | Australiana | Nelson | 2009 |
| SLC6A4 | 5HTTLPR | Genocidio de Ruanda | Eventos relacionados con la guerra y la no violencia | Africana | Kolassa | 2010 |
| ADCYAP1R1 | rs2267735 | Traumas de la infancia y la adultez | Traumas diversos | Afroamericanos | Ressler | 2011 |
| PAC1 (rs2267735-aleloC) | Maltrato en la infancia | Traumas diversos | Afroamericanos | Almli | 2013 | |
| COBL | rs406001 | Traumas de la infancia y la adultez | Traumas diversos | Afroamericanos y estadounidenses europoides | Xie | 2013 |
| ADRB2 | rs2400707-alelo A | Trauma en la infancia | Traumas diversos | Afroamericanos | Liberzon | 2014 |
| COBL | rs406001 | Maltrato en la infancia | Traumas diversos | Afroamericanos | Almli | 2014 |
5HTTLPR: Serotonin-Transporter-Linked Polymorphic Region; ADCYAP1R1: Adenylate Cyclase Activating Polypeptide 1 (Pituitary) Receptor Type I; ADRB2: Adrenoceptor Beta 2, Surface; COBL: Cordon-Bleu WH2 Repeat Protein; FKBP5: FK506 Binding Protein 5; GABRA 2: Gamma-Aminobutyric Acid (GABA) A Receptor, Alpha 2; PAC1: Pituitary Adenylate Cyclase-Activating Polypeptide Type I Receptor; RGS2: Regulator of G-Protein Signaling 2; SLC6A4: Solute Carrier Family 6 (transportador de neurotransmisores) Member 4.
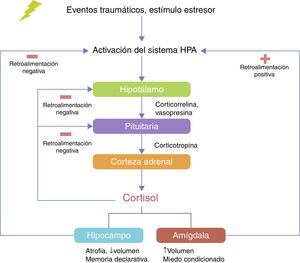
El eje HPA está vinculado a la respuesta neuroendocrina al estrés. El hipotálamo controla la secreción de corticotropina (ACTH) desde la glándula pituitaria anterior y estimula la consecuente secreción de cortisol por la glándula suprarrenal40. En condiciones de estrés agudo, los pulsos de liberación de corticorelina (CRH) y vasopresina (AVP) se incrementan, con lo que aumentan la liberación de ACTH y cortisol y otros factores, como angiotensina II, varias citocinas y mediadores de la inflamación40–42 (fig. 2). La interacción neurobiológica entre genes que actúan con el eje HPA se ha estudiado ampliamente en distintas enfermedades neuropsiquiátricas como la depresión43, el trastorno bipolar44, el abuso de sustancias45, el alcoholismo46 y el TEPT20.
Las proteínas citosólicas inmunofilinas fueron descubiertas por su habilidad de unión y mediación del efecto inmunosupresor de fármacos como la ciclosporina y la rapamicina47. El gen FKBP5 (FK506 Binding Protein 5) codifica una de las inmunofilinas que se une al inmunosupresor FK506 y rapamicina48 y lo ha asociado como gen regulador del eje HPA49. Diversos estudios han identificado el gen FKPB5 en la aparición de TEPT50–52; entre las primeras investigaciones que asociaron este gen, se encuentra la de Koenen et al. en 2005, en la que se incluyeron a 46 niños que ya habían sufrido accidentes automovilísticos, heridas por arma de fuego o arma blanca y otros tipos de trauma. Los polimorfismos rs3800373 y rs1360780 resultaron intensamente asociados al desarrollo de disociación peritraumática en este grupo de pacientes52. En un estudio de 900 sujetos mayoritariamente caucásicos, 4 SNP de FKBP5 interactuaron con la gravedad del abuso sexual de los niños como predictores de síntomas de TEPT en la adultez53.
Un reciente estudio evaluó los polimorfismos de FKBP5 (rs9296158, rs3800373, rs1360780, rs947008) en 2 poblaciones de veteranos excombatientes militares estadounidenses europoides. La primera población, de 1.585 veteranos y la segunda, de 577. Los resultados de este estudio indican que los 4 polimorfismos se asocian con los síntomas de gravedad del TEPT en ambas muestras50. Esta variación genética es un factor de riesgo de posterior TEPT en la adultez, lo que ya se habí vinculado en niños víctimas de abuso sexual53,54. Estos resultados indican que el abuso infantil y la presencia de estos polimorfismos en una población expuesta a un evento traumático en la vida (como las poblaciones de este estudio) confieren riesgo de sufrir síntomas de TEPT graves en la edad adulta.
Además, FKBP5 como cochaperona en la regulación del receptor de glucocorticoides (GCCR/NR3C1) tiene un papel fundamental en la consolidación de memorias intrusivas. Este tipo de memorias son repetitivas y no deseadas y generan una experiencia sensoperceptual involuntaria que generalmente se asocia a recuerdos negativos en los pacientes con TEPT55. Distintos estudios han señalado que el cortisol potencia la consolidación de la memoria emocional56,57. Mediante un estudio de 46 sujetos incluidos para análisis genético, se analizaron los SNP rs3800373, rs9296158, rs1360780 y rs9470080 presentes en FKBP5, y se concluyó que los participantes homocigotos para los alelos de riesgo de los polimorfismos estudiados tienen mayor posibilidad de consolidar memorias de imágenes negativas debido a la modulación por FKBP5 del receptor GCCR/NR3C1 en la respuesta al estrés58.
Amígdala, hipocampo y corteza prefrontal en pacientes con TEPTLa relación de la amígdala con el hipocampo y la corteza prefrontal ha sido objeto de investigación neurobiológica en el TEPT. Estas regiones cerebrales son ricas en receptores de glucocorticoides y muy sensibles al estrés, lo que las convierte en un circuito de gran importancia para el condicionamiento del miedo59–62.
Estudios de neuroimagen han investigado la activación de estas áreas durante la exposición a estímulos relacionados con la experiencia traumática. Se ha encontrado que la corteza prefrontal medial (CPFm), que incluye el cíngulo anterior, la corteza subcallosa y el giro frontal medio, está implicada en los procesos de extinción del miedo condicionado63,64. En veteranos excombatientes se ha identificado incrementos en el flujo sanguíneo cerebral en la amígdala y disminución del flujo en el giro frontal medio a través de tomografía por emisión de positrones65, lo que indicaría hipersensibilidad en la respuesta de la amígdala a estímulos relacionados con un evento traumático66. En el trabajo de Kirby et al.67 se demostró que las emociones afectan a la formación de memorias. En situaciones de miedo, la amígdala basolateral induce en el hipocampo, estructura implicada en la formación de memorias declarativas, la generación de nuevas neuronas a partir de una población única de celulas madre neuronales en el giro dentado del hipocampo del adulto. La formación de estas nuevas neuronas se ha asociado al hecho de que los eventos emocionales se recuerden con más facilidad y durante más tiempo que las vivencias cotidianas, lo que tiene implicaciones importantes en la fisiopatología del TEPT68. En un estudio reciente en el que participaron jóvenes maltratados con TEPT, se encontró una disminución en el volumen de la corteza prefrontal ventromedial (CPFvm) a través de imagen por resonancia magnética funcional62.
Estudios de expresión de genes identificados en áreas involucradas en el circuito neuronal de TEPT arrojan diferentes marcadores genéticos que cobran interés en el estudio genético y molecular de esta condición, tanto en modelos animales como en humanos. Este es el caso del gen OPRL1 (opioid receptor-like 1) que codifica el receptor de nociceptina/orfanina FQ. Este sistema de receptor-ligando regula una variedad de funciones biológicas, como la respuesta al estrés69, la ansiedad70, el aprendizaje y la memoria71, la actividad locomotriz72 y las respuestas inmunitaria e inflamatoria73. En el modelo animal murino, se encontró expresión de este gen en la amígdala central. Utilizando la técnica de microarreglos, fue mayor la regulación del ARNm de OPRL1 en el grupo de animales con expresión de miedo que en el grupo de control74. En ese mismo estudio, Andero et al. utilizaron el péptido SR–8993, un nuevo agonista selectivo del receptor de nociceptina, como potenciador del deterioro del miedo aprendido (condicionado). Los hallazgos de ese estudio indican que la inyección intraperitoneal en el modelo animal de SR-8993 previene la consolidación de la memoria de miedo74. Además, este grupo de investigadores buscó encontrar asociación entre polimorfismos presentes en el gen OPRL1 y el desarrollo de TEPT. Utilizaron a 1.847 sujetos que ya habían sufrido eventos traumáticos, y se evidenció una asociación positiva del SNP rs6010719 y el incremento en los síntomas de individuos con TEPT con antecedente de abuso infantil.
El gen OPRL1 merece más atención y que se profundice la investigación biomédica y en estudios G×A, ya que en anteriores estudios se ha vinculado al alcoholismo75, condición frecuentemente compartida por los individuos que cursan con TEPT76–78. Además, también tiene un papel importante en el circuito del eje HPA en la respuesta al estrés. Hay evidencia que implica el sistema de la nociceptina en la respuesta al estrés a través de un control de la regulación en el eje HPA79–81. Devine et al. demostraron que la administración de nociceptina/orfanina FQ incrementa el cortisol en plasma de ratas experimentales79.
El gen FKBP5, como ya se ha comentado, modula la actividad del receptor de glucocorticoides y tiene gran expresión en el hipocampo. Se ha encontrado una asociación positiva del alelo de riesgo (T) SNP rs1360780 con un incremento en la transcripción de FKBP5, lo que genera un consecuente aumento en la inhibición de la señalización de glucocorticoides82. Las bajas concentraciones de glucocorticoides se han asociado a riesgo de TEPT65. También se ha relacionado este alelo con diferencias estructurales en el cíngulo posterior izquierdo caracterizadas por una disminución en la densidad de las fibras, diámetro axonal y mielinización en esta región83. El polimorfismo rs1360780 (TT/TC) se ha vinculado con alteraciones en la estructura del hipocampo izquierdo en la región CA1 e incremento en la atención hacía las señales de amenaza en tareas de atención84.
Otros genes de interés relacionados con diferencias en el funcionamiento cerebral en TEPT son SLC6A4 (gen transportador de serotonina) y ADCYAP1R1. Los alelos SNP rs16965628 G y 5-HTTLPR S están asociados a disminución en la expresión de SLC64A; el primero afecta a la actividad del córtex prefrontal ventrolateral (CPFvl), en tanto que el segundo afecta a la actividad de la amígdala65. El receptor PAC1 es codificado por el gen ADCYAP1R1. Este receptor se encuentra ampliamente expresado en la amígdala, el hipotálamo y el hipocampo, y está asociado con un incremento en el riesgo de TEPT, especialmente en las mujeres85. El alelo de riesgo SNP de ADCYAP1R1 rs2267735 (C) se ha asociado con una disminución de la expresión de ADCYAP1R1 y menor de su ARNm; este alelo modula la actividad de la amígdala y el hipocampo, lo que se evidencia en una mayor activación de estas estructuras ante estímulos amenazantes86.
Algunas otras variaciones genéticas asociadas con diferencias en la estructura cerebral en TEPT involucran a los genes COMT y BDNF. Las variaciones genéticas en el SNP de COMT rs4680 se asocian con disminución del volumen de la sustancia gris de la corteza del cíngulo anterior (CCA)87 y en el SNP rs6265 de BDNF se asocian con una alteración en la extinción del miedo en humanos y en modelos animales murinos88. Se ha encontrado que BDNF interactúa con la señalización de glucocorticoides (importantes para la plasticidad cerebral), y los mayores niveles de BDNF se asocian con una mejora en la señalización de glucocorticoides y una menor vulnerabilidad al estrés89.
Estos datos indican que la vinculación de genes implicados en el circuito amígdala-CPFm-hipocampo podrían ser objeto de estudio para la identificación de marcadores biológicos de TEPT en individuos con exposición previa a eventos traumáticos.
Sistema noradrenérgicoLa norepinefrina es un elemento importante en la fisiopatología del TEPT. Esta catecolamina actúa como neurotransmisor sintetizado en el locus ceruleus en el tallo cerebral90,91 y como homona liberada por la zona medular de la glándula suprarrenal92. Esta molécula ejerce su función biológica en los grupos de receptores alfa y beta adrenérgicos93 y como principal neurotransmisor del sistema nervioso simpático94. Algunos estudios han vinculado el sistema noradrenérgico con la respuesta al estrés y el miedo generados en los pacientes con TEPT95. Un grupo de investigadores logró identificar en líquido cefalorraquídeo (LCR) de veteranos de guerra estadounidenses concentraciones tónicas de norepinefrina en los sujetos con TEPT en comparación con los controles96,97. Esto confirma la hipótesis de que el sistema noradrenérgico presenta una hiperactividad en los sujetos con TEPT, así como la sobreconsolidación de la memoria de miedo y los recuerdos intrusivos asociados16.
La catecolamina-o-metiltransferasa es una enzima implicada en la catálisis e inactivación de catecolaminas como dopamina, norepinefrina y epinefrina. El polimorfismo Val158Met de COMT se ha asociado con aparición de TEPT y abolición de la respuesta al miedo condicionado98–100. Este polimorfismo ha sido objeto de experimentación en estudios previos que lo vinculan con trastornos de ansiedad, sobre todo en los portadores homocigotos Met/Met101. Un estudio reciente asocia este polimorfismo a la disminución de la capacidad de los seres humanos para reponerse a eventos traumáticos o situaciones dolorosas, conocida como resiliencia102. También se ha encontrado que la metilación de islas CpG en regiones de COMT, incluida la región promotora, está influida por la presencia del polimorfismo Val158Met; esto regula la expresión génica y la función de la enzima103,104 y se asocia con un deterioro de la inhibición al miedo generado previamente en un modelo de paradigma condicionado104.
Epigenética en TEPTLos estudios epigenéticos han cobrado gran interés durante los últimos años. El termino epigenética se refiere al «estudio de los cambios en la función del gen que sean mitóticamente heredables y no impliquen un cambio en la secuencia de ADN»105. De esta manera, identificándolas en estudios experimentales, se han estandarizado modificaciones epigenéticas como: a) metilación de ADN; b) modificacion post-traduccional de histonas; c) remodelacion de cromatina; d) variantes en histonas, y e) ARN no codificante106. Los estudios epigenéticos en TEPT podrían explicar diferencias individuales en los sujetos expuestos al trauma que presentan vulnerabilidad para TEPT. De esta manera, estos estudios permiten una aproximación molecular considerando la vulnerabilidad familiar, la predisposición a ciertos ambientes y la exposición prolongada a ciertos efectores de trauma107.
Hay evidencia de que la metilación del ADN está implicada en todos los estados de consolidación, reconsolidacion y mantenimiento de la formación de memoria tanto en el hipocampo como en la corteza cerebral108. Los estudios en modelos animales murinos permitieron esclarecer que la acetilación de la histona H3 en el área CA1 del hipocampo se presentaba en el modelo de miedo condicionado, y con la utilización de inhibidores de la enzima desacetilasa de histonas, se lograba potenciar la formación de la memoria108,109.
Un grupo de investigadores conducidos por Weaver110 descubrió que los cambios en la metilación del ADN del gen del receptor de glucocorticoides en el hipocampo producidos por variaciones en el comportamiento materno de las ratas hacia sus descendientes generan una regulación en el eje HPA. El modelo de crianza, en el cual las ratas madres fueron retiradas tempranamente después de haber dado a luz a sus crías para impedir la interacción natural (lamer y asear a sus crías), generó cambios heredables en la expresión del gen del receptor de glucocorticoides en el hipocampo. Estos cambios se generaron por hipermetilación del promotor del gen. También se ha demostrado la metilación del ADN en células de respuesta inmunitaria en sangre periférica de sujetos con TEPT111.
DiscusiónLos estudios genéticos de identificación de polimorfismos y genes asociados a enfermedad en TEPT han vinculado los genes SLC6A438,39,65,86, FKBP549–53,58,82–84,100, ADCYAP1R185,86, ADRB2112 y OPRL174, entre otros, como candidatos en el riesgo de TEPT. La dificultad que plantean los estudios de asociación genética es la falta de reproducibilidad en los diferentes grupos poblacionales19. Esto puede deberse a las diferencias del ambiente al que están expuestos los sujetos de estudio y en ocasiones también a los tamaños de muestra utilizados por los investigadores. Sin embargo, son de gran interés los estudios de relación G×A, sobre todo en condiciones psiquiátricas como el TEPT, en las que es necesario el criterio diagnóstico de haber vivido, antes de la aparición de los síntomas, un evento traumático20. Es importante anotar que la mayoría de los estudios de G×A se han realizado con las consideraciones diagnósticas preestablecidas en el DSM–IV para el diagnóstico de TEPT. Sin embargo, desde la publicación en 2013 del DSM–V con las modificaciones diagnosticas y la inclusión de nuevos criterios para el diagnóstico de TEPT, se podría realizar otros estudios considerando no solo a quienes han sufrido directamente el evento traumático, sino también a quienes indirectamente han mostrado síntomas asociados a TEPT. Se podría considerar si las variaciones genéticas más asociadas a riesgo de enfermedad en quienes presenciaron de manera directa el evento traumático podrían ser las mismas de quienes presentan los síntomas de TEPT pero por contacto indirecto con el trauma.
Los primeros estudios moleculares en TEPT centraron su atención en el eje HPA20,49; sin embargo, los estudios de secuenciación genómica de genoma completo (GWAS) en muestras poblacionales grandes vinculan nuevos genes candidatos que cobran interés cuando se estudian de manera experimental los mecanismos moleculares en que estos genes están implicados19,21. Las variaciones genéticas presentes en las enfermedades neuropsiquiátricas implican magnitudes de riesgo de sufrir cierta enfermedad, pero se trata de trastornos mentales poligénicos y multifactoriales15,20, lo cual requiere un estudio más preciso de la interacción: variación genética por vías de señalización intracelular y extracelular; variación genética por expresión de genes; variación genética por cambios estructurales; variación genética por modificaciones epigenéticas. Es posible trasladar todo ello al campo experimental a través de estudios celulares, moleculares y con experimentación en modelos animales.
El sistema amígdala-CPFm-hipocampo requiere más atención experimental en genética y estudios moleculares, en particular en relación con los genes implicados en los mecanismos sinápticos y de neurotransmisión en los procesos de miedo, ansiedad, aprendizaje y memoria. Se ha vinculado distintos neurotransmisores y sus respectivos receptores a procesos cognitivos como la memoria, el aprendizaje y las funciones ejecutivas8. Estos componentes cognitivos están vinculados a los síntomas de los pacientes con TEPT, sobre todo los recuerdos intrusivos y las memorias del evento62–66.
ConclusionesEl TEPT es una condición psiquiátrica grave que genera discapacidad. Aunque la susceptibilidad a sufrir un evento traumático en la vida es > 50%, la prevalencia de este trastorno se encuentra en un 7–12%, dependiendo de la población estudiada, lo cual indica predisposiciones genéticas y ambientes que marcan diferencias entre los sujetos que sufren la enfermedad6,113. Los estudios de interacción G×A buscan asociar variaciones genéticas y características ambientales como factores vinculantes al desarrollo de la enfermedad. Para estos trastornos mentales poligénicos y complejos, la investigación epidemiológica a través de estudios de G×A es una herramienta interesante y útil para abordar las relaciones multifactoriales en el TEPT.
El eje HPA, el sistema noradrenérgico y el circuito amígdala-CPFm-hipocampo se consideran pivotales en el circuito neurobiológico implicado en el desarrollo del TEPT. Sin embargo, diferentes genes relacionados con la transmisión sináptica y neurotransmisores como serotonina, glutamato, GABA y dopamina también han sido implicados en estudios de experimentación animal y poblacional.
Los mecanismos epigenéticos como la metilación de islas CpG en regiones promotoras de genes implicados en el desarrollo del TEPT indican mecanismos heredables que merecen atención, ya que podrían dilucidar biomarcadores de riesgo y/o progreso de la enfermedad. La continuidad en los estudios de asociación genética con muestras poblacionales grandes y su reproducibilidad en modelos celulares y animales permitirán entender mejor los mecanismos celulares que subyacen a esta condición.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.