Los antipsicóticos son medicamentos que pueden producir elevaciones transitorias de las enzimas hepáticas. La clozapina es un antipsicótico atípico usado en el tratamiento de la esquizofrenia refractaria a los antipsicóticos convencionales y existe evidencia que puede producir elevaciones de las transaminasas hepáticas, expresión de daño hepático con patrón hepatocelular.
MétodosReporte de caso y revisión no sistemática de la literatura relevante.
Presentación del casoUna mujer de 39 años con diagnóstico de esquizofrenia paranoide acudió a un servicio de urgencias de un hospital general por náuseas, vómitos e ictericia que apareció tras el inicio de clozapina. No hubo mejoría clínica de la paciente durante la hospitalización, que falleció a los 44 días de su ingreso.
Revisión de la literaturaLa clozapina puede elevar las cifras de función hepática de manera transitoria y asintomática. Hay criterios clínicos para recomendar la suspensión de este antipsicótico.
ConclusionesEste caso es el tercero en la literatura que registra un desenlace fatal tras un cuadro de hepatotoxicidad inducido por clozapina.
Antipsychotics are drugs that can produce transient elevations of hepatic enzymes. Clozapine is an atypical antipsychotic used in treatment-resistant schizophrenia and there is evidence that it can produce elevations of hepatic transaminases, expression of liver damage in a hepatocellular pattern.
MethodsCase report and non-systematic review of the relevant literature.
Case presentationA 39-year-old woman with a diagnosis of paranoid schizophrenia attended the emergency department of a general hospital for nausea, vomiting and jaundice that appeared after the initiation of clozapine. There was no clinical improvement during hospitalisation, and death occurred after 44 days.
Literature reviewClozapine can increase the liver enzyme levels transiently and asymptomatically; however, there are clinical criteria that recommend the withdrawal of the antipsychotic.
ConclusionsThis is the third case reported in the literature of a fatal outcome of clozapine-induced hepatotoxicity.
La clozapina es un antipsicótico atípico utilizado preferentemente en la esquizofrenia refractaria al tratamiento1. Se reserva para este fin por su riesgo de agranulocitosis (recuento absoluto de neutrófilos <500/μl), que tiene una prevalencia de alrededor del 0,7%2, esto condiciona su uso a monitorización con controles periódicos de citología sanguínea.
En general, todos los antipsicóticos pueden elevar las enzimas hepáticas. Dentro del grupo de los antipsicóticos típicos, la clorpromazina está más asociada3. En este caso, el tipo de lesión es colestásico (disminución del flujo biliar, que en este caso no implica algún tipo de obstrucción)4. Dentro del grupo de los atípicos, la clozapina es el que más se relaciona con efectos hepatotóxicos5. Hasta un 60% de los pacientes tienen aumentos de las transaminasas hepáticas y un 15-30%, elevaciones de hasta 2-3 veces el valor normal6. Estas elevaciones son a menudo transitorias y asintomáticas, pero hay casos en los cuales la hepatotoxicidad inducida por clozapina puede ser grave, como se ha reportado en diferentes series de casos3.
A continuación se presenta el caso de una mujer con diagnóstico de esquizofrenia paranoide que ingresó a un servicio de urgencias por un cuadro de náuseas, vómitos e ictericia aparentemente desencadenados por la clozapina, y que acabó lamentablemente en desenlace fatal por un shock hipovolémico. Debido a los escasos registros en castellano sobre hepatotoxicidad por clozapina, se hace apropiado este reporte y revisión de la literatura.
Presentación del casoSe trata de una mujer de 39 años, con diagnóstico de esquizofrenia paranoide desde 4 años antes y sin antecedentes psiquiátricos familiares ni consumo de drogas. Entre los antecedentes médicos de importancia, se encontraban una cirugía abdominal a los 8 años por un traumatismo hepático debido a un accidente de tránsito (se desconocen los hallazgos) y hepatitis A en la niñez. No hay registro de problemas hepáticos posteriores. Tampoco lo había de consumo adicional de alguna hierba o producto no farmacéutico. En su historia psicofarmacológica figuraban tratamientos previos con risperidona, decanoato de haloperidol, olanzapina y quetiapina. A pesar de tomar la medicación antipsicótica, sus síntomas psicóticos no habían evolucionado favorablemente, por lo cual su médico tratante decidió iniciar clozapina 200mg desde el primer día de tratamiento. La paciente presentó mejoría clínica de los síntomas positivos a las 4 semanas de tratamiento, pero sufría mareos de tipo ortostático. Dos meses antes de su ingreso (a las 8 semanas de tomar la clozapina) aparecieron náuseas de predominio matutino, pero había estabilidad clínica de los síntomas psicóticos, por lo cual decidieron disminuirle la dosis de clozapina a 150 mg/día. Un mes antes de su ingreso se presentaron además vómitos esporádicos. Por estas molestias acudió a un gastroenterólogo, y le realizaron una endoscopia digestiva alta que evidenció una gastritis crónica eritematosa moderada y reflujo biliar. La paciente suspendió la clozapina 8 días antes de su ingreso por las molestias. Por las náuseas y los vómitos persistentes, así como la ictericia, la paciente acudió a un servicio de urgencias de un hospital general. No se tiene información de cuándo se inició la ictericia. No había alteración de peso ni hiporexia.
Al examen físico se encontró a la paciente con mucosas orales secas, con escleras, piel y mucosas ictéricas (++/+++) y dolor a la palpación a nivel de epigastrio y mesogastrio. No se evidenció aumento del tamaño hepático. La temperatura axilar era de 37,5°C.
Sus exámenes de función hepática al ingreso fueron transaminasa glutámico oxalacética (GOT) 183 U/l, transaminasa glutámico pirúvica (GPT) 268 U/l, con bilirrubina total (BT) en 3,5mg/dl. Su hemograma completo mostró leucocitos en 7.970/μl, con eosinófilos en 40/μl (normal, 20-500/μl) y proteína C reactiva en 1,3 mg/dl.
Los hallazgos de la ecografía abdominal al ingreso mostraron un hígado de contornos regulares, con una ecotextura parenquimal incrementada sin lesiones focales o difusas. Las vías biliares y el colédoco eran de calibre normal y sin litiasis vesicular. La ecografía renal fue normal. Sus pruebas serológicas para hepatitis B y C fueron negativas. Se le diagnosticó un síndrome emético y un síndrome ictérico hasta descartar una hepatotoxicidad inducida por clozapina, y se decidió su hospitalización. Se indicó colocación de sonda nasogástrica pero, a pesar de esta indicación, persistieron 13 días las náuseas y los vómitos, los cuales eran de contenido bilioso.
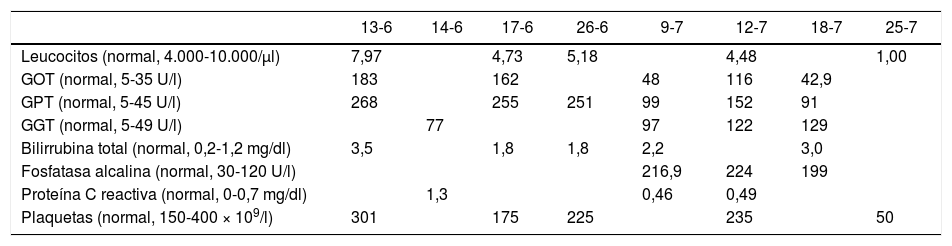
A los 15 días del ingreso, se probó la tolerancia oral con una dieta líquida porque había estado 2 días sin vómitos, pero continuaban las náuseas, por lo que se volvió a colocar la sonda nasogástrica por reaparición de los vómitos. Otros exámenes realizados fueron: tirotropina, 1,36μIU/ml (normal, 0,3-4,5μIU/ml); T4 libre, 16,8 pg/ml (normal, 8,9-17,2 pg/ml); IgG, 1.236mg/dl (normal, 656-1.351mg/dl); ANA, 1/100 patrón DFS70 positivo. En la tabla 1 se muestra la evolución de la función hepática durante la hospitalización. Como se puede apreciar, la GOT y la GPT se encontraban 3 veces por encima del valor superior normal en la paciente al mes de hospitalización.
Evolución de los exámenes de laboratorio
| 13-6 | 14-6 | 17-6 | 26-6 | 9-7 | 12-7 | 18-7 | 25-7 | |
|---|---|---|---|---|---|---|---|---|
| Leucocitos (normal, 4.000-10.000/μl) | 7,97 | 4,73 | 5,18 | 4,48 | 1,00 | |||
| GOT (normal, 5-35 U/l) | 183 | 162 | 48 | 116 | 42,9 | |||
| GPT (normal, 5-45 U/l) | 268 | 255 | 251 | 99 | 152 | 91 | ||
| GGT (normal, 5-49 U/l) | 77 | 97 | 122 | 129 | ||||
| Bilirrubina total (normal, 0,2-1,2 mg/dl) | 3,5 | 1,8 | 1,8 | 2,2 | 3,0 | |||
| Fosfatasa alcalina (normal, 30-120 U/l) | 216,9 | 224 | 199 | |||||
| Proteína C reactiva (normal, 0-0,7 mg/dl) | 1,3 | 0,46 | 0,49 | |||||
| Plaquetas (normal, 150-400 × 109/l) | 301 | 175 | 225 | 235 | 50 |
Otros exámenes solicitados fueron una tomografía computarizada abdominal al mes de hospitalizada, en la cual se encontró un hígado de situación, forma y tamaño dentro de lo normal, con disminución de la densidad en fase simple (sin contraste intravenoso) y con el contraste; no se localizaban lesiones focales ni dilatación de vías biliares, con un colédoco de calibre conservado. La vesícula biliar se describió como colapsada, con edema perivesicular y ausencia de litiasis. La conclusión fue una hepatopatía difusa leve y edema perivesicular. Por la sospecha de una obstrucción intestinal, le realizaron una radiografía de tránsito intestinal, que no se pudo concluir por los vómitos inducidos por la sustancia de contraste, y una endoscopia digestiva alta, que mostró a nivel del estómago un lago mucoso y bilioso en regular cantidad, el antro con una mucosa con moteado blanquecino, congestivo, sin erosiones y un píloro congestivo. Se concluyó: gastropatía congestiva antral y reflujo biliar.
Desde el ingreso de la paciente, la intolerancia a la vía oral debido a las náuseas y vómitos y la ictericia persistieron hasta el día 42 de la hospitalización, cuando aparecieron vómitos porráceos. Se evidenció una glucosa en 45mg/dl y un tiempo de protrombina de 20 s. Un día después se complicó con encefalopatía y un cuadro de fallo multiorgánico refractario por una hemorragia digestiva alta. La causa no se pudo determinar por la evolución tórpida de la paciente, quien falleció 1 día después de instaurarse este cuadro.
DiscusiónLa hepatotoxicidad por medicamentos se refiere a cualquier daño en la función del hígado por la ingesta de medicamentos, hierbas o suplementos dietéticos y abarca desde elevaciones asintomáticas de enzimas hepáticas hasta la insuficiencia hepática aguda7. La hepatotoxicidad por medicamentos se puede clasificar de la siguiente manera: directa, idiosincrásica e indirecta.
El mecanismo directo, o intrínseco, se sabe que está relacionado con la acumulación del fármaco tras su ingestión, así como el daño directo de sus metabolitos en el hígado. Depende de la dosis, es predecible y el periodo de latencia es corto (1-5 días) después de dosis terapéuticas altas o dosis supraterapéuticas, como puede ser en el caso de una sobredosis intencional o accidental8.
El mecanismo idiosincrásico es el más común y hace referencia a la singularidad del individuo, que no depende de la dosis ni es predecible9. Este tipo de hepatotoxicidad es consecuencia de un daño hepático mediado por el sistema inmunitario o un daño celular directo10,11. La hepatotoxicidad por este mecanismo se inicia con la exposición del hepatocito a alguna forma de estrés, aunque hay también otros factores que sensibilizan a esta célula y amplifican el daño celular12. Intervienen mecanismos protectores, como el glutatión, que tiene la función de eliminar especies reactivas de oxígeno13 y la activación de genes antioxidativos y sus proteínas mediada por la vía protectora del factor nuclear eritroide 2-relacionado con el factor 2 (nuclear factor erythroid 2-related factor 2 [Nrf2])14. Un deterioro de estos mecanismos protectores puede llevar al daño en el hepatocito (disfunción proteica, alteración en la regulación de los transportadores de fármacos, toxicidad mitocondrial y daño lisosomal). La formación de los metabolitos reactivos del medicamento y la unión covalente pueden llevar a la activación inmunitaria de las células T15.
En el mecanismo idiosincrásico puede suceder un síndrome de hipersensibilidad, caracterizado por la eclosión de sarpullido, eosinofilia y aparición de autoanticuerpos, y se manifiesta tras un periodo de latencia corto (1 a 6 semanas). Aunque este mecanismo está poco claro, se postula que la reacción de hipersensibilidad es de tipo I por el aumento en algunos casos de la inmunoglobulina E, angioedema y rash cutáneo16,17. Otra hipótesis es la estimulación de los linfocitos T, con un posterior incremento de la interleucina 5, que promueve la producción de eosinófilos18.
Sobre la base de los hallazgos de laboratorio, el mecanismo idiosincrásico se puede clasificar en hepatocelular, colestásico y mixto19,20:
- •
Patrón hepatocelular: GPT ≥ 3 veces el valor superior normal y una razón GPT/fosfatasa alcalina (FA)≥5 veces. Es la manifestación más común del daño hepático idiosincrásico21.
- •
Patrón colestásico: FA≥2 veces el valor superior normal y una razón GPT/FA≤2 veces. Este patrón está relacionado con el daño en la secreción biliar, como el producido por la clorpromazina, que genera colestasis3,22.
- •
Patrón mixto: TGP≥3 veces el valor superior normal, FA≥2 veces el valor superior normal y una razón GPT/FA <5 y> 2 veces.
El tercer mecanismo que se describe es el daño hepático indirecto a través del aumento del riesgo del síndrome metabólico, que a su vez incrementa el riesgo de enfermedad de hígado graso no alcohólico, que se caracteriza por la acumulación hepática de triglicéridos23. Los antipsicóticos, sobre todo los atípicos, se asocian con ganancia de peso, hiperfagia, hiperglucemia, resistencia a la insulina, diabetes mellitus tipo 2 y dislipemia24.
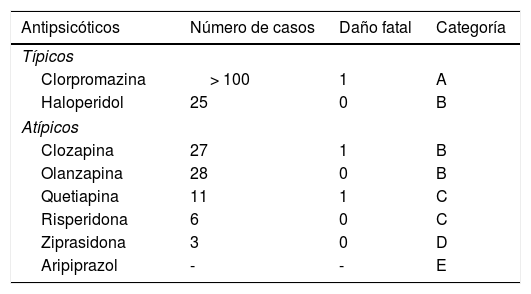
De los antipsicóticos atípicos, la clozapina es el más asociado con anomalías de la función hepática, habitualmente elevación de las transaminasas, que apunta a un daño hepático con patrón hepatocelular5. Es importante señalar que, además de la clozapina, otro de los antipsicóticos más hepatotóxicos es la clorpromazina, mientras que los menos hepatotóxicos son aripiprazol y ziprasidona3,5,25. En la tabla 2 se resumen los principales antipsicóticos y su clasificación de hepatotoxicidad.
Antipsicóticos y hepatotoxicidad
| Antipsicóticos | Número de casos | Daño fatal | Categoría |
|---|---|---|---|
| Típicos | |||
| Clorpromazina | > 100 | 1 | A |
| Haloperidol | 25 | 0 | B |
| Atípicos | |||
| Clozapina | 27 | 1 | B |
| Olanzapina | 28 | 0 | B |
| Quetiapina | 11 | 1 | C |
| Risperidona | 6 | 0 | C |
| Ziprasidona | 3 | 0 | D |
| Aripiprazol | - | - | E |
A: el medicamento causa daño hepático directo o idiosincrásico clínicamente aparente. Se han descrito más de 50 casos.
B: es muy probable que el medicamento cause daño hepático idiosincrásico clínicamente aparente. Se han descrito entre 12 y 50 casos.
C: es probable que el medicamento cause daño hepático idiosincrásico. Se han descrito menos de 12 casos.
D: es una causa infrecuente de daño hepático. Se han descrito menos de 3 casos.
E: no hay evidencia de que el medicamento haya causado daño hepático. Puede haber reportes de caso únicos, pero en gran medida no son convincentes.
E*: no se ha probado que el medicamento cause daño hepático.
X: se desconoce que el medicamento haya producido daño hepático. Se aplica a medicamentos recientemente introducidos o muy poco empleados en medicina clínica.
Las elevaciones de las pruebas de función hepática con clozapina dependen de la dosis y suele darse con 200-400mg/día27. La elevación de las enzimas hepáticas en rangos clínicamente significativos aparece a las 5-8 semanas de iniciarse la clozapina, con una media de tiempo de 34,2 días28,29. Las elevaciones de las transaminasas se normalizan espontáneamente sin reducir la dosis de la clozapina en cerca de la mitad de los pacientes, aproximadamente a las 9 semanas. Al reducir o suspender la clozapina, las enzimas hepáticas retornan a su valor normal en 4-6 semanas27,29,30.
Si bien no hay una escala específica para valorar la gravedad del daño hepático producido por la clozapina, en la tabla 3 puede apreciarse la severidad de la injuria hepática inducida por medicamentos en general.
Gravedad del daño hepático producido por medicamentos
| Gravedad | Descripción |
|---|---|
| Grado 0: sin daño hepático | Tolerancia al medicamento sin ninguna reacción hepatotóxica |
| Grado 1: daño hepático leve | Elevaciones séricas de GPT y/o fosfatasa alcalina, bilirrubina total <2,5 veces el límite superior normal, INR <1,5Puede haber fatiga, astenia, náuseas, anorexia, dolor abdominal superior derecho, ictericia, prurito, erupción o pérdida de peso |
| Grado 2: daño hepático moderado | GPT y/o fosfatasa alcalina elevados, con bilirrubina total ≥ 2,5 el límite superior normal o INR ≥ 1,5Los síntomas descritos pueden agravarse |
| Grado 3: daño hepático grave | Elevaciones séricas de GPT y/o fosfatasa alcalina, bilirrubina total ≥ 5 el límite superior normal con o sin INR ≥ 1,5 |
| Grado 4: insuficiencia hepática aguda | Evidencia de anormalidades en la coagulación indicada por INR ≥ 1,5 o actividad de protrombina <40%, signos de encefalopatía hepática y bilirrubina total ≥ 10 veces el límite superior normal o elevación diaria ≥ 1 mg/dl en las 26 semanas posteriores al comienzo del daño hepático inducido por medicamentos. Puede haber ascitis y disfunción de otros órganos |
| Grado 5: letal | Muerte debida a daño hepático inducido por fármacos o necesidad de trasplante hepático para la supervivencia |
Tomado de Yu et al.31.
Con respecto a la dosificación de la clozapina, la literatura recomienda iniciar con 12,5mg/día, con incrementos graduales de 25-50mg/día hasta llegar a 300mg/día a las 2-3 semanas, para disminuir los efectos adversos peligrosos como la hipotensión ortostática, las convulsiones, la miocarditis y el síndrome neuroléptico maligno32,33.
Las guías clínicas no son específicas respecto a monitorizar las enzimas hepáticas. La Maudsley Prescribing Guidelines in Psychiatry33 recomienda hacer una prueba de función hepática basal y otra a los 4-6 meses de tratamiento con clozapina.
Asimismo, si se está frente a síntomas clínicos como malestar general, fiebre, dolor abdominal, náuseas, vómitos, sarpullido, orina oscura o ictericia, se debe determinar las enzimas hepáticas y suspender la clozapina si los valores de GPT, GOT y GGT están por encima de 3 veces el valor normal o la FA o la bilirrubina total son> 2 veces el valor normal5,34-36. Se ha descrito insuficiencia hepática aguda fulminante, la cual por fortuna es extremadamente rara, con solo 2 casos (0,001%) publicados37,38.
En cuanto a nuestro caso, el diagnóstico de hepatotoxicidad inducida por clozapina se basó en la historia clínica de la paciente y la exclusión de otras posibles causas. Si bien la paciente tenía un test de ANA positivo, el patrón señalado DFS70 (moteado denso y fino, peso molecular de 70 kDa) se encuentra en individuos sanos39.
La paciente ingresó con valores de GPT 6 veces el límite superior, GOT 5 veces el límite superior y bilirrubina total en la banda de ictericia, sin evidencia de obstrucción por cálculos. Esto se considera daño hepático grave. La presentación fue hepatocelular por el marcado incremento de la GPT, los hallazgos ecográficos y los posteriores controles de FA, que no mostró valores> 2 veces el valor superior normal. A pesar de la suspensión de la clozapina, no se normalizaron las enzimas hepáticas ni hubo mejoría clínica. Las pruebas de función hepática debieron normalizarse al mes de suspenderse la clozapina. La hipótesis al respecto es que el antecedente de traumatismo abdominal de la niñez y la dosis inicial de clozapina 200mg/día sin titulación previa estarían relacionados con la hepatotoxicidad. Si bien la paciente cursó con uno de los efectos adversos gastrointestinales más frecuentes de la clozapina -las náuseas desde el primer mes de tratamiento, la persistencia de estas y la aparición de vómitos deberían poner en alerta y motivar la inmediata determinación de las enzimas hepáticas.
ConclusionesEl caso reportado corresponde a un cuadro de hepatotoxicidad inducida por la clozapina. Se llega a esta conclusión por la presentación de los síntomas, la exclusión de otras posibles causas, el examen físico y los hallazgos de laboratorio. Según la literatura revisada, este es el tercer caso con desenlace fatal. Luego de haber revisado la bibliografía, se recomienda:
- •
La medición del perfil hepático debe tenerse en consideración antes de iniciar la clozapina. El siguiente control debe ser a los 4-6 meses de tratamiento.
- •
Si el paciente presenta síntomas clínicos con la clozapina, como ictericia, fiebre, sarpullido, malestar, náuseas y vómitos, se debe medir el perfil hepático para valorar la elevación de las enzimas hepáticas. Si fueran> 3 veces el valor normal, se debe suspender la clozapina. En caso contrario, se puede continuar con la dosis de clozapina y hacer valoraciones continuas del perfil hepático.
- •
Se recomienda una dosificación progresiva de la clozapina, iniciando con 12,5 mg/día. Se debe incrementar 25-50mg/día hasta llegar a 300 mg/día a las 2-3 semanas.
Los autores declaran no tener ningún conflicto de intereses.