La activación de los linfocitos T se inicia a través de la presentación de antígenos endógenos o exógenos por células presentadoras de antígenos a través del complejo mayor de histocompatibilidad, el cual se une a un receptor especializado presente en los linfocitos T. Este reconocimiento desencadena una cascada de señalización intracelular que conlleva a un aumento en la expresión de integrinas, modificaciones del citoesqueleto y producción de factores de transcripción involucrados en la liberación de citocinas y mediadores inflamatorios. Uno de los inductores más importantes en la activación celular es el complejo enzimático con acción tirosina cinasa. Las cinasas que pertenecen a la familia SRC (SFK), FYN y LCK están involucradas en un gran número de procesos importantes en la activación, modulación de la respuesta linfocitaria y el desarrollo de enfermedades autoinmunes. La regulación de la señalización de las cinasas, así como de proteínas adaptadoras involucradas en la activación del linfocito T, son fundamentales para mantener el umbral de activación y modulación de la respuesta del linfocito. La fosforilación de sitios de regulación positiva de estas proteínas es importante para permitir una configuración activa de la proteína y de esta forma su máxima capacidad como cinasa. La fosforilación de los sitios de regulación negativa conlleva a una configuración cerrada de la proteína de tal forma que reduce su función de cinasa e inhibe su función. Las alteraciones en la señalización por modificación de algunas proteínas citoplasmáticas se asocian en algunos casos al desarrollo de enfermedades autoinmunes, como el lupus eritematoso sistémico. En condiciones fisiológicas, el complejo receptor de linfocitos T se reagrupa con complejos proteicos que interactúan armónicamente para generar una señal interna. Los eventos de señalización alterados son en parte los responsables de una expresión anómala de citocinas, entre ellas la interleucina-6 (IL-6), IL-10, IL-2, IFN y CD40 ligando; estas modificaciones alteran la capacidad de los linfocitos T para sobre estimular a los linfocitos B, traduciéndose en un aumento en la producción de autoanticuerpos y en el desencadenamiento de la enfermedad autoinmune.
The activation of T cells is initiated by the presentation of exogenous or endogenous antigens, by antigen presenting cells through the major histocompatibility complex, which binds to a special receptor on T cells. This acknowledgement triggers a cascade of intracellular signalling that leads to an increase in integrin expression, cytoskeletal modifications, and transcription factors production involved in the liberation of cytokines and inflammatory mediators. One of the most important inducers in cell activation is the enzymatic complex with tyrosine kinase action. The kinases which belong to the SRC (SFK) LCK and FYN family have been involved in a large number of important processes in the activation and modulation of the T cells response, as well as in the development of autoimmune diseases. Regulating the kinases signalling, as well as the adapter proteins involved in T cell activation, is essential for maintaining an activation threshold, as well as the modulation of cell response. The phosphorylation of the positive regulation sites of these proteins is important to allow an active configuration of the protein and thereby its maximum capacity as kinase. The phosphorylation of negative regulation sites leads to a closed configuration of the protein that reduces its kinase function, and thereby inhibits its own function. The alteration in signalling by the modification of certain cytoplasmic proteins in some cases is associated with the development of autoimmune diseases, such as systemic lupus erythematosus. Under physiological conditions the T cell receptor complex regroups with protein complexes that interact harmonically to generate an internal signal. The altered signalling events are partly responsible for an anomalous expression of cytokines, including the interleukin-6 (IL-6), IL-10, IL-2, IFN, and CD40 linking, these modifications affects the cells ability to over-stimulate T and B cells, resulting in an increased production of autoantibodies and the triggering of the autoimmune disease.
Los mecanismos de activación y regulación de linfocitos T involucran una cascada de eventos de señalización interna en las que gran número de proteínas tienen un papel relevante, induciendo en algunos casos fosforilación y activación de tirosina cinasas, lo que conlleva a la activación celular con liberación de citocinas y otros factores solubles. Una alteración en las proteínas involucradas en los eventos de señalización puede dar como resultado la pérdida de su mecanismo efector, lo que significaría un cambio en la activación de la célula. Los cambios funcionales inducidos como consecuencia de estas alteraciones generan comportamientos diferentes en los linfocitos T y B, lo que produce, en algunos casos, sobreexpresión de proteínas inductoras y un aumento en la síntesis de anticuerpos. En esta revisión se pretende incluir las proteínas y los marcadores más importantes involucrados en los eventos de señalización interna en linfocitos T, así como modificaciones en la expresión de algunas de ellas inducidas por mutaciones o por factores externos que desencadenan procesos autoinmunes como el lupus eritematoso sistémico (LES) (tabla 1).
Relación entre la activación linfocitaria normal y el lupus eritematoso sistémico
| Conceptos clave |
| Activación linfocitaria normal |
| Los mecanismos de activación y regulación de linfocitos T involucran a un gran número de proteínas que a través de mecanismos de fosforilación o desfosforilación son capaces de activar un gran número de moléculas efectoras |
| La señal generada por el TCR por sí sola no es suficiente para la activación del linfocito T; son necesarias señales adicionales proporcionadas por correceptores que proporcionen señales adicionales para garantizar una señal lo suficientemente fuerte |
| El TCR de los linfocitos T tiene la capacidad de reconocer péptidos que se encuentran unidos a proteínas del MHC. La señal se transmite al citoplasma a través del correceptor CD3 por medio de sus cadenas citoplasmáticas con patrón basado en tirosina y leucina conocida como ITAM |
| ITAM es fosforilado por SKF (FYN y LCK) creando sitios de unión de alta afinidad para proteínas como ZAP-70 |
| LAT es un complejo proteico conocido como signalosoma; su función es de andamiaje e integrador de varios elementos de señalización. Es fosforilado por ZAP-70 y permite el reclutamiento de proteínas como GRB2, GRAP y GADS |
| Cada proteína adaptadora asociada a LAT está involucrada en distintas vías de señalización lo que permite la interacción con distintas proteínas efectoras. Esto permite realizar cambios en el citoesqueleto, activar vías de supervivencia celular, sintetizar interleucinas |
| Las vías de señalización que involucran el calcio son importantes reguladores de la transcripción de genes efectores en el linfocito. Las altas concentraciones de calcio intracelular resultan en un aumento de la expresión de ligandos celulares como el ligando CD40 y FAS ligando |
| Los mecanismos reguladores de la activación permiten controlar la duración y detener las señales de activación garantizando la respuesta apropiada para un estímulo externo. Dentro de los mecanismos involucrados para el control de la respuesta se encuentran: Las vías de ubiquitinación y degradación proteica, el correceptor CTLA-4 y PTPN22 |
| Lupus eritematoso sistémico |
| La estructura del TCR está alterada en la mayoría de pacientes con LES, la cadena ζ TCR es reemplazada por la cadena γ del Fc¿R, lo que contribuye a anormalidades en la señalización. La señalización a través del TCR alterado en LES se presume que es mucho más fuerte debido a la asociación que hay entre FcR γ que es 100 veces más potente que la señalización por ZAP-70 |
| Alteraciones en los eventos tempranos de las vías de transducción de la señal en linfocitos T de pacientes con LES: se ha encontrado aumento en la actividad de las señales mediadas por el calcio intracelular y en vías de señalización por proteínas cinasa |
| En pacientes con LES se han documentado altas concentraciones de la proteína LAT en linfocitos T CD4+, siendo mayor en las poblaciones activadas de linfocitos T CD4+. Esto indica una regulación a nivel transcripcional o disminución de su degradación |
| La actividad MAP cinasa defectuosa puede alterar la coordinación de las señales necesarias para la producción normal de IL-2 y el mantenimiento de la tolerancia en los linfocitos T de pacientes con enfermedad autoinmune. Dentro de las alteraciones encontradas en esta proteína están la activación del complejo RAS/RAF y disminución de la translocación del complejo nuclear AP-1 |
| Los linfocitos T de pacientes con LES se caracterizan por expresar sobre su superficie celular gran cantidad de CD40 y FasL. Por un lado, la señalización FasL estimula la vía apoptótica disminuyendo la cantidad de linfocitos T, por otro lado, el aumento de la interacción CD40 con su ligando estimula la producción de anticuerpos por parte de linfocitos B |
| Hay una disminución del ligando CD80, por lo cual hay una deficiencia de la señal mediada por CD28 como señal complementaria para la activación linfocitaria, por ende, hay disminución de la producción de IL-2 |
| El polimorfismo del gen PTPN22 arg620try se ha relacionado con múltiples enfermedades autoinmunes, como el LES, la artritis reumatoide, la granulomatosis de Wegener, entre otros |
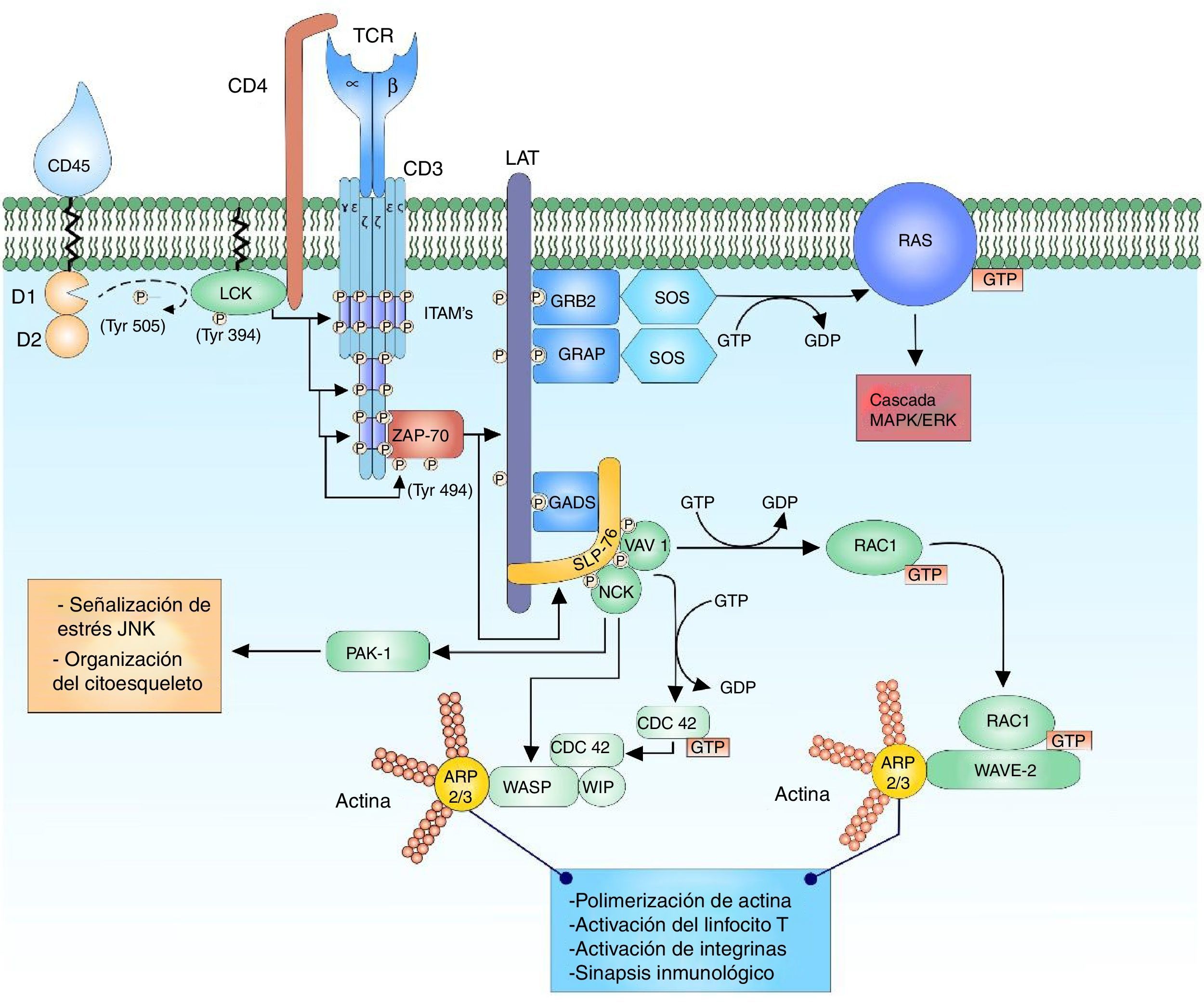
El T-cell receptor (TCR) es un heterodímero compuesto por una cadena alfa y una cadena beta que comparte similitud estructural con las inmunoglobulinas, teniendo un dominio variable y un dominio constante. Ambas cadenas se encuentran unidas a través de puentes disulfuro en un extremo cercano a la membrana celular. El dominio variable está conformado por secuencias de aminoácidos codificados por segmentos de genes variable (V), diverso (D) y unión (J). El segmento D solo se encuentra en los segmentos que codifican para la cadena beta del receptor1,2. Esta reorganización de segmentos en la región variable permite la formación de un sitio para el reconocimiento del antígeno. El TCR de los linfocitos T tiene la capacidad de reconocer péptidos que se encuentran unidos al complejo mayor de histocompatibilidad, expresado en la superficie de las células presentadoras de antígeno. Las cadenas alfa y beta del TCR tienen dominios citoplasmáticos cortos, que no participan en la señal intracelular debido a que no presentan sitios de fosforilación, se encuentran unidas a las cadenas del cluster of differentiation 3 (CD3), conformados por las cadenas heterodímeras CD3 δ¿, γ¿ y el homodímero ζζ del TCR1,3–5. Las cadenas alfa y beta del TCR pueden trasmitir la señal tras la unión de un péptido unido al complejo mayor de histocompatibilidad por medio de las cadenas CD3 al interactuar con las moléculas efectoras citoplasmáticas1,6 (fig. 1).
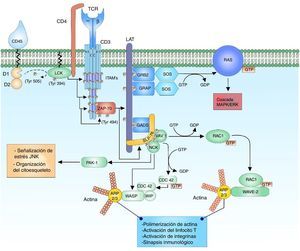
Unión de complejo TCR y pMHC. La unión de TCR y el péptido asociado a MHC genera la primera señal citoplasmática para la activación linfocitaria a través del correceptor CD3. La cinasa LCK de la familia de cinasas SRC se encuentra unida al correceptor CD4, lo cual facilita la fosforilación de los residuos de tirosina de las secuencias patrón ITAM de las cadenas heterodímeras CD3 δ¿, γ¿ y el homodímero ζζ del TCR, permitiendo el reclutamiento y la activación de ZAP-70. LCK activa ZAP-70 por medio de la fosforilación de su dominio regulador, permitiendo su función completa como cinasa..
La unión del peptide major histocompatibility complex (pMHC) y el TCR genera una señal primaria que por sí sola no es capaz de generar la activación de los linfocitos, necesita de otras señales secundarias7,8. La unión de correceptores como el cluster of differentiation 4 (CD4), cluster of differentiation 28 (CD28), lymphocyte function associated antigen (LFA-1), cluster of differentiation 2 (CD2) con moléculas provenientes de las células presentadoras de antígeno genera una señal secundaria suficiente para la activación y modulación del umbral de respuesta7–11.
Los trabajos de Tsokos et al. han evidenciado alteraciones en los eventos tempranos de las vías de transducción de señal en células T autorreactivas de pacientes con LES, haciendo énfasis en la vía de señalización dependiente de calcio. Los diseños experimentales en los que se utilizan anticuerpos monoclonales anti-CD3 para estimular linfocitos T han demostrado un aumento en la actividad de proteínas tirosina cinasas y en los niveles de calcio intracelular en linfocitos T autorreactivos de pacientes con LES, pero no en linfocitos T autorreactivos de pacientes con enfermedad mixta del tejido conectivo (EMTC) ni en linfocitos T de control12.
Otros grupos han reportado otro tipo de alteraciones en las vías de señalización intracelular en células T de pacientes con LES, en la señalización interna a partir del reconocimiento antigénico por TCR y en la transducción de la señal en los linfocitos T. La expresión de las cadenas ζ TCR está disminuida o ausente en la mayoría de las células T de los pacientes con LES, pero no en los que presentan otras enfermedades autoinmunes13. Esta anormalidad es específica de la enfermedad e independiente de la actividad y del tratamiento, por lo tanto, representa un defecto intrínseco potencial en la patogénesis del LES14,15.
Secuencias ITAM y función en la activación linfocitariaLa unión entre el TCR y el pMHC genera la primera señal citoplasmática para la activación linfocitaria a través del correceptor CD3, por medio de sus cadenas citoplasmáticas con un patrón basado en tirosina y leucina que forma una secuencia consenso de «YxxI/Lx (6-8) YxxI/L» (repeticiones de tirosina y leucina cada 6 a 8 aminoácidos)3,5,16,17. Esta secuencia patrón conocida como immuno receptor tyrosine-based activation motif (ITAM) es fosforilada en sus residuos de tirosina por cinasas, creando sitios específicos de unión para otras enzimas lo que permitirá transmitir y amplificar la señal16,17. Las proteínas encargadas de la fosforilación de los residuos de tirosina en las secuencias ITAM hacen parte de las cinasas de la familia SRC (proto-oncogene tyrosine-protein kinase SRC) y las cinasas de la familia SFK (SRC family kinasas)17–19.
Activación y regulación de las cinasas de la familia SRC, FYN y LCKLas cinasas de la familia SRC, FYN proto-oncogene, Src family tyrosine kinase (familia FYN) y leukocyte C-terminal Src kinase (familia LCK) están involucradas en un gran número de procesos relacionados con la activación y modulación de la respuesta linfocitaria. Tanto FYN como LCK comparten dominios similares a otras cinasas de la familia de SRC, como las regiones homólogas SRC homology 3 (SRC3 o SH3), regiones homólogas SRC homology 2 (SRC2 o SH2), dominios tirosina cinasa SRC homology 1 (SH1), región N terminal de adición de ácidos grasos saturados y un dominio C terminal para la regulación negativa20,21. Las SFK son reguladas positivamente por la fosforilación de residuos de tirosina en su sitio catabólico, lo que promueve un cambio conformacional de la proteína y así su máxima actividad cinasa y su regulación negativa por la fosforilación de los residuos de tirosina en su región carboxiterminal predispone la conformación cerrada de la proteína y una disminución de su actividad cinasa19,20. La cinasa LCK se encuentra unida al correceptor transmembranal CD4 por medio de enlaces no covalentes, cuando se da la interacción pHMC con el TCR, LCK es reclutada por su asociación con CD419. El correceptor CD4 se une al dominio invariable del pHMC facilitando el proceso de reconocimiento antigénico con el TCR y provocando la autofosforilación o transfosforilación de LCK en su región activa (Y394)20. Un regulador muy importante en la activación y la regulación de la actividad cinasa de LCK es CD457. El cluster of differentiation 45 (CD45) es una proteína transmembranal con 2 dominios citoplasmáticos, D1 y D2. El dominio 1 tiene actividad enzimática de fosfatasa y el dominio 2, aunque no se conoce del todo su función, puede estar involucrado en la regulación de los sustratos con los que interactúa D17,22. El dominio 1 actúa en la desfosforilación del residuo de tirosina inhibitorio (Y505) en la región carboxiterminal de LCK permitiendo la completa actividad de cinasa22.
Señalización citoplasmática del receptor de células TEl reclutamiento del correceptor CD4 permite la proximidad de la cinasa LCK a sus sustratos en las cadenas del correceptor CD3; de esta forma, la fosforilación de los ITAM en sus residuos de tirosina. La subunidad ζ del TCR modula la señal en el complejo TCR por su contribución de 6 ITAM por TCR3,16. Tanto FYN como LCK tienen la posibilidad de fosforilar los residuos de tirosina de los ITAM, sin embargo, ambos tienen distinta distribución. LCK tiene mayor afinidad a los residuos de ITAM de la cadena CD3 y del TCR, mientras FYN participa en la interacción con mediadores del citoesqueleto especialmente focal adhesión kinase (FAK)16,17,21,22. ¿Por qué hay tantos ITAM por complejo TCR? (10 por cada complejo); aunque no se conoce la respuesta exacta, se ha propuesto que esta cantidad de ITAM podría proveer la capacidad de amplificar la señal recibida por cada complejo TCR, aumentando la sensibilidad de la respuesta por la incorporación de 6 sitios específicos de fosforilación en las cadenas ζ del TCR y, adicionalmente, facilitar la expresión de citocinas16,18,23–25. Tampoco es claro el mecanismo exacto por el cual los residuos de ITAM son fosforilados, se piensa que el TCR al estar inactivo los residuos de tirosina, leucina e isoleucina se encuentran ocultos dentro de la región transmembrana del linfocito T y cuando el TCR es activado se genera un cambio estructural de las cadenas del CD3 permitiendo el descubrimiento de las secuencias para ser fosforiladas por las cinasas3,19.
La fosforilación de 2 residuos de tirosina de las secuencias ITAM de las cadenas CD3 actúan como sitios de unión de alta afinidad a proteínas que contienen dominios SH2 en tándem, como lo son las proteínas zeta-chain (TCR) associated protein kinase 70kda (ZAP-70) y spleen tyrosine kinase (SYK) miembros de la familia de cinasas SYK3,5,23,26. ZAP-70 se une a los residuos de tirosina de ITAM que han sido fosforilados por LCK por medio de sus dominios SH2, quedando en cercanía a LCK para ser fosforilada en su residuo de tirosina (Y493); esto permite su activación como cinasa y así su autofosforilación (o transfosforilación) para desarrollar su máxima actividad18,19.
Aunque la estructura y la función bioquímica de SYK y ZAP-70 son similares, hay una gran diferencia en su expresión; esto se debe al patrón de expresión de ZAP-70 que está restringido a linfocitos T y natural killer, mientras que SYK puede estar en linfocitos B, macrófagos, monocitos, mastocitos y plaquetas21. ZAP-70 activo, fosforila a linker for activation of T cell (LAT) y lymphocyte cytosolic protein 2 (SH2 domain containing leukocyte protein of 76kda) (SLP-76), que transmiten y diversifican la señal de activación16 (fig. 1).
Estabilizador de células T activadas signalosomaEl signalosome es un complejo proteico que está compuesto por varios elementos de señalización que están asociados y regulados por la actividad de proteínas de andamiaje27. LAT es el ejemplo de esta clase de proteínas que recluta otras proteínas para formar un gran complejo proteico que facilita la señalización de los linfocitos T19. LAT es una proteína transmembranal cuya expresión se limita a células hematopoyéticas incluyendo linfocitos T, natural killers, plaquetas y mastocitos. Está conformada por un dominio extracelular corto, un dominio transmembrana y un dominio citoplasmático largo que contiene residuos de tirosina28. LAT carece de actividad enzimática y actúa como adaptador molecular para un gran número de proteínas, coordina el reclutamiento de intermediarios proteicos y de enzimas efectoras; sin embargo, LAT no es esencial en la activación de los linfocitos T, pero desempeña un papel más importante en la modulación de la activación linfocitaria por medio de la activación de proteínas que actúan en la regulación negativa de la respuesta5,28. LAT es rápidamente fosforilado por ZAP-70 tras la activación del TCR, generando múltiples sitios de alta afinidad para la unión de proteínas con dominios SH2. Las proteínas adaptadoras de unión a LAT son conocidas como la familia de proteínas growth factor receptor bound protein 2 (GRB2), de las cuales hacen parte las proteínas GRB2, GRB2 related adapter protein (GRAP) y GRB2-related adaptor downstream of Shc (GADS). Estos adaptadores comparten una estructura similar que consiste en 2 dominios SH3 y un dominio SH2. Por medio de sus dominios SH2 se unen a los residuos fosforilados de LAT y permiten la unión de otras proteínas por sus dominios SH3 expuestos17,18. Estas proteínas unidas a LAT amplifican la señal de activación y, adicionalmente, la diversificación de las respuestas celulares tras la activación del linfocito T.
Cada proteína adaptadora asociada a LAT está involucrada en distintas vías de señalización, lo que permite la interacción con distintas proteínas efectoras. El adaptador proteico de LAT, GRB2 es punto de unión de múltiples proteínas gracias a sus dominios SH3, como la proteína son of sevenless (SOS). GRAP, una vez unido a LAT, recluta a SOS, Dynamin y Src-Associated substrate in Mitosis of 68 kDa (SAM68)17,18. GADS difiere de las otras proteínas adaptadoras de LAT por su distribución limitada a células hematopoyéticas y su dominio SH3 específico para la interacción con la proteína SLP-7628,29.
SLP-76 es un adaptador multidominio proteico que está restringido a células hematopoyéticas incluyendo linfocitos T, monocitos/macrófagos, natural killers, mastocitos y plaquetas28,30. Está conformada por una región rica en residuos de tirosina que son fosforilados por ZAP-70, una región central rica en prolina y una región carboxiterminal con un dominio SH2 que interactúa con una proteína adaptadora multidominio SLP-76 associated phosphoprotein/FYN binding protein (SLAP/FYB)17. ZAP-70 al fosforilar a SLP-76 en los residuos de tirosina sirve como sitio de unión a proteínas con dominios SH2 incluyendo Vav 1 guanine nucleotide exchange factor (VAV1), non-catalytic region of tyrosine kinase adaptor protein 1 (NCK) e IL2 inducible T cell kinase (ITK)17,28.
Los estudios comparativos de proteínas ZAP-70, LAT y SLP-76 realizados por Januchowski et al. en el 2007, en pacientes con LES y personas libres de la enfermedad, muestran un aumento significativo en la concentración de la proteína LAT en linfocitos T CD4+ de pacientes con LES, comparado con el grupo control, siendo aun mayor las concentraciones en las poblaciones activadas de linfocitos T CD4+ en comparación con las células vírgenes. Esto indica una regulación al alza a nivel transcripcional de la proteína o una disminución en la degradación proteolítica de la proteína31.
Regulación del citoesqueleto de actina tras la activación del linfocito TLa activación del linfocito T requiere la regulación de la organización del citoesqueleto de actina para facilitar la sinapsis inmunológica, permitiendo la comunicación con las células presentadoras de antígeno y facilitando distintos eventos que involucran: diferenciación a distintos linajes celulares, migración a través de los tejidos, adherencia celular, reorientación celular y secreción de mediadores celulares como citoquinas32.
La reorganización del citoesqueleto va acompañada de un número importante de eventos de señalización interna. El complejo adaptador proteico multidominio SLP-76 es fosforilado por ZAP-70 permitiendo la interacción de proteínas especializadas en los arreglos del citoesqueleto como VAV1 y NCK. VAV1 es una proteína especializada en el intercambio de nucleótidos de guanina perteneciente a la familia Rho GTPasa. La activación del SLP-76 por parte de ZAP-70 permite la unión de VAV1 a SLP-76 en sus dominios fosforilados y este a través de su dominio DH permite el intercambio de nucleótidos de GDP a GTP a las proteínas Ras-related C3 botulinum toxin substrate 1 (RAC1) y cell división control protein 42 (CDC42), activándolas y regulando los cambios del citoesqueleto que se llevarán a cabo en la sinapsis inmunológica33–38.
Los dominios fosforilados de SLP-76 interactúan con NCK facilitando el reclutamiento de las proteínas Wiskott-Aldrich syndrome protein (WASP) y p21-activated kinase (PAK1) para los arreglos del citoesqueleto33,39. PAK1 es miembro de la familia de cinasas Ser/Thr de las proteínas RAC1 y CDC42, y desempeña un papel importante en la organización del citoesqueleto y la activación de vías de señalización de estrés, como la cascada de señalización c-Jun N-terminal kinase (JNK)33.
La configuración activa de CDC42 modula la proteína WASP y junto con WAS/WASL-interacting protein family member 1 (WIP) forma el complejo WIP-WASP fundamental para la regulación de actin related proteins 2/3 (ARP 2/3)36,40. La configuración activa de RAC1 activa a la vez la proteína WASP-family verprolin-homologous protein (WAVE2) formando el complejo RAC1-WAVE2 que activa el complejo ARP2/3. El complejo ARP2/3 interactúa con los monómeros de actina para su polimerización y así facilita la organización del citoesqueleto para la sinapsis inmunológica33,34,36 (fig. 1).
WASP es reconocida por el síndrome Wiskott-Aldrich, una inmunodeficiencia de herencia ligada al cromosoma X que resulta de la mutación del gen WASP, específicamente una mutación en el dominio WH1, una región que es requerida para la estabilización proteica a través de la asociación con WIP, al no existir esta interacción se degrada WASP41.
La estructura del TCR está alterada en la mayoría de pacientes con LES, la cadena ζ TCR es reemplazada por la cadena γ del Fc¿R, lo que contribuye a anormalidades en la señalización42. La señalización a través del TCR alterado en el LES se presume que es mucho más fuerte debido a la asociación que hay entre FcR γ, que es 100 veces más potente que la señalización por ZAP-7043. Los estudios de Tsokos mostraron diferentes asociaciones moleculares entre la interacción de SYK con FcR γ desencadenantes de la señalización del TCR en pacientes con LES, encontrando: 1) aumento en la expresión de SYK pero no de ZAP-70; 2) mayor asociación de SYK con el citoesqueleto de actina comparado con ZAP-70; 3) inhibición de SYK normalizando la cinética de la polimerización de actina, y 4) diferencias entre SYK y ZAP-70, en sus patrones de asociación con moléculas de señalización claves, lo cual generan diferentes perfiles de señalización inducidos por el TCR43.
Señalizaciones efectoras del linfocito TLa unión del TCR con el péptido unido al MHC inicia una serie de eventos de señalización que preparan al linfocito para la diferenciación celular, la proliferación y la función efectora. Las vías de señalización que conllevan a la activación del nuclear factor kappa-light-chain-enhancer of activated B cells (NFκB), el factor activator protein 1 (AP-1) y nuclear factor of activated T-cells (NFAT), son cruciales para la expresión de moléculas efectoras requeridas para la función de los linfocitos.
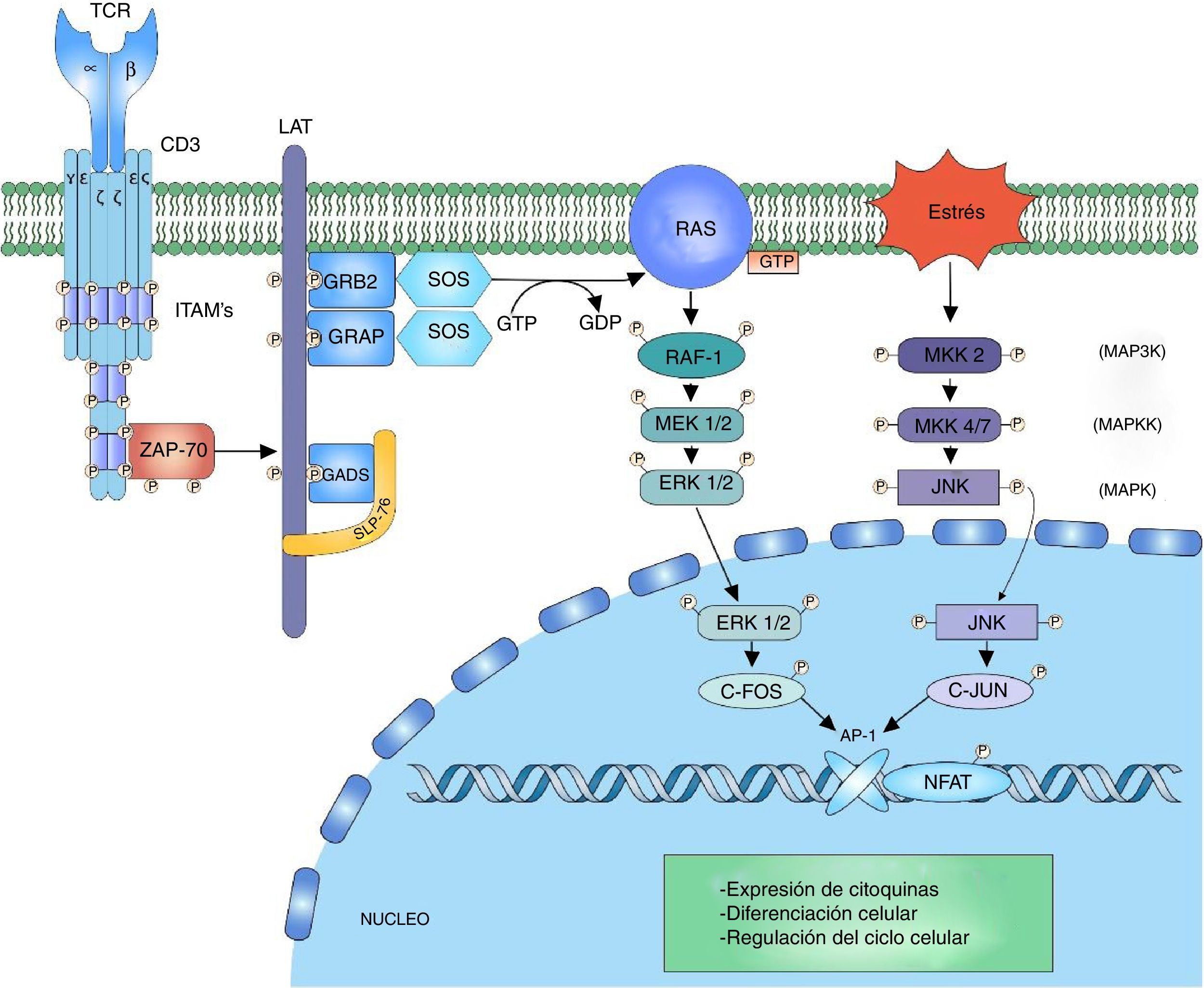
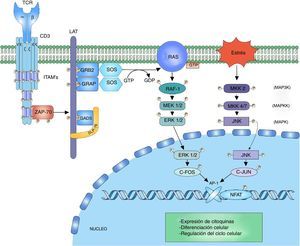
Señalización ERK-c-FosLa cascada de mitogen activated protein kinase (MAPK) es una forma de señalización para procesos celulares como diferenciación, crecimiento celular, proliferación, movilidad y respuesta al estrés. La señalización se desarrolla gracias a un núcleo de 3 cinasas (MAP3K, MAPKK y MAPK) que permiten la activación de componentes efectores (MAP kinase activated protein kinase (MAPK-APK)44. La cascada se propaga gracias a la activación en secuencia de las cinasas permitiendo la fosforilación de componentes reguladores. La señalización de extracellular-signal-regulated kinases (ERK1/2) inicia tras la fosforilación de LAT y la unión de las proteínas GRB2 y GADS, que actúan como adaptadores para el reclutamiento a la membrana del intercambiador de nucleótidos SOS para la activación de RAS7,45,46. RAS unido al GTP recluta y activa la primera cinasa RAF-1 (MAP3K), esta activa MEK1/2 (MAPKK) permitiendo la transmisión de la señalización a las cinasas ERK1/2 (MAPK). La señalización continúa en los complejos MAPK-APK o en otros sustratos que se encuentran tanto en el citoplasma como en el núcleo; sin embargo, la fosforilación de ERK1/2 del factor nuclear c-Fos es importante para impedir su degradación44 (fig. 2).
Cascada MAP cinasa: la cascada MAP cinasa inicia tras la fosforilación de signalosoma LAT por parte de ZAP-70 para el reclutamiento de las proteínas adaptadoras a LAT, GRB2 y GRAP. GRB2 y GRAP, las cuales reclutan el intercambiador de nucleótidos SOS, el cual intercambia GDP por GTP a la proteína RAS una proteína G. RAS permite la activación de la primera cinasa de la señalización MAP cinasa RAF-1. RAF-1 fosforila a MEK1/2 activándola y de este modo permitiendo la transmisión de la señalización a las cinasas ERK1/2. ERK1/2 activada fosforila al factor nuclear c-fos, impidiendo su degradación y permitiendo su interacción c-jun.
La cascada JNK, también llamada cascada inducida por estrés (stress-activated protein kinase cascade [SAPKs])44, involucra diferentes vías de señalización encargadas de la respuesta celular a estímulos de estrés. El estímulo de estrés es percibido por la célula y la señalización se transmite hasta las GTPasas CDC42 y RAC1, que van a activar la señalización MAPK, ya sea directamente sobre las cinasas MEKK2 (MAP3K) o indirectamente por medio de las cinasas MAP4K, que a la vez activan a las cinasas MAP3K47. La activación de MAP3K transmite la señal a través de la fosforilación a MKK4/7 (MAPKK), activando las cinasas JNK1/2/3 (MAPK). Las 3 isoformas de JNK tienen como función la fosforilación de c-Jun inhibiendo su degradación y permitiendo la interacción con otros factores transcripcionales47. La activación del factor c-Fos junto con la activación del factor c-Jun forman el factor AP-1, un factor heterodimérico que interactúa con NFAT para la síntesis de interleucina (IL)-2 y está involucrado en la supervivencia celular48 (fig. 2).
Los estudios sobre alteraciones en las vías de señalización en linfocitos T de pacientes con LES han mostrado defectos en la activación de la cascada MAP cinasa en respuesta a la señalización dada por el complejo TCR/CD3. Los defectos están relacionados con activación del complejo RAS/RAF y disminución de la translocación del complejo nuclear AP-1; de igual forma, se ha demostrado una disminución en la unión de SOS a GRB2 en linfocitos T de pacientes con LES49. La actividad MAP cinasa defectuosa puede alterar la coordinación de las señales necesarias para la producción normal de IL-2 y el mantenimiento de la tolerancia en los linfocitos T de pacientes con enfermedad autoinmune.
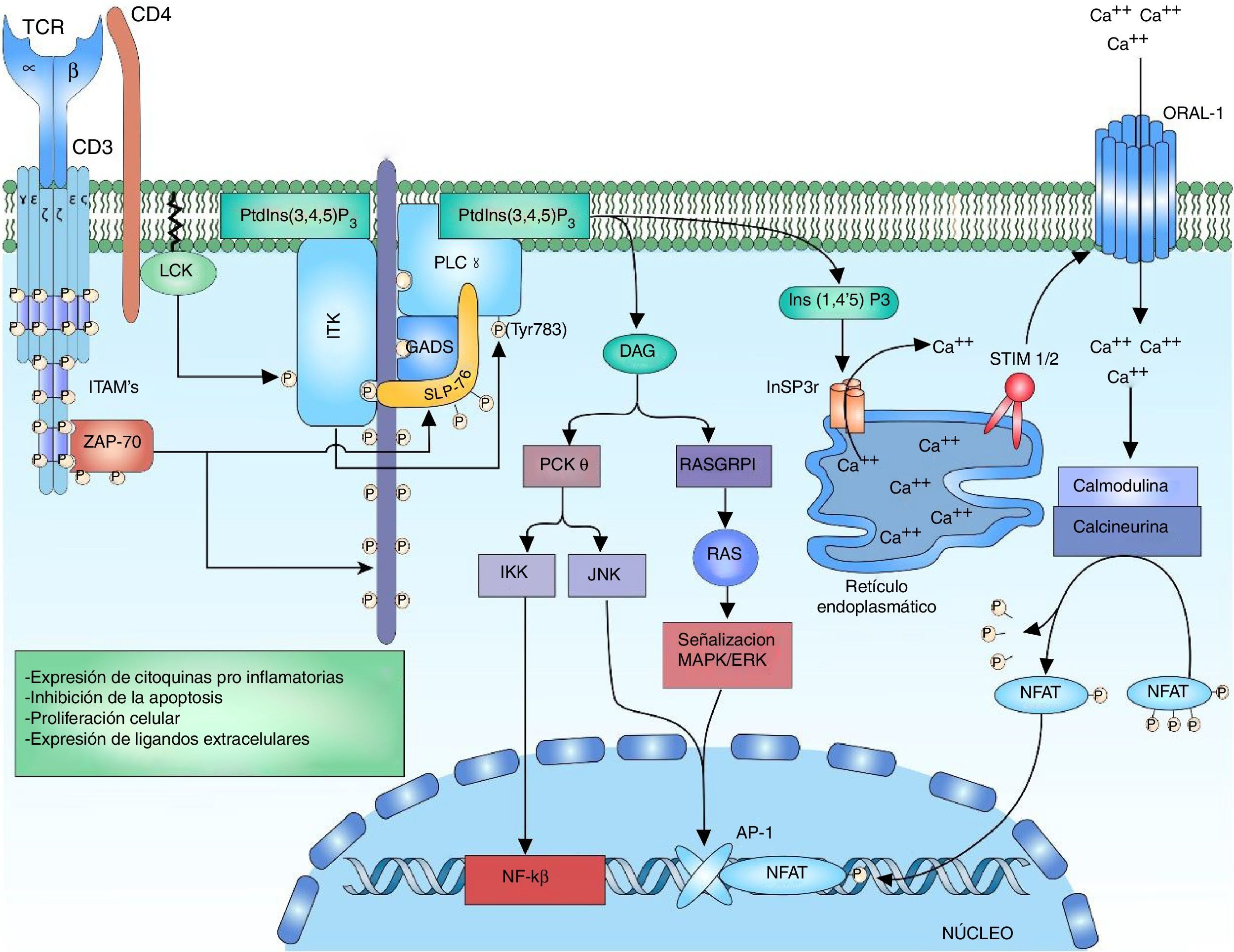
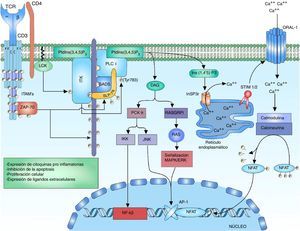
Señalización de la fosfolipasa C y el factor nuclear de células T activadasLa enzima ITK hace parte de la familia de tirosina cinasas tecprotein tyrosine kinase (TEC), entre los dominios de ITK se encuentran los dominios SH2 y SH3 para las interacciones proteicas y el dominio pleckstrin-homology domain (PH) de unión al PtdIns (3,4,5) P3 (phosphatidylinositol (3,4,5)-trisphosphate), siendo este necesario para su activación36,50. La activación de ITK requiere varios pasos relacionados, el primero es el reclutamiento y la unión de la proteína ITK a la membrana celular por medio de su dominio PH al PtdIns (3,4,5) P3. El PtdIns (3,4,5) P3 es producto de la fosforilación de PtdIns (4,5) P2 (phosphatidylinositol 4,5-bisphosphate) por la cinasa phosphatidylinositol 3-kinase (PI3K), las fosfatasas phosphatase and tensin homologue (PTEN) y SH2-domain-containing inositol-5-phospatase (SHIP) regulan la rotura del fosfato del PtdIns (3,4,5) P3 para formar PtdIns (4,5) P2, regulando así la señal del linfocito50–54. El segundo paso es la presencia de una cinasa de la familia SRC para la fosforilación del complejo ITK-PtdIns (3,4,5) para su activación. Dentro de la familia SRC que interactúa con ITK se encuentra la cinasa LCK, la cual es necesaria para su activación55. El tercer paso consiste en la interacción de ITK con proteínas involucradas en la señalización del TCR como el complejo LAT-GADS-SLP-7652,55. La activación de la enzima ITK permite la amplificación y la diversificación de la señal por medio de la fosforilación y la activación de la enzima phosphoinositol phospholipase C gamma 1 (PLCγ1). PLCγ1 regula el metabolismo de los fosfolípidos de inositol por medio de la hidrólisis del PtdIns (4,5) P2 para la formación de inositol 1,4,5- triphosphate (InsP3) y diacilglicerol (DAG). Existen 2 formas de la proteína, PLCγ1 y PLCγ2, predominando la forma PLCγ1 en los linfocitos T56,57 (fig. 3).
Activación del complejo TCR: tras la activación del TCR, la fosforilación de los residuos de LAT permiten el reclutamiento de la proteína de anclaje a LAT GADS; esta es fosforilada por ZAP-70 permitiendo la unión a SLP-76, que de igual manera es fosforilada por ZAP-70. La fosforilación de los residuos de la proteína multidominio SLP-76 permite la unión de la cinasa ITK. Para la activación de la cinasa ITK es necesario el anclaje de ITK a la membrana celular por medio de su domino PH al PtdIns (3,4,5) P3, la fosforilación de los residuos de tirosina de ITK por la cinasa LCK de la familia de las cinasas SRC para su activación. Interacción de ITK con otras proteínas como SLP-76, GADS y LAT. ITK activo fosforila a la enzima PLCγ1, la cual regula el metabolismo de los fosfolípidos de inositol por medio de la hidrólisis del PtdIns (4,5) P2 formando DAG e InsP3.
El diacilglicerol activa protein kinase C theta (PKCθ), que es una serina/cinasa miembro de la subfamilia de las PKC independientes de calcio, cuya expresión está limitada a linfocitos T, células musculares y plaquetas58. Se ha demostrado en estudios in vitro con células T Jurkat que LCK fosforila a PKC-θ en su dominio C2, que es un dominio de tirosina (Y90); sin embargo, no se ha demostrado que esta fosforilación esté involucrada en cambios con la actividad enzimática ni en su regulación, pero mutaciones en la tirosina 90 (cambio de tirosina a fenilalanina) han demostrado alteraciones en la activación de NFAT y AP-159. Una vez se activa PLCy1 y hay liberación de DAG, el DAG se une al dominio C1 de PKC-θ, cambiando su conformación a un estado abierto de su sitio activo permitiendo la fosforilación de sus sustratos58.
PKC-θ está involucrado en la activación de 2 factores de transcripción importantes para la activación del gen IL-2, que son AP-1 y NFκB. La activación del factor de transcripción AP-1 por PKC-θ se logra a través de la interacción con Ste20/SPS1 related proline and alanine rich kinase (SPAK), una cinasa de la familia Ste-20 involucrada en la señalización MAP cinasa60. La activación de NFκB puede ser inducida por la fosforilación de CARD11/CARMA (caspase recruitment domain-containing protein 11) por PKC-θ, liberando el complejo IκB kinase (IKK) que interactúa en la degradación mediada por ubiquitinación de inhibitor of kappa B (IκB), liberando de esta forma NFκB para su translocación al núcleo61. La translocación de NFκB al núcleo permite la transcripción de genes involucrados en la expresión de citocinas proinflamatorias, expresión de moléculas citotóxicas, proteínas inhibidoras de la apoptosis y la expresión de genes involucrados en la proliferación celular.
El DAG actúa en la estimulación de la vía MAPK/ERK, junto a JNK activan el factor AP-1. El calcio y el DAG regulan positivamente la translocación de la proteína RAS guanyl releasing protein 1 (RASGRP1) de la membrana del aparato de Golgi19,62. RASGRP1 realiza el cambio de GDP a GTP para la activación de la señalización MAPK/ERK por medio de RAS62,63 (fig. 3). La regulación del calcio está mediada por canales ubicados tanto en el retículo endoplasmático como en la membrana celular. La activación del TCR eleva rápidamente las concentraciones de InsP3 acoplándose al receptor InsP3R. Ins (1,4,5) P3 receptor es una glucoproteína unida a la membrana del retículo endoplasmático que actúa como canal de calcio que libera el calcio almacenado dentro del retículo al citoplasma, aumentando las concentraciones dentro de la célula51,64,65. Sin embargo, el calcio liberado del retículo endoplasmático no es suficiente para estimular a las proteínas dependientes de calcio, es por ello que es necesaria su liberación por otras vías como la activación de canales transmembrana. La pérdida de calcio dentro del retículo endoplasmático es censada por las proteínas STIM1 o STIM2 (stromal interaction molecule). Las proteínas STIM son proteínas transmembrana ubicadas en el retículo endoplasmático que actúan como sensores de los niveles de calcio manteniendo la homeostasis dentro de la célula66. La porción N-terminal de las proteínas STIM está ubicada en la luz del retículo y posee dominios especializados para censar pequeños cambios en la concentración de calcio dentro del retículo. Una vez se censan las bajas concentraciones de calcio, se genera un cambio de un estado dimérico basal a un estado oligomérico, el cual migra a la membrana plasmática y es capaz de desencadenar la entrada de calcio hacia la célula a través de canales calcio transmembrana ORAI (calcium release-activated calcium modulator 1) por dominios ubicados en su región C-terminal citoplasmática66,67.
El calcio dentro de la célula actúa como un segundo mensajero para la activación de NFAT. Las concentraciones elevadas de calcio dentro de la célula son cruciales para la activación del sensor intracelular sensible a calcio, calmodulina26. Normalmente, sin la presencia de calcio, la proteína permanece en un estado inactivo o «cerrado» y cuando hay un aumento de las concentraciones de calcio, el calcio se une a la calmodulina y sufre un cambio conformacional a un estado «abierto», permitiendo su unión a la enzima calcineurina68. La calcineurina es una proteína serina/fosfatasa calcio-calmodulina dependiente que defosforila múltiples regiones de NFAT, incluyendo su dominio de reconocimiento al ADN, de esta forma permitiendo la translocación del factor de transcripción al núcleo7,69,70 (fig. 3).
Se ha demostrado el papel de NFAT en la transcripción de un gran número de citocinas involucradas en la respuesta efectora del linfocito T, como IL-2, IL-4, IL-10, IFN-gamma, el factor estimulante de colonias de granulocitos y monocitos (GM-CSF), y TNF. También se ha demostrado el papel que desempeña NFAT en la expresión de IL-5 como en la expresión de CD40L y CD95L en linfocitos T de pacientes con LES70.
El calcio como segundo mensajero de múltiples vías de señalización es estrechamente regulado para garantizar una óptima respuesta celular ante un estímulo; alteraciones en su concentración implican señalizaciones anómalas que tienen implicaciones en la respuesta celular. Las altas concentraciones de calcio resultan en un aumento de la expresión de ligandos celulares, como lo son el ligando CD40 (CD40L) y Fas ligando (FasL)12. Estudios realizados por Tsokos et al. han demostrado que los linfocitos T de pacientes con LES expresan altas cantidades de FasL sobre su superficie, comparados con los grupos controles, dando explicación de las altas tasas de apoptosis que se evidencian en linfocitos de pacientes con enfermedad autoinmune71. Se evidenció además un aumento en la expresión del CD40L sobre la superficie celular de los linfocitos T y un aumento de la expresión de CD40 sobre la superficie de linfocitos B en pacientes con LES, así aumentando la interacción CD40-CD40L, que da lugar a un aumento de la estimulación de linfocitos B y producción de anticuerpos con consecuencias inmunológicas importantes72.
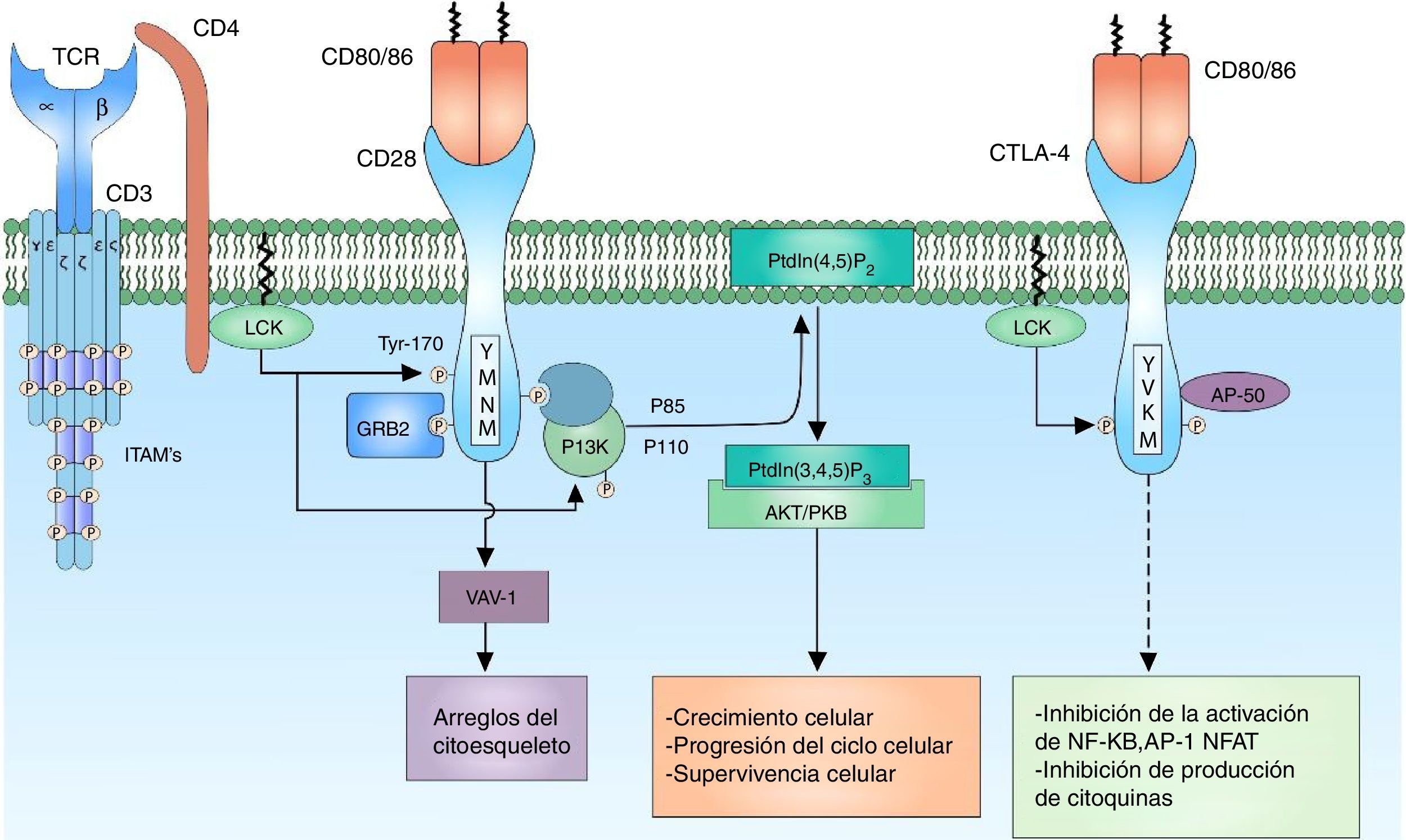
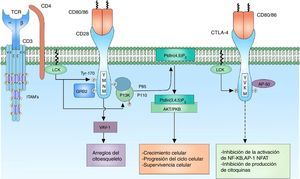
Señalización correceptor CD28La señal que se genera por la activación del TCR por sí sola falla en desencadenar una activación completa del linfocito; es necesaria la presencia de correceptores que proporcionen señales adicionales por medio de vías de señalización en común con la señal principal para que se garantice una señal suficientemente fuerte para la activación del linfocito T. El correceptor CD28 tiene gran importancia en la activación celular por su participación en la generación de señales coestimuladoras. Es una glucoproteína transmembrana que se expresa principalmente en linfocitos T activados y en reposo9. Se une a los ligandos CD80 (B7-1) y CD86 (B7-2) correceptores de las células presentadoras de antígenos, por lo tanto, está involucrada en procesos de proliferación, evita procesos de anergia, facilita la expresión de citoquinas y media la supervivencia celular73 (fig. 4).
Correceptor CD28: el correceptor CD28 tiene gran importancia en la activación celular por su participación en la generación de una señal coestimuladora. La unión del correceptor CD28 con sus ligandos CD80/86 y la fosforilación de sus residuos citoplasmáticos permiten la activación del receptor y de este modo el reclutamiento de las proteínas PI3K y GRB2. PI3K regula el metabolismo de los lípidos de inositol a través de la fosforilación del PtdIns (4,5) P2 a PtdIns (3,4,5) P3, que a su vez está involucrado en la activación de la señalización mediada por AKT/PKB.
Los aminoácidos que comprenden la cola citoplasmática del correceptor CD28 poseen actividad enzimática intrínseca. Esta cola citoplasmática posee 4 tirosinas que son clave para la señalización intracelular; son fosforiladas por FYN o por LCK. La fosforilación del residuo de tirosina 170 (Y170) que se encuentra ubicada en la secuencia patrón altamente conservada TYR-MET-ASN-MET (YMNM) permite el reclutamiento de proteínas con dominios SH2 como PI3K y GRB273–75 (fig. 4).
PI3K forma parte de la familia de enzimas que regulan la función biológica por medio de la generación de lípidos como segundos mensajeros. Esta se divide en distintas clases de acuerdo con su función; las PI3K clase I predomina principalmente en los linfocitos. A su vez, las PI3K se divide en 2 grupos, de acuerdo con su activación, siendo el grupo IA activado por receptores asociados a tirosina cinasas, correceptores y receptores de citocinas74. PI3K IA consta de 2 subunidades, la subunidad P85, que es la subunidad reguladora, se une a la secuencia patrón YMNM del correceptor CD28 para su activación; la subunidad P110, que es el complejo catabólico, actúa en la fosforilación del PtdIns (4,5) P2 a PtdIns (3,4,5) P374,76. Este lípido actúa en moléculas que contengan dominios PH, como AKT/PKB e ITK. AKT/PKB (protein kinase B) está relacionada en la regulación de numerosas vías de señalización que promueven el crecimiento celular, la progresión en el ciclo celular y la supervivencia77,78 (fig. 4).
Se ha demostrado que sin la segunda señal coestimuladora, los linfocitos T fallan en la producción de IL-2 y establece un estado de anergia79,80. Aunque la señalización mediada por CD28 en linfocitos T en pacientes con lupus se encuentra intacta, el ligando CD80 se encuentra disminuido conllevando a una deficiencia en la señalización mediada por CD28 y, por ende, en la disminución en la producción de IL-281.
Balsas lipídicasLas balsas lipídicas son microdominios en la membrana celular compuestos por lípidos diferentes de los que hacen parte normalmente la membrana celular, entre estos lípidos se encuentran los glucoesfingolípidos, esfingomielina, colesterol, entre otros. Estas balsas lipídicas crean un ambiente que permite acumular o segregar diferentes proteínas a una región específica82.
Los esfingolípidos tienen un punto de ebullición alto, lo que les permite formar conjuntos ordenados separados de la capa de fosfolípidos que tienen un punto de ebullición más bajo; el colesterol se mezcla preferentemente entre los esfingolípidos para estabilizar la estructura de la membrana y su fluidez. Por lo tanto, las balsas lipídicas pueden actuar como plataformas que se mueven libremente en la membrana celular83.
La complejidad del ambiente de las balsas lipídicas permite una regulación temporo-espacial de la regulación de la señal del linfocito T. Varias proteínas, como LAT, CD4 y LCK, se encuentran en las balsas lipídicas gracias a interacciones entre lípidos-lípidos o lípidos proteínas. La adición de grupos saturados a las proteínas con dominios intracelulares, extracelulares o transmembrana aumenta la afinidad de estas proteínas al ambiente organizado de las balsas lipídicas. LCK es modificado con la presencia de grupos de lípidos saturados y su presencia en las balsas lipídicas es requerida para la transducción de la señal a través de la activación del TCR84. LAT que también es modificado por la adición de estos grupos de lípidos saturados, una vez se activa el TCR hay un reclutamiento de proteínas propias de la señalización a las balsas lipídicas lo cual facilita la transducción de la señal83,84.
Regulación de la activación del linfocito
Co-receptor CTLA-4Cytotoxic T-lymphocyte antigen 4 (CTLA-4) es un correceptor que tiene un papel fundamental en la regulación negativa de la señal de activación del linfocito T; es una glucoproteína que comparte gran similitud con CD28 y, al igual que este, posee dominios extracelulares similares a las de las inmunoglobulinas. La expresión del correceptor CTLA-4 está restringida a linfocitos T, ya sean CD4 o CD8; sin embargo, no se expresa en linfocitos T vírgenes, pero se expresa en la membrana una vez el linfocito T está activado85,86.
Los ligandos de unión del CTLA-4 son CD80/86, ubicados en la membrana de la célula presentadora de antígenos. Se ha demostrado que la unión de CTLA-4 a sus ligandos CD80/86 es mucho más afín que la unión de CD28 a estos mismos85. La razón por la cual tanto CTLA-4 como CD28 comparten los mismos ligandos indica la presencia de una señal coestimuladora necesaria para la activación del linfocito T generada por la unión de CD28 y su ligando, y en contraste una señal reguladora que module la activación del linfocito generada por la unión de CTLA-4 a su ligando; de esta forma, mantiene un balance entre la señal de activación y la señal moduladora. CTLA-4 inhibe la activación linfocitaria por medio de la reducción de la producción de IL-2 y la disminución en la expresión del receptor para IL-2, deteniendo el ciclo celular en fase G187.
CTLA-4 se ubica en el citoplasma, en vesículas citoplasmáticas y su expresión a la superficie de las células se da por mecanismos regulados por clatrina, limitando de esta forma la unión de los ligandos CD80/86, previniendo la terminación prematura de la respuesta inmune. CTLA-4 posee una cola citoplasmática sin actividad enzimática intrínseca compuesta por secuencias patrón característico YVKM y 2 residuos de tirosina involucrados en la actividad y regulación de esta proteína (Y201, Y218). En su forma no fosforilada, el patrón Y201VKM del CTLA-4 se asocia a la subunidad AP50 del complejo proteico asociado a clatrina, lo cual determina el estado citoplasmático de la proteína. Múltiples proteínas con actividad cinasa actúan sobre el residuo crítico de tirosina del CTLA-4 (Y201), entre ellos los más importantes LCK y FYN88,89. La fosforilación de este residuo hace una translocación de las vesículas citoplasmáticas a la membrana celular permitiendo la interacción de CTLA-4 con su ligando y así modular la señalización del TCR inhibiendo la unión de AP-1 y NFAT al núcleo, y suprimiendo las vías de señalización de ERK y JNK. CTLA-4 actúa por medio de fosfatasas que actúan directamente sobre sustratos específicos, sin embargo, la señalización de CTL-4 en cuanto a cómo ejerce su efecto inhibitorio ha sido bastante discutida e inclusive contradictoria90.
Ubiquitinación y degradaciónLa ubiquitinación es el proceso por el cual las células pueden discriminar proteínas que van a ser degradadas, esto se lleva a cabo gracias a la marcación de la proteína con ubiquitina, lo cual permite su degradación. La ubiquitina es un péptido de 76 aminoácidos; se une a proteínas a través de 3 enzimas, E1, E2 y E3 por el proceso de ubiquitinación. El primer paso de la ubiquitinación consiste en la formación de un enlace tioéster con el residuo de glicina del C-terminal de la ubiquitina y el grupo sulfhídrico (o tiol) de la cisteína de E1 en su centro activo. El segundo paso consiste en la transferencia de la ubiquitina desde una enzima E1 a una enzima E2 de conjugación (Ubc). El paso final consiste en la unión de la E2-ubiquitina a una E3 ligasa; esta cataliza la formación de un enlace isopeptídico entre la glicina del C-terminal de la ubiquitina con la lisina del sustrato específico91. Las enzimas E3 tienen la función tanto de reconocimiento de la proteína específica, a la cual será llevada a la ubiquitinación, así como la capacidad de interactuar con las enzimas E2. Las proteínas marcadas en su lisina 48 poliubiquitinadas son sustrato de degradación proteica por medio del proteasoma 26S91,92.
La familia de proteínas Casitas B-lineage lymphoma (Cbl) son proteínas adaptadoras moleculares, se unen a proteínas para su ubiquitinación y su degradación. En mamíferos se encuentran 3 genes que codifican para las proteínas de la familia Cbl: c-cbl, cbl-b y cbl-3 (o también conocida como cbl-c)92–95. La estructura de las proteínas Cbl es similar entre ella, contiene un dominio de unión a tirosina cinasa o dominio tirosine kinase binding domain (TKB), un dominio really interesting new gene (RING) responsable de la función catalítica de las ligasas E3, una región rica en prolina (propias de las proteínas c-Cbl y Cbl-b) y un dominio C-terminal de asociación a ubiquitina o ubiquitin associated (UBA)93,94. En linfocitos T las proteínas c-Cbl y Cbl-b están encargadas del control de la señalización generada por la activación del TCR, esto por medio de la ubiquitinación de receptores activos y receptores asociados a tirosina cinasa. C-Cbl forma un complejo con la cadena zeta del TCR y ZAP-70 para promover la ubiquitinación de la cadena zeta y su degradación92,95,96. Se ha reportado que c-Cbl puede regular negativamente la función de ZAP-70 independiente de la proteólisis92. C-Cbl también interactúa con el dominio SH2 de la subunidad p85 de la enzima PI3K y de esta forma regula negativamente la señal de PI3K de coestimulador de la señalización del linfocito T97. Estudios se han enfocado en la relación existente entre Cbl-b y VAV1, aunque no se ha demostrado que Cbl-b esté involucrada en la degradación de VAV1, pero sí en el control de los sustratos de fosforilación tras la activación del TCR y la señal de coestimulación de CD28 para la activación de VAV134,94,98. La importancia de la acción antagónica de Cbl-b hacia PKC-θ es por la modulación del umbral de respuesta del linfocito T, por lo tanto, Cbl-b regula a PKC-θ a través de la regulación negativa de la señalización de VAV1 y PI3K, lo cual puede controlar la transcripción de IL-2 en ausencia de la coestimulación de CD2898,99. Sin embargo, estudios recientes han demostrado que PKC-θ es un regulador de la acción del Cbl-b; por medio de la coestimulación del receptor CD28 es posible su destrucción100 (fig. 5).
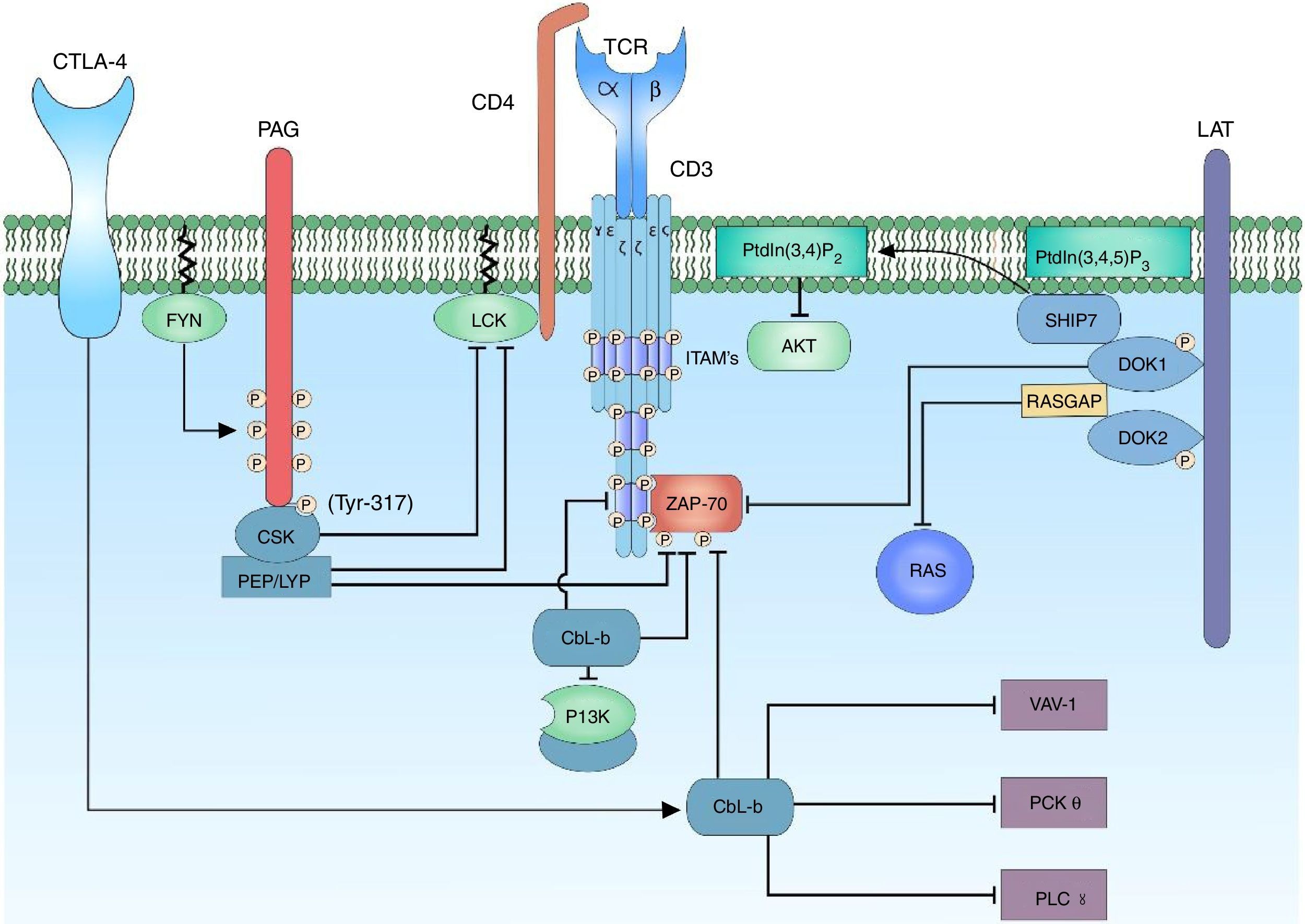
Regulación negativa de la señal de activación del complejo TCR. La regulación negativa de la señal de activación del TCR es importante para evitar procesos de anergia. En los linfocitos T, las proteínas c-Cbl y Cbl-b están encargadas del control de la señalización por medio de la ubiquitinación de receptores activos y receptores asociados a tirosina cinasa. Activado el correceptor CTLA-4, hay activación de la proteína Cbl-b para la regulación de la señal linfocitaria; este interactúa con la subunidad p85 de la enzima PI3K, regulando de esta forma la señal que proviene del correceptor CD28. Cbl-b interactúa con proteínas claves en la activación linfocitaria como VAV-1 y PLCy, inhibiendo la activación de PKC θ.
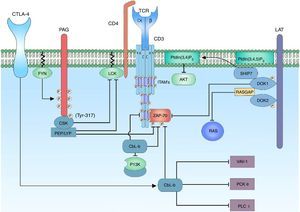
La regulación de la activación de las cinasas involucradas en la activación del linfocito T es fundamental para mantener un umbral de activación. Las enzimas C-terminal SRC kinase (CSK) son cinasas citoplasmáticas que fosforilan regiones involucradas en la regulación negativa de la familia de cinasas SRC. Es importante la proximidad de CSK a su sustrato y esto se logra gracias a su interacción con la proteína phosphoprotein associated with glycosphingolipid-enriched microdomain (PAG)101.
PAG, o también conocida como Csk-binding protein (CBP) es una proteína transmembrana ubicua con múltiples residuos de tirosina, que al ser fosforilados actúan como bolsillos de unión para proteínas que contengan dominios SH2; adicionalmente, posee 2 secuencias ricas en prolina que permiten la interacción con proteínas que contengan dominios SH3101,102. La característica de PAG en linfocitos T, a diferencia de las otras células, es su máximo punto de fosforilación cuando la célula se encuentra en reposo (en células diferentes de linfocitos T la unión de receptores de membrana con sus ligandos estimula la activación de PAG). Cuando la célula se encuentra inactiva, la fosforilación de PAG es mediada por la familia de cinasas SRC, específicamente por FYN101,103. El reclutamiento de CSK requiere la fosforilación de un sustrato de tirosina específico (Y317) de PAG, lo cual permite la unión de CSK a PAG por medio de su domino SH2; la unión de CSK a PAG no solo permite la proximidad de CSK a la membrana plasmática y, por ende, a su sustrato, si no que permite un cambio conformacional de la proteína y de este modo aumenta la actividad catalítica de la enzima104. Una vez CSK se encuentra en cercanía a LCK la fosforila en un sustrato de tirosina específico (Y505) permitiendo un cambio conformacional de la proteína a un estado cerrado y, por ende, sin actividad de cinasa. Cuando se da la activación del linfocito T, PAG es rápidamente desfosforilado resultando en la liberación de CSK de la membrana y este es secuestrado en el citoplasma por Ras GTPase-activating protein-binding protein 1 (G3BP); esto permite que se encuentre lejos de la sinapsis inmunológica104,105. Las enzimas candidatas de desfosforilar a PAG son CD45 o tyrosine-protein phosphatase non-receptor type 11 (PTPN 11)104,106 (fig. 5).
Docking protein 1 (DOK1/2) son adaptadores moleculares citoplasmáticos que están relacionados con la regulación negativa de la señal del TCR. DOK1/2 se unen a LAT junto con Phosphatidylinositol 3,4,5-trisphosphate 5-phosphatase 1 (SHIP1). SHIP1 hidroliza el fosfolípido del PtdIns (3,4,5) P3 para producir PtdIns (3,4) P2 y así regular la señal por medio de la interferencia del reclutamiento de proteínas que contengan el dominio PH como la proteína AKT o ITK53,107. DOK1/2 puede estar asociado con los ITAM fosforilados de las cadenas ζ y ¿, desplazando la unión de ZAP-70 a estas. También se ha demostrado que DOK1/2 contienen secuencias para los dominios SH2 y SH3, por lo cual se puede asociar a Ras GTPase activating protein (RASGAP)107. RASGAP es un atenuador de la activación de la proteína RAS, por lo que disminuye la señalización MAPK/ERK108. La unión de CSK a través de sus dominios SH2 a DOK1/2 puede estar involucrada en el reclutamiento para la inhibición de LCK107 (fig. 5).
Regulación negativa mediada por fosfatasas PTPN22Las fosfatasas de las tirosina cinasas (PTP) tienen un papel esencial, tanto en el mantenimiento del fenotipo activado de los linfocitos T, así como en la reversión del estado activado a un estado de reposo cuando termina la respuesta inmunitaria106. Cada PTP está formado por un dominio catalítico que posee preferencia al sustrato específico y dominios no catalíticos que están involucrados en la regulación de la actividad de fosfatasa. Dentro de los reguladores de la señal de activación se encuentra el producto del gen PTPN22, lymphoid-tyrosine phosphatase (LYP) expresado en humanos y su ortólogo murino PEP109. LYP/PEP es una fosfatasa de tirosina con expresión restringida a células hematopoyéticas, esta contiene un dominio de fosfatasa en su región N terminal, una región rica en prolinas y una región C-terminal altamente conservada entre su familia de fosfatasas llamado grupo PEST-PEP, un potente regulador negativo de la señal del TCR109. PEP actúa desfosforilando los residuos reguladores positivos de las proteínas FYN (Y417), LCK (Y394) y ZAP-70. Esta regulación negativa es posible gracias a su interacción con el dominio SH3 de la proteína CSK por sus secuencias patrón ricas en prolina110, mientras PEP desfosforila las tirosinas de las regiones reguladoras positivas de proteínas de la familia SRC, CSK fosforila las regiones reguladoras negativas de estas.
Alteraciones en el regulador de la señalización linfocitaria PTPN22 se han relacionado con múltiples enfermedades autoinmunes, incluyendo LES, artritis reumatoide, artritis juvenil idiopática, enfermedad autoinmune tiroidea, granulomatosis de Wegener, miastenia gravis, tiroiditis de Hashimoto, enfermedad de Graves, enfermedad de Addison, esclerosis sistémica, entre otras enfermedades109–111. Dentro de los estudios de la activación y transducción de la señal a través del TCR, se ha documentado el polimorfismo del gen PTPN22 (rs2476601; 1858C → T) y su relación con el LES. Este polimorfismo se caracteriza por la sustitución del aminoácido arginina por un triptófano en la posición 620 de secuencia de aminoácidos. Este cambio ocurre en la región proximal rica en prolina dominio de unión a SH3 del PTPN22. Esta porción rica en prolina es un importante sitio de unión para el dominio C-terminal de CSK, por lo cual este polimorfismo interrumpe la interacción entre PTPN22 y CSK; de esta forma, la supresión de la activación del linfocito T no se lleva a lugar. El efecto neto de este polimorfismo en la interacción entre PTPN22 y CSK para la generación de enfermedad autoinmune es tema de controversia y los mecanismos de acción propuestos están basados en modelos animales. Una explicación del papel del polimorfismo Trp620 en la patogénesis de la enfermedad autoinmune es la alteración en el balance de los linfocitos T efectores y los linfocitos T reguladores. Se sugiere que el balance entre los linfocitos T efectores promotores de enfermedad autoinmune y linfocitos T reguladores protectores es finamente regulado por la expresión o actividad de PTPN22111,112.
Alteraciones de las señales de activación de las células T en LESEl lupus eritematoso es un desorden autoinmune sistémico, crónico, potencialmente fatal. Los defectos pueden ocurrir en varias partes de la cascada inmune, resultando en presentaciones clínicas heterogéneas. A continuación, se describirán múltiples vías de señalización implicadas en la inmunopatogenia de la enfermedad.
Alteraciones en CD3La mayoría de los pacientes con LES tienen defectos en la expresión de las cadenas ζ del TCR, así como alteraciones en la fosforilación de estas. Las deficiencias en la fosforilación de las cadenas ζ del TCR tras la activación linfocitaria se ha observado en más del 78% de pacientes con lupus. Se han descrito múltiples mecanismos potenciales para explicar la disminución en la expresión113.
Estudios realizados por Tsuzaka et al. para investigar los mecanismos moleculares de la expresión reducida de las cadenas ζ del TCR aislaron el mRNA de las cadenas ζ en linfocitos T periféricos de 8 pacientes con LES. Por una parte, encontraron que 2 pacientes presentaron deleciones del exón 7 del mRNA de la cadena ζ; por otra parte, 6 pacientes presentaron mutaciones puntuales en el sitio de unión del GTP/GDP en el dominio 3 de ITAM que se acompañan de sustituciones de aminoácidos en el dominio 3 del ITAM114.
Se reconocen 3 dominios importantes del ITAM que al ser fosforilados son sitio de unión para proteínas tales como ZAP-70, actina, PI3K o Shk. Mutaciones de una o 2 tirosinas dentro del ITAM o que no se produzca la fosforilación, o solo monofosforilación, conlleva a alteraciones en la transducción de la señal. De esta observación es posible determinar que el mRNA aberrante del TCR es responsable de la disminución de la fosforilación y disfunción de la señal del TCR115.
La región no traducida 3’ de la cadena ζ del TCR (3’-UTR – unstranslate región 3’) ha demostrado que cumple un papel importante a nivel postranscripcional. El mRNA 3’-UTR tiene secuencias reguladoras en cis como lo son las secuencias ricas de adenosina-uridina que se unen a proteínas reguladoras trans y están implicadas tanto en la estabilización o desestabilización del transcrito. Análisis en el mRNA de las cadenas ζ han encontrado empalmes alternativos con pérdida de exones, así como inserciones en el transcrito115.
En el estudio de Chowdhury et al., determinaron que el mRNA de la cadena ζ del TCR presentaban un nuevo empalme alternativo con deleción de nucleótidos desde 672 a 1233 del exón viii de las cadenas ζ del mRNA. Este empalme (ζcDNA/AS-3’UTR) de 344 pb está expresado predominantemente en linfocitos T de pacientes con lupus comparado con controles sanos. Esta secuencia corta de 3’-URT es menos estable que la versión natural del mRNA; adicionalmente, tiene un mayor nivel de degradación en linfocitos T de pacientes con lupus, indicando que los linfocitos T de pacientes con lupus tienen factores adicionales que promueven la degradación de las cadenas cortas del empalme alternativo. Los resultados demuestran que la presencia de elementos reguladores en la región eliminada del empalme de 562 pb es requerida para la apropiada y eficiente traducción del mRNA116. Adicionalmente, la producción de esta cadena de empalme alternativo representa un mecanismo molecular que contribuye a la expresión disminuida de las cadenas ζ del TCR en pacientes con LES.
El Fc¿ receptor type I γ chain (Fc¿RIγ) es un miembro de la familia de proteínas de la cadena ζ, también es un componente de la región de los receptores de IgE de alta afinidad; contiene un ITAM citoplasmático que, a diferencia de la cadena ζ del CD3, media la señalización a través de la proteína cinasa SYK117. Como se mencionó previamente, SYK cinasa es 100 veces más potente que ZAP-70 y preferiblemente reclutada por Fc¿RIγ; de esta forma, al haber una disminución de las cadenas ζ del TCR hay un reemplazo por Fc¿RIγ; esto aumenta la actividad de SYK. La cinasa SYK es una proteína capaz de fosforilar ITAM independientemente de la actividad de SFK, a diferencia de ZAP-70, activando múltiples vías de señalización por medio de VAV, PLCγ, SLP76 y la unidad subreguladora PI3K. En pacientes con LES, respecto a controles sanos, se ha demostrado la interacción entre la proteína SYK con VAV y PLC, produciendo el aumento de las concentraciones de calcio intracelular y el aumento de las vías de señalización dependientes de calcio; otro cambio inducido por la señalización mediada por SYK es la polimerización de la actina118.
La IL-2 es un factor regulador muy importante en la respuesta del linfocito T; está involucrada en la modulación de la duración y la intensidad de la respuesta inmunitaria, también como factor de crecimiento para linfocitos T que se produce posterior a la estimulación del TCR. La IL-2 se ha caracterizado por ser un factor indispensable para la inducción de la tolerancia, generalmente a través de 2 mecanismos: activación de los mecanismos inducidos de muerte celular y por la inducción y mantenimiento de células T reguladoras. Como elemento clave en la modulación entre la respuesta inmunitaria proliferativa y la inducción de la tolerancia, IL-2 debe ser estrechamente regulada en orden para mantener la homeostasis en la respuesta inmunitaria119.
La búsqueda de los mecanismos responsables en los cambios en la síntesis de IL-2ha revelado una serie de alteraciones en el sitio de ocupación del factor de transcripción a nivel del promotor IL-2 de linfocitos T, obtenidas de pacientes con LES. El sitio –180ha demostrado ser especialmente importante en la desregulación de la transcripción de IL-2. Comprende un sitio de unión para CREB/CREM. Cuando CREB es fosforilado, actúa como un factor positivo que mejora la transcripción. Por otra parte, cuando CREM se activa, desplaza a pCREB y actúa como un represor transcripcional, evitando la unión de p300 y CBP. Los cambios en los niveles de CREM están asociados con el complejo enzimático activar calcio/calmodulina dependiente de quinasa IV (CaMKIV). Los niveles de esta cinasa son más altos en células T derivadas de pacientes con LES120,121.
Linfocitos Th17, IL-7 y lupus eritematoso sistémicoLa activación crónica de la respuesta inflamatoria en pacientes con LES conlleva a la liberación de múltiples citocinas que van a contribuir activamente a la inflamación y el daño tisular. Los diferentes subtipos de linfocitos T tienen la capacidad de secretar citocinas que ayudarán en la respuesta inflamatoria; de esta forma, los linfocitos Th1 son esenciales para controlar las infecciones por microorganismos intracelulares por medio de la secreción del IFN-γ, lo cual tiene la capacidad de activar macrófagos, mientras que los linfocitos Th2 producen IL-4, IL-5 e IL-13 que están involucradas en el control de parásitos y alérgenos por medio de la activación de eosinófilos. Existe otro subtipo de linfocitos, conocidos como Th17, los cuales producen IL-17; esta interleucina tiene múltiples efectos inflamatorios, entre estos, inducir la secreción de otras citocinas, quimiocinas, de múltiples linajes celulares incluyendo células epiteliales y fibroblastos. Promueve la proliferación, la maduración y el reclutamiento de neutrófilos a través de múltiples factores de crecimiento e IL-18, permite el reclutamiento de células inflamatorias, como macrófagos y otros linfocitos, así como la liberación de metaloproteinasas que causan destrucción del tejido conectivo122.
En pacientes con LES se ha documentado un aumento de los conteos celulares de Th17, así como de las concentraciones plasmáticas de IL-17; sin embargo, no ha sido posible relacionar los niveles de IL-17 con el nivel de actividad lúpica, indicando que esta interleucina está constitutivamente y establemente producida en pacientes con LES independiente de la actividad de la enfermedad123. Aunque los pacientes con LES tienen un aumento de la producción de IL-17, el papel de esta citocina en la patogénesis del lupus no se encuentra bien estudiado. La IL-17 puede inducir la producción de múltiples mediadores inflamatorios de células inmunes y no inmunes que pueden participar en la activación de células inflamatorias y en daño tisular.
ConclusionesLa activación del linfocito T es un proceso complejo con múltiples componentes que se relacionan entre sí; esta intricada maquinaria que inicia por el reconocimiento entre el TCR y un péptido montado sobre una molécula mayor de histocompatibilidad permite la activación de la familia de cinasas SRC, FYN y LCK, que fosforilan los residuos de tirosina de las secuencias ITAM presentes en las cadenas del CD3. Estos dominios fosforilados permiten la incorporación de ZAP-70, propagando de esta forma la señal a través de la fosforilación de la proteína de anclaje LAT que diversifica la señal reclutando nuevas cinasas. LAT propaga la señalización del TCR en 3 grandes vías importantes, la cascada MAP cinasa a través de GRB2 y GRAP, modificaciones en el citoesqueleto y liberación de calcio como segundo mediador por GADS. Estas distintas vías terminarán en la activación de múltiples promotores que facilitarán la síntesis de citocinas que actuarán como efectores de la respuesta linfocitaria. La regulación de la activación del linfocito T es importante para finalizar la activación y evitar estados de anergia o autoinmunidad. Entre los componentes reguladores de la activación del linfocito T está el correceptor CTLA-4, la ubiquitinación y degradación de proteínas claves en la activación, el reclutamiento de SHIP1 por DOK1/2 y la activación de PTPN22. La alteración en mecanismos de activación y regulación puede conllevar a procesos de autoinmunidad como el LES, un desorden crónico con manifestaciones clínicas heterogéneas. Se han descrito cambios clave, como alteraciones en la fosforilación o defectos en la expresión de las cadenas ζ del TCR, alteración en la expresión en los subtipos de linfocitos predominando los linfocitos Th17 con una elevación en IL-17 o cambios en proteínas claves para la transducción de la señal, como el cambio de las cadenas ζ del CD3 por Fc¿RIγ que generarán señales aberrantes en la activación linfocitaria.
Una vez conocido el mecanismo de activación normal del linfocito T, los mecanismos de señalización celular y la regulación de las vías de transmisión, podemos entender la patogenia de la enfermedad autoinmune y la heterogeneidad de las manifestaciones clínicas que la caracteriza. Adicionalmente, dicho conocimiento nos ha permitido hacer uso de elementos clave en señalización linfocitaria en búsqueda de herramientas diagnósticas con nuevos biomarcadores que permitan hacer un seguimiento de la enfermedad, su actividad y la investigación de nuevas dianas terapéuticas.
Selección de la informaciónPara la realización de un artículo de revisión narrativo se realizó la búsqueda a través de la base de datos PubMed, usando los términos: “T cell activation”, “TCR signals”, “Inmune cell signaling in lupus”, “pathogenesis of systemic lupus”, “Signal transduction TCR”, “ITAM AND TCR”, “T cell AND SYK”, “ZAP-70 AND TCR”, “TCR structure”, “Regulation activation TCR”, “TCR AND autoimmunity”, “Lipid rafts AND T cell”. Se seleccionaron artículos entre los años 1945 hasta 2017, artículos en inglés y español, y de tipo como review, clinical trial, research, editorials, opinion. Se seleccionaron aquellos artículos que explicaran la vía de señalización linfocitaria, así como aquellos estudios que estuvieran relacionados con alteraciones en la activación del linfocito T y la patogenia del LES. De los artículos seleccionados, se identificaron las referencias de aquellos temas que se deseaban profundizar; posteriormente, se revisó el abstract y se determinaba si era pertinente o no para la revisión. También se seleccionaron artículos por medio de la opción de PubMed «similar article».
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos a Daniela Alejandra Gordillo por la realización de los gráficos y por su participación en la elaboración del manuscrito.