El lupus eritematoso sistémico es una enfermedad autoinmune sistémica de severidad variable, con tendencia a presentar brotes en el trascurso de su evolución. Sin tratamiento, la nefritis lúpica sigue siendo una de las principales causas de enfermedad renal en etapa terminal y también se asocia con un aumento en la morbimortalidad. En la actualidad, el tratamiento de inmunosupresión estándar (ciclofosfamida o micofenolato) ha logrado preservar de forma significativa la función renal y mejorar la supervivencia. Infortunadamente, un subconjunto de pacientes con nefritis lúpica no responde al tratamiento de inmunosupresión inicial y se define como refractario, lo cual constituye un gran desafío debido a la escasa evidencia de terapias alternativas fundamentadas en ensayos clínicos controlados, en ocasiones con resultados desfavorables. En este escrito se presenta una actualización de las terapias disponibles referentes a nefritis lúpica refractaria.
Systemic lupus erythematosus is a systemic autoimmune disease of variable severity with a tendency to flare up during its course. Without treatment, lupus nephritis remains one of the main causes of end-stage renal disease and is also associated with an increase in morbidity and mortality. Currently, standard immunosuppression treatment (cyclophosphamide or mycophenolate) has managed to significantly preserve kidney function and improve survival. Unfortunately, a subset of patients with lupus nephritis do not respond to initial immunosuppression treatment and is defined as refractory, constituting a great challenge given the scarce evidence of alternative therapies based on controlled clinical trials and that sometimes obtain unfavorable results. We also provide an update on the available therapies for refractory lupus nephritis.
El lupus eritematoso sistémico (LES) es una enfermedad autoinmune sistémica de severidad variable, con tendencia a presentar brotes en el trascurso de su evolución. Las alteraciones inmunológicas, particularmente la producción de diversos anticuerpos antinucleares, son una de sus características determinantes. En su fisiopatología intervienen tanto el sistema inmune innato como el adaptativo, así como la interacción entre genes con factores ambientales que causan alteraciones inmunológicas sostenidas contra ácidos nucleicos autólogos1. El daño tisular atribuido a la enfermedad es causado por autoanticuerpos o depósito de complejos inmunes, principalmente en los riñones, el corazón, los vasos sanguíneos, el sistema nervioso central, la piel, los pulmones, los músculos y las articulaciones, lo que conlleva una morbilidad significativa y un aumento de la mortalidad2.
El LES tiene un marcado predominio femenino, con casi 10 pacientes mujeres por cada hombre afectado por la enfermedad. La incidencia varía entre 0,3 y 31,5 casos por 100.000 individuos por año y ha aumentado en los últimos 40 años, probablemente debido al reconocimiento de casos más leves. La prevalencia en todo el mundo incluso supera los 50-100 casos por 100.000 adultos3. En Colombia se ha estimado una prevalencia promedio de 8,77/10.000 habitantes desde el 2012 hasta el 2016, siendo más frecuente entre los 45 y los 49 años. Así mismo, se ha calculado una relación mujer: hombre de 8,07:1, en tanto que los departamentos con mayor prevalencia en orden descendente son: Bogotá, Antioquia y Valle del Cauca4. La gravedad de la enfermedad varía según el origen étnico y es más severa en pacientes con ascendencia africana y en latinoamericanos.
En una cohorte de pacientes con LES de reciente diagnóstico se produjo NL en el 38% de los casos, durante una media de seguimiento de 4,6 años5. Los pacientes más jóvenes, especialmente hombres con títulos altos de anti-DNA o actividad moderada a severa por índices de actividad validados, tienen un mayor riesgo de presentar compromiso renal6. Según la cohorte Gladel (Grupo Latinoamericano de Estudio del Lupus), la NL está presente en el 52% de los pacientes con LES en Latinoamérica, y en Colombia se ha descrito que hasta el 55% desarrolla compromiso renal7.
Es de resaltar que la NL es la manifestación orgánica grave más frecuente del LES. Su presentación clínica se manifiesta por proteinuria (> 0,5g por día) o una relación proteína/creatinina en orina> 0,5mg/mg, o proteína urinaria> 3+por análisis con tira reactiva8. Infortunadamente, cerca del 35% de los pacientes con NL no responde al tratamiento de inmunosupresión inicial y se define como refractario, lo cual constituye un gran desafío debido a la escasa evidencia de terapias alternativas fundamentadas en ensayos clínicos controlados, en ocasiones con resultados desfavorables9. Esta revisión se centra en describir y actualizar los tratamientos de la NL refractaria.
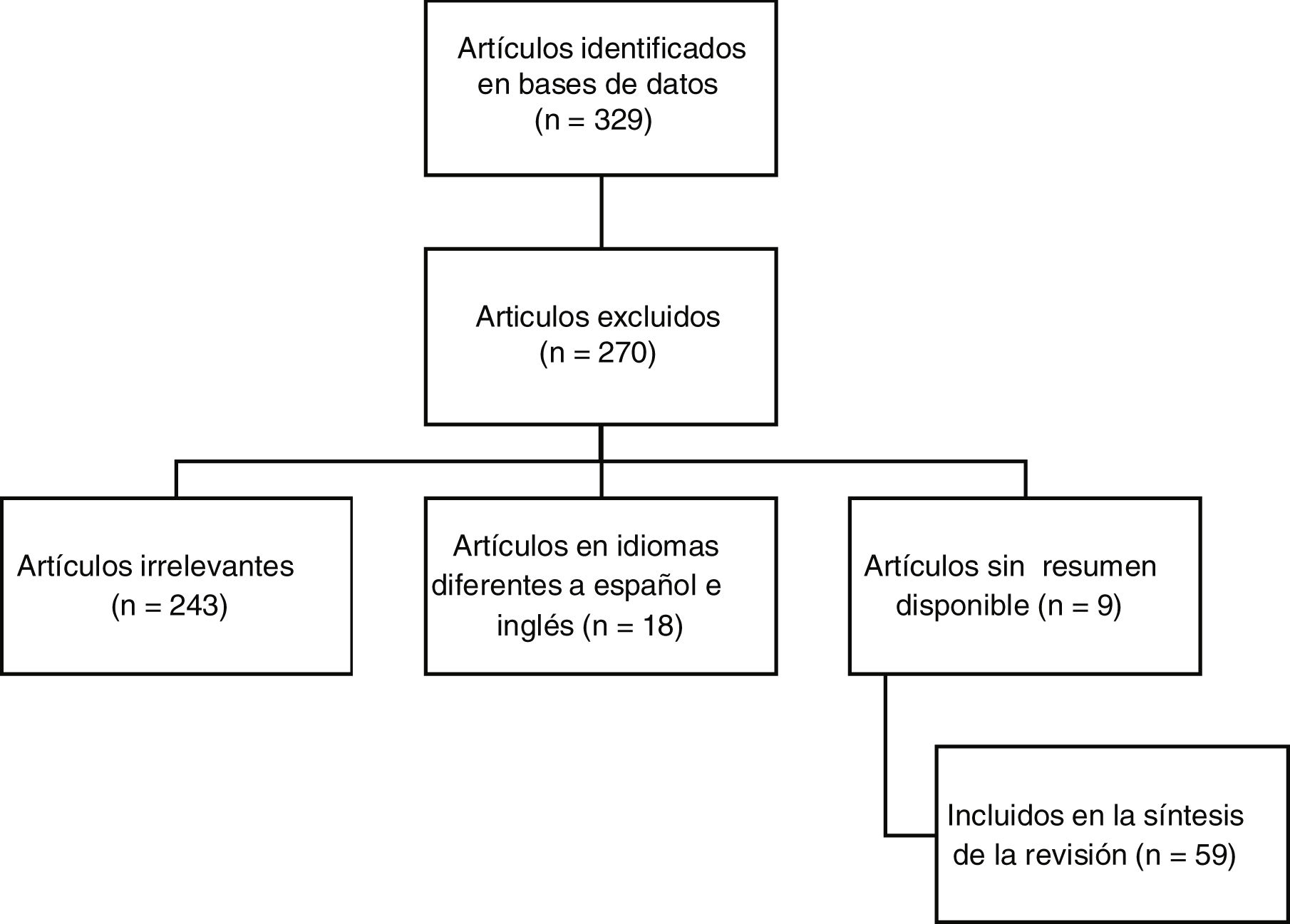
MetodologíaSe realizó una revisión narrativa no sistemática de la literatura en inglés y español, de acuerdo con el objetivo de tener la información más actualizada disponible para los artículos referenciados desde el 2019, en bases de datos primarias como: Pubmed, Embasey y Lilacs. Los términos medical subject headings utilizados fueron: «nefritis lúpica refractaria», «tratamiento» y «tratamiento de la nefritis lúpica proliferativa focal o difusa resistente o recidivante», los cuales se combinaron utilizando operadores booleanos (AND,OR). En la figura 1 se presenta un diagrama de flujo que detalla la estrategia de búsqueda.
Definiciones para evaluar la respuesta al tratamientoLos pacientes que no logran una respuesta al tratamiento de inmunosupresión inicial se definen como refractarios o resistentes. Cabe resaltar que la verdadera resistencia es muy infrecuente y por lo general ciertos casos se clasifican de forma equivocada, particularmente los que no logran adherencia completa o presentan dificultades para continuar el régimen de tratamiento prescrito. En la actualidad, no existe ningún consenso sobre una clara definición de respuesta completa con el tratamiento inmunosupresor en pacientes con NL proliferativa. Debido a ello, la incidencia de NL refractaria es variable. Las directrices EULAR/ERA-EDTA definen a la enfermedad refractaria como la ausencia de mejoría en 3-4 meses, no lograr una respuesta parcial después de 6 a 12 meses, o una respuesta completa después de 2 años de tratamiento10,11.
La respuesta completa, que puede tardar hasta 3 años en lograrse, se caracteriza por un sedimento urinario inactivo, disminución de proteinuria a<0,5g/día y creatinina normal o estable12. Debido a esto, las recomendaciones ACR sugieren mantener la continuidad del tratamiento con el régimen de inducción elegido durante otros 6 meses antes de considerar su cambio, a diferencia de lo planteado por las guías Eular/ERA-EDTA, que están a favor de un cambio más temprano (en los primeros 3 meses) puesto que el daño renal es irreversible. La respuesta parcial se refiere a una reducción de la proteinuria> 50% a un rango no nefrótico (< 3,5g/día), un sedimento urinario inactivo y una creatinina normal, que por lo general se alcanza después de 6 a 12 meses de tratamiento13,14.
Se ha considerado repetir la biopsia renal si la respuesta al tratamiento inmunosupresor no es clara, específicamente cuando conlleva un cambio en la intervención terapéutica. Sin embargo, definir la respuesta por la proteinuria o por biopsia puede resultar en clasificar equivocadamente a algunos pacientes como refractarios, dado que muchos de ellos pueden tener presentaciones tardías o avanzadas de la enfermedad y no tener el potencial para alcanzar la remisión debido al daño renal crónico.
El enfoque terapéutico para los pacientes que se consideran resistentes a la terapia inicial, es decir, aquellos que tienen evidencia clínica o histológica de nefritis activa, varía con el medicamento utilizado para la inducción y la gravedad de la enfermedad. Los que no alcanzan la remisión después de 6 meses con ciclofosfamida se cambian a micofenolato, o viceversa15. Se han planteado otras opciones terapéuticas como los inhibidores de calcineurina, la plasmaféresis o el trasplante de células madre mesenquimales, y un reporte de caso informa un resultado favorable de las células TCAR dirigidas a CD1916. A continuación, se describe cada uno de estos tratamientos de acuerdo con los niveles de evidencia disponibles en la actualidad.
RituximabEl rituximab se ha considerado una de las primeras alternativas de tratamiento cuando hay falla terapéutica al micofenolato y a la ciclofosfamida. Sin embargo, la evidencia en la NL refractaria proviene de estudios de etiqueta abierta, lo que causa cierta incertidumbre referente a su eficacia. A pesar de esto, ha mostrado resultados favorables en ciertos estudios de cohorte en los cuales el tratamiento ha sido efectivo en distintas etnias y para las diferentes definiciones de NL refractaria17–19. Adicionalmente, se han presentado muchas diferencias con respecto al método de evaluación de la respuesta al rituximab, ya que en algunos estudios se utilizó el índice de actividad SLAM, mientras que en otros se empleó el British Lupus Isles Assessment Group Index (Bilag) o el Systemic Lupus Erythematosus Disease Activity Measure (Sledai)20.
De acuerdo con un metaanálisis, el seguimiento medio de los pacientes ha sido de 60 semanas, y el rituximab ha logrado una sorprendente tasa de respuesta general del 74% en los casos refractarios. Los autores de este estudio demostraron una mejor tasa de respuesta (ya sea completa o parcial) en la NL clase III, pero menos frecuente en las clases IV y V21, en tanto que otro metaanálisis estimó una tasa de respuesta completa del 51% y parcial del 27%22. Ha habido cierta variabilidad en los regímenes de tratamiento empleados, pero en general se ha aplicado el protocolo para el tratamiento del linfoma (375mg/m2 semanales durante 4 semanas) o el protocolo basado en artritis reumatoide (1.000mg los días 1 y 15), con ligeras modificaciones en algunos casos.
El estudio RING (NCT01673295) es un ensayo clínico internacional aleatorizado que recluta a pacientes con el objetivo de probar la eficacia para lograr una respuesta renal completa en pacientes con NL con proteinuria persistente (≥ 1g/día) con al menos 6 meses de terapia estándar. En Colombia, se describió una cohorte de 42 pacientes con LES severo y refractario tratados con rituximab, después de la falta de respuesta a los glucocorticoides y al menos otro medicamento inmunosupresor.
Se observó una reducción en el requerimiento de glucocorticoides y desde el primer seguimiento a los 3 meses, el 28% alcanzó la remisión completa y el 36% la remisión parcial, según la proteinuria. Estos criterios de respuesta se mantuvieron durante 12 meses23. En conjunto, toda esta evidencia apoya firmemente el uso de rituximab en pacientes no suficientemente controlados con el tratamiento inicial. Dado el papel determinante que desempeñan las células B en la patogenia de la enfermedad, y los resultados que se han mostrado hoy en día, se sigue haciendo investigaciones centradas en la depleción de las células B como uno de los objetivos principales de tratamiento.
BelimumabSe ha demostrado que un aumento del BAFF se asocia con una recaída temprana de la enfermedad (habitualmente en menos de 1 año). En general, se ha descrito un aumento significativo de los niveles de BAFF después del tratamiento con rituximab, mientras que después de 6 a 8 meses, cuando la repoblación de células B estaba en curso, los niveles de BAFF disminuyeron hasta alcanzar niveles basales24. Este hallazgo sugiere que la depleción de células B por sí sola no logra alcanzar la respuesta clínica esperada y que la combinación con la inhibición del BAFF podría tener un efecto sinérgico. Adicionalmente, la terapia secuencial con rituximab y belimumab se ha empleado con éxito en varios pacientes con NL refractaria y puede ser un enfoque terapéutico prometedor, particularmente en los pacientes que presentan recaídas tempranas25,26.
Además de la reducción de los niveles del BAFF, la combinación de rituximab y belimumab ha mostrado disminuir de forma significativa la formación de trampas extracelulares de neutrófilos27. Hasta la fecha el único estudio publicado es el BEAT-Lupus, en el cual los 52 pacientes que lo conformaban recibieron rituximab para la nefritis lúpica y se dividieron en los grupos de belimumab y placebo. No hubo restricciones en cuanto al uso de prednisolona o medicamentos inmunosupresores para los pacientes que ingresaron al estudio. El criterio de valoración principal fue la disminución de los niveles de anticuerpos anti-ADN bicatenario a las 52 semanas. El estudio cumplió su criterio de valoración con una disminución de los niveles de anticuerpos anti-dsDNA a las 12 semanas (media de 86 frente a 108 UI/ml, p=0,004), 24 semanas (69 frente a 99, p <0,0001) y 52 semanas (47 frente a 193, p=0,0003).
También se observó una disminución de los brotes graves (Bilag A) (3 brotes graves frente a 10 con placebo, HR 0,27, p=0,032). El tiempo hasta el primer brote moderado o grave (Bilag A o 2B) tuvo una tendencia hacia la mejoría, sin significación estadística (8 brotes frente a 14, p=0,14). Los datos de seguridad fueron similares en ambos brazos del estudio28. El estudio BLISS Believe propone un diseño para establecer la superioridad del belimumab en las combinaciones planteadas de los tres brazos de tratamiento (placebo, rituximab o tratamiento estándar), lo que permite una mejor observación a largo plazo de una verdadera remisión clínica y su durabilidad, así como evaluar con más precisión los aspectos de seguridad del medicamento (se espera su publicación definitiva)29.
En el estudio Calibrate, la adición de belimumab a un régimen de tratamiento con rituximab y ciclofosfamida fue segura en pacientes con NL refractaria. Este régimen disminuyó la maduración de las células B de transición a vírgenes maduras durante su reconstitución y mejoró la selección negativa de células B autorreactivas. La eficacia clínica no mejoró, sin embargo, el estudio no tuvo el poder estadístico suficiente para evaluar la eficacia del belimumab y fue diseñado principalmente para evaluar su seguridad30. Es importante resaltar que el riesgo de progresión a enfermedad renal en etapa terminal en pacientes con NL clase IV es cercano al 30%, por lo que la evidencia creciente de estas terapias resulta ser muy prometedora para evitar este desenlace31. Se desconoce, en caso de tener alguna contraindicación a la administración de rituximab, si el tratamiento con otros anti-CD20 como obnituzumab y ofatumumab puede obtener los mismos resultados, aunque este último se ha utilizado con éxito en un paciente con NL refractaria potencialmente mortal32.
Inhibidores de la calcineurinaLa evidencia de los inhibidores de calcineurina también ha tenido cambios importantes en cuanto a su eficacia y seguridad en la NL refractaria. Los inhibidores más representativos dentro de este grupo son la ciclosporina y el tacrolimus. Estos dos fármacos se han estudiado extensamente en la NL, especialmente en Asia, con evidencia creciente de su eficacia en la NL refractaria. La ciclosporina se une a su receptor citoplasmático, la ciclofilina, y el complejo fármaco-receptor resultante se une a la calcineurina e interfiere con la producción de IL-2, lo que conduce a una inhibición selectiva y reversible de la respuesta inmunitaria mediada por linfocitos T. Además de su potente acción inmunosupresora, se ha demostrado que la ciclosporina tiene efectos antiproteinúricos directos. Este último mecanismo se relaciona con la estabilización de actina en los podocitos33.
El tacrolimus se une a un receptor citoplasmático diferente, la proteína de unión a la FK-12, que luego tiene interacción con la calcineurina34. Es de resaltar que este grupo de medicamentos logra reducir la proteinuria empleando mecanismos no inmunes, los cuales implican un gran sesgo con respecto la interpretación equivocada de una respuesta clínica favorable. Adicionalmente, los niveles de proteinuria se han tomado como uno de los criterios de valoración principal en varios de sus estudios, por lo que la interpretación de una respuesta renal debe evaluarse junto con otras variables como los niveles de creatinina y el sedimento urinario. En un estudio prospectivo aleatorizado abierto para el tratamiento de inducción de NL se investigó la terapia «multitarget», la cual comprende glucocorticoides, tacrolimus y MMF, y se demostró que esta es superior a la ciclofosfamida intravenosa en la inducción de la remisión a los 6 meses. La diferencia observada se atribuyó principalmente a una mejor respuesta de la NL de clases IV y V o IV/V combinada35.
Cabe resaltar que muchos pacientes habían recibido ciclofosfamida o micofenolato antes de la aleatorización y la gran mayoría recibió dosis intermedia de glucocorticoides. La tasa de remisión renal completa en el análisis por intención de tratar fue significativamente mayor (50% frente a 5%) en el grupo de terapia «multitarget», mientras que la respuesta parcial no difirió entre ambos grupos de tratamiento36. En un estudio observacional prospectivo en China se adicionó tacrolimus (2 o 3mg, según el peso corporal) al tratamiento en 26 pacientes resistentes a la ciclofosfamida. La respuesta completa se observó en un 38,5% y la parcial en un 50%, acompañándose de un descenso en la proteinuria de 6,9g/día a 1,11g/día, junto con una disminución significativa del Sledai. Curiosamente, los pacientes clasificados como no respondedores tenían NL clase III en la biopsia renal37.
La respuesta de los casos refractarios (clases IV y V o IV/V combinada) también se observó en un estudio coreano, con una tasa de respuesta del 78%. La proteinuria disminuyó de una relación creatinina/proteína basal de 2,19 a 0,44g/g de creatinina, después de 12 meses. A pesar de estos resultados favorables, la dosis media de prednisolona se mantuvo superior a 10mg/día en el último seguimiento38. De acuerdo con las observaciones de la eficacia del tacrolimus, el tratamiento con ciclosporina A también ha llegado a tener buenas tasas de respuesta en NL refractaria. Se ha descrito una serie de 6 casos refractarios con NL que recibieron ciclosporina A, debido a que no lograron la remisión después de micofenolato (2-3g por día). La adición de ciclosporina A (2,6 a 3,7mg/kg/día) condujo a una reducción de la proteinuria de 2,4g/día a 0,5g/día. Cuatro pacientes lograron una remisión completa, uno tuvo una remisión parcial y el otro no alcanzó ninguna respuesta39.
Aunque numerosos estudios han demostrado que los inhibidores de la calcineurina tienen un buen perfil de seguridad, vienen a consideración algunas advertencias. La primera de ellas es que su efecto hemodinámico intrínseco (disminución de la tasa de filtración glomerular por vasoconstricción intrarrenal) podría conducir a lesión renal aguda o incluso llevar a una nefrotoxicidad crónica irreversible40. La segunda es la dificultad del ajuste de la dosis, ya que su concentración en sangre debe monitorearse por niveles. La tercera es que la hipertensión y la hiperglucemia son complicaciones importantes inherentes a su continuidad41. Finalmente, el síndrome hemolítico urémico secundario, debido al daño endotelial directo, puede llegar a ser un evento adverso potencialmente mortal42. Un nuevo inhibidor de la calcineurina, la voclosporina, ha demostrado recientemente su eficacia sobre el placebo en un estudio clínico de fase II y probada en un estudio de fase III (Aurora 1), siendo otra opción prometedora para el tratamiento de la NL refractaria43.
Terapia extracorpórea, plasmaféresis e inmunoadsorciónLa evidencia de la terapia extracorpórea como la plasmaféresis y la inmunoadsorción en la NL refractaria es mínima, dado que se basa principalmente en reportes de caso y estudios observacionales. Un estudio controlado-aleatorizado, realizado por el Lupus Nephritis Collaborative Study Group, examinó la eficacia de la plasmaféresis cuando se agregó a la terapia estándar en pacientes con NL grave sin lograr una mejoría en los desenlaces clínicos44. La evidencia científica más consistente sugiere que la adición de la terapia extracorpórea podría ser eficaz en el tratamiento de mujeres embarazadas con signos de enfermedad activa, síndrome antifosfolípido o en NL refractaria45,46.
La inmunoadsorción ha reemplazado a la plasmaféresis en muchos países, debido a que los pacientes presentan menos efectos sistémicos y eventos adversos secundarios, especialmente hemorragias, complicaciones anafilácticas e infecciones potencialmente mortales47–49. Adicionalmente, tiene ventajas en la eliminación de anticuerpos específicos, como se ha demostrado en un gran estudio observacional50. Dentro de los estudios más representativos, se describe uno que incluyó a 8 pacientes con enfermedad refractaria, los cuales se sometieron a inmunoadsorción, recibían ciclofosfamida y lograron una mejoría en los niveles de proteinuria y creatinuria51. La terapia extracorpórea podría ser una opción razonable en pacientes con un curso de la enfermedad refractario o en los que tienen una contraindicación absoluta de la intensificación del tratamiento convencional, particularmente aquellos que presentan una infección severa en el mismo momento del brote renal.
Trasplante de células madre mesenquimalesEn algunos estudios se ha empleado el trasplante alogénico de células madre mesenquimales (CMM) con buenos resultados. Las CMM tienen funciones inmunomoduladoras, incluida su capacidad para estimular la diferenciación y la proliferación de células T reguladoras52. En un estudio se hizo el trasplante de CMM en 15 pacientes con NL refractaria. Después de 12 meses de seguimiento, la proteinuria disminuyó de 2.505mg/día a 858mg/día. Junto con este resultado también se observó una mejoría significativa del Sledai, con una disminución de 12,2 a 3,2 en el mismo periodo de observación. No hubo efectos secundarios potencialmente mortales después del procedimiento, a diferencia de lo que sucede en el trasplante autólogo de células madre53.
En un estudio de seguimiento del mismo grupo se estableció una tasa de remisión del 60,5% y una tasa de recaída del 22,4%54. Otro estudio multicéntrico posterior que incluyó a la mayoría de los pacientes con NL informó la remisión y una respuesta clínica parcial en el 27,5% y en el 32,5%, respectivamente. La tasa de supervivencia general durante el periodo de seguimiento a 12 meses fue del 92,5%, sin ninguna muerte relacionada con el procedimiento55. A pesar de ser una terapia bastante prometedora, en Colombia se requiere más experiencia, desarrollo tecnológico y personal altamente calificado para aplicarla de forma sistemática.
Terapia inmunosupresora alternativaExisten pocos datos de tratamientos alternativos, se ha descrito que la mizoribina, un inmunosupresor que inhibe la inosina monofosfato deshidrogenasa, se empleó en una serie japonesa de 17 pacientes con NL resistente. Se pudo observar una disminución en la excreción urinaria de proteínas de 194 a 114mg/dl después de 24 meses56. También se describe una serie de 7 pacientes con NL que presentaron falla a la ciclofosfamida, por lo que se indicó tratamiento adicional con dosis altas de inmunoglobulina (1 a 6 ciclos de 400mg/kg por 5 días), y se logró una disminución importante en la proteinuria en el seguimiento a 6 meses, acompañado de un aumento en la albúmina y disminución del colesterol sérico57.
Las terapias emergentes no han logrado buenos resultados y en muchos estudios se han excluido pacientes con NL (como en los casos de abatecept y epratruzumab). El estudio TULIP-LN1, que examina la eficacia de anifrolumab en LN proliferativa activa, está en curso (NCT02547922) en espera de obtener resultados favorables. En la tabla 1 se presentan los estudios clínicos en curso más representativos.
Estudios clínicos en curso
| Nombre | Tipo de estudio | Número de pacientes | Fecha de inicio | Objetivo |
|---|---|---|---|---|
| RING | Intervención | 194 | Noviembre del 2014 | Probar si el RTX es eficaz para lograr una RNC completa a pesar de 6 meses de tratamiento con CYC o MMF |
| TULIP-LN1 | Intervención | 147 | Noviembre del 2015 | Evaluar la eficacia y la seguridad de un régimen de tratamiento IV de 2 dosis de anifrolumab junto con CYC o MMF versus placebo |
CYC: ciclofosfamida; MMF: micofenolato; RNC: respuesta renal completa; RTX: rituximab.
Las medidas de apoyo generales en todos los pacientes con NL focal o difusa incluyen restricción de sodio y proteínas en la dieta, control de la presión arterial, minimización de la proteinuria con inhibidores del sistema renina-angiotensina-aldosterona, uso de antimaláricos (salvo que exista alguna contraindicación) y tratamiento de la dislipidemia58. Adicionalmente, algunos pacientes pueden presentar microangiopatía trombótica concomitante. Las causas potenciales de microangiopatía trombótica en pacientes con LES incluyen la púrpura trombocitopénica trombótica, la mediada por el complemento y la nefropatía por el síndrome de anticuerpos antifosfolípido42. Se debe considerar la exclusión de estos diagnósticos diferenciales o la progresión a una NL membranosa antes de evaluar la refractariedad al tratamiento, ya que ambas entidades pueden requerir enfoques de tratamiento completamente diferentes.
Finalmente, en la figura 2 se describe cómo se clasifica un paciente como refractario, mientras que en la figura 3 se expone el orden jerárquico del tratamiento de la NL refractaria. Además, en la tabla 2 se presentan los artículos más relevantes que sustentan las recomendaciones de las líneas de tratamiento mencionadas en la figura 3.
Artículos más representativos para establecer las líneas de tratamiento en orden jerárquico
| Autor y año | Tipo de estudio | Fármaco | Comentario | Referencia |
|---|---|---|---|---|
| Weidenbusch et al. / 2013 | Metaanálisis | Rituximab | Logró demostrar una sorprendente tasa de respuesta general (74%) | 21 |
| Jones et al. / 2019 | Estudio clínico (fase II) | Belimumab | Único estudio clínico realizado en NL refractaria posterior al tratamiento con rituximab | 28 |
| Bao et al. / 2008 | Estudio clínico de etiqueta abierta | Tacrolimus | Demostró superioridad a la CYC en la inducción a 6 mesesPresentó limitaciones importantes (sesgos de selección) | 36 |
| Liang et al. / 2010 | Estudio piloto de intervención | CMM | Mejoría notable en los niveles de proteinuriaDisminución significativa en el puntaje de Sledai | 53 |
| Kronbichler et al. / 2016 | Revisión sistemática | Terapia extracorpórea | Útil en escenarios particulares:SAFEmbarazo con contraindicación a otros tratamientosInfección activa | 46 |
| Levy et al. / 2000 | Serie de casos | Inmunoglobulina | Indicada en pacientes con falla a la CYCMejoría en los niveles de proteinuria y otras variables de riesgo CV | 57 |
CMM: células madre mesenquimales; CV: cardiovascular; CYC: ciclofosfamida; SAF: síndrome antifosfolípido; Sledai: Systemic Lupus Erythematosus Disease Activity Index.
En la actualidad se conocen tratamientos novedosos con buenos resultados clínicos, como se expone en el caso de la terapia secuencial con rituximab y belimumab, dado que presentan mejores perfiles de eficacia y seguridad. De acuerdo con la evidencia disponible, estos medicamentos se consideran la primera línea de tratamiento en la NL refractaria. Se prefieren particularmente en los casos de NL clase III, aunque pueden ser de utilidad en casos más graves o de presentación tardía. A diferencia del rituximab y el belimumab, los inhibidores de la calcineurina han mostrado mejores tasas de respuesta en los estadios avanzados de la enfermedad (NL clase IV y V o IV/V combinada) con mayores reducciones en los niveles de proteinuria.
Se debe tener en cuenta que la proteinuria en estos casos puede no reflejar de forma precisa la actividad renal, ya sea por el daño crónico e irreversible del glomérulo, o por el efecto antiproteinúrico directo de este grupo de medicamentos. Una gran limitante es que su mayor evidencia proviene de pacientes asiáticos, lo que impide en gran medida la extrapolación de sus resultados. Añadido a esto, se ha demostrado previamente que las respuestas a los diferentes tratamientos varían según el origen étnico, y puede que los resultados no sean reproducibles en pacientes de ascendencia africana o latinoamericana. Otras dificultades importantes es que los pacientes requieren un seguimiento acucioso de la función renal, niveles del fármaco y vigilancia de otras comorbilidades como la diabetes y la hipertensión, que se pueden agravar por sus efectos secundarios. La terapia extracorpórea podría ser una opción en pacientes con curso refractario o en los que tienen una contraindicación absoluta a la intensificación del tratamiento convencional, como en el caso de una infección activa.
El trasplante de CMM parece ser un tratamiento prometedor y seguro, con muy pocos efectos secundarios. A diferencia del trasplante autólogo de células madre, se requieren estudios con mayores niveles de evidencia para implementarla de forma sistemática. Por su parte, los estudios disponibles de terapias inmunosupresoras alternativas han sido muy desalentadores. De acuerdo con los datos actuales, es posible que la inmunoglobulina tenga algún beneficio, sin embargo, en la serie descrita se han requerido ciclos prolongados, con un aumento en los costos de forma exponencial. Se espera que el anifrolumab pueda llegar a tener buenos resultados en la NL para posteriormente considerarlo en estudios de NL refractaria.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.