Colombia está viviendo 2 fenómenos importantes, las transiciones demográfica y epidemiológica, los cuales se ven reflejados en un proceso acelerado de enveje cimiento poblacional que, a su vez, aumenta la prevalencia de enfermedades crónicas, entre ellas la artritis reumatoide (AR). De acuerdo con la edad de aparición, la AR se clasifica en 2 subgrupos: la enfermedad reumatoide de aparición temprana y la AR de aparición tardía (en pacientes > 65 años). Anteriormente, se pensaba que la diferencia más importante entre los 2 subgrupos era que la AR de aparición tardía tenía un mejor pronóstico que la enfermedad reumatoide de aparición temprana. En la actualidad, se han descrito las diferencias que existen entre estas 2 formas de presentación de la AR. A través de este artículo se describirán las principales diferencias que existen en cuanto a la epidemiología, patogenia, manifestaciones clínicas, tratamiento, pronóstico y funcionalidad de los pacientes con AR de presentación temprana y tardía.
Colombia is experiencing two major phenomena, a demographic and an epidemiological transition, which is reflected in an accelerated process of population aging. This, in turn, increases the prevalence of chronic diseases, of which rheumatoid arthritis is one of them. According to the age of onset, it is classified into two subgroups: younger onset RA or YORA, and late onset RA or EORA (onset at 65 years or older). It was previously thought that the most important difference between the two subgroups was that EORA had a better prognosis than YORA. The differences between these two diseases has currently been described. This article presents the main differences as regards the epidemiology, pathogenesis, clinical manifestations, treatment, prognosis, and functioning of patients with RA of early and late presentation.
Actualmente, la sociedad colombiana está siendo testigo de un fenómeno sociodemográfico: el envejecimiento poblacional, un aumento gradual de la población > 65 años, que para 1980 se estimaba en 5,6, 6,8% para el año 2000 y 12,8% para 20251.
Según estimaciones de la Organización de las Naciones Unidas, el número de personas mayores de 60 años en el mundo pasará de 600 millones en 2000 a 1.200 millones en 2025 y a casi 2.000 millones en 2050. Durante esos 50 años, se espera que la proporción de personas de 60 años y más se duplique en el mundo, pasando del 10% actual a cerca del 21%, mientras en los países en vía de desarrollo este porcentaje crecerá de forma más acelerada, incluso hasta llegar a cuadruplicarse durante el mismo período2.
En el contexto regional, de 48 millones de adultos mayores que habitaban en América Latina en 2005 (8,8% de la población latinoamericana), pasaremos a 114,5 millones en 2030 (16,3% de la población). Es recurrente, en las distintas proyecciones consultadas, que en los países en vía de desarrollo, el crecimiento de la población mayor de 60 años sea más acelerado con respecto al de los países desarrollados3. Específicamente, en el caso de Colombia, se observa el mismo fenómeno, pero de alguna manera, acentuado. Durante los últimos treinta años, la población colombiana creció a una tasa promedio anual de 1,69%, mientras que los adultos mayores lo hicieron al 3,26%, en contraste con América Latina, en donde la población total creció en promedio 1,83% anual y la población mayor de 60 años creció a un ritmo promedio de 2,89% anual.
En 2005, año en que se realizó el último censo de población, Colombia contaba con 3.777.900 adultos > 60 años, esto es, cerca del 9% de los 42.090.500 habitantes del país; esta cifra sobrepasa en más de 1,5% las proyecciones del Centro Latinoamericano y Caribeño de Demografía, que en julio de ese mismo año publicó en su boletín demográfico N.° 76 un cálculo cercano al 7,4% de personas mayores de 60 años para Colombia en 2005. Es decir, que la población colombiana está envejeciendo más rápido de lo proyectado y más rápido respecto a los demás países de la región4.
El envejecimiento tiene un gran impacto sobre aspectos como el estilo de vida, la disminución de la capacidad física y sensorial, la capacidad de ingresos, la socialización, la independencia y el estado general de salud, lo cual hace que el envejecimiento poblacional represente una elevada carga para los servicios sanitarios y asistenciales1.
Según lo expuesto, se evidencia un aumento en la población mayor y, a su vez, un incremento de la prevalencia de enfermedades crónicas. De acuerdo con la edad de aparición, la artritis reumatoide (AR) se ha clasificado en 2 subgrupos: la enfermedad reumatoide de aparición temprana (YORA), y la AR de aparición tardía (EORA), esta última definida como aquella que debuta en pacientes mayores de 65 años. Se han descrito las diferencias que existen en las manifestaciones articulares y extraarticulares, el pronóstico de la enfermedad y la funcionalidad de los pacientes con YORA y EORA. A medida que se ha avanzado en la comprensión del proceso de inmunosenescencia se ha propuesto que la fisiopatología de la AR en los ancianos puede ser diferente. Este proceso complejo consiste en una serie de cambios que llevan a la reorganización y a un desarrollo diferente de la respuesta inmune. También se presentan mecanismos compensatorios y alteraciones cualitativas que se traducen en una menor respuesta a las inmunizaciones contra agentes patógenos como el virus de la inf luenza y un aumento de la incidencia de enfermedades autoinmunes como la AR5. Los principales cambios en el sistema inmune están dados por el aumento en los linfocitos T de memoria y disminución de los linfocitos nativos o vírgenes, lo que se traduce en una menor capacidad para responder a antígenos nuevos. De la misma manera, se evidencia una disminución en la médula ósea de los precursores de los linfocitos B.
A través de este artículo se revisará la importancia del alto impacto epidemiológico que tiene esta patología en los adultos mayores en el ámbito funcional, lo que se refleja en la sobrecarga en el ámbito familiar y de carga al sistema de salud. Esto obliga, a su vez, a entender que el enfoque de estos pacientes debe ser diferente. Se hará una revisión narrativa de la etiología, diagnóstico, tratamiento, pronóstico y rehabilitación que se debe hacer al abordar a un adulto mayor con AR, intentando resaltar las diferencias existentes entre la YORA y la EORA.
EpidemiologíaLa AR es una enfermedad inflamatoria crónica, sistémica, caracterizada por la destrucción de la membrana sinovial con una prevalencia de 2% en mayores de 60 años. Las tasas de incidencia anual alrededor del mundo son altamente variables (de 9 a 900 por 100.000 habitantes), dependiendo del género y la etnicidad6. En el Reino Unido, el registro de artritis de Norfolk mostró que la incidencia de AR en hombres aumenta paulatinamente con la edad, mientras que en las mujeres la incidencia se incrementa por encima de los 45 años llegando a un punto máximo a los 75 años, momento en el cual empieza a declinar7.
Entre 20–30% de los pacientes con AR inician la sintomatología a partir de los 60 años, y en los países occidentales, la AR puede afectar hasta al 5% de las mujeres mayores de 70 años. Estos hechos junto con el carácter crónico de la enfermedad y el mejor pronóstico de esta, gracias al mejor control que se logra con los tratamientos antirreumáticos, hacen que en las series de pacientes con AR exista un elevado porcentaje de enfermos que sobrepasan los 60 años y que la edad media de los pacientes en muchas de estas series se encuentre entre los 60–65 años8.
Clásicamente, en la AR se ha descrito una relación de 2 o 3 mujeres por cada hombre afectado por la enfermedad; dicha relación ha sido atribuida al papel que juegan las hormonas sexuales en las mujeres. En los pacientes mayores de 60 años se observa una tendencia a la relación 1:1; sin embargo, esto probablemente no solo tenga que ver con la caída estrogénica en la mujer posmenopáusica, sino también con la alteración en la concentración de hormonas androgénicas en el hombre9,10.
Etiología y patogénesisLa influencia genética en la AR ha sido soportada por numerosos estudios. La mejor asociación genética conocida para AR es con el antígeno leucocitario humano clase II que contenga la región DRB1. La presencia y efecto de este alelo tiene asociación con inicio temprano de la enfermedad, enfermedad erosiva y manifestaciones extraarticulares. Hay variaciones étnicas en la frecuencia del alelo DRB1 asociado con AR, y algunas variaciones han sido descritas entre pacientes con inicio temprano y tardío de la enfermedad. Por ejemplo, en España, González-Gay et al.11 reportaron que la YORA estaba fuertemente asociada con DRB1*04, mientras que la EORA estaba asociada con DRB1*01 y no se asociaba con DRB1*04. Adicionalmente, los pacientes con EORA seronegativa exhibían un incremento en la frecuencia de DRB1*13/*14, similar a los pacientes con polimialgia reumática.
Otras hipótesis muestran que el envejecimiento inmune acelerado es un fenómeno encontrado en pacientes con AR temprana y no está inf luenciado por la duración de la enfermedad y el tratamiento12,13. También, en estudios longitudinales, la frecuencia de linfocitos T CD28 negativos en la enfermedad es predictor de erosiones severas en articulaciones, así como la presencia de manifestaciones articu lares en estudios de prevalencia14. Estas observaciones han sido interpretadas a favor del envejecimiento inmune como evento primario relacionado en la patogénesis de la enfermedad y no como consecuencia de la presencia de citocinas inflamatorias. Existen excepciones a esta interpretación (por ejemplo, la transcripción del gen CD28 en linfocitos T jóvenes puede ser significativamente regulada por el factor de necrosis tumoral (TNF, en inglés tumor necrosis factor) alfa.
Los mecanismos de represión genética mediados por TNF son los mismos que ocurren con la replicación de linfocitos T con el envejecimiento. Bajo la influencia del TNF, los linfocitos T vírgenes pierden la expresión de un factor de iniciación que es necesario para la transcripción del CD28. Sin embargo, la represión de CD28 mediada por TNF no es completa y es fácilmente reversible, lo cual está en contraste con la pérdida de CD28 que se observa en la senescencia replicativa o en pacientes con AR. Todos los linfocitos T de pacientes con AR tienen reducción en la expresión de superficie celular del CD28 cuando son medidos por citometría de f lujo, mientras que unos pocos tienen pérdida completa de CD285,15.
La evidencia más convincente es que el envejecimiento inmune acelerado es primario (o al menos no exclusivamente secundario) y llega de estudios genéticos. La pérdida incrementada de CD28 en linfocitos T periféricos se ha asociado con el HLA-DRB1*04, lo cual, también, predispone a AR. En individuos saludables, la frecuencia de células CD28 negativas ha sido correlacionada con la infección por citomegalovirus. Esta correlación se mantiene en pacientes con AR, sugiriendo que la infección por citomegalovirus y el envejecimiento acelerado de las enfermedades reumáticas son factores de riesgo clave que llevan a la senescencia de esta población celular16–18.
Manifestaciones clínicasLa AR del anciano se consideraba, anteriormente, como menos agresiva y de evolución lenta, poco destructiva y no deformante, caracterizada por un inicio brusco y con afección predominante de la cintura escapular. Este concepto ha cambiado últimamente17,18.
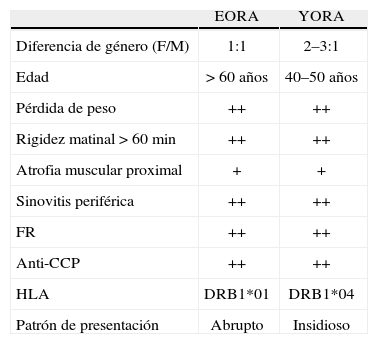
La principal diferencia en la clínica de la YORA con respecto a la EORA es que en ancianos es una enfermedad que se presenta con igual prevalencia tanto en mujeres como en hombres. La relación es 1:1, en cambio, en YORA es de 3:19. En adultos jóvenes se atribuye que la frecuencia es mayor en las mujeres, debido al papel que juegan las hormonas sexuales. Algunos estudios sugieren que la severidad de la EORA en hombres es mayor que en mujeres19.
Otra diferencia importante es que mientras en los adultos jóvenes, la AR se presenta de una manera insidiosa, en los ancianos el cuadro se presenta como un cuadro agudo sistémico con mayor compromiso de las articulaciones, simulando un proceso infeccioso10. Los principales síntomas son rigidez matinal incapacitante y dolor marcado que afecta, principalmente, grandes articulaciones proximales (hombros, caderas y rodillas), acompañado de fatiga y pérdida de peso18,19. En el examen físico se puede evidenciar la presencia de sinovitis de los hombros y las muñecas y articulaciones metacarpofalángicas e interfalángicas proximales. Puede haber limitación en los arcos de movimiento, aunque a veces no está presente, y usualmente hay compromiso de tejidos blandos10. Otra diferencia importante con la YORA es que el daño articular en EORA es mayor. Esto puede obedecer a que las articulaciones, en estos pacientes, son articulaciones y estructuras óseas más desgastadas asociadas a la presencia de múltiples comorbilidades en las personas de mayor edad20 (tabla 1).
Manifestaciones clínicas de artritis reumatoide en el anciano
| EORA | YORA | |
| Diferencia de género (F/M) | 1:1 | 2–3:1 |
| Edad | > 60 años | 40–50 años |
| Pérdida de peso | ++ | ++ |
| Rigidez matinal > 60 min | ++ | ++ |
| Atrofia muscular proximal | + | + |
| Sinovitis periférica | ++ | ++ |
| FR | ++ | ++ |
| Anti-CCP | ++ | ++ |
| HLA | DRB1*01 | DRB1*04 |
| Patrón de presentación | Abrupto | Insidioso |
EORA: artritis reumatoide de aparición tardía; FR: factor reumatoide; YORA: enfermedad reumatoide de aparición temprana.
El envejecimiento está asociado con una alta prevalencia de autoanticuerpos organoespecíficos y no organoespecíficos, dentro de los cuales se incluye el factor reumatoide (FR). Este último es de particular importancia ya que se ha reportado que su presencia en adultos mayores sanos es más elevada que la reportada en la población general. En esta puede presentarse hasta un 5% de FR positivo en pacientes sanos, mientras que en > 60 años aumenta hasta 10 o 15%; es decir, con la edad, aumentan los falsos positivos del FR17,21.
Por lo tanto, si tenemos en cuenta que las artralgias son motivos de consulta frecuentes en el anciano, sumadas a una mayor cantidad de falsos positivos del FR, podemos decir que es fácil que se presenten falsos diagnósticos de AR en ancianos con otras condiciones musculoesqueléticas en la práctica clínica. El anticuerpo antipéptido cíclico citrulinado es una prueba que se comporta con una mayor sensibilidad y especificidad en el diagnóstico de la AR y se ha demostrado como válido en EORA22,23.
Otra prueba que aumenta con el envejecimiento, como un cambio esperable, es la velocidad de sedimentación globular; al menos de 20 a 25% de los individuos sanos, mayores de 65 años, presentan valores por encima de los patrones de referencia. La velocidad de sedimentación globular constituye un reactante de fase aguda, el cual por definición se eleva como parte de los procesos inflamatorios, es por esto que en la clínica, habitualmente, se utiliza para diferenciar la actividad de la AR24. Es aceptado que los reactantes de fase aguda, velocidad de sedimentación globular y proteína C reactiva son útiles en el diagnóstico, en la valoración de la actividad de la enfermedad y en la respuesta al tratamiento en los pacientes con EORA1, pero su interpretación debe hacerse a la luz de la clínica del paciente.
Diagnóstico diferencialSon varias las patologías que se deben diferenciar de la EORA, entre estas se encuentran: polimialgia reumática, artropatía por cristales de pirofofosfato de calcio, gota, osteoartrosis, entre otras. Con respecto a la diferenciación con polimialgia reumática, en esta el FR es negativo, es menos común la sinovitis periférica, hay mayor pérdida de peso y mayor atrofia muscular proximal25,26 (tabla 2).
Diagnóstico diferencial de artritis reumatoide
| Artropatías por cristales (gota, pseudogota o artropatía crónica por pirofosfatos) |
| Polimialgia reumática |
| Osteoartrosis |
| RS3PE (remitting seronegative symmetrical synovitis with pitting edema) |
| Artritis relacionada con enfermedades del tejido conectivo o vasculitis sistémicas |
| Artritis relacionadas con neoplasias |
| Osteoartropatía hipertrófica |
| Sarcoidosis |
| Artritis infecciosa (hepatitis B y C, VIH y otros) |
VIH: virus de la inmunodeficiencia humana.
Los medicamentos utilizados en los ancianos son los mismos que se utilizan en los pacientes adultos jóvenes (analgésicos, glucocorticoides, fármacos antirreumáticos modificadores de la enfermedad [FAME] o agentes biológicos). La principal diferencia radica en la importancia de tener en cuenta las características particulares que esta población presenta con el envejecimiento. Dentro de las más importantes están las asociadas a cambios farmacocinéticos, las comorbilidades, una mayor susceptibilidad al padecimiento de infecciones y la alteración en la función renal que se presenta con la edad. Por esto, es necesario medir la tasa de filtración glomerular y no solo los niveles de creatinina sérica, teniendo en cuenta que en este grupo poblacional la masa muscular disminuye con la edad, y es frecuente que ancianos con valores séricos normales o levemente aumentados de creatinina presenten un deterioro importante del filtrado glomerular27.
El objetivo del tratamiento, al igual que en los pacientes jóvenes, es la remisión de la enfermedad. Se busca controlar las manifestaciones clínicas para prevenir el daño estructural y conservar la función articular, reduciendo, de esta manera, la morbilidad y compromiso funcional asociados. A pesar de los cambios con el envejecimiento, se debe evitar una excesiva precaución en la administración de fármacos para garantizar un tratamiento óptimo, sobre todo al inicio de la enfermedad, cuando hay mayor actividad y debe instaurarse una terapéutica oportuna que disminuya la probabilidad de daño articular y secuelas irreversibles. Para esto, es necesario ajustar el tratamiento de manera individual y efectuar un seguimiento estrecho para reconocer la necesidad de ajustar la terapia a las características y las comorbilidades de cada paciente. Anteriormente, el paciente anciano era tratado con mayor frecuencia con antiinf lamatorios no esteroideos (AINE) y glucocorticoides, y se utilizaban menos los FAME o agentes biológicos.
Lo anterior y el hecho de que los ancianos presenten múltiples comorbilidades y tratamientos que los hacen cumplir criterios de exclusión se ve reflejado en que los mayores de 65 años no fueran tenidos en cuenta en la mayoría de ensayos clínicos realizados para FAME. Por lo tanto, la información que existía era limitada con respecto a la eficacia y seguridad del uso de diferentes tratamientos en los pacientes de esta edad. Afortunadamente, en la actualidad, gracias a la introducción de la terapia biológica, se realizan permanentemente estudios para evaluar la seguridad y la eficacia de los diferentes tratamientos en los pacientes con AR, que incluyen pacientes ancianos28.
En cuanto a los AINE, en los ancianos es bien conocido que existe un riesgo aumentado de toxicidad, por lo que se recomienda utilizarlos a dosis bajas, durante el menor tiempo posible y evaluando los riesgos gastrointestinal, cardiovascular, hepático y renal, que pueda presentar cada paciente29. Dentro de los riesgos gastrointestinales que se han de tener en cuenta, vale la pena recordar que se considera que tener más de 65 años es un factor de riesgo de hemorragia digestiva asociado a la ingesta de AINE. Los AINE selectivos y no selectivos se asocian con un alto riesgo de sangrado gastrointestinal por lo que están contraindicados en pacientes con úlceras o hemorragia gastrointestinal activa, con historia de sangrado gastrointestinal o perforación durante el tratamiento con AINE30.
Los inhibidores de la COX-2 están contraindicados en pacientes con enfermedad coronaria documentada, arteriopatía periférica o con historia de accidente isquémico transitorio; también es importante mencionar que tanto los AINE como los inhibidores COX-2 selectivos se deben evitar en pacientes con hepatopatía, enfermedad renal asociada a la edad, anticoagulados o en tratamiento con inhibidores de la enzima convertidora de angiotensina o antagonistas del receptor de angiotensina II.
En cuanto al uso de corticoides, al igual que en el resto de pacientes adultos, se recomiendan cuando la enfermedad está activa o como terapia puente, mientras comienzan a actuar los FAME o los agentes biológicos. La dosis indicada máxima es de 7,5mg/día. Estas recomendaciones se hacen basadas en estudios que dicen que utilizar corticoides durante períodos cortos enlentece el daño estructural en AR de reciente comienzo31. Sin embargo, se desconocen sus efectos sobre la enfermedad a largo plazo. En ancianos se ha modificado el manejo con corticoides. Anteriormente, estos medicamentos eran más utilizados en esta población que en adultos jóvenes.
Actualmente, se recomienda utilizarlos igual que en los pacientes jóvenes, es decir, a la mí nima dosis efectiva y durante el menor tiempo, una vez se haya evaluado el riesgo/beneficio de utilizarlos, e inclusive se recomienda hacerlo con mayor precaución que en las personas jóvenes, por los frecuentes efectos secundarios que se presentan con la edad. Dentro de los efectos secundarios más conocidos en los ancianos están: aumento de 2–3 veces el riesgo de presentar diabetes mellitus después del tratamiento durante 6 meses, incremento del riesgo de falla cardíaca, infecciones, osteonecrosis, osteoporosis, desequilibrio hidroelectrolítico e hipertensión arterial. La ingesta crónica también se asocia a discrasias sanguíneas, glaucoma y cataratas. Con respecto a la osteoporosis, es importante mencionar que, especialmente, en ancianos se asocia con una alta tasa de morbimortalidad, por lo que es obligatorio controlar la densidad mineral ósea y, desde el inicio de la administración de glucocorticoides, instaurar medidas preventivas al respecto32.
En cuanto a los FAME, los que más se han estudiado en ancianos son metotrexato (que se considera de primera elección) y leflunomida33. Los ensayos clínicos muestran la diferencia de la eficacia del metotrexato en adultos jóvenes, sin embargo, no se ha encontrado diferencia estadísticamente significativa34,35; entre adultos mayores y adultos jóvenes, se da en cuanto a que en adultos jóvenes con AR de inicio temprano la respuesta con este fármaco es mejor17. Sin embargo, también está confirmado que la edad no influye en la eficacia de este fármaco en los pacientes con AR de larga evolución. En cuanto a la seguridad, en las personas mayores de 65 años, se ha observado un incremento de los efectos adversos, aunque solo es estadísticamente significativo para los efectos adversos graves que obligan a la suspensión del fármaco, los cuales, afortunadamente, son muy poco frecuentes. Los principales efectos adversos observados son los mismos que en los pacientes más jóvenes. Hay que tener especial precaución en los pacientes ancianos con deterioro de la función renal, en los que la dosis debe ajustarse en función del aclaramiento de creatinina, y no se recomienda su administración si esta es inferior a 15ml/min.
Otra precaución importante es la interacción de los AINE con el metotrexato, por lo cual en los pacientes que toman ambos medicamentos se debe realizar una estrecha vigilancia de la función renal18. Otra interacción frecuente que existe es con el clotrimazol y sulfas, por lo que se debe evitar la administración en conjunto de estos medicamentos con metotrexato para evitar alteraciones hematológicas graves. Vale la pena mencionar que en la práctica clínica diaria muchos de los efectos adversos graves del metotrexato, en los ancianos, son ocasionados por errores en la administración del medicamento21. Para evitar esto, es necesario especificar que la dosis administrada debe ser semanal, nunca diaria. Se debe intentar garantizar que el anciano sea supervisado en la toma de sus medicamentos por algún familiar. Sobre el uso de leflunomida, en ancianos, hay un estudio observacional que evaluó la eficacia y la seguridad de este fármaco en pacientes ancianos italianos con diferentes patologías. En este estudio no se encontraron diferencias en la eficacia y toxicidad entre los pacientes ancianos y los más jóvenes. En los 3 primeros meses de tratamiento, las causas más frecuentes de suspensión fueron rash, hepatotoxicidad o toxicidad gastrointestinal, y a los 10 meses fueron persistencia de actividad de la enfermedad y síntomas gastrointestinales36. Existe un estudio observacional australiano en el cual en pacientes ancianos que reciben metotrexato y leflunomida se observa un aumento de la pancitopenia37,38.
Con respecto a los antimaláricos en pacientes ancianos, no se cuenta con estudios específicos que evalúen la eficacia y seguridad de estos medicamentos. Lo que se recomienda es ajustar la dosis de hidroxicloroquina en pacientes que tengan insuficiencia renal crónica, ya que se sabe que la eliminación de este medicamento (45%) es por vía renal, lo que aumenta la toxicidad retiniana. Teniendo en cuenta que algunos autores consideran que la edad mayor de 65 años es un factor de riesgo para desarrollar retinopatía, se hace indispensable en los adultos mayores realizar revisiones oftalmológicas periódicas para identificar tempranamente toxicidad ocular.
La evidencia que existe sobre la eficacia de la terapia biológica en ancianos es escasa y en ocasiones contradictoria, ya que esta población es, generalmente, excluida de los ensayos clínicos por varias razones. Primero, los ancianos presentan múltiples comorbilidades y cursan con polifarmacia, lo que hace que no cumplan con criterios de inclusión para ingresar a los estudios. Segundo, en la práctica clínica es frecuente que cuando se informa a los pacientes ancianos sobre las terapias biológicas, estos las rechacen con mayor frecuencia que los pacientes jóvenes. Y por último, aunque cada vez menos, el propio médico es reacio a ofrecer terapias biológicas a pacientes de edad muy avanzada14,25,26,38,39.
La información que permite apoyar su uso en esta población es solo de terapia biológica con anti-TNF, pues, sobre medicamentos como rituximab, abatacept o tocilizumab no hay datos disponibles. Esta información sale de datos obtenidos de diferentes países. La mayoría de estos permite concluir que puede haber una efectividad similar entre la terapia en adultos jóvenes y ancianos23,26,28. Sin embargo, otros datos no apoyan su uso. Existe un estudio realizado por Bathon Hetland et al., en el cual se concluye que hay una respuesta más baja en ancianos con AR de larga evolución que recibieron manejo con etanercept. Los datos obtenidos del registro danés reportan que la edad avanzada es un predictor de peor respuesta a la terapia con anti-TNF40,41.
La forma de valorar la respuesta al tratamiento con anti-TNF es con las herramientas DAS28 (para severidad) y el HAQ (para funcionalidad). Para el DAS28, inicialmente estos puntajes suelen estar más elevados en ancianos; sin embargo, posteriormente, la mejora es similar en adultos jóvenes y ancianos2°. Con respecto al HAQ, se ha encontrado que en mayores de 75 años, disminuye menos con respecto a personas de menor edad. Se cree que esto pueda ser secundario a las comorbilidades asociadas a la edad y no por la respuesta al tratamiento biológico42.
Sobre la seguridad de los anti-TNF, por un lado, se ha encontrado que los pacientes ancianos presentan una tasa de efectos adversos más alta que la de los adultos jóvenes39,40. La tasa de infecciones que requieren hospitalización, sobre todo si los pacientes están recibiendo conjuntamente glucocorticoides, es uno de los principales efectos adversos encontrados. En el estudio británico realizado por Galloway et al.43, que incluyó a 15.396 pacientes con AR tratados con fármacos modificadores de la enfermedad y con agentes biológicos, se encontró que 1.808 pacientes tratados con ambos medicamentos presentaron infecciones graves. Estas se incrementan levemente durante los 6 primeros meses en los pacientes tratados con anti-TNF respecto a los tratados con FAME tradicionales34. Otro hallazgo del estudio fue que las infecciones se incrementaban con la edad de los pacientes, tanto con ambos medicamentos; sin embargo, estos hallazgos no tuvieron diferencia estadísticamente significativa. Por último, se describe que las neoplasias en pacientes ancianos que reciben terapia anti-TNF tienen una tasa más alta que la de los pacientes jóvenes. Sin embargo, el número de casos de cáncer no fue diferente al esperado en la población general con la misma edad29,31.
Como se mencionó en el aparte de epidemiología, la AR es una enfermedad prevalente en ancianos que ocasiona discapacidad y deterioro en la funcionalidad y la calidad de vida, y ya está establecido que con el paso de los años esto va a ser cada vez más evidente. En Estados Unidos, la AR y la osteoartrosis son consideradas las primeras causas de discapacidad17,18. El 23% de estos pacientes ancianos presenta limitación para actividades básicas cotidianas22.
La evaluación funcional es fundamental para el estudio de un anciano con enfermedad articular o musculoesquelética. La habilidad para levantarse de una silla, andar distancias cortas y asearse hace la diferencia entre la vida independiente y requerir asistencia física o ingreso en una institución13. Para evitar esto último, existe evidencia científica sólida que demuestra que al enrolar a los adultos mayores en actividad física regular y programas de fisioterapia puede disminuir la dependencia para actividades básicas cotidianas en un 32%22. Esto se ve reflejado en un mejor control del dolor, aumento de la funcionalidad y retraso en la discapacidad de pacientes con AR.
A pesar de conocerse ampliamente los beneficios del ejercicio en pacientes con AR, el 55% de ellos, que son mayores de 65 años, permanecen sedentarios, lo que demuestra cómo se está subutilizando este recurso terapéutico. Otro aspecto clave para garantizar la adherencia de los pacientes al tratamiento farmacológico y no farmacológico está dado por la educación al paciente anciano y a su cuidador o familiar. Las personas adultas mayores reportan bajas tasas de educación (8,5%) sobre su enfermedad22. Se hace necesario prestar mayor importancia a estos aspectos (ejercicio físico, rehabilitación y educación al paciente) para que junto con el inicio oportuno y adecuado de los medicamentos se pueda garantizar un adecuado tratamiento de la AR en el anciano.
PronósticoActualmente, se considera que la AR del anciano puede tener un pronóstico igual o peor que en el paciente más joven. Por esta razón, se recomienda iniciar el tratamiento de forma temprana y agresiva, como se describió anteriormente, con el objetivo de reducir la progresión clínica, radiológica y la discapacidad44,45.
ConclusiónLa AR de aparición tardía es una entidad que por las características clínicas especiales inherentes a la edad de los sujetos que la padecen merece una mayor atención por parte del reumatólogo. El manejo interdisciplinario es clave para lograr un mayor control de la enfermedad y mejoría en la funcionalidad del paciente. Aspectos como las múltiples comorbilidades y polifarmacia típica del adulto mayor deben considerarse siempre en el momento de hacer el abordaje terapéutico y seguimiento. Se necesitan estudios adicionales sobre diagnóstico, tratamiento y pronóstico de esta entidad en este grupo etáreo46,47.