La dislipidemia es la alteración metabólica más prevalente en el síndrome de Sjögren primario (SSP), se sugiere una asociación entre niveles bajos de colesterol de alta densidad (HDL) y la actividad de la enfermedad.
ObjetivosEl propósito de este estudio es describir las características del perfil lipídico y explorar la correlación entre sus componentes y la actividad del SSP.
Materiales y métodosEstudio descriptivo de corte trasversal, se revisaron las historias clínicas de pacientes mayores de 18 años que asistieron al Hospital Universitario Clínica San Rafael, con criterios clasificatorios para SSP durante el periodo de enero del 2015 a diciembre del 2019. Para el análisis estadístico se utilizó el software RStudio versión 4.0.2. Se efectuó un análisis descriptivo de las variables clínico-demográficas y serológicas para evaluar la correlación entre ellas.
ResultadosSe revisaron en total 250 historias clínicas, de las cuales, 35 cumplían con los criterios de inclusión. La edad promedio fue de 53,4 años; el 88,3% de la población fueron mujeres. La mediana del tiempo de enfermedad fue de 42 meses. Las medias de colesterol total, HDL, colesterol de baja densidad (LDL) y triglicéridos fueron de 191 mg/dL, 42,6 mg/dL, 118,9 mg/dL y 157 mg/dL, respectivamente. Se encontró un coeficiente de correlación de Pearson entre el índice de actividad ESSDAI y el colesterol HDL de -0,43 (IC 95% -0,67–0,12), valor p = 0,008. Se realizó un modelo lineal entre el índice de actividad ESSDAI total y el colesterol HDL, y como resultado se halló un coeficiente estimado de -0,17. La curva ROC, con un punto de segregación de colesterol HDL de 43,5 mg/dL, mostró un área bajo la curva (AUC) de 0,603 (IC 95% 0,40-0,80). Al excluir los pacientes con índice de masa corporal (IMC) alto, el AUC mejoró, con un punto de segregación de 38 mg/dL.
ConclusionesLos pacientes con niveles bajos de colesterol HDL mostraron mayores índices de actividad de la enfermedad, con un punto de corte menor a 43 mg/dL, siendo más marcado en pacientes con IMC normal.
Dyslipidaemia is the most prevalent metabolic disorder in primary Sjögren's syndrome (PSS) and an association between low HDL cholesterol levels and disease activity has been suggested.
ObjectivesThe purpose of this study is to describe the characteristics of the lipid profile in patients with PSS and explore the correlation between the components of the lipid profile and the activity of the disease.
Materials and methodsA descriptive cross-sectional study. We reviewed the medical records of patients over 18 years of age with criteria for PSS who attended the Hospital Universitario Clínica San Rafael during the period between January 2015 to December 2019. We used R-studio software version 4.0.2 for statistical analysis. A descriptive analysis of the clinical-demographic and serological variables was carried out to evaluate the correlation between them.
ResultsA total of 250 medical records were reviewed, of which 35 met the inclusion criteria. The average age was 53.4 years and 88.3% were women. The median duration of disease was 42 months. The mean values for total cholesterol, HDL, LDL and triglycerides were 191 mg/dL, 42.6 mg/dL, 118.9 mg/dL and 157 mg/dL respectively. A Pearson correlation coefficient of -.43 (95% CI -.67 to -.12) p-value = .008 was found between the ESSDAI activity index and HDL cholesterol. A linear model was performed between the total ESSDAI activity index and HDL cholesterol, finding an estimated coefficient of -.17. A ROC curve was performed with an HDL cholesterol segregation point of 43.5 mg/dL with an area under the curve of .603 (95% CI .40-.80). By excluding patients with high BMI, the area under the curve improved with a segregation point of 38 mg/dL.
ConclusionsPatients with low levels of HDL cholesterol showed higher rates of disease activity, with a cut-off point lower than 43 mg/dL being more marked in patients with normal body mass index.
El síndrome de Sjögren primario (SSP) es una enfermedad autoinmune sistémica, crónica, no asociada a otro proceso reumatológico, que se caracteriza por un infiltrado inflamatorio linfocitario en las glándulas secretoras, lo cual tiene como resultado el síndrome Sicca (sequedad en ojos, boca, faringe, laringe y/o vagina)1. Se han descrito manifestaciones extraglandulares hasta en un 50% de los pacientes, con compromiso principalmente de los sistemas musculoesquelético, neurológico, respiratorio y cutáneo, así como alteraciones metabólicas con una mayor prevalencia de diabetes, hiperuricemia y dislipidemia2,3; esta última es la más frecuente, con una razón de probabilidad (OR) de 1,42 con respecto a la población sin diagnóstico de SSP4,5.
Hasta el momento, los estudios de asociación entre dislipidemia y SSP han puesto en evidencia el aumento del riesgo cardiovascular en este grupo de pacientes; sin embargo, en los últimos años ha cobrado importancia la relación entre el SSP y el colesterol de alta densidad (HDL), por considerarse este último un posible factor de actividad de la enfermedad6,7. En Colombia no disponemos de datos en torno a las características metabólicas de los pacientes con SSP y su relación con cada uno de los componentes del perfil lipídico y la actividad inmunológica. El objetivo principal del presente estudio fue describir las características del perfil lipídico en una cohorte de pacientes con SSP y explorar la correlación entre los componentes de dicho perfil y la actividad de la enfermedad. Se busca que los resultados del estudio puedan contribuir a entender mejor el compromiso sistémico de la enfermedad y que se puedan plantear nuevos objetivos para su control.
Materiales y métodosPoblaciónSe incluyeron pacientes mayores de 18 años con diagnóstico de SSP, según los criterios clasificatorios americanos-europeos 2002, que acudieron a los servicios de consulta externa y/o hospitalización del Hospital Universitario Clínica San Rafael, ubicado en Bogotá (Colombia), entre enero del 2015 y diciembre del 2019. Se excluyeron pacientes con condiciones clínicas o farmacológicas que pudieran alterar el perfil lipídico, como diabetes mellitus, hipotiroidismo, enfermedades hipofisiarias, enfermedad hepatocelular, alcoholismo, virus de inmunodeficiencia humana, embarazo y consumo de fármacos como esteroides, tiazidas y antirretrovirales, entre otros.
Tipo de estudio y diseñoSe realizó un estudio observacional descriptivo de corte transversal. Se eligió un muestreo no probabilístico por conveniencia.
Recolección de datosCon previa autorización del Comité de Ética Médica del Hospital Universitario Clínica San Rafael, se revisaron las historias clínicas en el sistema institucional Health On Line (HEON). Se seleccionaron los pacientes con el diagnóstico por código CIE10 M350 (síndrome de Sjögren) y se aplicaron los criterios de elegibilidad y el instrumento de medición, con las siguientes variables: edad, género, variables clínicas (tiempo de evolución de la enfermedad en meses, peso, talla, índice de masa corporal [IMC], xeroftalmia, xerostomía, xerodermia, artritis, sialoadenitis, fenómeno de Raynaud, compromiso renal, compromiso pulmonar, neuropatía, compromiso cardiaco, vasculitis) y variables serológicas (leucopenia, factor reumatoideo, anticuerpos antinucleares [ANA] título y patrón, anti-Ro/SSA, anti-La/SSB, complemento, IgG, vitamina D, colesterol total, colesterol HDL, colesterol de baja densidad (LDL), triglicéridos y biopsia de glándulas salivales).
El EULARSjögren's Syndrome Disease Activity Index (ESSDAI) fue el instrumento estandarizado y validado que se empleó para evaluar la actividad de la enfermedad. Se evaluaron cada uno de los 12 dominios del instrumento que están en relación directa con los sistemas comprometidos por la enfermedad: constitucional, sistema nervioso central, pulmonar, renal, muscular, sistema nervioso periférico, biológico, hematológico, cutáneo, articular, glandular y linfático. A cada dominio se le asignó una puntuación de actividad, de acuerdo con lo registrado en la historia clínica (0 = no actividad, 1 = baja actividad, 2 = moderada actividad, 3 = elevada actividad). Finalmente, se realizó un cálculo de actividad global de la enfermedad sumando los resultados de los 12 dominios y estableciendo el grado de actividad (actividad baja de 1 a 4, actividad moderada de 5 a 13 y actividad alta mayor a 13)8,9.
Análisis estadísticoPara el análisis estadístico se utilizó el software RStudio, versión 4.0.2 (RStudio, Inc.). Se efectuó un análisis descriptivo de las variables clínico-demográficas y serológicas. Para evaluar la correlación entre variables cuantitativas, se empleó el coeficiente de correlación de Pearson, de acuerdo con la normalidad de los datos en el análisis bivariado. Posteriormente, se realizó un modelo lineal simple entre las variables con correlación significativa para evaluar la asociación con actividad por ESSDAI (variable dependiente). Para el análisis multivariado se evaluó la asociación entre ESSDAI y las variables predictoras; se ejecutó un modelo lineal generalizado polinomial con distribución Poisson función canónica ‘log’.
A continuación, se midieron los residuales de Deviance y Pearson para evaluar la calidad del modelo. A fin de estimar los puntos de corte de las variables con asociación significativa con respecto a la actividad de la enfermedad, se elaboraron curvas ROC con cálculo del AUC, y a efectos de evaluar la exactitud del test, se calculó: sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo. Finalmente, para determinar la asociación entre las variables cualitativas, se realizó el test exacto de Fisher, considerando una p significativa ≤ 0,05.
Consideraciones éticasEsta investigación se clasificó como sin riesgo, de acuerdo con la Resolución 8430 de 1993 del Ministerio de Salud (hoy de Salud y Protección Social), puesto que se trata de una investigación documental que no interviene o modifica las variables biológicas o clínicas de los sujetos de investigación; se mantuvo la confidencialidad de la información obtenida de las historias clínicas, según la Resolución 1995 de 1999. No se inició la recolección de los datos hasta no tener la aprobación por parte del Comité de Investigación del Hospital Universitario Clínica San Rafael.
ResultadosEn nuestro estudio se revisaron en total 250 historias clínicas, de las cuales, 35 cumplían con los criterios de inclusión. Las características generales de la población se describen en la tabla 1.
Características generales de la población
| (n = 35) | Núm. (%) | ||
|---|---|---|---|
| Variablescualitativas | |||
| GéneroFemeninoMasculino | 31 (88,3%)4 (11,7%) | ||
| Xeroftalmia | 23 (65,7%) | ||
| Xerostomía | 27 (77,1%) | ||
| Xerodermia | 7 (20%) | ||
| Artritis | 15 (42,9%) | ||
| Sialoadenitis | 11 (31,4%) | ||
| Fenómeno de Raynaud | 9 (25,7%) | ||
| Compromiso renal | 6 (17,1%) | ||
| Compromiso pulmonar | 2 (5,7%) | ||
| Neuropatía | 2 (5,7%) | ||
| Compromiso cardiaco | 0 (0%) | ||
| Vasculitis | 2 (5,7%) | ||
| Leucopenia | 4 (11,4%) | ||
| Factor reumatoideo positivo | 11 (31,4%) | ||
| ANA positivos | 22 (62,9%) | ||
| Anti-Ro/SSA positivo | 14 (40%) | ||
| Anti-La/SSB positivo | 8 (22,9%) | ||
| Crioglobulinemia | 0 (0%) | ||
| Hipocomplementemia | 7 (20%) | ||
| Hipergamaglobulinemia policlonal | 7 (20%) | ||
| Biopsia de glándulas salivalesSin reporte/sin biopsiaNegativaPositiva | 22 (62,9%)6 (17,1%)7 (20%) | ||
| Variables cuantitativas | |||
| % | X | IQR | |
| Edad | 54 | 48-62 | |
| Tiempo de evolución de la enfermedad (meses) | 42 | 15-114 | |
| ESSDAI totalConstitucionalLinfadenopatíaGlandularArticularCutáneoRespiratorioBiológicoRenalMuscularSistema nervioso periféricoSistema nervioso centralHematológico | 3 (8,6%)0 (0%)3 (8,6%)15 (42,9%)0 (0%)2 (5,7%)10 (28,6%)6 (17,1%)0 (0%)2 (5,7%)0 (0%)2 (2%) | 2 | 0,1-6,5 |
| Colesterol total (mg/dL) | 191 | 167,8-223,5 | |
| Colesterol HDL (mg/dL) | 42 | 34,5-51,5 | |
| Colesterol LDL (mg/dL) | 123,6 | 100,3-141,5 | |
| Triglicéridos (mg/dL) | 130,8 | 111-177 | |
| Peso (kg) | 65 | 55,5-71,5 | |
| Talla (cm) | 156,5 | 151-160 | |
| Índice de masa corporal (IMC) | 26,05 | 22,46-29,16 |
ANA: anticuerpos antinucleares; ESSDAI: EULAR Sjögren's Syndrome Disease Activity Index.
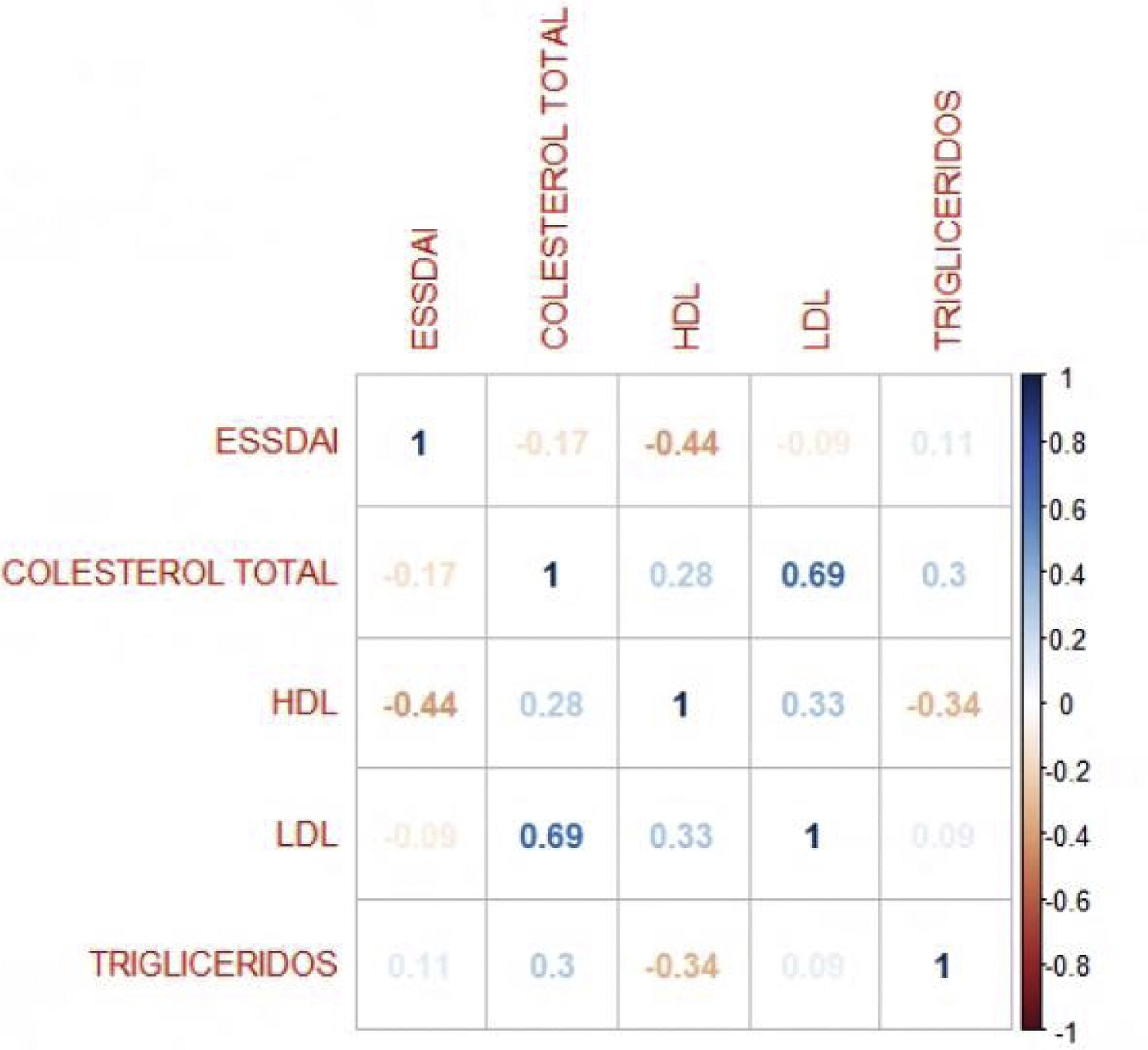
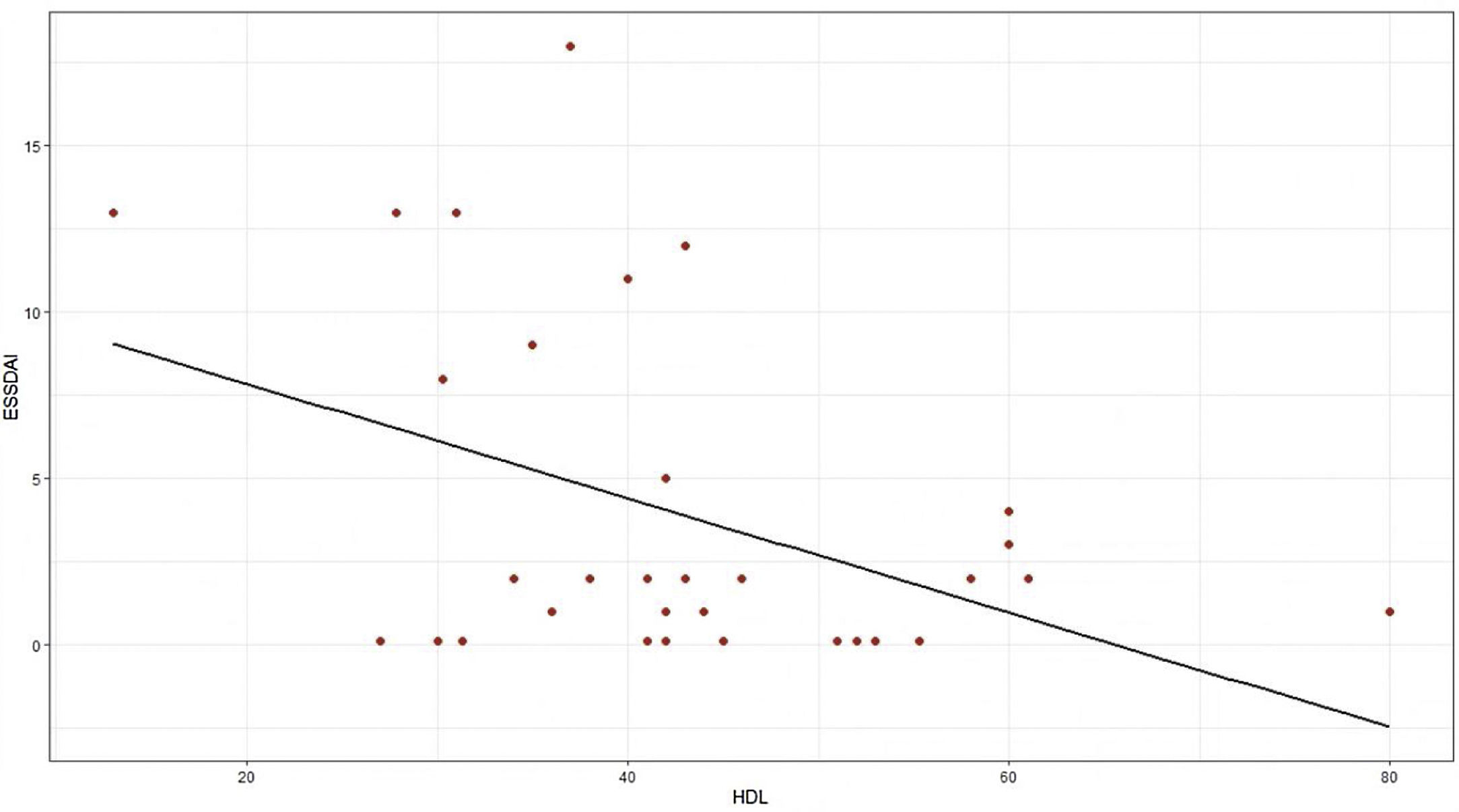
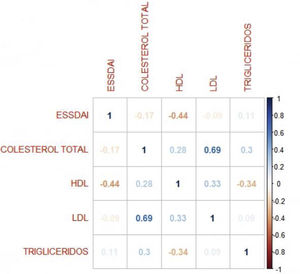
El índice de actividad moderada fue de 11,5 y ningún paciente presentó actividad severa. En relación con el IMC, más del 50% tenía problemas de sobrepeso y obesidad, con una mediana de 26 y un rango intercuartílico de 19 a 38. El coeficiente de correlación de Pearson entre el índice de actividad ESSDAI y el colesterol HDL fue -0,43 (IC 95% -0,67 a -0,12), valor p = 0,008. Al explorar la correlación entre el índice de actividad ESSDAI y los demás componentes del perfil lipídico, no se encontró significancia estadística. Tomando como variable dependiente, el índice de actividad ESSDAI total y teniendo en cuenta la correlación significativa con el colesterol HDL, se realizó un modelo lineal entre estas dos variables, y se halló un coeficiente estimado de -0,17 (fig. 1).
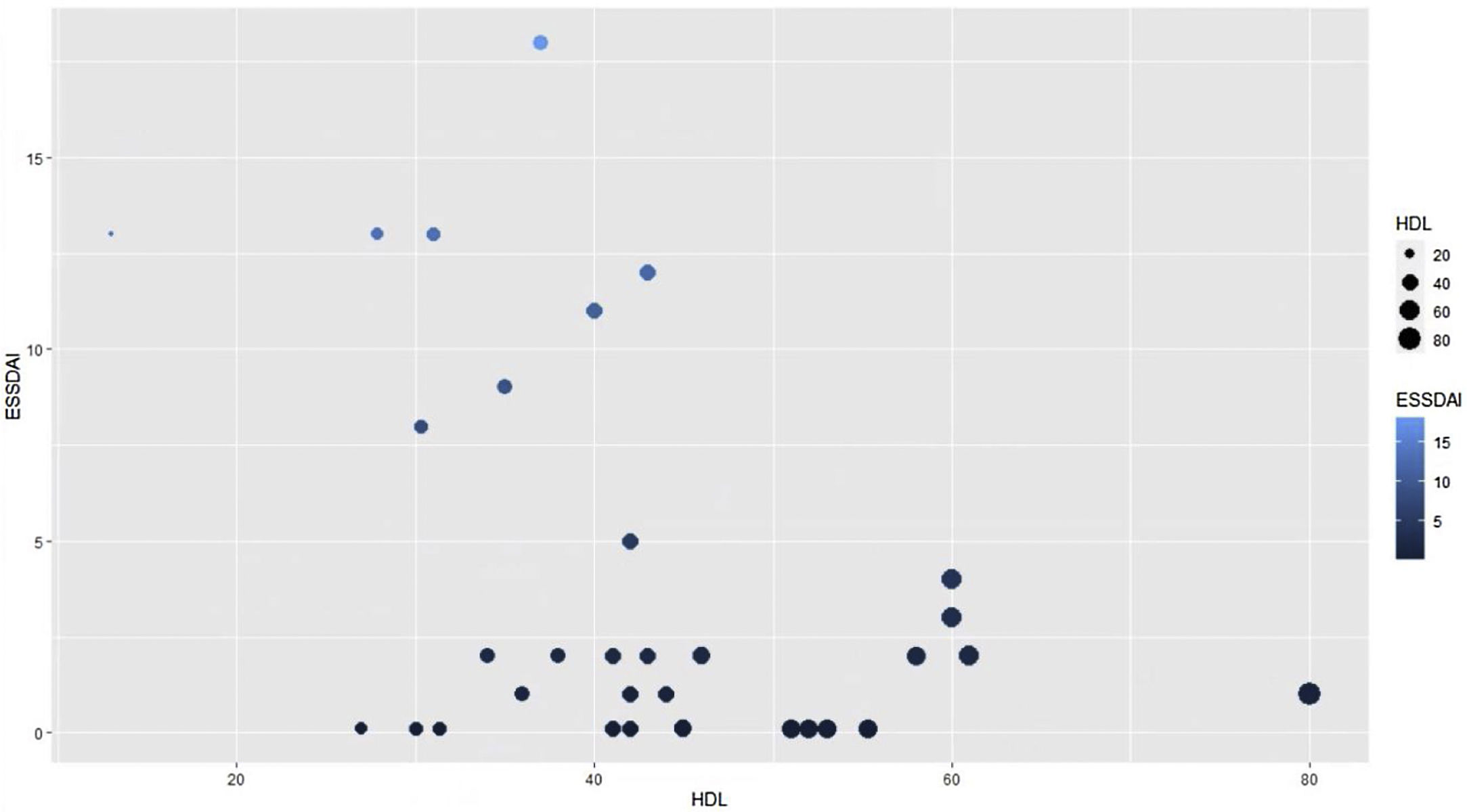
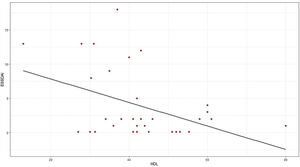
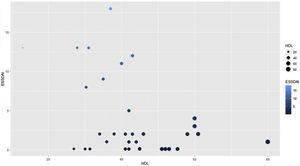
Para hallar la asociación entre la variable dependiente ESSDAI, se realizó un modelo lineal generalizado polinomial con los demás componentes del perfil lipídico (colesterol total, HDL, LDL y triglicéridos), utilizando una función de distribución Poisson (link = ‘log’), y se encontró que el colesterol HDL se conservó como variable independiente con respecto al índice de actividad ESSDAI; a su vez, el colesterol LDL también se comportó como variable predictora. La media de los residuales de Deviance fue de -0,1 y la media de los residuales de Pearson, 0,3. Al representar la relación entre el índice de actividad ESSDAI y el nivel de colesterol HDL, se observa que a mayores valores de colesterol HDL, menor actividad de la enfermedad (figs. 2 y 3).
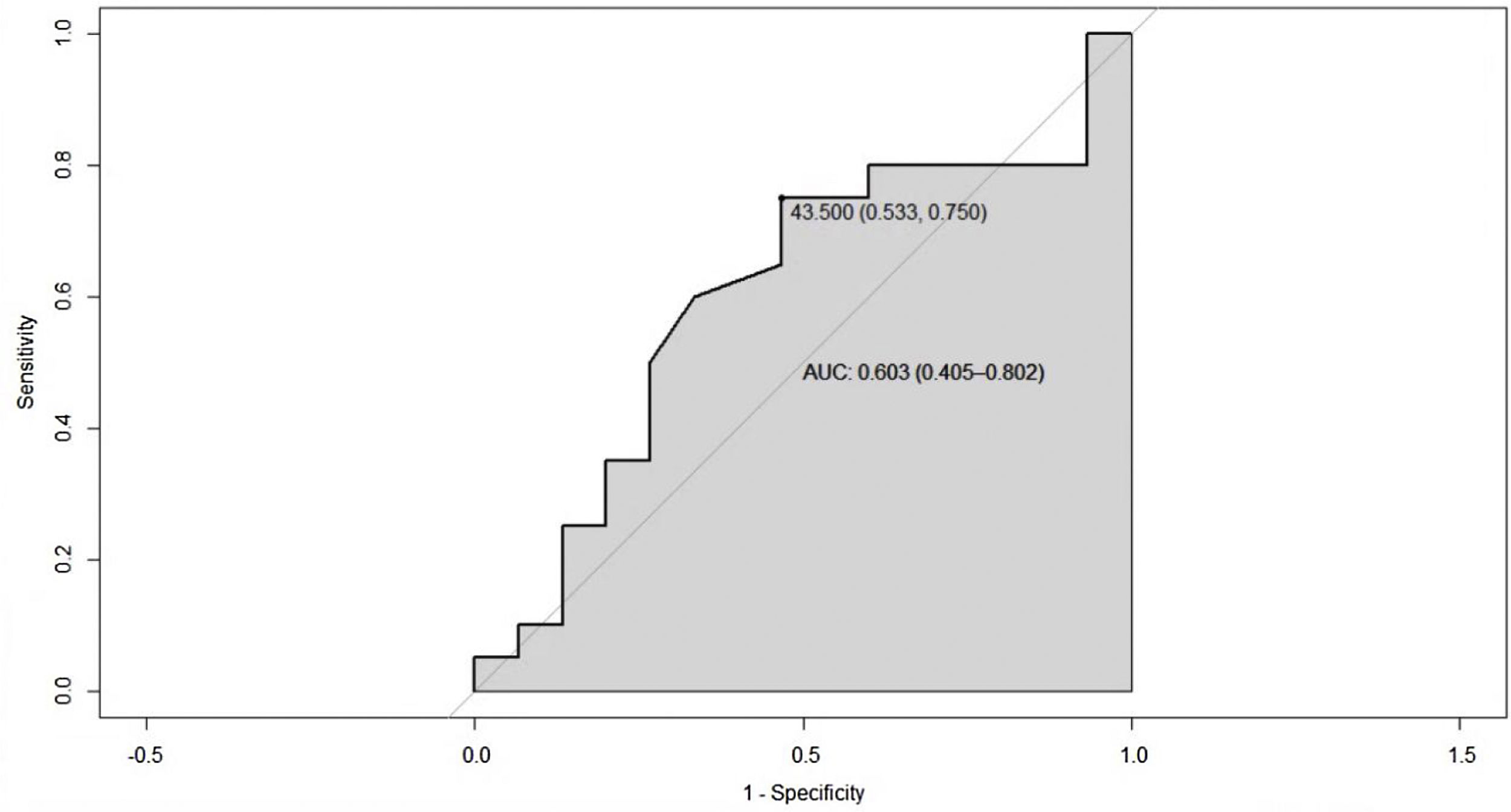
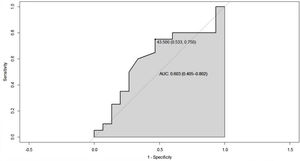
Puesto que a menor valor de colesterol HDL hay mayor actividad de la enfermedad, la variable ESSDAI total se dicotomizó en activos y no activos, con el propósito de establecer un punto de corte para colesterol HDL que permitiera segregar los dos estados de la enfermedad. En tal sentido, se realizó la curva ROC, en la cual se encontró un punto de segregación de colesterol HDL de 43,5 mg/dL, con un AUC de 0,603 (IC 95% 0,40-0,80), lo que refleja una regular capacidad de discriminación (fig. 4).
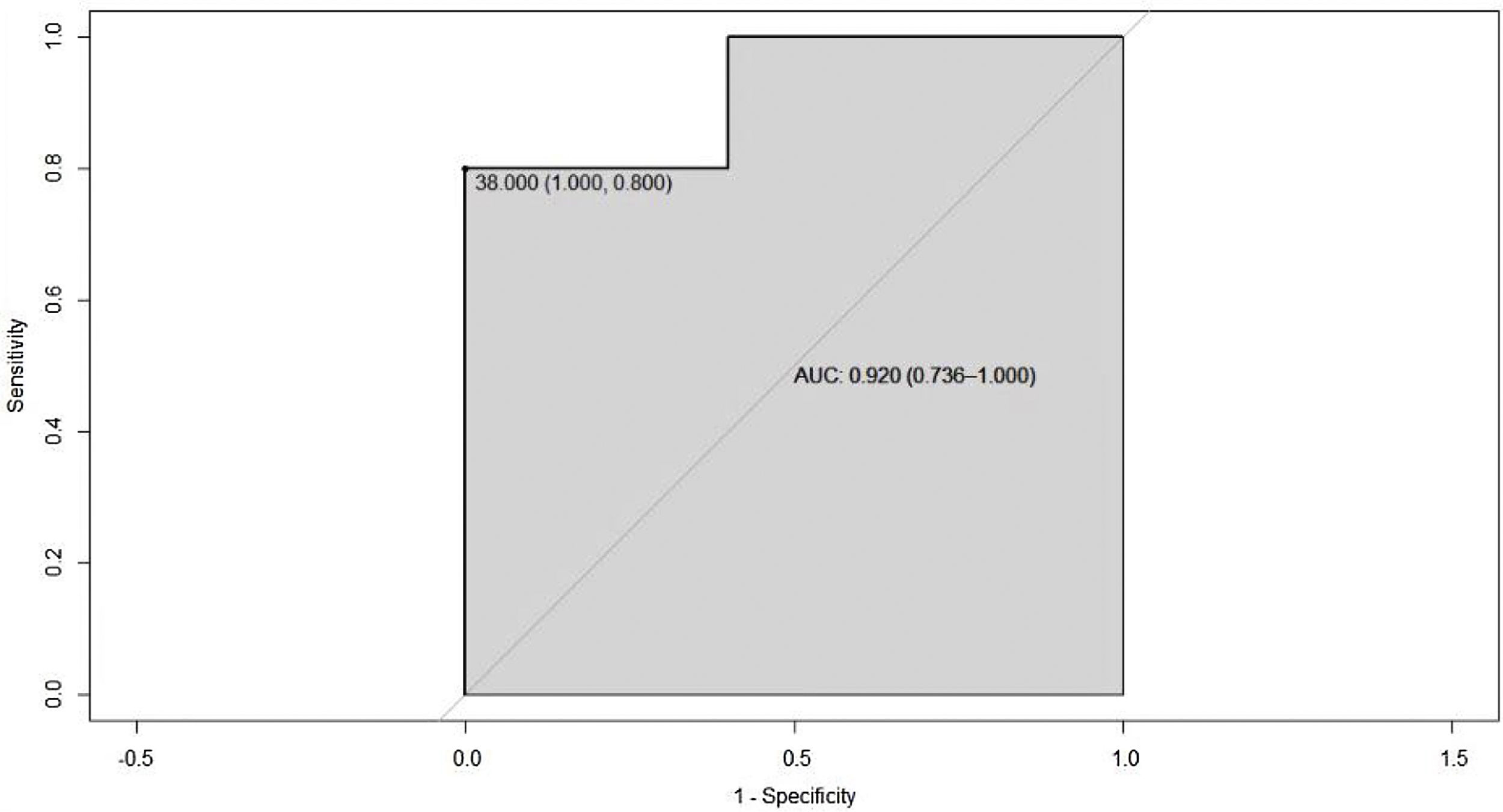
Debido a que el sobrepeso o la obesidad pueden interferir en la definición del punto de corte de colesterol HDL, se analizó solamente el grupo de pacientes con IMC normal, y se encontró una curva ROC con un punto de segregación de colesterol HDL de 38 mg/dL y AUC de 0,92 (IC 95% 0,73-1), lo que es muestra de mejoría de la capacidad de clasificar este grupo de pacientes (fig. 5).
Por último, se encontró una asociación significativa entre leucopenia y niveles de colesterol HDL con punto de corte de 43 mg/dL (tabla 2).
Asociación entre variables clínico-serológicas y niveles de colesterol HDL con punto de corte 43 mg/dL
| Variable (n) | HDL > 43 | HDL < 43 | p |
|---|---|---|---|
| Xeroftalmia (23) | 11 | 12 | 0,13 |
| Xerostomía (27) | 10 | 17 | 1 |
| Artritis(15) | 6 | 9 | 1 |
| Sialoadenitis (11) | 4 | 7 | 1 |
| Fenómeno de Raynaud (9) | 9 | 3 | 1 |
| Compromiso renal (6) | 0 | 6 | 0,64 |
| Compromiso pulmonar (2) | 0 | 2 | 0,51 |
| Neuropatía (2) | 0 | 2 | 0,51 |
| SS y vasculitis (2) | 0 | 2 | 0,51 |
| Leucopenia (4) | 4 | 0 | 0,01* |
| Factor reumatoideo (11) | 7 | 4 | 1 |
| ANA (22) | 9 | 13 | 0,72 |
| Anti-Ro/SSA (14) | 5 | 9 | 1 |
| Anti-La/SSB (8) | 4 | 4 | 0,43 |
| Hipergammaglobulinemia (7) | 1 | 6 | 0,21 |
| ESSDAI constitucional (3) | 0 | 3 | 0,69 |
| ESSDAI glandular (3) | 0 | 2 | 0,51 |
| ESSDAI articular (15) | 4 | 11 | 0,31 |
| ESSDAI respiratorio (2) | 0 | 2 | 0,51 |
| ESSDAI biológico (10) | 3 | 7 | 0,70 |
| ESSDAI renal (6) | 0 | 6 | 0,13 |
| ESSDAI SNP (2) | 0 | 2 | 0,51 |
| ESSDAI hematológico (2) | 2 | 0 | 0,3 |
ANA: anticuerpos antinucleares; ESSDAI: EULARSjögren's Syndrome Disease Activity Index; SNP: sistema nervioso periférico; SS: síndrome de Sjögren.
Las alteraciones del perfil lipídico son comunes en distintas enfermedades autoinmunes como el lupus eritematoso sistémico, la artritis reumatoide y el síndrome de Sjögren y conllevan alto riesgo de complicaciones cardiovasculares. En los últimos años, se ha demostrado en modelos animales el rol del colesterol HDL en la respuesta inflamatoria, pues su inhibición se asocia con la proliferación de células madre hematopoyéticas y favorece la expresión de receptores en la superficie celular, promoviendo la actividad de linfocitos T y la formación de autoanticuerpos10–12. El SSP se ha descrito como un predictor independiente de enfermedad ateroesclerótica, al describirse en este grupo de pacientes aumento del grosor de la pared arterial, en presencia de factores de riesgo cardiovascular tradicionales, entre los que se incluyen las alteraciones en el perfil lipídico OR 2,8 (IC 95% 1,04-7,54)13.
Por lo anterior, al considerar que la fracción del colesterol HDL podría tener un impacto en la actividad de la enfermedad, se realizó una descripción de las características del perfil lipídico en una cohorte de pacientes con SSP, y se exploró la correlación entre los componentes de dicho perfil y la actividad de la enfermedad. Al realizar una búsqueda bibliográfica, se encuentran pocos estudios que relacionen la actividad de la enfermedad con el valor del colesterol HDL. En los reportados hasta el momento, se encuentran datos similares a los obtenidos aquí, en relación con la mayor proporción de afectación del género femenino, con índices de actividad entre leves y moderados14 y una relación significativa entre el índice de actividad y al valor del colesterol HDL, la cual es inversamente proporcional y se observa en estados tempranos de la enfermedad, teniendo en cuenta la mediana de tiempo de seguimiento desde el inicio de los síntomas en este estudio.
Otras investigaciones similares no solo encontraron esta misma asociación, sino que observaron que valores de colesterol HDL inferiores a 39 mg/dL se asocian con otras enfermedades de base inmunológica como la diabetes mellitus tipo 1, la púrpura inmune primaria y la enfermedad celiaca15. Una variable que se observó común a otros estudios publicados es el sobrepeso, sin embargo, al realizar los análisis estadísticos se demostró que esta variable no altera la relación previamente establecida; de hecho, al realizar un subanálisis de los pacientes que tenían un IMC normal, se encontró una correlación negativa más alta entre la actividad de la enfermedad y los niveles de HDL4,14,16. La curva ROC en este subgrupo de pacientes muestra un AUC de 0,92 (IC 95% 0,73-1), lo que sugiere una buena capacidad de clasificar entre pacientes, con y sin actividad de la enfermedad.
Las variables del perfil lipídico de colesterol LDL, colesterol total y triglicéridos tuvieron un comportamiento similar al descrito en otros estudios13,17,18. En relación con los valores de colesterol HDL, los obtenidos en este estudio (42,6 mg/dL) son inferiores a la mayoría de los registrados en otros estudios, cuyo valor promedio oscila entre 49 y 69 mg/dL17,18. De igual manera, el porcentaje de pacientes con niveles de colesterol HDL menor a 40 mg/dL fue mayor en este estudio, comparado con otros (34 vs. 10-13%).
Lo anterior plantea la posibilidad de establecer un posible objetivo terapéutico en el manejo integral de pacientes con SSP, en relación con el control y el seguimiento del perfil lipídico, no solo por el alto riesgo cardiovascular que ya está establecido, sino por la posibilidad de que el colesterol HDL sea un marcador de actividad inmunológica. Así mismo, vale la pena plantear en futuros estudios si las estrategias enfocadas en el incremento de los niveles de colesterol HDL tienen impacto en el control de la enfermedad, lo que incentiva al análisis rutinario del perfil lipídico en pacientes con SSP, dado el posible impacto en la actividad de la enfermedad.
LimitacionesLas limitaciones de este estudio se relacionan con el carácter retrospectivo y la ausencia de seguimiento temporal, los que impide determinar la evolución en las variables evaluadas. Por otro lado, al realizar la revisión de historias clínicas hay un gran porcentaje de estas con datos clínicos incompletos, lo que conlleva una disminución importante del tamaño de la muestra.
ConclusionesEn este estudio se encontró que los pacientes con SSP con niveles bajos de colesterol HDL mostraban mayores índices de actividad de la enfermedad, con un punto de corte menor a 43 mg/dL, y al excluir a los pacientes con IMC, se observó una alta mejora del AUC de 0,92, con un punto de segregación de 38 mg/dL, lo cual debería ser explorado en otros estudios para determinar si podría ser útil para evaluar la actividad de la enfermedad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.