Las infecciones son una causa importante de morbilidad y mortalidad en pacientes con lupus eritematoso sistémico (LES). Conocer las infecciones que se presentan con mayor frecuencia en los pacientes con lupus podría permitir un diagnóstico y tratamiento oportuno. En este artículo se revisa la frecuencia de infección en pacientes con LES, las principales complicaciones infecciosas y los factores implicados en su desarrollo.
Infections are a major cause of morbidity and mortality in patients with systemic lupus erythematosus (SLE). Know which infections occur more frequently in patients with lupus may allow early diagnosis and timely treatment. In this article we review the frequency of infection in patients with SLE, major infectious complications and the factors involved in its development.
Dentro de las complicaciones asociadas al lupus eritematoso sistémico (LES) y su tratamiento, sobresalen las infecciones como un fenómeno frecuente, complejo y con graves consecuencias para el paciente, éstas ocurren tanto al inicio de la enfermedad como en etapas tardías. Diferentes factores, tanto genéticos como adquiridos, predisponen a los pacientes con LES a infecciones.
Aunque la mayoría de infecciones se deben a microrganismos comunes, también se presentan episodios graves por oportunistas, especialmente en usuarios de medicamentos inmunosupresores. Con frecuencia, no es fácil diferenciar un proceso infeccioso intercurrente de una exacerbación de la enfermedad y, en algunas ocasiones, pueden ocurrir simultáneamente, constituyendo un real desafío diagnóstico y terapéutico.
Se ha observado que los pacientes con LES que desarrollan infección requieren hospitalizaciones más prolongadas8. Desafortunadamente, el porcentaje de muertes a causa de infección en esta entidad, no ha variado en los últimos 50 años9.
MetodologíaSe realizó una revisión narrativa no sistemática de la literatura en idiomas inglés y español, que permitiera responder la siguiente pregunta: ¿cuál es la frecuencia de las complicaciones infecciosas, y cuáles los factores predisponentes a infección y los tipos de infección más prevalentes, en pacientes con lupus eritematoso sistémico?; limitada a los últimos 15 años, para información referenciada en las bases de datos: Pubmed, Embase y Lilacs. Utilizando las siguientes palabras en inglés: lupus erythematosus systemic, infection, opportunistic infection; y en español: lupus eritematoso sistémico, infección, infecciones, infecciones oportunistas. La búsqueda en Pubmed se desarrolló con los siguientes términos y descriptores: ((«Lupus Erythematosus, Systemic» [Mesh]) AND «Infection» [Mesh]) OR («Lupus Erythematosus, Systemic» [Mesh]) AND «Opportunistic Infections» [Mesh]. Con similar metodología se realizó búsqueda en Embase, sin encontrar artículos diferentes a los ya citados en Pubmed; en Lilacs se encontraron 5 artículos empleando la búsqueda: (lupus eritematoso sistémico) e (infección) en idioma español.
Se realizó la lectura de cada artículo y se seleccionaron los relacionados con la pregunta de interés; también se revisaron los escritos referenciados en los artículos resultantes de la búsqueda. En total se incluyeron 82 artículos (31 provenientes de la búsqueda en bases de datos y 51 referenciados en éstos).
Lupus eritematoso sistémico e infecciónLa frecuencia de complicaciones infecciosas en pacientes con LES varía de acuerdo con la serie1 (entre 26% y 78%); se estima que hasta el 50% de los pacientes con LES presentará una infección seria durante el curso de la enfermedad2,3. En algunos países las infecciones representan la primera causa de hospitalización en pacientes con LES y, dependiendo de la serie, las complicaciones infecciosas son la primera o segunda causa de mortalidad temprana1,3.
En la cohorte LUMINA, que incluyó 288 pacientes, a cinco años de seguimiento, fallecieron 34 individuos, siendo la infección la responsable del 32% y la actividad de la enfermedad del 41% de las muertes4; en la cohorte GLADEL, con 1.214 pacientes, la infección fue responsable del 14% de las muertes y la asociación actividad-infección del 44%5. En un estudio multicéntrico que incluyó 1.000 pacientes de siete ciudades europeas, las infecciones se presentaron en 270 sujetos (27%) y representaron el 28.9% de las muertes6. Igualmente, un estudio retrospectivo realizado en Brasil, en el que se evaluó el resultado de 113 autopsias de pacientes con LES, encontró que la infección fue responsable del fallecimiento en el 58% de los casos7.
Se ha observado que los pacientes con LES que desarrollan infección requieren hospitalizaciones más prolongadas8. Desafortunadamente, el porcentaje de muertes a causa de infección en esta entidad, no ha variado en los últimos 50 años9.
Factores que predisponen a infección en lupus eritematoso sistémicoLos pacientes con LES son más susceptibles al desarrollo de infecciones que la población general1,10. Esta mayor susceptibilidad obedece a factores genéticos, factores propios de la enfermedad (intrínsecos) y al uso de medicamentos inmunosupresores1,11,12 (factores extrínsecos) (tabla 1).
Factores que confieren susceptibilidad a infección en lupus eritematoso sistémico
| Factores que incrementan el riesgo de infección en LES |
| Genéticos (intrínseco) |
| Deficiencia heredada de complemento |
| Déficit homocigótico de lectina fijadora de manosa |
| Alelo R131 del receptor FcγRIIa |
| Relacionados con la enfermedad (intrínseco) |
| Alteración en la función de neutrófilos y monocitos |
| Anticuerpos contra FcγR |
| Disfunción y disminución del número de linfocitos |
| Disminución de receptores de complemento (CR2,CR3, CR4) |
| Menor producción de citoquinas (TNFα, IL-2) |
| Asplenia funcional |
| Otros relacionados con la enfermedad |
| Hipoalbuminemia |
| Nefritis |
| Neuropsiquiátrico |
| Actividad determinada por SLEDAI |
| Inmunosupresores (extrínsecos) |
LES: lupus eritematoso sistémico; MBL: lectina fijadora de manosa.
Dentro de los factores genéticos se encuentran: las deficiencias heredadas de proteínas del complemento (C1q, C2, C4, C5 y C8), el déficit de lectina fijadora de manosa (MBL) por polimorfismos y el alelo R131 del receptor FcgRIIa13. Los pacientes con LES y deficiencia heredada de proteínas del complemento que participan tempranamente en la activación de este sistema (C1, C2, C4) tienen alto riesgo de infección por Streptococcus pneumoniae y los que tienen deficiencias heredadas de proteínas del complemento que participan tardíamente (C5-C9) presentan mayor susceptibilidad a infección por Neisseria meningitidis3,14. Por su parte, la deficiencia homocigota de MBL3,15,16 confiere cuatro veces más riesgo de infecciones graves respecto a los pacientes sin el déficit3,16 y la presencia del alelo R131 del receptor FcgRIIa (produce baja afinidad a IgG2), que se relaciona con mayor riesgo de nefropatía en los pacientes con LES17,18, se asocia a un aumento de las infecciones bacterianas3,18.
Los factores propios de la enfermedad (intrínsecos) que predisponen a infección se relacionan con defectos en la inmunidad innata y adaptativa. En LES se han observado defectos en la quimiotaxis, el reconocimiento de microorganismos, la función fagocítica y el metabolismo oxidativo de los neutrófilos; algunos pacientes presentan anticuerpos antigranulocitos que generan neutropenia8; adicionalmente, la función fagocítica de monocitos y macrófagos puede estar alterada por la presencia de anticuerpos contra los tres tipos de receptores Fc gamma (FcgR), hay reducción en el número de receptores celulares de complemento (CR2,CR3,CR4) en linfocitos B, polimorfonucleares neutrófilos (PMN) y células dendríticas; y disminución en la producción de algunas citoquinas, como factor de necrosis tumoral alfa (TNF-a) e IL-219–21.
Los pacientes con LES pueden presentar anormalidades en la función y en el número de linfocitos T, en particular en los linfocitos ayudadores. Estas anormalidades constituyen un factor de riesgo para el desarrollo de infecciones por microorganismos intracelulares22–24. Algunos pacientes con LES desarrollan asplenia funcional (< 5% de los pacientes) y alteración en la opsonización (por déficit del complemento y MBL), lo que condiciona disminución de la capacidad del sistema retículo endotelial para eliminar microrganismos, incrementándose el riesgo de desarrollar infecciones serias por encapsulados25,26.
Otro factor que predispone a infección en LES, de gran importancia, es el uso de glucocorticoides27–32 (GCs) y otros inmunosupresores. La dosis de GCs a partir de la cual se incrementa el riesgo de infección aún no ha sido definida3,29,33; no obstante, algunos estudios han encontrado que los bolos de metilprednisolona confieren mayor riesgo. En el estudio realizado por Ramírez et al., en la Universidad de Antioquia, en el que se evaluó la asociación de actividad lúpica y el riesgo de infección nosocomial en pacientes con LES, se encontró, en el análisis multivariado, que el uso de bolos de metilprednisolona durante la hospitalización se asoció con el desarrollo de infección intrahospitalaria (OR 3.95; (IC 95% 1.22–12.8) p=0.02); este hallazgo también se describió en otro estudio realizado por Noëly et al.28,34. La disminución en la producción de citoquinas secundaria a la supresión del factor nuclear Kappa B (NFkB) y la inhibición de la función de PMN, monocitos y linfocitos T, son probablemente el mecanismo responsable del incremento del riesgo de infección con el uso de esteroides23,35.
En el estudio de Ramírez et al., se observó que los pacientes que recibieron en el último mes dosis de prednisolona menor a 20mg/día, presentaron menos infecciones que los que no recibieron GCs o estaban con una dosis superior a 20mg/día; este hallazgo se ha reportado también por otros autores. Aparentemente, estas dosis de GCs pueden corregir las alteraciones inmunes intrínsecas que confieren riesgo de infección en pacientes con LES activo30,34,36. Por su parte, la ciclofosfamida también se ha asociado con incremento del riesgo de infección, en particular por oportunistas como herpes zoster y Pneumocystis jirovecii. El riesgo es mayor cuando el nadir de los leucocitos es menor o igual a 3.000 cel/ml y se administran dosis altas de GCs simultáneamente11,28,37–41. Hasta el momento, el uso de azatioprina no parece incrementar el riesgo de infección por bacterias u oportunistas; no obstante, algunos autores refieren incremento en la frecuencia de infecciones virales. Chan et al. observaron que en pacientes con LES, la frecuencia de infección con el uso de micofenolato mofetil (MMF) es similar a la frecuencia de infección con ciclofosfamida. Se ha descrito mayor frecuencia de herpes zoster en los pacientes tratados con este medicamento42–45
Otros factores que se han relacionado con incremento en el riesgo de infección en pacientes con LES son: la hipoalbuminemia, la nefritis, una alta actividad de la enfermedad determinada por SLEDAI y el compromiso neuropsiquiátrico28,46–49.
Microrganismos, lugares y tipos de infección más frecuentesLos microrganismos más prevalentes en las infecciones de pacientes con LES son, en orden de frecuencia: las bacterias, los virus y los hongos.
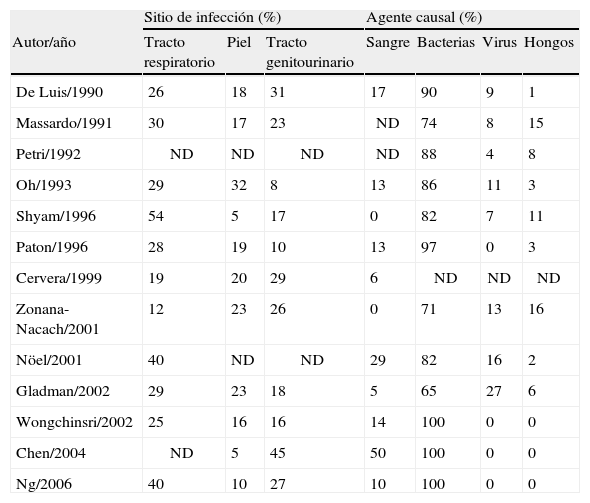
Cerca del 80% de las infecciones en estos individuos son causadas por bacterias. Las más frecuentes (50%) son: Staphylococcus aureus, Streptococcus pyogenes, Streptococcus pneumoniae y Escherichia coli2,27,28,48,50, otras menos frecuentes son Enterococcus spp, Klebsiella spp, Pseudomonas spp, Salmonella y Listeria. La piel y los tractos respiratorio y genitourinario son los sitios de infección más frecuentes51,52 (tabla 2).
Sitios de infección más frecuentes y microrganismos implicados en infecciones en pacientes con lupus eritematoso sistémico. Resultados de algunos estudios
| Sitio de infección (%) | Agente causal (%) | ||||||
| Autor/año | Tracto respiratorio | Piel | Tracto genitourinario | Sangre | Bacterias | Virus | Hongos |
| De Luis/1990 | 26 | 18 | 31 | 17 | 90 | 9 | 1 |
| Massardo/1991 | 30 | 17 | 23 | ND | 74 | 8 | 15 |
| Petri/1992 | ND | ND | ND | ND | 88 | 4 | 8 |
| Oh/1993 | 29 | 32 | 8 | 13 | 86 | 11 | 3 |
| Shyam/1996 | 54 | 5 | 17 | 0 | 82 | 7 | 11 |
| Paton/1996 | 28 | 19 | 10 | 13 | 97 | 0 | 3 |
| Cervera/1999 | 19 | 20 | 29 | 6 | ND | ND | ND |
| Zonana-Nacach/2001 | 12 | 23 | 26 | 0 | 71 | 13 | 16 |
| Nöel/2001 | 40 | ND | ND | 29 | 82 | 16 | 2 |
| Gladman/2002 | 29 | 23 | 18 | 5 | 65 | 27 | 6 |
| Wongchinsri/2002 | 25 | 16 | 16 | 14 | 100 | 0 | 0 |
| Chen/2004 | ND | 5 | 45 | 50 | 100 | 0 | 0 |
| Ng/2006 | 40 | 10 | 27 | 10 | 100 | 0 | 0 |
ND: no disponible.
En la tabla se omiten otros sitios de infección y agentes causales menos frecuentes. Modificado de: Alarcón GS. Infections in systemic connective tissue diseases: systemic lupus erythematosus, scleroderma, and polymyositis/ dermatomyositis. Infect Dis Clin North Am. 2006;20:849-75.
En el estudio del grupo de la Universidad de Antioquia, en el 18% de los casos no se aisló ningún microrganismo; en quienes se logró un aislamiento microbiológico, los bacilos Gram negativos representaron el 49%, los cocos Gram positivos el 26% y los hongos, virus y parásitos el 14,49%. Los microrganismos más frecuentes fueron: E. coli (21%), Klebsiella spp (8,7%), Staphylococcus aureus meticilino sensible (7,25%), Staphylococcus aureus meticilino resistente (7,25%), Candida spp (8,7%) y herpes virus34 (4,35%).
La infección de tejidos blandos por S. pneumoniae, que es inusual en adultos inmunocompetentes, se reporta con más frecuencia en pacientes con LES, al igual que la sepsis fatal por este microrganismo53,54; si se comparan con la población general, los pacientes con LES desarrollan con mayor frecuencia infección por Salmonella, debido a los defectos en la inmunidad discutidos previamente. Con frecuencia los pacientes con LES que sufren infección por Salmonella reciben tratamiento inmunosupresor y muchos desarrollan bacteriemia55,56.
En general, la prevalencia de bacteriemia en pacientes con LES fluctúa entre 16% y 47%8,57. La supervivencia a corto y mediano plazos es menor en los pacientes que la desarrollan57. En pacientes de origen asiático, los bacilos Gram negativos son los microrganismo más frecuentes en bacteriemias; en occidente son los cocos Gram positivos57.
Con respecto a las infecciones virales, se ha observado que la infección por herpes zoster es más común en pacientes con LES que en pacientes con otras enfermedades autoinmunes58. En LES ésta es la infección viral más frecuente27–29,48,59 (40%). Otros virus que afectan a pacientes con LES son: citomegalovirus y parvovirus B1960. Fiebre, artralgias, malestar general, erupción cutánea, linfadenopatía y citopenias, son manifestaciones de infecciones por virus que fácilmente pueden ser confundidas con un brote de lupus.
Infecciones oportunistasEn LES la mayoría de casos de infección micótica se debe a Candida spp, que con frecuencia genera afección orofaríngea, pero también puede producir infecciones urinarias, infecciones de tejidos blandos, fungemia e infección micótica invasiva. Otros hongos reportados han sido: Cryptococcus neoformans, que produce meningitis en la mayoría de los casos, y Aspergillus spp que genera afección pulmonar, del sistema nervioso central y cutánea61–64.
Diversos estudios han documentado un aumento de la susceptibilidad a la tuberculosis (TB) entre los pacientes con LES, especialmente en áreas donde la tuberculosis es endémica65–70. La prevalencia de TB en pacientes con LES varía considerablemente entre las diferentes series, situándose entre 2 y 11%67–69,71,72. Varios estudios han demostrado una dosis acumulada mayor de prednisolona antes de la infección por TB en pacientes con LES66,67,70. La TB en estos individuos presenta mayor afección extrapulmonar (entre 30 y 66%), compromiso pulmonar más extenso y recaídas más frecuentes67.
Actividad o infecciónCon frecuencia, resulta difícil diferenciar la actividad del LES de un proceso infeccioso intercurrente. Establecer el diagnóstico correcto es trascendental ya que la conducta terapéutica a adoptar es diferente. Así, el tratamiento innecesario con antibióticos en ausencia de infección conlleva riesgo de resistencia bacteriana y el uso de inmunosupresores en procesos infecciosos no controlados puede poner en riesgo la vida del paciente.
La actividad del LES puede generar temperaturas altas73 (hasta 41 °C [106 °F]), no obstante, la fiebre por actividad lúpica habitualmente desaparece dentro de los primeros dos a cinco días de tratamiento con esteroides, mientras que la fiebre por infección persiste74. En el estudio de Stahl et al., la leucocitosis, la neutrofilia, los calofríos y los anticuerpos anti-DNA negativos eran más frecuentes en presencia de infección y, la leucopenia, la linfopenia, la serositis, la poliartritis, la nefritis y la afección cutánea, en actividad de la enfermedad75. Sin embargo, el uso de esteroides puede producir leucocitosis y no siempre los pacientes con LES activo tendrán anti-DNA. Igualmente, algunas infecciones generan poliartritis, serositis, nefritis y manifestaciones cutáneas. Por su parte, Inoue observó que el recuento de leucocitos y el nivel de alfa 2 globulina en la electroforesis de proteínas ayudaban a diferenciar actividad de enfermedad de infección; el nivel de alfa 2 globulina se encontraría elevado en las infecciones76. El complemento suele estar disminuido en el contexto de actividad renal y normal, o incrementado en algunos procesos infecciosos, no obstante, puede estar normal en manifestaciones extra-renales y bajo en sepsis grave, endocarditis infecciosa, colonización de derivaciones ventrículo-peritoneales, glomerulonefritis posinfecciosa y otras condiciones no infecciosas como desnutrición, anemia hemolítica microangiopática, crioglobulinemia, hepatopatías, entre otras; adicionalmente, en situaciones de coexistencia actividad del lupus e infección, no establecería diferencias77.
Se ha propuesto la determinación de proteína C reactiva (PCR) como elemento útil para diferenciar la actividad de infección en LES. Otros reactantes de fase aguda como ferritina y velocidad de sedimentación globular no ayudan a establecer la diferencia, toda vez que se incrementan en ambas situaciones. Un incremento moderado en la PCR ha sido observado en pacientes con poliartritis78 y serositis por LES79 (en serositis media de 7,6mg/dl, comparado con exacerbación sin serositis, en la cual la media era 1,6mg/dl). Se acepta que incrementos mayores a 10mg/dl son inusuales en el contexto de actividad aislada80, sugiriendo un proceso infeccioso hasta que se demuestre lo contrario.
El papel de la procalcitonina para identificar infecciones bacterianas en LES permanece controversial. Un estudio demostró que los individuos con infección bacteriana o micótica tenían mayores niveles de procalcitonina (n=9) que aquellos con infecciones virales (n=3) o recaídas de la enfermedad (n=7) y que los controles sanos81 (n=11). No obstante, otro estudio reportó que en pacientes con LES e infecciones graves no se observó incremento en niveles de procalcitonina82, pero éste contó con pocos pacientes con infección sistémica (n=5). Un reporte reciente encontró que los pacientes con LES e infección bacteriana tenían niveles altos de procalcitonina, los cuales disminuyeron luego de tratar la infección (p=0.002) y, que los niveles de procalcitonina fueron significativamente mayores en pacientes con infección bacteriana, respecto a los pacientes con actividad de la enfermedad (p<0.001); adicionalmente, que eran mayores los niveles de procalcitonina en los pacientes con sepsis (p=0.028), pero, la sensibilidad de la procalcitonina para detectar infección bacteriana fue baja (38.2%) comparada con la sensibilidad de la PCR80. Este estudio sugiere que en pacientes con LES la PCR es más sensible que la procalcitonina para detectar infección bacteriana y que la procalcitonina es útil para establecer la presencia de sepsis (con mucha certeza pero con pobre sensibilidad).
ConclusiónLas infecciones son una causa importante de morbilidad y mortalidad (temprana y tardía) en pacientes con LES. En lupus hay incremento de la susceptibilidad a infección debido a factores intrínsecos relacionados con la enfermedad y la carga genética, y a factores extrínsecos condicionados por el uso de inmunosupresores. El reconocimiento oportuno de las infecciones intercurrentes es esencial para la pronta instauración de la terapia y, teóricamente, disminuir la mortalidad atribuida a infección que desafortunadamente no ha cambiado en las últimas décadas; es difícil establecer la diferencia entre actividad de la enfermedad e infección intercurrente y determinar la presentación simultánea. El mejor conocimiento de los patrones de infección en estos pacientes es esencial para planear estrategias de prevención de dichas complicaciones.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.