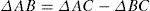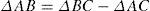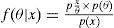Para el desarrollo de políticas sanitarias y económicas en el sector salud, es necesario que la toma de decisiones esté basada en la evidencia. El desarrollo de nuevas tecnologías para el cuidado de la salud se ha incrementado en las últimas décadas permitiendo la aparición, cada vez más rápida, de múltiples alternativas farmacológicas para el manejo de una misma patología; dada la cantidad de intervenciones se hace indispensable comparar las relevantes, en especial, mediante la realización de ensayos clínicos controlados, con el fin de evaluar y determinar la mejor alternativa en términos de beneficios, menores efectos adversos y costos. Sin embargo, debido a la ausencia de este tipo de estudios dado su alto costo, las comparaciones indirectas de tratamientos como las redes de meta-análisis y las comparaciones mixtas de tratamientos, son una herramienta útil para la selección de la mejor opción. Esta revisión, proporciona una orientación sobre la interpretación de las comparaciones indirectas, los métodos, supuestos, validez, métodos de análisis, beneficios y limitaciones, con el fin de proporcionar herramientas suficientes para la adecuada toma de decisiones en salud.
For the development of health and economic policies in the health system, it is necessary for decision making is based on evidence. The development of new technologies for health care has increased in recent decades, allowing the appearance, fastest growing, multi-drug alternatives for handling the same pathology, given the number of interventions is essential to compare all relevant specially through controlled clinical trials, to evaluate and determine the best alternative in terms of benefits, fewer side effects and costs. However, due to the absence of this type of study due to its high cost, indirect comparisons of treatments such as networks of meta-analysis and mixed treatment comparisons provide a useful tool for selecting the best treatment option. This review provides guidance on the interpretation of indirect comparisons, methods, assumptions, validity, analysis methods, benefits and limitations in order to provide sufficient tools for proper decision-making in health.
Los avances en las tecnologías farmacéuticas llevan a que las alternativas terapéuticas aumenten con el tiempo y los profesionales en salud deban decidir entre múltiples intervenciones que compiten entre sí. Sin embargo, tener un mayor número de alternativas terapéuticas crea una mayor necesidad de información relacionada con cada intervención1–3. En la práctica clínica, a pesar de los potenciales benéficos de tener un mayor número de alternativas, la selección de la mejor intervención terapéutica se puede dificultar debido a la falta de evidencia clínica disponible4–6. Por ejemplo, existen diversos medicamentos biológicos disponibles para el tratamiento de los pacientes con artritis reumatoide (AR) que no responden a medicamentos antirreumáticos modificadores de la enfermedad (DMARs, por sus siglas en inglés), principalmente el metotrexate, y aun así no existe suficiente evidencia clínica respecto a cuál sería el biológico más costo-efectivo.
La toma de decisiones en salud, idealmente debe considerar las condiciones clínicas de los pacientes, las necesidades, temores, preferencias y expectativas que estos tienen, con el fin de ofrecer el tratamiento más adecuado en cada caso, evaluando los riesgos y beneficios de cada alternativa, basándose en la evidencia clínica disponible y considerando también el costo-efectividad de cada intervención7–9. Por lo cual, la medicina basada en la evidencia (MBE) se ha consolidado como una herramienta fundamental para la toma decisiones en salud, enfocada a comparar la efectividad entre intervenciones médicas10–13.
La información más válida para tomar una decisión con respecto a una intervención médica proviene de los ensayos clínicos controlados aleatorizados (ECC), también denominados estudios «cabeza a cabeza» y de las revisiones sistemáticas o meta-análisis de ECC de alta calidad14–16. Estas comparaciones directas (CD) se han establecido como el «Gold Standard» para evaluar la eficacia y seguridad de las intervenciones médicas y para hacer las evaluaciones eco nómicas17–19. Para lograr ese objetivo, los ECC deben ser sólidos metodológicamente y ser capaces de detectar las diferencias mínimas clínicamente importantes y significativas entre las intervenciones evaluadas. Si un ECC se realiza con pobre calidad y múltiples sesgos, sus resultados pueden ser confusos y originar falsas interpretaciones, así, una aleatorización inadecuada puede incrementar la razón de disparidad, también conocida como «Odds Ratios» (OR) entre las intervenciones hasta en 41%, y un cegamiento inadecuado hasta en 17%. Los OR se consideran como una medida de asociación, definida como la razón entre la probabilidad de que ocurra un evento y de que no ocurra en términos de eficacia, siendo una medida similar al riesgo relativo20. En conclusión, un bajo poder del ensayo se traduce en una disminución en la probabilidad de detectar las diferencias entre las intervenciones17.
Bajo el contexto de la toma de decisiones y el proceso de evaluación de las tecnologías sanitarias, los estudios de efectividad o costo-efectividad, y especialmente los meta-análisis de los ECC de este tipo, se caracterizan por la combinación cuantitativa de resultados de estudios similares con diseño y población comparables16. En múltiples ocasiones los nuevos medicamentos son comparados contra placebo o con medicamentos de referencia, pero generalmente no se reportan CD con más de dos intervenciones, o con dos o más medicamentos recientemente aprobados1,4. Los meta-análisis tradicionales, que usan ECC de CD no pueden discriminar el efecto independiente de las diferentes intervenciones, ni comparar las diferencias en el efecto entre ellas, por lo cual, usualmente, se limitan a evaluar un solo tipo de intervenciones o las agrupan dentro de la misma clase terapéutica para calcular el efecto promedio de esas intervenciones pero no por separado21,22.
El desarrollo de cualquier ECC requiere de recursos importantes en tiempo, número de pacientes y costo, lo cual hace que no se realicen de forma rutinaria para todas las comparaciones posibles o relevantes en la práctica clínica, por lo anterior las CD entre los medicamentos no están siempre disponibles2,5,7,12,17. Cuando estas CD son insuficientes, o no existen, puede ser posible usar los diferentes resultados de los ECC para estimar los efectos relativos de los diferentes tratamientos. En este sentido, las comparaciones indirectas (CI) surgen como una muy buena alternativa para hacer objetiva la toma de decisiones en salud cuando los ECC de un tratamiento no estén disponibles4–6,23. Las CI y las redes de meta-análisis (RMA), pueden proporcionar información útil para comparar los efectos del tratamiento entre las intervenciones de interés y de esta manera apoyar la toma decisiones para escoger la mejor opción terapéutica1,24–26.
Materiales y métodosEl presente manuscrito corresponde a una revisión narrativa no sistemática de literatura desarrollada en los últimos 10 años en idiomas inglés y español. Se realizó una búsqueda y revisión de literatura en las bases de datos PubMed, Embase y Scielo utilizando los términos y frases «indirect treatment comparisons», «bayes theorem» [Mesh], «Meta-analysis as topic» [Mesh], «decision making» [Mesh], «models statistical» [Mesh], «comparative effectiveness researchs» [Mesh], «network meta-analysis» «meta regression analysis» y «mixed treatment comparison». Se utilizaron los descriptores booleanos AND/OR para cada uno de los términos y tener una búsqueda más sensible, dado el escaso material publicado hasta la fecha. Adicionalmente, se realizó selección manual de los artículos considerados de interés sobre el tema y se amplió la información mediante la revisión de artículos referenciados en los documentos encontrados inicialmente y literatura gris. Tanto la búsqueda como la selección de los artículos se realizaron de forma independiente por los diferentes autores y cada uno realizó lectura, análisis, asociación de nuevas referencias y construcción literaria para posteriormente ser analizada, validada por el grupo de autores y corregida bajo el mejor estilo literario. Se realizó lectura de cada artículo y se seleccionaron los relacionados al tema en cuestión. Se incluyeron en total 79 artículos.
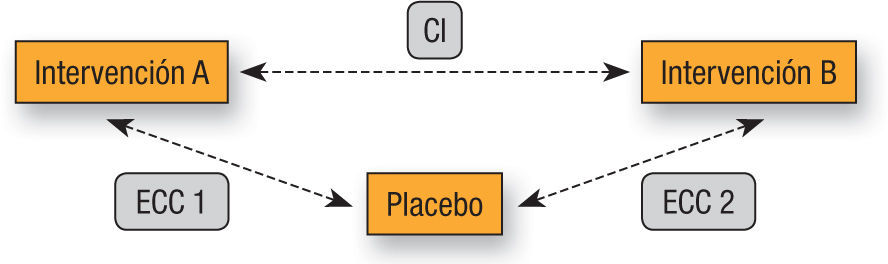
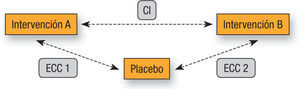
ResultadosComparaciones indirectasLas comparaciones entre intervenciones en salud se definen como indirectas si los efectos de las intervenciones que se comparan entre sí por su desempeño y efectividad, están mediadas por un comparador común (fig. 1), el cual puede ser placebo o una intervención activa, es decir, un medicamento de uso estándar15,16. Las CI no solamente se utilizan para realizar comparaciones entre medicamentos de la misma clase o dosis de la misma intervención, cuando por ejemplo, se realiza un sub-grupo de análisis, las comparaciones entre diferentes intervenciones farmacológicas versus cirugía o entre diferentes clases de medicamentos también se pueden apoyar en las CI3,24. Aunque la validez de las CI ha sido altamente cuestionada durante los últimos años, las evaluaciones de efectividad comparativa tendrán que depender de ellas en ausencia de CD y su interpretación dependerá de la metodología empleada10,16,17,27 (fig. 1).
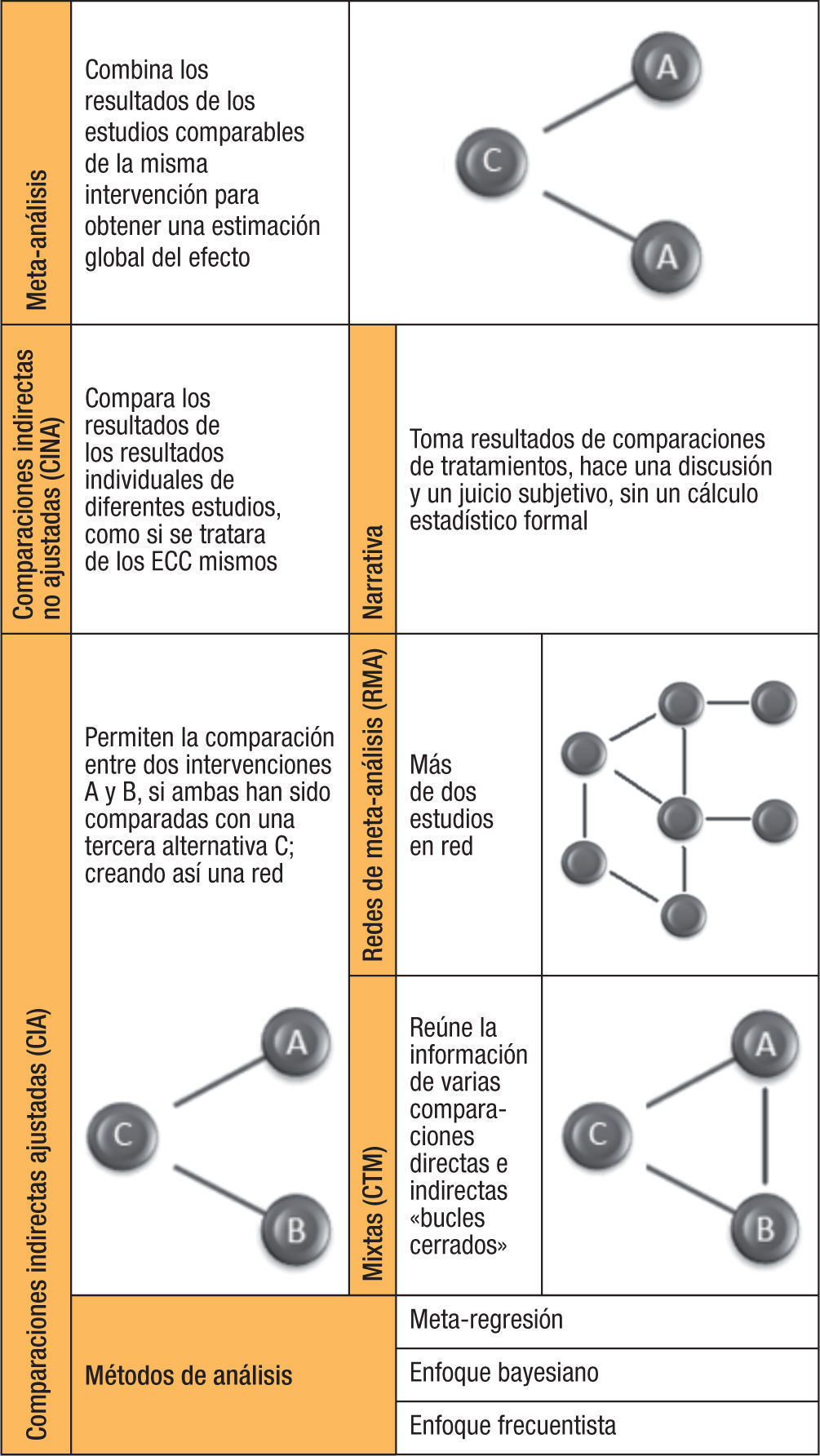
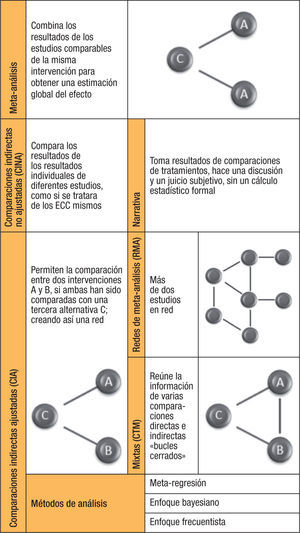
Existen diferentes formas de realizar una CI y las definiciones para cada una de ellas varían en la literatura. En general, los métodos para las comparaciones indirectas pueden clasificarse en dos categorías: comparaciones no ajustadas (CINA) o «Naive», en las cuales entrarían las comparaciones informales (CII); y comparaciones ajustadas formales (CIA) que utilizan el método de Bucher23. Dentro de las CIA existen métodos que las pueden subclasificar como análisis de meta-regresión (MR), la red de meta-análisis (RMA) que utiliza el método de Lumley, y los métodos bayesianos1,14,18,28. Por otro lado, hay un híbrido compuesto por las comparaciones mixtas que incluyen CD y CI, que igual pueden usar los métodos descritos anteriormente. Entre ellas las CINA son las que tienen mayor riesgo al sesgo, mientras que CIA y los análisis MR ofrecen un alto grado de validez14,15 (fig. 2).
Comparación indirecta no ajustada o «Naive»Las CINA se basan en la comparación de diferentes intervenciones usando datos de distintos estudios con un comparador común. La comparación de interés es entre las intervenciones A y B, que tienen a la intervención C como el comparador común, bien sea con placebo u otro fármaco, se comparan A y B de forma indirecta ignorando a C. Se realiza una agrupación meta-analítica de todos los grupos tratados con A para obtener una estimación global uA, y de la misma manera con todos los grupos tratados con B para obtener uB. Se rompe la asignación aleatoria dentro de los ECC y se tienen en cuenta los diferentes brazos de intervención individuales, de todos los estudios analizados, como si ellos fueran del mismo ECC15,16. Se denomina «CI no ajustada» porque no se ajusta para los eventos de la intervención C. Existen cuatro maneras de comparar el efecto global estimado uA y uB: cálculo de la estimación global de efectos uA versus uB, evaluar la diferencia entre uA y uB mediante significancia estadística, comprobar los intervalos de confianza entre ambos mediante sobre-posición, y comparación narrativa de la eficacia de A y B16.
La CINA ha sido ampliamente criticada por incrementar los sesgos y las sobre estimaciones, por ello los métodos de ésta no son recomendados y se consideran equivalentes a datos observacionales sujetos a sesgos similares1,14–16,22,29–32. Otro tipo de CINA, es la también llamada CINA narrativa, con menor poder de evidencia, la cual consiste en la discusión y juicio subjetivo, sin cálculo estadístico formal del efecto relativo ni de su significación estadística, a partir de los resultados de varias comparaciones de tratamientos en ECC. Comúnmente son empleadas en revisiones sistemáticas o narrativas temáticas, en las que por la gran diferencia entre las características de los estudios no es posible llevar a cabo un meta-análisis8,14,18.
Comparación indirecta ajustadaLas CIA son el primer método válido disponible que hace posible llevar a cabo CI15. Cuando no existen CD cabeza a cabeza que permitan obtener información de efectividad de intervenciones se puede recurrir a las CIA32. Las CIA han sido usadas durante los últimos años de manera común y más frecuentemente en revisiones sistemáticas que evalúan los efectos de las intervenciones farmacológicas disponibles. La síntesis de los datos no es derivada de ensayos cabeza a cabeza necesariamente, pero utilizan datos de múltiples ECC de manera indirecta7,32–35. Siendo la comparación de interés A vs. B, y C el comparador común para ambos tratamientos, que puede ser un medicamento o placebo, mediante métodos derivados del meta-análisis se calculan los efectos globales estimados uAC y uBC8,16. Para la comparación de ambos efectos globales estimados se utilizan los mismos métodos empleados para las comparaciones indirectas no ajustadas16.
El propósito de mantener la aleatorización es asegurar que los factores de confusión conocidos y desconocidos se distribuyan uniformemente a través de los grupos de tratamiento, en las CI no es posible conocer si estos factores de confusión A y B fueron distribuidos uniformemente entre los ensayos AC y BC, por lo tanto, la clave de este tipo de comparación, a diferencia de las comparaciones no ajustadas, es que no rompen la aleatorización inicial de cada ECC individual1,4,24,30,34. Las CI se pueden considerar similares a un análisis retrospectivo observacional29.
Los métodos estadísticos para las CI ajustadas deben cumplir con algunos supuestos, en este sentido, unos estudios consideran que el único requerimiento es que las poblaciones de los estudios individuales contengan alguna subpoblación en común, de otro lado, el supuesto de similitud asume que los factores modificadores del efecto del tratamiento son similares en los dos estudios o grupos de estudios, que se comparan en términos clínicos y metodológicos8,14. Para mejorar el poder estadístico de una CI ajustada, ésta puede combinarse con evidencia derivada de intervenciones cabeza a cabeza, para ello se cuenta, actualmente, con herramientas estadísticas que utilizan supuestos similares a los adoptados por los meta-análisis y las comparaciones pares, aunque requieren tener varios ECC2,14. En general, la validez de una CIA se garantiza por la calidad de los ECC, la homogeneidad de los resultados y la similitud entre los brazos de comparación8.
Las CI ajustadas utilizan el método sugerido en 1997 por Bucher et al.10, gracias a su menor complejidad, en éste las CI de las intervenciones nuevas y las clásicas son calculadas mediante los resultados de las CD entre ellas con una intervención de control, utilizando los OR como medida de estimación de los efectos30. Para ello, se pueden realizar las estimaciones mediante el uso de modelos de efectos fijos o de efectos aleatorios. El modelo de efectos aleatorios es el recomendado para prevenir la subestimación de los errores estándar en las CIA33. La CIA asume que la eficacia relativa de un tratamiento es la misma en todos los ECC incluidos, y asume la independencia entre las comparaciones por pares, que no se encuentran en los ECC de tres brazos26. Entre las limitaciones de este modelo se encuentra que únicamente puede ser aplicado a datos generados a partir de ECC de dos brazos, sólo se deben considerar efectos medidos mediante OR y comparaciones entre tres intervenciones A, B, C. Es importante recordar que cualquier sesgo en los estudios utilizados para las comparaciones podrá, también, afectar la validez de la CI27,33.
Entre los resultados de los efectos de los medicamentos comparados mediante CD y CI, no se han encontrado diferencias significativas, aunque los efectos en ECC cabeza a cabeza tienden a ser mayores en comparación con las CI ajustadas. Entre los factores que influyen en las diferencias se encuentran el azar, los sesgos de los ECC, los sesgos de la CIA, la heterogeneidad clínicamente significativa, las medidas del desenlace, las diferencias metodológicas y la variación de los efectos entre los subgrupos poblacionales35,36. En este sentido, las CIA surgen como una herramienta útil para rectificar e interrogar los resultados derivados del azar de los ECC cabeza a cabeza, el uso de las CIA debe ser extendido hacia los casos en que los ECC de CD son abundantes, como en la introducción de nuevas terapias. Las discrepancias entre las CD y las CIA deben ser cuidadosamente investigadas, con el fin de encontrar las explicaciones que deben incluir, principalmente, las deficiencias metodológicas y la heterogeneidad clínica significativa entre los ECC34.
Meta-análisis convencionalLos MA son una forma de revisión sistemática, cuantitativa, en la que los estudios individuales son combinados y resumidos matemáticamente, todos los estudios incluidos comparan la misma intervención con el mismo comparador1,36–39. El principal beneficio del MA consiste en resumir los estimados de los efectos de la intervención, el cual resulta ser, la mayoría de las veces, más preciso que los obtenidos de los estudios individuales, sin embargo, si la heterogeneidad de los estudios es muy grande y la calidad de los mismos es baja, el efecto estimado podría ser, incluso, menor. El estudio de la hetero-geneidad y la cuantificación del riesgo también son beneficios derivados de este tipo de estudio40. Esta herramienta se ha convertido en indispensable para la toma de decisiones en salud, considerándose como el más importante tipo de estudio en la jerarquía de la evidencia. El primer intento de resumir los resultados de estudios individuales fue realizado en 1904 por Karl Pearson, cuando examinaba el efecto preventivo de las inoculaciones de suero en el manejo de la fiebre entérica1,22,31,36,38,39,41–43.
La base estadística de los meta-análisis puede resumirse en dos modelos: 1) el modelo de efectos fijos, se basa en la suposición de que la única fuente de variación en los resultados es la que ocurre intra-estudio, es decir, que el efecto esperado de cada estudio es el mismo, así las diferencias encontradas en los resultados se deben a errores aleatorios (azar). Asume que los estudios son homogéneos, que no hay diferencias en población, criterios de selección de los sujetos y aplicación de tratamientos; y 2) el modelo de efectos aleatorios, asume que existe una distribución en los efectos, lo que da lugar a heterogeneidad entre los resultados del estudio, supone que los estudios incluidos en el meta-análisis son una muestra aleatoria de un universo de todos los estudios posibles, que respondan a una determinada pregunta de investigación. El modelo de efectos aleatorios incluye dos fuentes de variabilidad, intraestudio (error aleatorio) y entre estudios (heterogeneidad). Los efectos se ponderan según estas fuentes, así, los resultados varían en torno al efecto promedio global36,37.
Entre las limitaciones para garantizar los supuestos de los MA se encuentran la baja calidad de los estudios incluidos, los sesgos y la heterogeneidad; en este sentido es posible manejar esta última mediante el modelo de efectos aleatorios o de modelos mixtos que incluye efectos aleatorios más covariables. Cuando se realiza un MA debe ponerse de manifiesto que existe más heterogeneidad entre los resultados de los estudios incluidos de lo que se podría esperar por azar38,41.
La evaluación de la consistencia de los efectos a través de los estudios mediante la interpretación de la heterogeneidad entre ECC es un punto clave, por lo tanto, la heterogeneidad entre los resultados de los estudios debe ser analizada detenidamente para hallar su causa; ésta puede derivarse de las diferencias en las características de los pacientes incluidos en cada ECC, las cuales están relacionadas con la eficacia del tratamiento y también deben tenerse en cuenta las diferencias entre los criterios de inclusión y exclusión de los estudios (edad, severidad de la enfermedad, estratificación del riesgo). La identificación de las características de los pacientes como causa de heterogeneidad puede ayudar a identificar los tipos de pacientes que se pueden beneficiar o no de las intervenciones estudiadas34,40,43. De la misma manera, las características del diseño del estudio, tales como diferencias en los métodos de administración de la intervención, tiempo de seguimiento y calidad del diseño, pueden conducir a la heterogeneidad observada en el MA. Las variaciones entre poblaciones de áreas geográficas diferentes también aportan a la heterogeneidad40.
Red de meta-análisisLa RMA es una técnica de CI desarrollada por Lumley18, es un tipo especial de meta-análisis, considerada como una extensión de MA de comparaciones pares indirectas1,44. En los MA todos los estudios incluidos comparan la misma intervención con el mismo comparador, en un «network meta-analysis» o RMA este concepto se amplía mediante la inclusión de múltiples intervenciones pares (dos intervenciones son comparadas), a través de una serie de comparaciones y proporciona estimaciones del efecto con fines de efectividad comparada mediante los tratamientos múltiples1,22,44.
La RMA se caracteriza por combinar pruebas directas e indirectas para comparaciones pares, con lo que se obtiene una mayor síntesis de la evidencia disponible que el tradicional meta-análisis, permite la combinación de ECC que comparen diversos grupos de tratamiento, proporciona estimaciones del efecto relativo del tratamiento entre las intervenciones de la competencia y permite una estimación de los efectos heterogéneos de cualquier medicamento1,26,45. Por ejemplo, si dos tratamientos A y B nunca han sido comparados entre sí, pero se han comparado frente a un placebo C: los medicamentos A y B han sido superiores a C, mediante una red de meta-análisis se puede hacer una comparación indirecta entre A y B1,18,46. Las RMA se basan en la suposición de que en una escala adecuada, se pueden sumar y restar estimaciones de los efectos relativos del tratamiento, la diferencia (D) en el efecto entre los tratamientos A y B (DAB) es igual a la diferencia de efectos entre los tratamientos AC y BC y C47.
Una RMA se inicia con una red de prueba, las intervenciones de interés y los ECC que han comparado los tratamientos directamente. Su estructura, generalmente, es evidente a partir de un diagrama en el que cada nodo representa una intervención o una clase de tratamientos, y cada línea representa el enlace que conecta los tratamientos que han sido comparados directamente en uno o más ECC26. El principal supuesto de la RMA es que la comparación entre dos intervenciones puede ocurrir en un circuito cerrado (fig. 1), este diseño es necesario para calcular la inconsistencia entre la evidencia27. Otros supuestos son que los estudios combinados únicamente deben ser considerados si son clínica y metodológicamente similares y cuando se combinan evidencia directa e indirecta se asume la consistencia entre ambas26.
Un MA de una CD, usualmente, requiere que los estudios individuales estimen tanto el efecto del tratamiento común o los efectos de los tratamientos específicos del estudio, distribuidos alrededor de un valor típico. La selección entre un efecto común y la distribución del efecto da lugar a los enfoques de efectos fijos o aleatorios, respectivamente26,48. La heterogeneidad entre los estudios de una CD es aceptable, sin embargo, en la combinación de evidencia directa e indirecta la heterogeneidad conduce a una pérdida de similitud. Por lo tanto, en la RMA es necesario evaluar en todos los casos la heterogeneidad, consistencia y similitud26.
Las ventajas de la RMA son la capacidad de detectar inconsistencias entre los ECC de los diferentes tratamientos, estimar las diferencias de tratamiento y evaluar la incertidumbre en estas estimaciones18. La RMA se ha usado para comparar la eficacia de diferentes terapias antihipertensivas, evaluación de biológicos para el manejo de la artritis reumatoide, VIH y en análisis de costo-efectividad de diferentes terapéuticas10,22,25,49,50.
Las redes de MA son menos fiables que las CD aleatorizadas, pero son muy útiles en la planificación de CD y en los casos en que las CD no sean éticamente posibles o no se encuentren disponibles. Sin embargo, los resultados de las pruebas indirectas en conjunto con las directas pueden reforzar la evaluación entre las intervenciones consideradas, obteniendo una estimación más precisa y ampliar la inferencia a la población de la muestra1,2,14. Aun así, la inconsistencia posible entre los resultados de la comparación podría, en determinado momento, alterar la confiabilidad general de la red e impide la extrapolación de dichos resultados22. Otra limitación es que puede combinar la evidencia de ensayos muy heterogéneos de manera desapercibida, por lo que estudios de baja calidad metodológica o con diferencias clínicas pueden tener una influencia indebida en los resultados45.
Comparaciones de tratamientos mixtosNuevos métodos para evaluar la efectividad relativa de intervenciones competitivas con mayor coherencia y eficiencia, ofrecen oportunidades únicas para investigación en efectividad comparativa y soportar la toma de decisiones en salud13,51,52. El factor clave para decidir entre el uso de evidencia directa sola o una combinación con indirecta, es la cantidad de evidencia directa que existe, es decir, si se encuentra disponible una cantidad suficiente de evidencia directa con resultados conclusivos probablemente no sea necesario considerar las CI8,15. La combinación de evidencia directa e indirecta proveniente de los ECC, se conoce como comparaciones de tratamientos mixtos53,54 (CTM). Otro término para las CTM es meta-análisis de tratamiento mixto (MTM), y dada su similitud con el modelo propuesto por Lumley también se hace referencia a ellas como red de meta-análisis o parte de ellas27.
Las CTM son una generalización de MA de comparaciones pares, dirigidas a sintetizar la información sobre más de dos comparaciones, consideradas extensiones de los métodos de meta-análisis con gran potencial para estimar la efectividad comparativa de múltiples intervenciones, con base en ECC que individualmente no comparan todas las opciones de tratamiento13,15,30,53,55, mediante la realización de juicios coherentes sobre cuál de los tratamientos es el más efectivo y generación de estimaciones de los efectos relativos de cada intervención comparada con cada una de las otras analizadas en una red56.
El objetivo de una CTM es combinar toda la información disponible en un conjunto de estimados coherentes en la cual se respeta la aleatorización original de toda la evidencia incluida55. Las CTM permiten la estimación de la efectividad de cada intervención en relación con cada una de las otras, se hayan o no comparado directamente en ECC15,54,56. También permite calcular la probabilidad de cada tratamiento para ser el más efectivo entre el conjunto estudiado57. Este enfoque únicamente puede ser aplicado a redes conectadas de ECC que relacionen cada intervención de interés con otro tratamiento30,54,56,58.
La combinación de la evidencia directa e indirecta para tres o más tratamientos es posible mediante la manipulación de los resultados de comparaciones pares, por ejemplo, por medio del uso de resúmenes meta-analíticos de estas comparaciones para cada intervención. Extensiones de los modelos de efectos estándar (fijos y aleatorios) son comúnmente usados para este propósito, sin embargo, también se propone el uso de un modelo jerárquico bayesiano para k-comparaciones, donde k es el número de intervenciones por evaluar, el cual es una extensión natural de un modelo meta-analítico diseñado para sintetizar comparaciones entre tratamientos pares58,59. Usando métodos bayesianos que involucran cadenas de Markov de Monte Carlo, mediante herramientas de software como el «BayesianWinBUGS», es posible clasificar los tres o más tratamientos de interés y determinar una probabilidad que indique cuál de ellos es el «mejor». Ésta es una muestra potencial de la habilidad de los métodos estadísticos bayesianos para realizar declaraciones de probabilidad27,30,58.
Teniendo k cantidad de tratamientos por comparar con k ≥ 2, el tratamiento A representa el tratamiento de referencia en un modelo de meta-análisis de k comparaciones de tratamiento. Cuando es de interés comparar dos tratamientos pero la evidencia de ECC es limitada, las CTM pueden realizarse si existe suficiente evidencia para comparar cada tratamiento A y B frente a C. El tratamiento C actúa como el tratamiento de referencia y cada uno de los anteriores (A y B) debe ser comparado con C. Las DAC y DBC representan la eficacia relativa de los tratamientos A y B con relación al tratamiento C, respectivamente. Posteriormente, la eficacia relativa del tratamiento B en relación con el A puede obtenerse así27:
Los beneficios potenciales de extender los MA a enfoques de CI y CMT son multifacéticos30. Las principales ventajas de las CTM sobre otras CI como las propuestas por Bucher, et al.10, y Song et al.33, son su aplicación para evaluar la eficacia relativa entre dos o más intervenciones, mediante la combinación de toda la evidencia directa e indirecta en un análisis único y simultáneo de una gran cantidad de comparaciones, facilitar la deducción simultánea en relación con todos los tratamientos con el fin de compararlos, clasificarlos y seleccionar el mejor, optimizar el poder estadístico de las CI proporcionando estimaciones más precisas y reduciendo la incertidumbre con intervalos de confianza más estrechos en comparación con los resultados basados en CD o CI solamente, y permitir la comprobación formal de la consistencia entre la evidencia directa e indirecta mediante el análisis de ésta27,30,54,57,58. Por otro lado, mediante el uso de métodos bayesianos, como se comentó previamente, existe la posibilidad de determinar la probabilidad que tiene cada una de las intervenciones incluidas para ser la mejor entre el grupo de análisis. Sin embargo, entre las limitaciones de las CTM se encuentran la validez de los juicios hechos a priori y la complejidad del método.
Supuestos de una comparación de tratamientos mixtosLos supuestos requeridos para una CTM son exactamente los mismos relacionados con un meta-análisis de comparación par o una CI individual, excepto que se deben mantener para todo el conjunto de estudios y se basan en la consistencia entre las comparaciones. Factores como la variación del efecto del tratamiento dependiente de la severidad de la enfermedad pueden invalidar una CTM. No debe considerarse una limitación de la metodología, sino una limitación de los datos, ya que para una población definida el modelo será compatible por definición30.
Un supuesto fundamental en el modelo de efectos fijos de los meta-análisis es que el efecto real es una constante entre todos los estudios, asumiendo que todos los ensayos AB estiman el mismo efecto relativo de tratamiento de AB (B con respecto a A), y que todos los estudios AC, BC e inclusive CD, podrían estimar este efecto si ambos brazos A y B han sido incluidos en ellos. De otro lado, para un modelo de efectos aleatorios, se asume que los efectos relativos de tratamiento ensayo-específico provienen de una distribución común independientemente de si las intervenciones A y B fueron incluidas en el mismo estudio. Más fácilmente, si uno puede imaginar que cada ensayo incluye cada tratamiento, entonces, el supuesto clave es que los brazos faltantes son aleatorios, sin importar la eficacia del tratamiento. La mayoría de las dudas respecto a las CMT se refieren a si este supuesto de consistencia entre la evidencia directa e indirecta es seguro52,56,58.
En el caso en que se desee realizar CTM para combinaciones de tratamientos, los supuestos se basan en cómo los tratamientos interactúan entre sí cuando son combinados, de esta forma se pueden construir diferentes modelos de CTM: en los cuales todos los efectos son asumidos para ser completamente aditivos «modelo de efectos aditivos», cada tratamiento par puede interactuar «modelo de interacción de dos vías» o cada conjunto de tratamiento puede interactuar «modelo de interacción total». En términos de estimación de efectos comparativos entre todos los tratamientos el «modelo de interacción total» es idéntico al modelo de CTM convencional, el cual puede ignorar la dependencia entre la efectividad de las combinaciones de medicamentos, incluyendo la efectividad de la intervención individual57.
Evaluación de la consistencia en comparaciones de tratamientos mixtosLa consistencia se refiere a que cada intervención para el efecto verdadero del tratamiento se asume como similar para cada estudio en el análisis, independientemente de si el estudio asignó los pacientes a esos dos tratamientos. El supuesto de consistencia se puede considerar como una extensión del supuesto de homogeneidad y no debe ser tomado cuando uno o más de los efectos verdaderos de tratamiento son modificados por características particulares y los ensayos incluidos difieren con respecto a las características, por consiguiente, si las interacciones son detectadas, el supuesto podría ser poco realista y los resultados del ECC original serían cuestionables54. Los «modelos de inconsistencia» han sido propuestos para valorar la consistencia entre evidencia directa e indirecta en redes complejas. En tales modelos los factores de inconsistencia son adicionados a las ecuaciones básicas de consistencia y esta es valorada mediante la comparación de los modelos con y sin dichos factores. Sin embargo, es necesario revisar con más detalle las comparaciones específicas, para evidenciar más claramente en cada caso si la evidencia indirecta se combina o se suma a la evidencia directa para formar las estimaciones de las CTM56.
Existen, en principio, dos métodos para verificar la consistencia entre la evidencia directa e indirecta, ambos permiten la comparación de estimados basados en evidencia directa contra los basados en evidencia indirecta. El primer método es el «back-calculation» o cálculo retrógrado, que deduce la contribución de evidencia indirecta de la evidencia directa y el desenlace de un análisis de CTM, siendo útil cuando sólo los datos disponibles consisten en resúmenes combinados de comparaciones pares. El segundo «node-splitting» o separación de nodos es más general pero computacionalmente intensivo, separa la evidencia de una comparación particular (nodo) en directa o indirecta, y puede ser aplicado a redes en donde se encuentran disponibles datos a nivel de ensayo56.
Ambos métodos pueden ser usados para graficar las consistencias posteriores de los efectos de tratamiento obtenidos, usando evidencias directas e indirectas únicamente, lo cual ofrece una herramienta visual para valorar la concordancia entre ambos tipos de evidencia. Estas gráficas posteriores de consistencia no muestran únicamente cómo se comporta la consistencia entre las evidencias directa e indirecta, sino también el grado de precisión con el que se comparan entre sí y cómo afectan el estimado final de la CTM. El grado de concordancia entre las evidencias directa e indirecta (solapamiento entre ambas curvas) es medido formalmente por los p-valores bayesianos56.
Métodos de análisisPara sintetizar los resultados de los diferentes ECC en las CI que comparan más de dos intervenciones simultáneamente y obtener sus efectos relativos estimados, es necesario utilizar métodos estadísticos complejos que preserven la aleatorización y brinden beneficios adicionales según el resultado que se desea obtener. Para la mayoría de los modelos de análisis se podría seguir ya sea un enfoque frecuencial o una aproximación bayesiana. En la práctica actual de la mayoría de los meta-análisis para las comparaciones directas se utilizan métodos frecuentistas. Para los modelos más complicados, en particular las redes que implican comparaciones de tratamientos mixtos, los métodos bayesianos han sufrido sustancialmente mayor desarrollo, facilitado por los avances en la informática que apoyan su intensidad computacional y la necesidad de controlar la convergencia a la distribución posterior1,15,27.
Enfoque frecuentistaLa estadística frecuentista ha sido el enfoque dominante en la investigación clínica durante las últimas cinco décadas26,60. La etiqueta de «frecuentista» se aplica a la mayoría de los métodos estadísticos tradicionales aplicados al hacer comparaciones, incluyendo las medias ponderadas con intervalos de confianza (sobre la base de una distribución normal asumida). En este modelo, la probabilidad es el límite de la frecuencia relativa, y asume que el experimento se puede repetir bajo condiciones idénticas. Sin embargo, solo aplica a eventos que aún no han ocurrido y a fenómenos repetitivos como lanzar una moneda26.
La principal virtud del enfoque tradicional es el rigor extremo y la estrechez del enfoque para el experimento de interés, sin embargo, la inflexibilidad relacionada con este enfoque limita la innovación en el diseño y el análisis de los ECC. Por esta razón los ECC tienden a ser extensos y costosos. La inferencia estadística frecuentista es un enfoque inverso al bayesiano. Se centra en que la probabilidad de los resultados de un ensayo supone que una hipótesis particular es verdadera. Así, un p-valor frecuentista es la probabilidad de observar resultados más extremos que los resultados observados, suponiendo que la hipótesis nula es verdadera por lo que existe una fuerte dependencia de las conclusiones sobre el diseño, ambas características actualmente son cuestionables científicamente13,60–62.
Técnicas de meta-regresión para CILos métodos de meta-regresión (MR) han sido usados cada vez más frecuentemente en CI, su popularidad consiste en su potencial para explicar la heterogeneidad de los estudios y ajustar los factores de confusión, con el fin de apoyar las decisiones clínicas en cuanto a cómo, dónde y para quién un tratamiento es benéfico36,40,43.
Las MR involucran el estudio de múltiples variables mediante modelos de regresión, que explican la variación en el desenlace y si la heterogeneidad es dada por una o más características del estudio, de la población o del tratamiento. Su objetivo es relacionar la magnitud del efecto de una o más características de los diferentes estudios incluidos36,40,43,53,63–65. En ella los efectos globales estimados uAC y uBC, siendo C el comparador, son calculados de manera separada en dos modelos de regresión. Además de ajustar los efectos en los grupos de los comparadores, los modelos de regresión pueden ajustarse para los efectos de las diferentes variables consideradas para controlar la heterogeneidad, por ejemplo: la edad de la población o la severidad de la enfermedad16. En este sentido, las CIA pueden ser vistas como una de las formas más simples de MR24.
Los factores predictores de la regresión de cada estudio incluyen el protocolo, las características de la población o variables que describen la logística del mismo. Las preguntas que se pueden resolver mediante una MR incluyen la estimación de los efectos de las intervenciones, controlando las diferencias entre los estudios, y la determinación de múltiples variables que pueden comprometer la heterogeneidad64. Las asociaciones derivadas de una MR son observacionales y, por lo tanto, tienen una interpretación más débil que las relaciones causales derivadas de comparaciones aleatorizadas52.
Enfoque BayesianoLos métodos estadísticos bayesianos han venido siendo usados en investigación clínica y farmacológica cada vez más, el uso del enfoque Bayesiano representa un cambio fundamental en la conducta de la investigación médica, como consecuencia del progreso rápido en el desarrollo de medicamentos y el menor costo de los mismos53,60,61,66,67. En la teoría frecuentista los parámetros distribucionales (media, varianza, proporción, etc.) son fijos y desconocidos. En el enfoque bayesiano estos parámetros se asumen aleatorios. La inferencia bayesiana exige el conocimiento de una probabilidad a priori, es decir, conocida de antemano (estudios previos, experiencia, opinión de expertos, un ensayo previo o actual) y de los datos obtenidos, con lo que se procede al cálculo de la verosimilitud (likelihood) y, finalmente, se obtiene una probabilidad a posteriori26,27. La verosimilitud es una función de los parámetros de un modelo estadístico que permite realizar inferencias acerca de su valor, a partir de un conjunto de observaciones. No debe confundirse con el término probabilidad el que a partir de una serie de parámetros conocidos permite realizar predicciones acerca de los valores que tomaría una variable aleatoria62.
Si la distribución posterior se encuentra en la misma familia que la distribución de probabilidad anterior son, entonces, llamadas distribuciones conjugadas o un “conjugate prior” de la verosimilitud. Por ejemplo, la familia gaussiana se conjuga a sí misma con respecto a una función de probabilidad gaussiana: si la función de probabilidad es gaussiana, la elección de una gaussiana antes sobre la media asegurará que la distribución posterior también sea gaussiana. Consideremos el problema general de inferir una distribución para un parámetro u dado algún dato x, por el teorema de Bayes, la distribución posterior p(δ|x) es igual al producto de la función de verosimilitud θ → p(δ|x) y la distribución anterior, p(θ) dividido por la probabilidad de los datos p(x) 66,68.
Una RMA puede realizarse dentro de un marco bayesiano o frecuentista. Con un enfoque frecuentista, el resultado del análisis es una estimación puntual con un intervalo de confianza del 95% (IC). Un IC del 95%, bajo muestreo repetido, contendría el parámetro real de la población del 95% de las veces. Debe tenerse en cuenta que la CI obtenida con un enfoque frecuentista no puede ser interpretada en términos de probabilidades, el IC del 95% no significa que hay 95% de probabilidad de que la población valor está entre los límites del intervalo1. Los métodos bayesianos implican una combinación formal de una distribución de probabilidad previa, lo que refleja la creencia previa de los valores posibles del parámetro del modelo de interés, con una distribución de probabilidad de estos parámetros sobre la base de los datos observados, para obtener una distribución de probabilidad posterior correspondiente1,27.
El modelo jerárquico bayesiano fue propuesto en 1995 por Smith, Spiegelhalter, Caldwell y Thomas59; y, a su vez, el más completo de los diferentes modelos propuestos para la realización de la red meta-análisis Bayesiano parece ser el propuesto por Lu y Ades27. Es la continuación de los modelos anteriores propuestos por Caldwell y Smith, basado en la implementación de las técnicas de integración numérica de cadenas de Markov de Monte Carlo (CMMC), como metodología alternativa a los modelos de efectos fijos y aleatorios para meta-análisis de comparaciones pares, y se ha extendido al modelo general para CTM de k-tratamientos15,27,58,59.
La necesidad de una distribución a priori para el elemento que no se conoce, pero que se desea conocer a través de la observación, es el principal problema con este enfoque. Este es un punto importante, ya que la distribución posterior estimada puede cambiar considerablemente en función de la anterior elegida. Afortunadamente, es posible encontrar antecedentes poco informativos, que no afectan el resultado. Tales distribuciones previas poco informativas parecen decir que antes del análisis (es decir, antes de que se han observado los primeros datos), cualquier valor es posible que el verdadero valor de un determinado parámetro y que, por lo tanto, no se justifica para favorecer a uno más que a otro27.
Una ventaja de los enfoques bayesianos es que el método conduce naturalmente a un marco de decisión que apoya la toma de decisiones, además, permite a los investigadores actualizar el conocimiento mediante la acumulación de información en ensayos. Tal actualización puede ocurrir en un momento dado o de manera continua en el tiempo con la posibilidad de modificar el diseño del estudio, lo que incluye desequilibrar la aleatorización para favorecer terapias con mejor desempeño, quitar o adicionar brazos de tratamiento y cambiar la población de estudio para concentrarse en los subgrupos de pacientes que responden mejor a las terapias experimentales66. Para una RMA, una ventaja específica es que la distribución de probabilidad posterior permite el cálculo de la probabilidad de que una de las intervenciones que compiten es mejor. Este aspecto de un análisis bayesiano permite proporcionar información que es directamente relevante para los tomadores de decisiones de atención de salud. En este sentido los enfoques bayesianos son únicos27,53,61,62.
Los métodos bayesianos tienen grandes ventajas en el campo del desarrollo de medicamentos. Entre ellas se incluye la capacidad de sintetizar información, el proceso de actualizar el conocimiento de manera progresiva en cualquier momento y sin restricciones, como resultado de la acumulación de información en cada ECC, la utilidad vinculada a la toma de decisiones en salud, la capacidad de calcular y utilizar probabilidades de predicción de distribución de resultados futuros con base en los resultados actuales, la construcción de modelos jerárquicos para apropiarse de la información entre terapias o subtipos de enfermedad, donde la fuerza de endeudamiento depende de la homogeneidad de los datos y estimación de la evidencia directa para efectos de interés, usando la probabilidad posterior en lugar de calcular indirectamente la probabilidad de los datos observados, suponiendo efectos particulares mediante el uso de p valores13,61,65,66,69,70.
La investigación en efectividad comparativa, es el análisis de toda la evidencia disponible de los diferentes estudios que abordan un problema determinado en términos de riesgo vs. beneficio. Se considera el enfoque estadístico bayesiano como el método ideal para este tipo de investigaciones, dado que es inherentemente sintético y además no tiene limitaciones filosóficas en cuanto a la capacidad de analizar en simultáneo toda la evidencia disponible53,60,69. Sin embargo, no es la panacea, aunque tiene múltiples ventajas sobre el uso del enfoque frecuentista, por ejemplo, no es inmune a los sesgos ya que no puede convertir la evidencia de pobre calidad en buena evidencia, aunque puede incluir la posibilidad de hallar sesgos, es usualmente difícil obtener información sobre ellos y, generalmente, se incluyen desapercibidos en la distribución a priori y lucha de la misma manera que el enfoque frecuentista con los datos perdidos; y aunque intenta el rescate de datos perdidos mediante imputación múltiple, no logra la credibilidad suficiente y, por lo tanto, el vacío persiste de alguna manera70,71.
Las consecuencias de tomar un enfoque bayesiano para el diseño de un ECC son la eficiencia, la comparación de intervenciones en ausencia de comparaciones cabeza a cabeza, la selección del mejor tratamiento para los pacientes en el ECC y la gran precisión en relación con los desenlaces primarios, por ejemplo, la relación entre desenlaces tempranos y tardíos13,67.
Validez, calidad y problemas metodológicosLas CI tienen muchas limitaciones y no logran sustituir los ECC, por lo tanto, es importante ser consciente de ellas para definir cuándo se pueden utilizar y en qué medida sus resultados son válidos y confiables28. Es imprescindible, entonces, analizar su validez interna y externa, de la misma manera que para todos los estudios y métodos. Son tres los pilares fundamentales para garantizar la validez interna de las CI: 1) la identificación adecuada de los estudios, 2) la alta calidad de los estudios incluidos y 3) el grado de sesgo de confusión debido a violaciones de similitud y consistencia1,6,27.
La calidad de una CI dependerá de diversos factores, incluida la metodología escogida y la validez de los supuestos. En varias áreas clínicas la evidencia de alta calidad no existe o es inconclusiva, por lo que el desarrollo de CI es una alternativa útil3. La validez está condicionada a la validez interna de los ECC individuales incluidos, y es importante tener en cuenta que no es posible obtener resultados de buena calidad en una combinación, si los estudios incluidos son de baja calidad, aunque hayan sido bien seleccionados28.
Los supuestos clave de las CI son la similitud clínica y metodológica, la consistencia y la homogeneidad, éstos pueden considerarse como una extensión del supuesto original de homogeneidad en los MA. La valoración de dichos supuestos es vital para asegurar la calidad, validez e interpretación correcta de los resultados de las CI, por lo que cualquier violación a estos principios puede invalidar la CI3,28.
El supuesto principal de las metodologías de CI es la si militud entre los efectos de tratamiento, esto es, el efecto verdadero del tratamiento en la comparación de dos o más intervenciones sería similar entre todos los estudios independientemente si se incluyen una o ambas de dichas intervenciones. Si el supuesto de similitud se viola, la validez de la CI será cuestionable y es necesario valorar en qué forma influye en el resultado. La similitud, sin embargo, es difícil de valorar dado que no existen métodos estándar que determinen el supuesto de similitud aunque se proponen los análisis de sensibilidad, análisis de subgrupos y MR1,3,6,14,24,26,27.
La consistencia se refiere a que los resultados entre la evidencia directa e indirecta para la misma comparación de tratamiento sean similares, en caso contrario se deben investigar las causas de la discrepancia3,28. Las razones potenciales para que no haya consistencia entre las CD y CI incluyen: el azar, la heterogeneidad clínica, la heterogeneidad metodológica, la heterogeneidad estadística, la medida del efecto, los sesgos de publicación y, por último, el informe selectivo de desenlaces o de los análisis1,28,33.
Por último, si en la CI se van a utilizar resultados obtenidos de un MA, es necesario que los estudios que se combinan sean similares y sus resultados sean homogéneos. Esta variabilidad se define como heterogeneidad y es la variabilidad en el resultado medido en cada estudio con respecto al resultado global promedio3,6,72. Según Thompson, la heterogeneidad se clasifica en clínica y de diseño1,6,64. La heterogeneidad clínica se refiere a que los estudios no se relacionan con el objeto de interés, es decir, comprende las diferencias entre las poblaciones estudiadas para el mismo tratamiento o las diferencias en los desenlaces medidos, por lo que no depende del investigador64. Por su parte, la heterogeneidad de diseño es susceptible de control por parte del investigador ya que puede decidir cuándo el estudio debe ser retrospectivo o prospectivo, cuánto es el tiempo de seguimiento, qué desenlace será medido y los métodos estadísticos que serán empleados, entre otros1,6,28,64.
A diferencia de la similitud, si existen métodos estándar para valorar la homogeneidad, ésta puede cuantificarse mediante la prueba de Chi-cuadrado (Estadístico Q), aunque tiene un bajo poder estadístico, y el Test I2 que es la proporción de la variación de cada estudio respecto a la variación total. Valores del 25%, 50% y 75% corresponderían a una heterogeneidad baja, moderada y alta, respectivamente. De la misma manera, las características del diseño del estudio tales como diferencias en los métodos de administración de la intervención, tiempo de seguimiento, factores de calidad del diseño, pueden conducir a heterogeneidad que es observada en el MA. Las variaciones entre poblaciones de áreas geográficas diferentes también aportan a la heterogeneidad3,6,40,73.
Es importante recordar que la calidad de las revisiones y, por lo tanto, de las CI depende de preservar la aleatorización original de los ECC incluidos, la aplicación de medidas del efecto del tratamiento y de la precisión. También se considera alta calidad si la homogeneidad se mide por algún método como el test de Chi-cuadrado, I-cuadrado estadístico o la estimación entre la varianza de los estudios en un modelo de efectos aleatorios. La valoración de la consistencia y el supuesto de inconsistencia cuando se combina evidencia directa con indirecta, también mejoran la calidad de la comparación3,26.
En general, se considera que el supuesto básico de los meta-análisis de efectos fijos es la homogeneidad, para las CIA se requiere, además, suponer la similitud, y para la combinación de evidencia directa e indirecta ajustada, es necesario añadir el supuesto de consistencia entre la evidencia mediante los modelos de efectos fijos o aleatorios, dado que aunque la CIA sea válida puede no ser consistente con la evidencia directa de ECC, debido a la heterogeneidad clínica significativa14.
La validez externa analiza en qué medida se pueden extrapolar los resultados a una población particular o de interés y está limitada por la validez externa de cada ECC incluido en la red de ensayos. Desde el punto de vista de la toma de decisiones, cierta heterogeneidad entre los ECC en la red de ensayo puede aumentar la validez externa, siempre que la heterogeneidad en las CD sea superior a la variación de los modificadores del efecto entre los estudios de la CI para evitar violaciones de similitud y los sesgos tanto como sea posible1,28.
Utilidad de las comparaciones indirectas en artritis reumatoideLa artritis reumatoide (AR), es una enfermedad crónica, autoinmune, de etiología desconocida, que se caracteriza por la inflamación progresiva y el daño articular irreversible; llevando finalmente a una disminución de la calidad de vida y mortalidad prematura74–76. Los medicamentos modificadores de la enfermedad (DMARs) solos o combinados han demostrado su capacidad para retrasar la progresión de la enfermedad77. Aquellos pacientes con AR activa temprana y establecida, de intensidad moderada-severa, que han fracasado a tratamiento con DMARs, incluido metotrexate (MTX), son candidatos a recibir terapias biológicas76. Actualmente, se dispone de ocho agentes biológicos para el tratamiento de la AR: cinco medicamentos que actúan bloqueando el factor de necrosis tumoral alfa (anti-TNF): infliximab, etanercept, adalimumab, certolizumab y golimumab; un inhibidor de la IL-1: anakinra; una proteína de fusión moduladora de la activación de células T: abatacept y un anticuerpo monoclonal contra el receptor de la IL-6: tocilizumab19,76,77. Todos estos agentes han sido probados frente a MTX para la eficacia en la prevención de progresión de la enfermedad en varios ECC77.
Aunque los biológicos típicamente han sido comparados con placebo, no existen ECC comparando medicamentos biológicos cabeza a cabeza. Se hace necesario conocer la efectividad y seguridad para decidir sobre el mejor tratamiento para cada paciente19,77. Por lo tanto, dado el elevado costo de estos medicamentos se hace necesario usar otros métodos como las CI para ayudar a la toma de decisiones en el área de la reumatología. Hasta el momento se han realizado diversas CI para evaluar la eficacia de los diversos tratamientos para la AR. En una de las CI encontradas en la literatura, que comparó la efectividad de DMARs y biológicos, encontró que todos los DMARs y biológicos fueron significativamente más eficaces que el placebo en el siguiente orden: certolizumab, tocilizumab, rituximab, infliximab, etanercept, adalimumab, golimumab, abatacept, anakinra, y MTX. En las comparaciones por parejas, cada clase fue más eficaz que el MTX, pero ninguno fue más eficaz que otro19. Mientras una CI sobre biológicos, evidenció que en comparación con el placebo, los biológicos se asocian con una mayor mejoría clínica ACR50 (American College of Rheumatology). Sin embargo, los biológicos se asociaron con más eventos adversos y anakinra fue el menos eficaz de todos los otros biológicos. Dentro de los resultados más representativos de este estudio, anakinra fue menos efectivo que el adalimumab y etanercept, y etanercept fue más seguro que adalimumab, anakinra e infliximab78. En otra CI de biológicos, en pacientes con AR previamente tratados con MTX y biológicos en ausencia de comorbilidades, no existen diferencias entre infliximab, etanercept, adalimumab, certolizumab, golimumab, abatacept, anakinra y tocilizumab en la eficacia en términos de respuesta ACR20, ACR50, ACR70, ni en la interrupción del tratamiento debida a efectos adversos76. Por otro lado, los resultados de una CI publicados en Cochrane respecto a la eficacia de los biológicos en el tratamiento de AR, mostraron que los anti-TNF son similares, se encontró una única diferencia respecto al infliximab que fue superior a anakinra en la mejoría del ACR2079.
Finalmente, en ausencia de ECC de comparaciones cabeza a cabeza que evalúen la eficacia y seguridad de medicamentos biológicos para el tratamiento de enfermedades autoinmunes, y especialmente los que comparen la eficacia de biológicos en el tratamiento de la AR, las CI, como son las CTM y las RMA surgen como una herramienta complementaria para ayudar a profesionales de la salud y dirigentes públicos en la toma de decisiones en salud21.
ConclusionesPara la toma de decisiones en salud es necesario contar con evaluaciones económicas, de efectividad y seguridad de las diferentes alternativas de intervención; para ello los estudios de comparaciones directas tipo ECC «cabeza a cabeza» serían la mejor elección. Si n embargo, este tipo de estudios casi nunca están disponibles debido, principalmente, a su elevado costo. En estas situaciones, se hace necesario contar con otras herramientas de análisis como lo son las CI. Las CI de tratamientos permiten utilizar modelos estadísticos que evalúan el efecto de cada terapia y compararlas entre sí, convirtiéndose en una herramienta complementaria para apoyar la toma de decisiones en salud. Por ejemplo, si una comparación entre las intervenciones A y B es necesaria, pero sólo existe una comparación entre A y C, y una entre B y C, es posible emplear las CI con el fin de determinar estadísticamente cuál sería la mejor intervención. En cuanto a qué tipo de CI usar, los diferentes métodos tienen sus ventajas e inconvenientes. Las RMA y especialmente las CTM parecen ser los mejores métodos cuando se tiene tanto evidencia directa como indirecta. Por último, para las buenas prácticas de investigación, así como para una adecuada toma decisiones en salud, se debe tener en cuenta que los resultados obtenidos de las CI pueden llevar a erradas interpretaciones de sus resultados dada su naturaleza y ser susceptibles a sesgos y errores. Por lo tanto, se hace necesario conocer las ventajas y limitaciones de las CI, así como comprender adecuadamente los supuestos básicos de ellas y aplicar la más adecuada para cada situación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.