Presentar el caso de una paciente inmunosuprimida que desarrolló una enfermedad autoinmune.
Pacientes y métodosMujer de 30 años, inmunosuprimida por antecedente de trasplante hepático ortotópico, que desarrolló infección intestinal por citomegalovirus y hemorragia alveolar.
ResultadosLa paciente presentó hallazgo serológico positivo para ANCA PR3. Se clasificó como granulomatosis con poliangitis. Por su antecedente, se consideró inducción y mantenimiento con un anti-CD20, sin nueva recaída durante un seguimiento de 6 meses.
ConclusiónLos pacientes con inmunosupresión tienen factores de riesgo para desarrollar enfermedades autoinmunes.
To present the case of an immunosuppressed patient who developed an autoimmune disease.
Patients and methods30-year-old woman, immunosuppressed due to a history of orthotopic liver transplant, who developed intestinal infection by cytomegalovirus and alveolar haemorrhage.
ResultsPatient presented a positive serological finding for PR3 ANCA, classified as granulomatosis with polyangiitis. Due to her history, induction, and maintenance with an anti-CD20 were considered, with no further relapse over 6-month follow-up.
ConclusionImmunosuppressed patients have risk factors for developing autoimmune diseases.
Las vasculitis asociadas a anticuerpos anticitoplasma de neutrófilo (VANCA), como la granulomatosis con poliangitis (GPA), la poliangitis microscópica y la granulomatosis eosinofílica con poliangitis, son enfermedades autoinmunes (EAI) que afectan predominantemente vasos sanguíneos de pequeño calibre1. Estas enfermedades tienen una incidencia, en una cohorte de 20 años en Estados Unidos, de 1,3, 1,6 y 0,4 casos por 100.000 habitantes para GPA, poliangitis microscópica y granulomatosis eosinofílica con poliangitis, respectivamente, con una prevalencia total de 42,1/100.000 habitantes. La edad promedio de presentación es de 61,1±16,5 años2, y la relación hombre:mujer es de 1,5:13. La GPA es más común en población europea y la poliangitis microscópica en asiáticos4. En Colombia, la GPA constituye el 9,4% de los casos5.
Las VANCA pueden comprometer órganos importantes, como los riñones y el tracto respiratorio4; una de las manifestaciones más severas es la hemorragia alveolar (HA). Esta condición se caracteriza por hemoptisis, anemia, infiltrados pulmonares e insuficiencia respiratoria hipoxémica, con una histopatología que incluye acumulación de hemosiderófagos, capilaritis pulmonar o enfermedad pulmonar blanda6,7. Las complicaciones son particularmente graves en pacientes inmunocomprometidos, como aquellos trasplantados y en terapia inmunosupresora8.
En el contexto de los trasplantes hepáticos (TH) indicados por EAI (aproximadamente el 24% de los casos), un 30% de estos pacientes experimentan recaídas, y entre el 2,35% y el 6,2% desarrollan otras EAI de novo. Los factores de riesgo son: receptor joven, mujer donante y los regímenes inmunosupresores que pueden alterar la regulación inmunitaria y aumentar la susceptibilidad a EAI, agravadas por la liberación de autoantígenos tras daño tisular o infecciones postrasplante9.
El desarrollo de VANCA en el contexto de pacientes trasplantados es un fenómeno clínicamente significativo pero poco común, que refleja una interacción compleja entre predisposición genética (alelos HLA-DR3 o HLA-DR4), alteraciones inmunológicas y factores ambientales como las infecciones9. Algunos estudios epidemiológicos informan una presentación cíclica de GPA consistente con un desencadenante infeccioso, por ejemplo, el estatus de portador nasal de Staphylococcus aureus o infección por citomegalovirus (CMV)10–12. Kronbichler et al. encuentran infección por CMV en 7 de 16 pacientes con VANCA, la mayoría en pulmón y riñón13.
Hay pocos casos reportados de VANCA en TH14. Se presenta el caso de una paciente con inmunosupresión por medicamentos, TH e infección por CMV, que desarrolló HA por VANCA-PR3+.
Caso clínicoMujer de 30 años, mestiza, con antecedentes de hipotiroidismo, sinusitis crónica y cirrosis hepática secundaria a hepatitis autoinmune, diagnosticada a sus 11 años (Child Pugh: C [10 puntos]; MELD: 15 puntos; ascitis; encefalopatía hepática West Haven [III] y disfunción hepatocelular avanzada). Requirió TH a los 22 años de edad. Después de 3 años, presentó rechazo celular crónico, ductopenia grave (3 de 15), progresión a fibrosis de F1 a F2, disfunción crónica del injerto y colangitis esclerosante mientras recibía prednisolona 5mg/24h, azatioprina 50mg/24h, tacrólimus XL 3mg/24h y ácido ursodesoxicólico 300mg/12h. La paciente presentó infección por CMV con compromiso gastrointestinal recurrente con hemorragia gastrointestinal. La biopsia del colon mostró inflamación crónica activa grave y ulcerada, por lo que recibía terapia profiláctica con valganciclovir 450mg/12h y mesalazina 500mg/12h. Cinco meses antes estuvo hospitalizada por neumonía necrosante sin demostración de etiología infecciosa.
Consultó en febrero de 2023 por trauma cortocontundente en el hemitórax derecho con esfacelación de 2×3cm, secreción purulenta y fiebre (38-39°C). Cinco días después, presentó un aumento del tamaño de la lesión (10×3cm) y lesiones adicionales de 1×1cm, ulceradas, vesiculopustulares, con halo eritematosovioláceo, y otras costrosas necróticas, dolorosas, localizadas en las mamas, los maléolos, el pubis y el glúteo derecho. Recibió clindamicina 600mg/8h IV, pero fue remitida a las 48h a un hospital de cuarto nivel de complejidad por el empeoramiento de los síntomas.
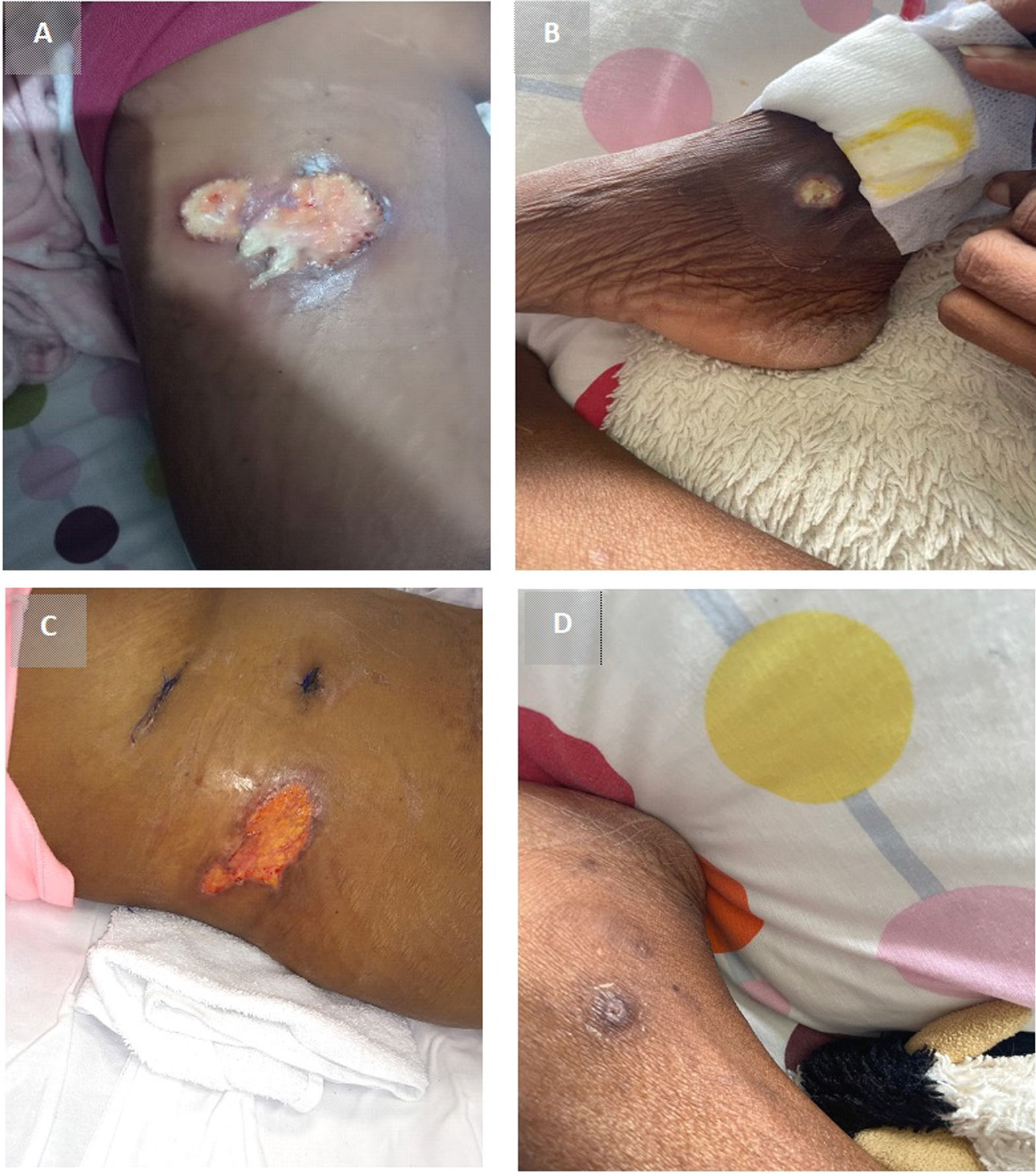
La paciente ingresó taquicárdica (121lpm), hipotensa (90/57mmHg), taquipneica (24rpm), con una temperatura de 36,8°C, ictericia mucocutánea, aftas gingivales y labiales, herida de 10×3cm en la región lateroinferior del hemitórax derecho, dolorosa, con secreción seropurulenta (fig. 1A). Presentaba crépitos apicales derechos, edema simétrico grado i en los miembros inferiores, bradipsiquia, bradilalia, temblor distal en las manos y lesiones ulceradas en las zonas descritas (fig. 1B).
A) Herida de 10×3cm en la región lateroinferior del hemitórax derecho, en relación con arcos costales 9-10, con presencia de secreción seropurulenta y múltiples membranas. B) Lesión vesiculopustular redonda con halo eritematosovioláceo en maléolo interno de pie derecho. C y D) Lesiones de piel cicatrizando de manera satisfactoria. Se consideró una reacción de patergia.
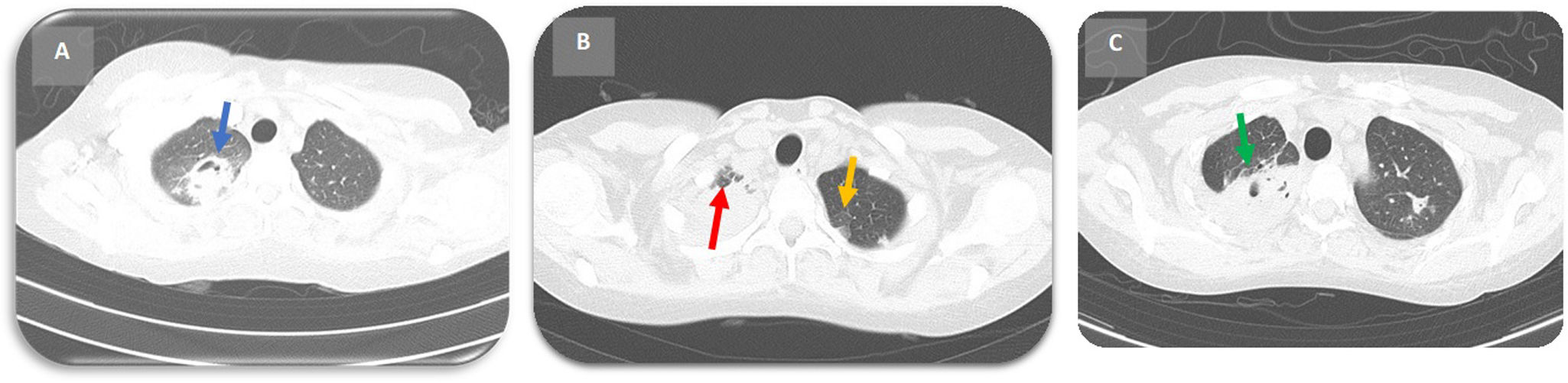
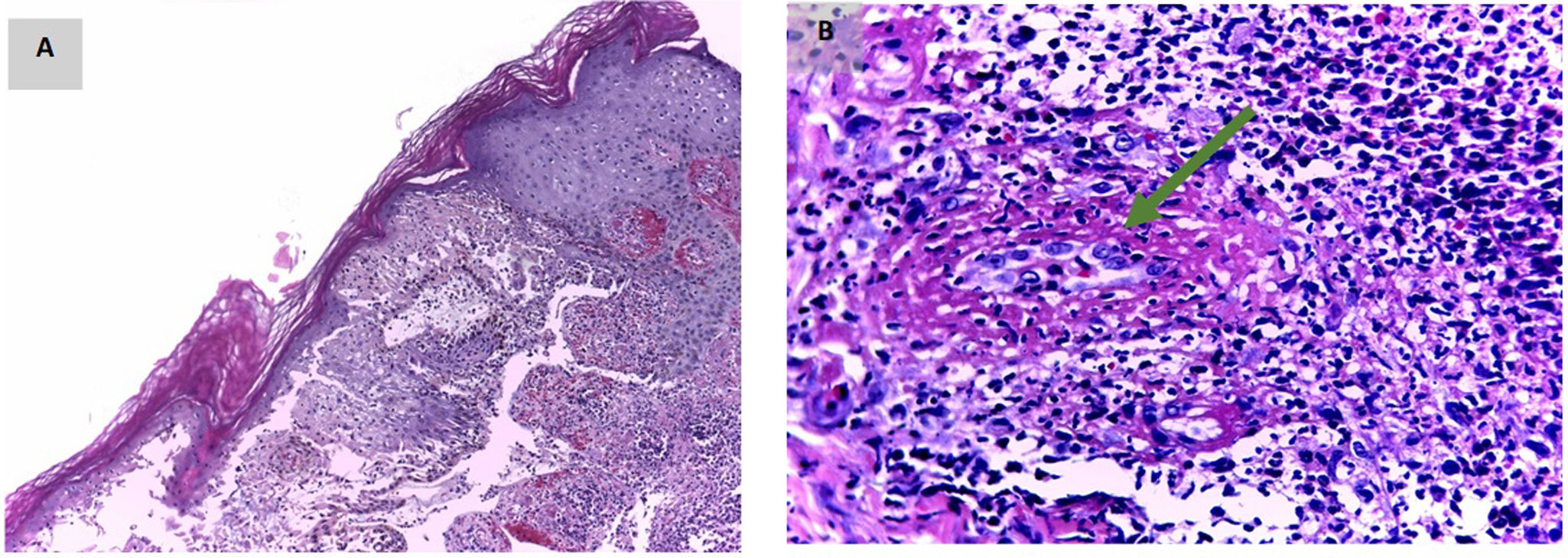
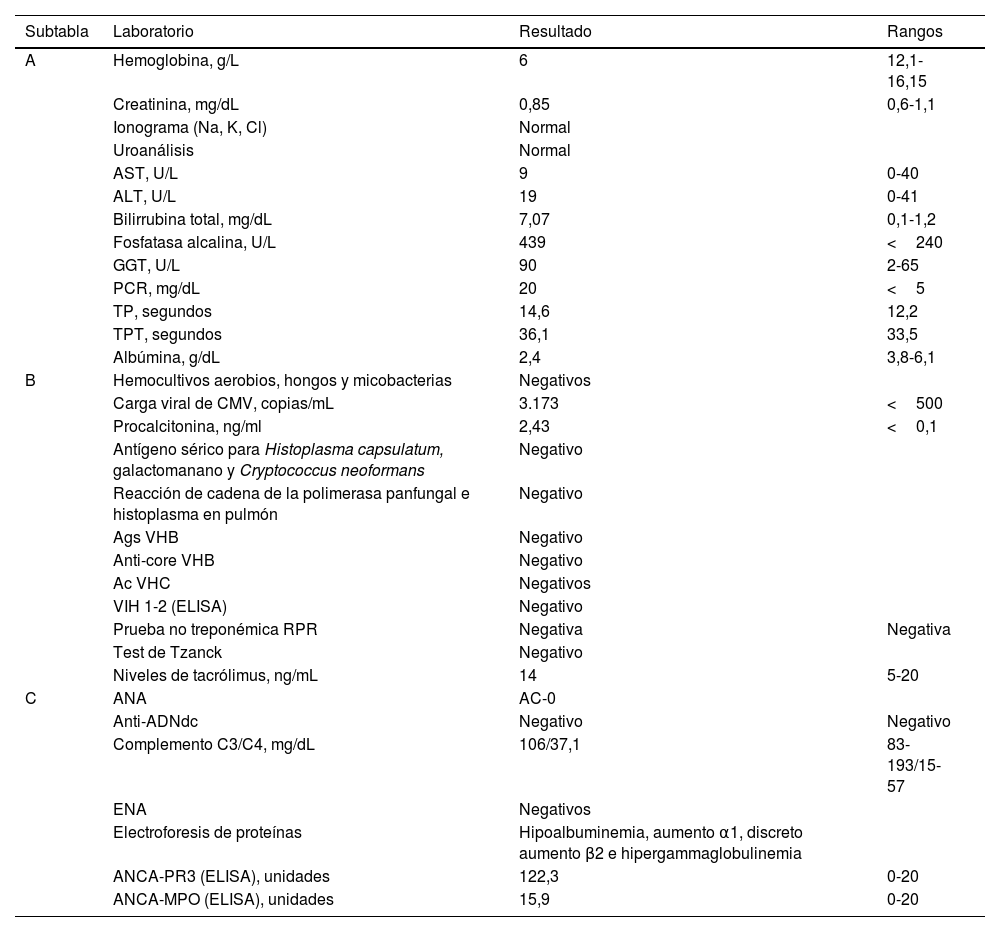
Se diagnosticó sepsis de tejidos blandos y neumonía necrosante y se manejó con piperacilina/tazobactam 4,5g IV/8h, vancomicina 1g IV/12h y transfusión de 2 unidades de glóbulos rojos. En los paraclínicos (tabla 1, subtabla A) se documentó anemia grave (hemoglobina de 6g/L, microcítica, hipocrómica, heterogénea), hiperbilirrubinemia conjugada, aumento de fosfatasa alcalina y proteína C reactiva (20mg/dL). La tomografía computarizada (TC) de tórax mostró infiltrados alveolares multilobares indicativos de neumonía necrosante (fig. 2A). El grupo de hepatología descartó alteración del injerto y encefalopatía hepática; se concluyó que la alteración neurológica correspondía al tacrólimus como efecto adverso, aunque los niveles séricos fueran normales. La biopsia de piel no mostró hallazgos orientadores (fig. 3 A y B). Los estudios de anemia (sangrado, hemólisis, sustratos) fueron negativos.
Hallazgos de laboratorio
| Subtabla | Laboratorio | Resultado | Rangos |
|---|---|---|---|
| A | Hemoglobina, g/L | 6 | 12,1-16,15 |
| Creatinina, mg/dL | 0,85 | 0,6-1,1 | |
| Ionograma (Na, K, Cl) | Normal | ||
| Uroanálisis | Normal | ||
| AST, U/L | 9 | 0-40 | |
| ALT, U/L | 19 | 0-41 | |
| Bilirrubina total, mg/dL | 7,07 | 0,1-1,2 | |
| Fosfatasa alcalina, U/L | 439 | <240 | |
| GGT, U/L | 90 | 2-65 | |
| PCR, mg/dL | 20 | <5 | |
| TP, segundos | 14,6 | 12,2 | |
| TPT, segundos | 36,1 | 33,5 | |
| Albúmina, g/dL | 2,4 | 3,8-6,1 | |
| B | Hemocultivos aerobios, hongos y micobacterias | Negativos | |
| Carga viral de CMV, copias/mL | 3.173 | <500 | |
| Procalcitonina, ng/ml | 2,43 | <0,1 | |
| Antígeno sérico para Histoplasma capsulatum, galactomanano y Cryptococcus neoformans | Negativo | ||
| Reacción de cadena de la polimerasa panfungal e histoplasma en pulmón | Negativo | ||
| Ags VHB | Negativo | ||
| Anti-core VHB | Negativo | ||
| Ac VHC | Negativos | ||
| VIH 1-2 (ELISA) | Negativo | ||
| Prueba no treponémica RPR | Negativa | Negativa | |
| Test de Tzanck | Negativo | ||
| Niveles de tacrólimus, ng/mL | 14 | 5-20 | |
| C | ANA | AC-0 | |
| Anti-ADNdc | Negativo | Negativo | |
| Complemento C3/C4, mg/dL | 106/37,1 | 83-193/15-57 | |
| ENA | Negativos | ||
| Electroforesis de proteínas | Hipoalbuminemia, aumento α1, discreto aumento β2 e hipergammaglobulinemia | ||
| ANCA-PR3 (ELISA), unidades | 122,3 | 0-20 | |
| ANCA-MPO (ELISA), unidades | 15,9 | 0-20 |
Ac VHC: anticuerpos contra el virus de la hepatitis C; Anti-ADNdc: anticuerpos antiácido desoxirribonucleico de doble cadena; Ags VHB: antígeno de superficie del virus de la hepatitis B; ALT: alanino aminotransferasa; ANA: anticuerpos antinucleares; ANCA-MPO: anticuerpos anticitoplasma de neutrófilo antimieloperoxidasa; ANCA-PR3: anticuerpos anticitoplasma de neutrófilo antiproteinasa 3; Anti-core VHB: anticuerpo contra el antígeno del core del virus de la hepatitis B; AST: aspartato aminotransferasa; CMV: citomegalovirus; ELISA: enzimoinmunoanálisis de adsorción; ENA: anticuerpos nucleares extractables totales; GGT: gamma glutamil transferasa; PCR: proteína C reactiva; RPR: reagina plasmática rápida; TP: tiempo de protrombina; TPT: tiempo parcial de tromboplastina; VIH: virus de la inmunodeficiencia humana.
A) Lóbulo superior derecho (segmento apical y posterior): consolidación con broncograma aéreo y vidrio esmerilado periférico, necrosis o cavitaciones centrales (flecha azul) y nódulos de distribución centrolobulillar, áreas difusas de consolidación, algunas de aspecto nodular con broncograma aéreo. B) Consolidación parenquimatosa extensa apical derecha que compromete los segmentos posterior y apical del lóbulo superior, con incipiente cavitación y broncograma aéreo; aumentadas al comparar con estudio previo (flecha roja). Consolidaciones nodulares peribroncovasculares heterogéneas, con incipiente cavitación, «halo» de vidrio esmerilado predominio apical bilateral (flecha amarilla). C) Mejoría del compromiso pulmonar 10 días después de la aplicación de rituximab (flecha verde).
A) Inflamación aguda necrosante con vesiculación. B) Severa necrosis e infiltrado neutrofílico que compromete vasos sanguíneos (flecha verde). Se hicieron tinciones especiales de Ziehl-Neelsen, ácido periódico de Schiff y metenamina, negativas para bacilos resistentes al alcohol y hongos, e inmunohistoquímica para virus del herpes simple (1 y 2) y CMV, también negativas.
Al séptimo día de hospitalización presentó rectorragia y persistía febril. Se realizó colonoscopia (tabla 2), con biopsia, inmunohistoquímica y carga viral para CMV positivas, por lo que se inició ganciclovir 300mg IV/12h, y se realizaron paraclínicos sin encontrar etiología infecciosa adicional (tabla 1, subtabla B). Se consideró que la lesión del hemitórax derecho no presentaba sobreinfección. En el octavo día de hospitalización presentó deterioro respiratorio, necesidad de oxígeno a alto flujo y se inició meropenem 1g IV/8h. La fibrobroncoscopia y el lavado broncoalveolar (LAB) mostraron hemosiderófagos del 82% y estudios microbiológicos negativos; la TC de tórax de control (fig. 2B) mostró progresión de los infiltrados de ocupación alveolar y consolidación cavitada en el lóbulo superior derecho, por lo que se le realizó biopsia pulmonar abierta.
Estudios paraclínicos y de imágenes
| Imagenología | Resultado |
|---|---|
| Resonancia magnética cerebral simple y contrastada | Sin hallazgos patológicos |
| Ecografía hepatobiliar | No se observa dilatación de la vía biliar. |
| Colonoscopia total | Colon derecho y transverso: múltiples úlceras segmentarias, de tamaños variables y profundas, la mayor de casi 2cm, recubiertas de fibrina en su mayoría.Conclusión: Colitis ulcerada segmentaria a estudio, colitis ulcerada por CMV a estudio.Biopsia de colon: mucosa colónica sin áreas de tortuosidad que indiquen cronicidad. Se observa una extensa ulceración con abundante tejido de granulación e infiltrado inflamatorio mixto. No se observan granulomas, células displásicas ni eosinofilia tisular. Hay zonas de hemorragia. Inmunohistoquímica para CMV: positiva. |
| Endoscopia digestiva superior | La mucosa es de aspecto normal hasta los 26cm, donde se observan formaciones mucosas digitiformes en la pared posterior; hay una que forma un puente mucoso. No se observan varices esofágicas, esofagitis o masasBiopsia de esófago: esofagitis activa, negativa para esófago de Barrett.Biopsia de cuerpo: gastritis crónica no atrófica sin actividad. Negativa para metaplasia, displasia y malignidad. Helicobacter pylori ausente.Biopsia de antro: gastritis crónica no atrófica activa leve. Negativa para metaplasia, displasia y malignidad. Helicobacter pylori ausente. |
| Tomografía computarizada de senos paranasales | Engrosamiento mucoso del seno frontal y celdillas etmoidales anteriores; no se observó erosión ni destrucción de las diferentes estructuras óseas. |
CMV: citomegalovirus.
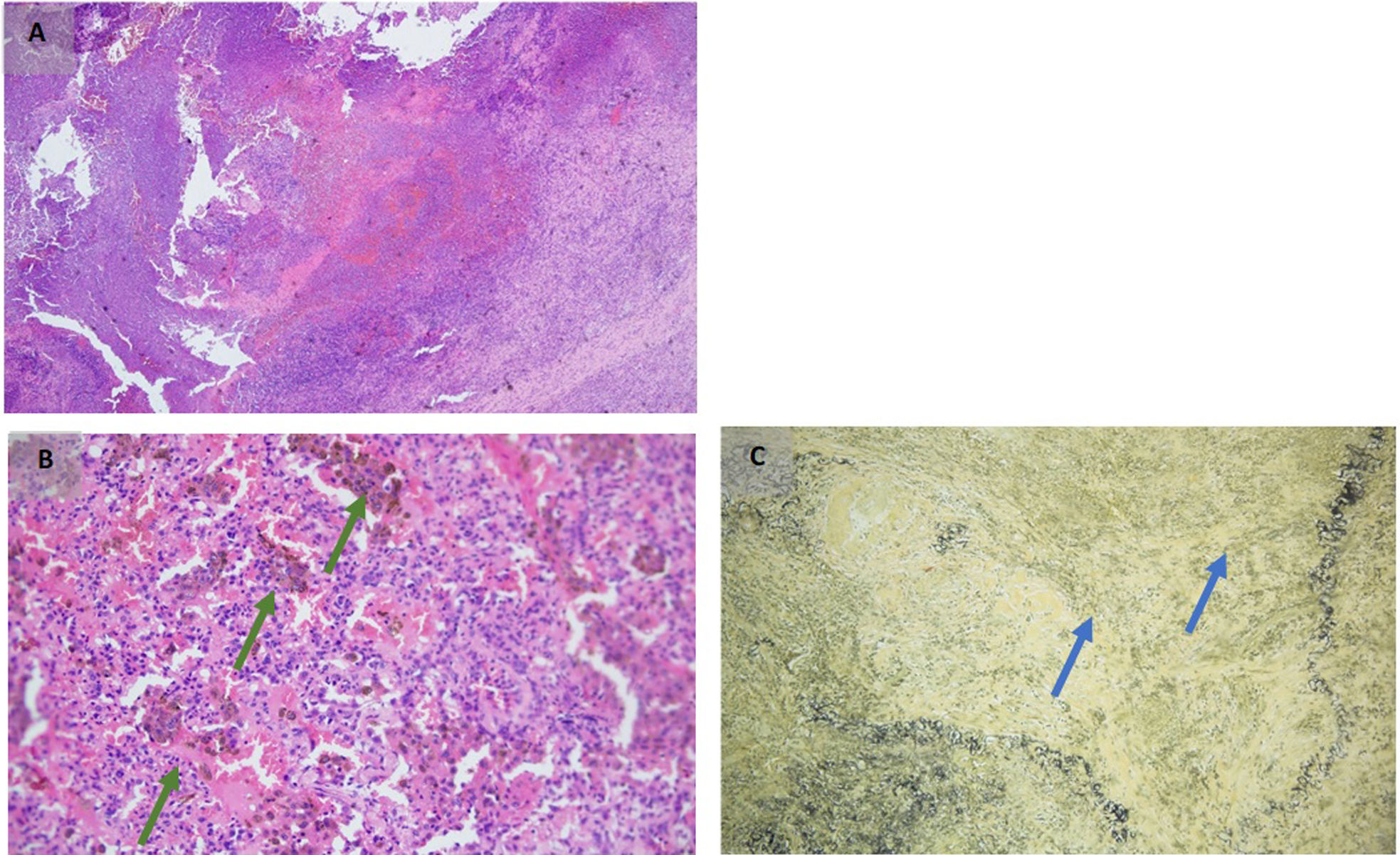
Se solicitó valoración por el grupo de reumatología, que consideró que las lesiones cutáneas de maléolo y tórax podrían corresponder a un fenómeno de patergia. Se documentaron anticuerpos anti-PR3 (ELISA) altamente positivos y la biopsia pulmonar en cuña mostró capilaritis y HA con granulomas (fig. 4 A-C); se llegó a un diagnóstico final de GPA ANCA PR3+. Se hizo terapia de inducción con metilprednisolona 500mg IV/día (3 días), seguida de prednisolona 60mg/día y rituximab 1g IV (día 1 y día 15), dada la contraindicación para utilizar ciclofosfamida por el esquema inmunosupresor del TH. Se indicó profilaxis para Pneumocystis jirovecii con trimetropina/sulfametoxazol 80/400mg VO/día.
A) Necrosis licuefactiva mapeada con formación de abscesos de polimorfo nucleares neutrófilos. B) Capilaritis y hemosiderófagos, un signo indirecto de hemorragia alveolar (flechas verdes). C) Coloraciones especiales de elástico con disrupción de capa túnica elástica interna de un vaso arterial por polimorfonucleares neutrófilos (flechas azules).
Diez días después de la primera aplicación de rituximab, la fiebre cedió, con mejoría gradual de los síntomas respiratorios, las imágenes tomográficas pulmonares (fig. 2C) y los reactantes de fase aguda. La hemoglobina permanecía estable, en ausencia de sangrado gastrointestinal y hemoptisis, y presentaba una cicatrización adecuada de las lesiones de la piel (fig. 1C y D).
Por la condición especial de la paciente, se consideró continuar el mantenimiento con rituximab. El seguimiento a 6 meses no registró una nueva recaída.
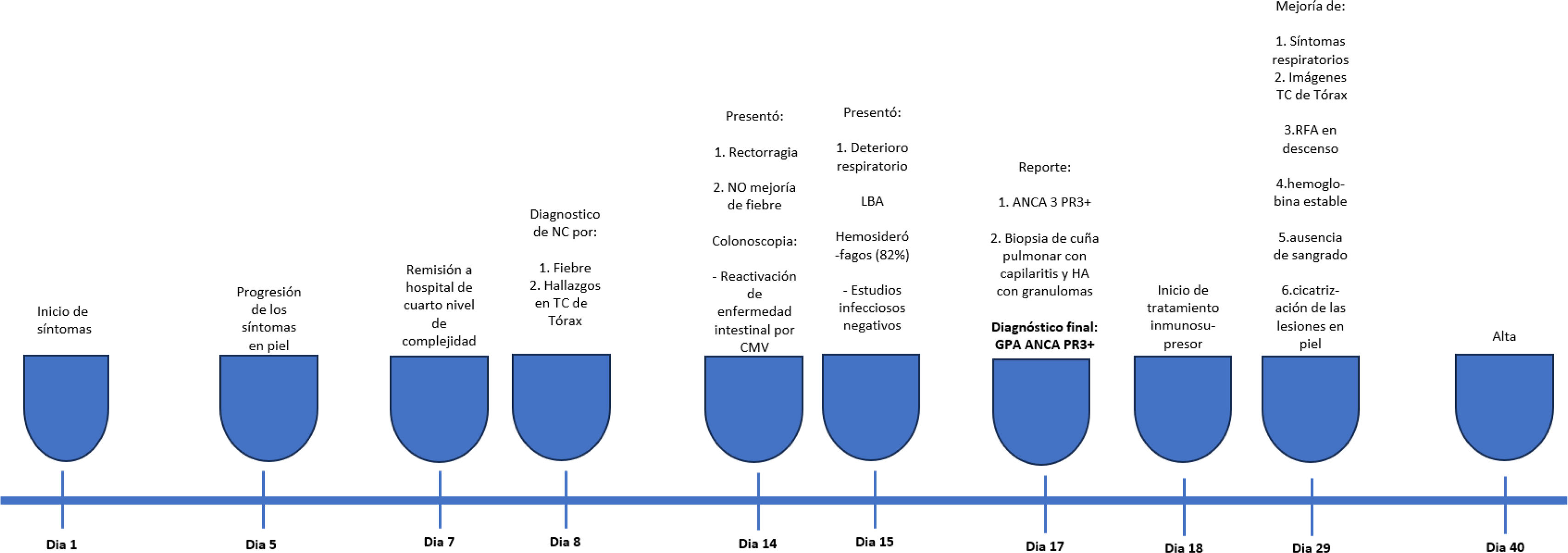
La figura 5 ilustra de manera esquemática la línea del tiempo, clave para comprender la progresión del caso clínico.
Línea de tiempo con cronología detallada de los momentos críticos, los puntos de intervención y la respuesta de la paciente. ANCA: anticuerpos anticitoplasma de neutrófilo; CMV: citomegalovirus; GPA: granulomatosis con poliangitis; LBA: lavado broncoalveolar; HA: hemorragia alveolar; NC: neumonía necrosante; PR3: proteinasa 3; TC: tomografía computarizada.
Fuente: Elaboración propia.
En el presente caso clínico se destacan el potencial papel del CMV como «disparador» de VANCA y el hecho de que se presentara esta entidad en una paciente con TH. Creciente evidencia muestra que infecciones virales como CMV, VIH, VEB, parvovirus B19 y covid-19 pueden desencadenar vasculitis sistémicas15–17. Chanouzas et al. fenotipificaron células T CD4+CD28 nulas en 53 pacientes con VANCA en remisión (seropositivos para CMV) y 30 controles seropositivos para CMV, mediante citometría de flujo después de la estimulación con lisado de CMV, y concluyeron que las células T CD4+CD28 nulas eran específicas de CMV y expresaban un fenotipo Th1 con altos niveles de secreción de interferón gamma, factor de necrosis tumoral alfa, CX3CR1, CD49d, CD11b, perforina y granzima B. La proporción de células T CD4+CD28 nulas fue de casi el doble en pacientes con VANCA; este fenotipo citotóxico se relacionó con un aumento de la expresión de marcadores endoteliales y mayor rigidez arterial, siendo marcador de mortalidad cardiovascular11.
En la literatura se reportan casos de infección por CMV en pacientes con VANCA y se muestra que anormalidades inmunológicas en las vasculitis idiopáticas pueden predisponer al desarrollo de infección por CMV, especialmente durante la terapia inmunosupresora; así mismo, la activación Th1 y NK en respuesta a la infección por CMV puede conducir a la destrucción de tejidos y vasculitis14. Otro posible mecanismo es el mimetismo molecular, en el cual la exposición a virus que comparten secuencias de aminoácidos con autoantígenos conduce a una inmunidad de reacción cruzada18. La paciente presentó además HA (hemosiderófagos 82%), anemia y biopsia con capilaritis pulmonar.
En una revisión sistemática de West et al. que incluye 9 estudios con 207 pacientes, se determinó que la prevalencia de HA en los pacientes con VANCA fue del 8-36% y que el 57% de los pacientes tenían anticuerpos ANCA-PR3+19. En otro estudio de HA asociada a vasculitis en 80 pacientes, 49 de ellos presentaron GPA (61%), y de estos últimos, 12 presentaron nódulos pulmonares cavitados20. En la radiografía de tórax se pueden observar anomalías inespecíficas: opacidades difusas en vidrio esmerilado o consolidación, y, a veces, un patrón de perfusión tipo mosaico, que indica vasculitis arteriolar. Algunos pacientes con HA tienen radiografía de tórax normal. La TC de alta resolución tiene mayor sensibilidad y las características clásicas incluyen opacidades en vidrio esmerilado con distribución aleatoria21. La broncoscopia y el LBA complementan el diagnóstico. En un contexto de HA con radiografía de tórax normal, la broncoscopia tiene una sensibilidad<20%, mientras que en pacientes con hemoptisis masiva la sensibilidad es>90%. En el LBA, la presencia de>20% de hemosiderófagos apunta fuertemente a HA22.
Es frecuente encontrar fenómenos autoinmunes luego de un TH. El uso de inhibidores de la calcineurina favorece la salida de precursores autorreactivos del timo al interrumpir la acción de las células T reguladoras. Después del trasplante, la liberación de autoantígenos de los hepatocitos o generados por un proceso infeccioso, a través de mecanismos de mimetismo molecular, activa las células T autorreactivas quiescentes. Además, se ha demostrado asociación por defecto en su codificación o ausencia con el anticuerpo dirigido a glutatión-S-transferasa T19.
En la literatura se encontró un solo caso reportado de VANCA después de TH, en un hombre de 56 años con cirrosis alcohólica en tratamiento con inhibidores de calcineurina y micofenolato. Inició con hemoptisis, TC de tórax con consolidación, LBA con hemosiderófagos>20%, ausencia de microorganismos patógenos y ANCA-MPO+, y presentó mejoría clínica con dosis moderadas de glucocorticoides23.
En las guías actuales de tratamiento de las VANCA, se recomienda inducir la remisión con ciclofosfamida o rituximab en los pacientes con compromiso de órganos o que amenacen la vida. En esta paciente se eligió rituximab porque debía continuar con los inmunosupresores indicados por el TH; además, se siguieron las recomendaciones de dosis iniciales y decrecientes de glucocorticoides24. Se indicó profilaxis de P. jirovecii con trimetoprima/sulfametoxazol (800/160mg en días alternos o 400/80mg diarios)25.
ConclusionesSe presenta el caso de una mujer de 30 años con antecedente de TH que desarrolló HA como manifestación clínica de GPA ANCA PR3+ e infección por CMV como factor precipitante. Según nuestro conocimiento, este es el primer caso reportado de HA en un paciente con antecedente de TH, infección por CMV y vasculitis necrosante sistémica ANCA PR3+. Debe incluirse en el diagnóstico diferencial de etiologías infecciosas y sospecharse ante la caída de hemoglobina sin causa clara e infiltrados de ocupación alveolar recurrentes.
FinanciaciónNinguna.
Consideraciones éticasEn el presente manuscrito nos basamos en la ética de las publicaciones científicas, cumpliendo con la normativa vigente en investigación bioética; además, se obtuvo la autorización del Comité de Ética de la institución (Hospital Pablo Tobón Uribe). Se le solicitó a la paciente su consentimiento informado para participar en la investigación descrita, teniendo en cuenta que no debe existir ninguna evidencia que permita su identificación y guardando absoluta confidencialidad de la información obtenida, así como conservando el consentimiento firmado por el participante y la carta de aprobación del comité.
Consentimiento informadoDisponible para su consulta.
Conflicto de interesesNinguno.