Las vasculitis ANCA ocasionan aumento de la morbimortalidad, alta carga de enfermedad y daño de órgano, especialmente renal.
ObjetivosDeterminar los factores que se asocian con el desarrollo de insuficiencia renal crónica terminal al egreso hospitalario en los pacientes con granulomatosis con poliangitis y poliangitis microscópica, caracterizar la población y describir las causas de hospitalización, los tratamientos recibidos y las complicaciones presentadas durante la estancia hospitalaria.
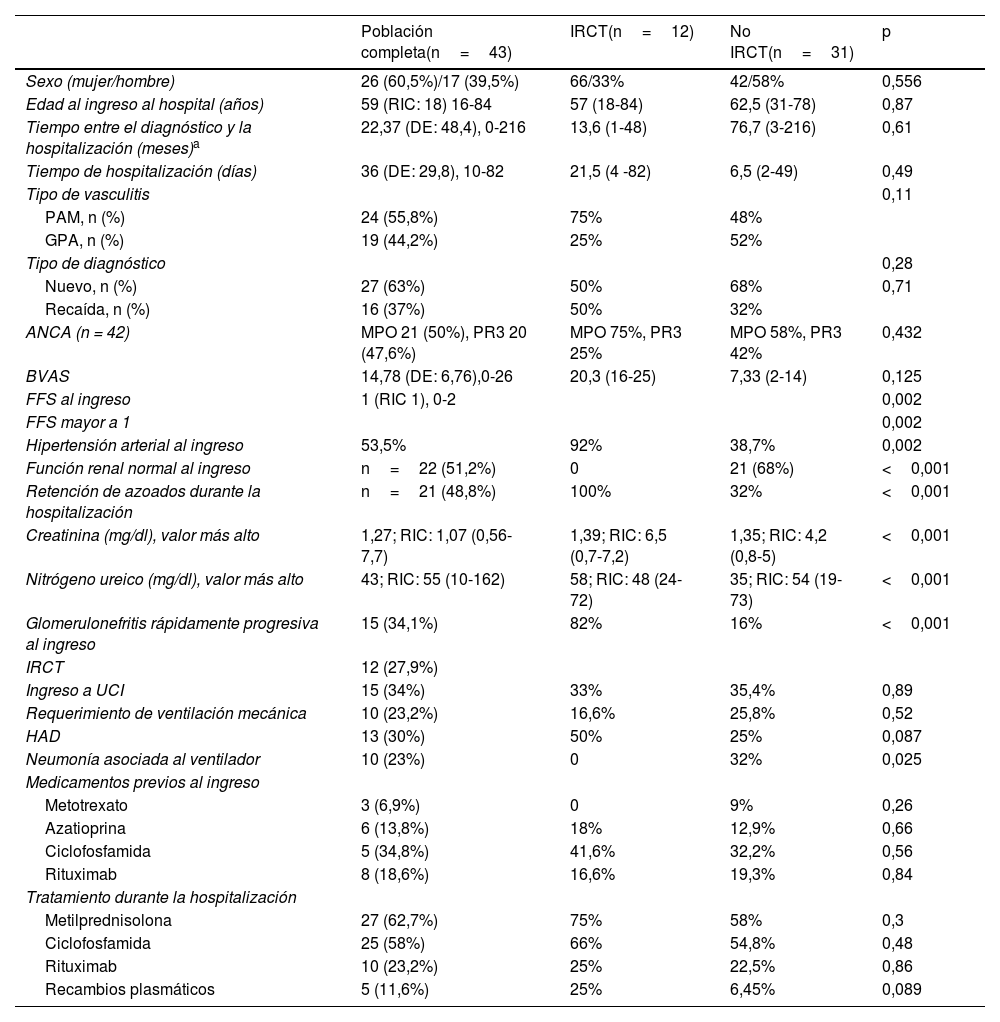
Materiales y métodosSe incluyeron los pacientes con 18 o más años con diagnósticos previos o nuevos de poliangitis microscópica o granulomatosis con poliangitis que requirieron hospitalización entre el 1 de enero del 2013 y el 30 de abril del 2021. La asociación con el desarrollo de insuficiencia renal crónica se evaluó con chi-cuadrado (χ2) de Pearson o prueba exacta de Fisher y t de Student o U de Mann Whitney, de acuerdo con la naturaleza de las variables. Se hicieron modelos multivariantes exploratorios que incluyeron los factores asociados con insuficiencia renal crónica terminal con p<0,15 en el análisis bivariante o con plausibilidad biológica.
ResultadosLa cohorte está constituida por 43 pacientes, 55,8% con poliangitis microscópica y 44,2% con granulomatosis con poliangitis. Doce pacientes (27,9%) desarrollaron insuficiencia renal crónica durante la hospitalización. Aquellos con hipertensión arterial y retención de azoados al ingreso, edema pulmonar y Five Factor Score ≥1 tuvieron más riesgo de egresar con ese desenlace. La función renal normal al ingreso fue un factor protector. La glomerulonefritis rápidamente progresiva y la hipertensión arterial al ingreso se asociaron con insuficiencia renal crónica terminal en los modelos exploratorios ajustados por el tipo de vasculitis, puntaje del Birmingham Vasculitis Activity Score, presencia de hemorragia alveolar difusa y uso de recambios plasmáticos. Estas variables se identificaron como factores para incluir en modelos multivariante en estudios multicéntricos.
ConclusionesEl 88,8% de los pacientes con vasculitis asociada a ANCA tuvieron compromiso renal y el 27,9% de ellos desarrollaron insuficiencia renal crónica terminal durante la hospitalización. La glomerulonefritis rápidamente progresiva y la hipertensión arterial al ingreso al hospital se asociaron con el desarrollo de este desenlace, mientras que la función renal normal al ingreso fue un factor protector.
ANCA vasculitis has been associated with increased morbidity and mortality, high disease burden, and organ damage, especially renal.
ObjectivesTo determine factors associated with end-stage kidney disease at hospital discharge in microscopic polyangiitis and granulomatosis with polyangiitis patients, to characterize our population, hospitalization causes, treatment received, and complications during stay.
Materials and methodsAdults with previous or new diagnosis of microscopic polyangiitis and granulomatosis with polyangiitis who required hospitalization between January 01, 2013, and April 30, 2021, were included. Association with end-stage kidney disease development was evaluated by Pearson's Chi2 (χ2) or Fisher's test, and Student's t or Mann-Whitney U test according to the nature of the variables. Exploratory multivariate models were made including factors associated with end-stage kidney disease.
ResultsForty-three patients were included, microscopic polyangiitis 55.8, and granulomatosis with polyangiitis 44.25. Twelve patients (27.9%) developed early end-stage kidney disease. High blood pressure, high urea nitrogen levels on admission, as well as pulmonary oedema, and Five Factor Score >1 entailed a higher risk. In contrast, normal kidney function on admission was a protective factor. Rapidly progressive glomerulonephritis and arterial hypertension on admission were associated with end-stage kidney disease. In adjusted exploratory models according to vasculitis type, Birmingham Vasculitis Activity Score, diffuse alveolar haemorrhage, and plasma exchange use were identified as factors to include in multivariate models in multicentre studies.
Conclusion88% of patients had renal involvement and 27.9% developed end-stage kidney disease. Rapidly progressive glomerulonephritis and arterial hypertension on hospital admission were associated with early development of end-stage kidney disease while normal renal function on admission was a protective factor for this outcome.