La evidencia creciente muestra que las complicaciones no asociadas a la esclerosis sistémica (ES) son una causa cada vez más frecuente de hospitalización y mortalidad, dentro de las cuales las infecciones se encuentran entre las primeras cinco causas. Los pacientes con ES presentan un riesgo elevado de infección asociado con las opciones terapéuticas y con la enfermedad misma. Por ejemplo, el compromiso pulmonar se asocia con una mayor frecuencia de infecciones respiratorias, mientras que la presencia de úlceras digitales o calcinosis pueden resultar en infecciones de piel y tejidos blandos, incluso en osteomielitis. Por otro lado, la tendencia creciente hacia la inmunomodulación y la inmunosupresión, como tratamiento de las enfermedades autoinmunes, pondrá a estos pacientes en un mayor riesgo de infecciones, incluidas las infecciones oportunistas. Son necesarios un umbral bajo de sospecha y un alto nivel de alerta entre las especialidades tratantes, particularmente los reumatólogos, para la prevención, el diagnóstico temprano y el manejo de las complicaciones infecciosas. Sin embargo, la información respecto a estrategias de gestión de riesgo en ES, como la vacunación o la profilaxis antibiótica, es escasa. Se realizó una revisión narrativa no sistemática que presenta una actualización sobre las complicaciones infecciosas en pacientes con ES.
Mounting evidence has shown non-systemic sclerosis (SSc) related complications as a rising cause of hospital admission and mortality, out of which infections are among the top-five causes. Patients with SSc are at an increased risk of infection due to several features of the treatment options and the disease itself. For instance, lung involvement is associated with a higher frequency of respiratory infections, whereas the presence of digital ulcers or calcinosis may result in skin and soft tissue infections, and even osteomyelitis. On the other hand, the growing trend towards immunomodulation and immunosuppression in patients with autoimmune diseases will place SSc patients at a higher risk of infectious complications, including opportunistic infections. A low suspicion threshold and an increasing awareness among treating specialists, particularly rheumatologists, are warranted for prevention, early diagnosis and management of infectious complications. Nonetheless, data on risk management strategies in SSc, such as vaccination and antimicrobial prophylaxis, are scarce. A narrative non-systematic review was performed to provide an update of infectious complications in patients with SSc.
La esclerosis sistémica (ES), también denominada esclerodermia, es una enfermedad crónica del tejido conectivo mediada por mecanismos inmunológicos, caracterizada por un depósito desproporcionado de colágeno en la piel y en los órganos internos; sus características principales son la fibrosis y la vasculopatía1,2. Se describen dos subgrupos principales, limitado y difuso, según la extensión del compromiso cutáneo3. La ES presenta la razón de mortalidad estandarizada (RME, es decir, el riesgo de muerte comparado con el de la población general) más alta entre las enfermedades reumáticas4. Como es una enfermedad sistémica, pueden estar presentes innumerables signos y síntomas, particularmente renales, cardiopulmonares, gastrointestinales y musculoesqueléticos. Por lo tanto, su manejo es un desafío cada vez mayor para los reumatólogos y los médicos de especialidades relacionadas.
Con respecto a las enfermedades infecciosas, los pacientes con ES tienen un mayor riesgo de infección debido a la enfermedad en sí, principalmente de infecciones respiratorias debidas a enfermedad pulmonar intersticial (EPI)5 y de infecciones de la piel/tejidos blandos debidas a la presencia de úlceras digitales (UD) o calcinosis, que pueden progresar a osteomielitis6,7.
Así mismo, la creciente tendencia hacia la inmunomodulación y la inmunosupresión pondrá a los pacientes con ES en un mayor riesgo de infecciones, como se observa cada vez más en otras enfermedades autoinmunitarias8, incluyendo las infecciones oportunistas (IO). Para el manejo de las manifestaciones de la enfermedad se recomiendan medicamentos como ciclofosfamida (CYC), micofenolato de mofetilo (MMF), metotrexato (MTX), azatioprina (AZA), glucocorticoides, y terapia biológica (es decir, rituximab [RTX])9-12. Se están investigando varias dianas inmunológicas novedosas con resultados prometedores13. Adicionalmente, la vía de aplicación intravenosa de prostanoides y algunos inmunosupresores puede generar un mayor riesgo de infección. Además, el uso prolongado de inhibidores de la bomba de protones (IBP) y el uso de ciclos de antibióticos para el sobrecrecimiento bacteriano son intervenciones que deben ser consideradas como factores de riesgo de infección.
En el presente artículo ofrecemos una revisión actualizada de las enfermedades infecciosas en los pacientes con ES, incluyendo su epidemiología, sus manifestaciones clínicas y las estrategias de manejo de riesgos.
MétodosSe hizo una revisión narrativa no sistemática. Realizamos una búsqueda de literatura en cuatro bases de datos (Cochrane, Medline, Embase y LILACS [que incluye literatura de América Latina]). Se incluyeron artículos en ingles, español, francés, italiano, portugués y alemán. La estrategia de búsqueda incluyó los siguientes términos: Systemic scleroderma, Infection, Infectious Disease Medicine, Communicable Diseases. Se obtuvo literatura gris al utilizar estos términos en Google y se aplicó una estrategia de «bola de nieve» para recuperar la literatura útil de las referencias de los artículos revisados.
Infecciones y ES: epidemiologíaLos avances recientes en el tratamiento de la ES han influido en las causas de muerte e ingreso al hospital. Se ha observado un cambio de la crisis renal a las causas cardiovasculares (p. ej., insuficiencia cardíaca congestiva [ICC]), pulmonares (es decir, EPI e hipertensión arterial pulmonar [HAP]), neoplásicas e infecciosas como las principales causas de muerte y hospitalización5,14-26. Un metaanálisis que incluyó datos hasta el 2006 encontró una RME de 3,53, la cual no ha cambiado significativamente en los últimos 40 años14. Rubio-Rivas et al. reportaron una RME más baja (2,72) utilizando un enfoque similar; los autores estimaron una supervivencia acumulada desde el inicio (primer síntoma de Raynaud) del 87% y del 74% a los 5 y 10 años, respectivamente, mientras que la supervivencia desde el diagnóstico fue del 75% y del 62%, respectivamente. Además, ellos describieron una tendencia hacia la mejora de la mortalidad entre los estudios realizados antes y después de 1990, aunque estadísticamente significativa solo para la supervivencia a cinco años a partir del diagnóstico (71 vs. 84%)27. Anteriormente, la principal causa de muerte en los pacientes con ES era la crisis renal. El uso de inhibidores de la enzima convertidora de angiotensina condujo a una profunda reducción del 42% de los casos a menos del 6% a principios de la década del 200022. Sin embargo, la evidencia creciente ha mostrado que las causas no relacionadas con ES, tanto de muerte como de hospitalización, se acercan al 50%14,15,17,20,22,23, de las cuales las infecciones se están convirtiendo en una causa importante.
Infección como causa de muerteDos metaanálisis que incluyeron datos desde 1960 hasta la primera década del 2000 reportaron una frecuencia de muerte secundaria a infección en ES del 7%14,19. Además, los informes de la base de datos internacional del Grupo Europeo de Ensayos e Investigación en Esclerodermia (EUSTAR), clasificaron a las infecciones entre las primeras cinco causas de muerte15,24. Un estudio que utilizó certificados de defunción de Francia corroboró una frecuencia similar y reportó la infección como causa de defunción en 11% de los certificados. Los autores informaron una alta mortalidad por infecciones pulmonares y una tasa de muertes por infección cinco veces más alta entre los pacientes con ES en comparación con la población general24; se ha informado una evidencia similar en varias cohortes de todo el mundo16,17,20,21,23,28.
Algunos informes sugieren un cambio temporal en las causas de muerte, con un aumento de las infecciones. Steen y Medsger informaron que la proporción de infecciones como causa de muerte en su cohorte (1972-2001) varió del 2% (1972-1976) al 9% (1997-2001); aunque no se observaron diferencias estadísticas entre los períodos, hay una tendencia hacia una mayor frecuencia22. Además, dos estudios realizados con 10 años de diferencia en los Estados Unidos, basados en las bases de datos del Proyecto de Costos y Utilización de la Atención Médica-Muestra Nacional de Pacientes Hospitalizados (HCUP-NIS, por sus siglas en inglés, Healthcare Cost and Utilization Project-Nationwide Inpatient Sample), que utilizaron una metodología similar, presentaron un aumento significativo de las infecciones como causa de muerte y hospitalización26,29; Chung et al. (2002-2003) demostraron que las infecciones estaban entre las primeras tres causas de muerte, representando el 13% de los eventos26. Mientras que diez años más tarde (2012-2013) Ram Poudel et al., informaron que los diagnósticos más frecuentes de los pacientes hospitalizados fallecidos fueron infección/septicemia (32,7%) seguidos de compromiso pulmonar (20%) y cardiovascular (15,7%). Las infecciones (diferentes a las oportunistas) tuvieron una alta OR ajustada para la mortalidad (3,36, IC 2,73-4,41)29.
Infección como causa de hospitalizaciónVarias cohortes han reportado a las infecciones como una causa frecuente de admisión al hospital en los pacientes con ES, clasificándolas entre las tres primeras causas y como la causa más común no relacionada con ES17,18,21,26,29,30. Los sistemas respiratorio, piel/tejidos blandos, gastrointestinal y el tracto urinario son los sitios de infección más comunes que motivan el ingreso al hospital, aunque sus frecuencias difieren según la cohorte. Las infecciones se han asociado con mayores costos, estadías más prolongadas y mortalidad29.
La ocurrencia de infecciones en la ES se puede explicar por el uso creciente de agentes inmunosupresores. Ram Poudel et al. exploraron esta hipótesis comparando las hospitalizaciones no relacionadas con ES frente a aquellas relacionadas con ES con infección/septicemia, utilizando una variable subrogada (estaba disponible un código para «quimioterapia», que puede representar el uso de CYC o RTX, aunque no es posible constatarlo). Ellos encontraron una proporción significativamente más alta del uso de quimioterapia en las hospitalizaciones por ES con infección/septicemia, tanto en los pacientes que vivieron (9,2 vs. 4,1%, p < 0,0001) como en aquellos que fallecieron (17,4 vs. 6,3%, p = 0,0005). Los pacientes que murieron tenían mayores proporciones de HAP (43,3%), insuficiencia respiratoria (72,4%) e ICC (38,4%), lo cual puede representar una enfermedad más agresiva que requirió una inmunosupresión más fuerte y, por lo tanto, un mayor riesgo de infección. Interesantemente, los autores encontraron que un ingreso más alto se asoció con un mayor riesgo de muerte. Ellos propusieron una paradoja de acceso, en la que, entre otras causas, un ingreso más alto puede representar un mejor acceso a los agentes inmunosupresores29. En cambio, otro estudio que analiza la hipótesis de la terapia inmunosupresora no encontró ninguna asociación estadística entre la infección respiratoria y el uso de inmunosupresores como grupo17. En esta línea, los estudios recientes con tocilizumab (TCZ)31,32 y abatacept (ABA)33 no respaldan un mayor riesgo de infecciones, como se discutirá más adelante.
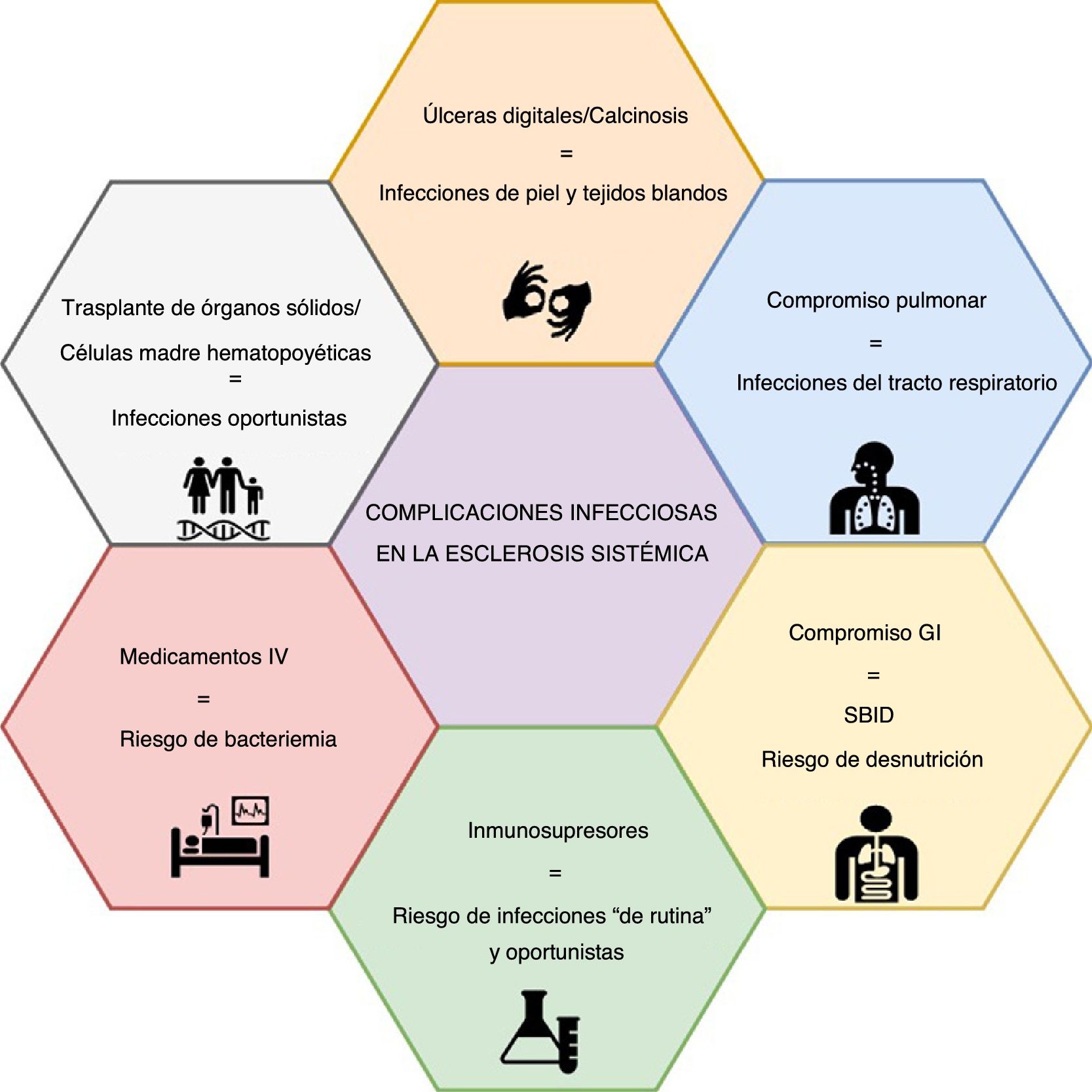
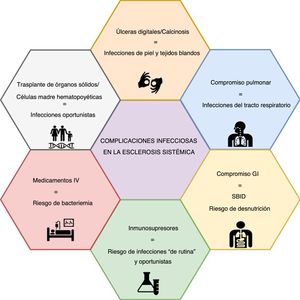
Infecciones y ES: compromiso de órganos específicosLas complicaciones infecciosas en la ES se pueden atribuir a factores asociados con la enfermedad o a los medicamentos (fig. 1). Las primeras parecen ser más frecuentes, y está representadas principalmente por infecciones pulmonares y de tejidos blandos.
Infecciones de piel y tejidos blandosEl compromiso de la piel debido a UD es una de las complicaciones más frecuentes de la ES, y puede estar asociado con infección de tejidos blandos en 19-54% de los pacientes6,7,34-36. El mecanismo etiológico de las UD difiere entre las úlceras isquémicas, las relacionadas con deformidades articulares y aquellas asociadas con calcinosis5. Respecto de las complicaciones infecciosas, los reportes de la literatura por lo general no discriminan por mecanismo y, por lo tanto, es difícil definir una clara diferencia de riesgos.
Sin embargo, particularmente en presencia de calcinosis, el desarrollo de celulitis es una complicación frecuente37,38. También se han reportado la progresión a piomiositis estreptocócica39 y casos de fascitis necrosante40.
Algunos estudios han reportado más complicaciones infecciosas entre el subgrupo de pacientes con ES cutánea limitada41. Las infecciones de las UD pueden progresar a osteomielitis, con una incidencia que puede llegar al 8%, aumentar hasta el 17% en pacientes con UD activa6,42-44 y al 42% cuando esas úlceras tienen algún signo de infección7. Los agentes patógenos aislados con mayor frecuencia son Staphylococcus aureus, Pseudomonas aeruginosa y Escherichia coli, una información esencial para la elección del tratamiento antibiótico empírico45. Además, la incapacidad relacionada con la enfermedad empeora con estas infecciones, ya que 8-16% de los pacientes requieren amputación quirúrgica como parte de su manejo46. Los pacientes que necesitan desbridamiento quirúrgico, amputación u otra intervención aguda, presentarán un mayor riesgo de infección, necrosis y cicatrización lenta de la herida, requiriendo por lo tanto una vigilancia cuidadosa47.
Compromiso respiratorioEn algunas series de ES, el sistema respiratorio es el sitio más frecuente de complicaciones infecciosas, representando hasta el 24% de los eventos reportados8. Se han propuesto diversos mecanismos para explicar este fenómeno, incluyendo la EPI, que se desarrolla en cerca del 50-60% de los pacientes con ES, siendo la principal causa de muerte en varias series48,49; el 40% de estas muertes se atribuyen a infección pulmonar50. Debido al compromiso estructural pulmonar, las infecciones bacterianas son frecuentes (p. ej., neumonía con o sin necrosis, absceso pulmonar, empiema, etc.)51. Como los pacientes con compromiso pulmonar presentan exacerbaciones frecuentes, es vital descartar las complicaciones infecciosas como causa de síntomas respiratorios agudos; para identificar los agentes infecciosos puede ser necesaria una broncoscopia temprana52. La procalcitonina ha mostrado alguna utilidad en este escenario, en el que un valor positivo puede evidenciar una infección bacteriana activa, aunque el umbral no está bien establecido53,54.
Por otra parte, la dismotilidad esofágica se ha asociado con neumonía por aspiración (OR 1,23, IC 1,05-10,55), infección grave (OR 3,22, IC 1,01-10,51)30 y muerte intrahospitalaria25; algunos autores han propuesto que la microaspiración puede contribuir a la EPI55,56. Puede ser difícil distinguir la neumonía de la EPI52. Por este motivo, Sehra et al.25 propusieron que «se deben tener precauciones estrictas para evitar la aspiración en los pacientes con ES que son admitidos al hospital, incluyendo medidas simples como la elevación de la cabecera de la cama, evitar la sobresedación y hacer evaluaciones de la deglución que probablemente ayudarían a disminuir la mortalidad intrahospitalaria».
También se ha reportado neumonía bacteriana y TB en la ES. Dos estudios poblacionales en Taiwán (2000-2006 y 2001-2012) exploraron el riesgo de TB en ES57 y enfermedades reumáticas58, en comparación con pacientes sanos de la misma edad. Se encontró que los pacientes con ES tienen un riesgo significativo 2,81 veces mayor de infección general por TB (Razón de Tasas de Incidencia [IRR, por sus siglas en inglés, Incidence Rate Ratio] 2,81, IC 1,36-5,37) y un riesgo 2,53 veces mayor de TB pulmonar (IRR 2,53, IC 1,08-5,30); se reportó una tendencia, aunque no significativa, hacia un mayor riesgo de TB extrapulmonar (IRR 4,22, IC 0,27-17,57). Se encontró que la ES es un factor de riesgo independiente para infección por TB, con un cociente de riesgo (HR, del inglés, Hazard Ratio) de 2,99 (IC 1,58-5,63). Se exploraron los factores de riesgo de TB en ES: la edad > 60 años y la presencia de HAP fueron estadísticamente significativas en el análisis multivariado; interesantemente, la exposición a glucocorticoides o CYC solo fue significativa en el análisis univariado57. Lu et al. reportaron hallazgos similares, aunque sus métodos fueron diferentes, ya que los autores combinaron datos de ES y miositis inflamatoria como un grupo58. Además, entre los pacientes que recibieron terapia con pulsos de dexametasona como parte de su tratamiento, se informó TB pulmonar en el 9% y TB extrapulmonar en el 20%59. La TB extrapulmonar se ha asociado también con el uso de CYC, altas dosis de glucocorticoides e inhibidores del Factor de Necrosis Tumoral (TNF)-ɑ 60,61. Algunas series han reportado infecciones por micobacterias no TB en el 18% de los pacientes con EPI62.
El compromiso pulmonar por otros microorganismos oportunistas incluye la infección por Pneumocystis jirovecii que, aunque rara vez se ha reportado en pacientes con ES63,64, se ha asociado con dosis altas de glucocorticoides (≥20 mg/día en este estudio) o con dosis más bajas de glucocorticoides con el uso concomitante de CYC65 con una mortalidad cercana al 50%. Por lo tanto, se debe considerar un bajo umbral de sospecha entre los reumatólogos y los especialistas tratantes para establecer el diagnóstico en pacientes con tratamiento altamente inmunosupresor que consultan por disnea progresiva y tos seca66; en los pacientes de alto riesgo se debe considerar la profilaxis67.
La bola fúngica de Aspergillus fumigatus se ha encontrado en grandes espacios bullosos en pacientes con EPI, de modo que se debe considerar en los pacientes con hemoptisis y masas pulmonares68. Se informó un caso de actinomicosis pulmonar en un paciente en tratamiento con infliximab69.
Compromiso gastrointestinalEl sobrecrecimiento bacteriano en el intestino delgado (SBID) es una manifestación gastrointestinal frecuente. Para el tratamiento del SBID se pueden considerar varios antibióticos, tales como amoxicilina, quinolonas (p. ej., ciprofloxacina), tetraciclinas (p. ej., doxiciclina), metronidazol, antibióticos mínimamente absorbibles (p. ej., rifaximina) y trimetoprim/sulfametoxazol (TMP/SMX)70,71. Se pueden administrar mensualmente cursos cíclicos durante 10-14 días. Desde la perspectiva de las enfermedades infecciosas, no hay que olvidar que el uso regular de antibióticos está relacionado con diarrea asociada con antibióticos y un mayor riesgo de infección por Clostridioides difficile72,73. Aunque a menudo se considera la clindamicina como el principal causante de infección por C. difficile, la mayoría de los antibióticos mencionados para el tratamiento del SBID también pueden estar asociados73. Se pueden presentar innumerables síntomas que van desde leves hasta un compromiso sistémico severo. Los principales síntomas agudos que deben motivar una búsqueda activa son malestar, dolor abdominal, náuseas, vómito, fiebre y leucocitosis74. Asimismo, la presencia de compromiso gastrointestinal se ha relacionado con una mayor incidencia de diarrea no causada por estrongiloidiasis (OR 2,28, IC 1,21-6,56)30.
Interesantemente, se reportó una alta incidencia de candidiasis esofágica, a finales de la década de los 80, en pacientes con ES que necesitaban IBP y los autores la relacionaron con dismotilidad esofágica más que con el tratamiento inmunosupresor75,76. No obstante, este fenómeno parece ser poco frecuente en la literatura reciente. De hecho, solo se reportó un caso entre los artículos recuperados30. Además, en nuestra experiencia la candidiasis esofágica rara vez se observa en la práctica clínica.
La prevalencia del Helicobacter pylori en los pacientes con ES es un fenómeno interesante, ya que puede ser casi el doble de la de la población inmunocompetente, aunque su prevalencia se basa principalmente en la positividad de la prueba ELISA77. Su ocurrencia se ha asociado con la presencia de actividad de la enfermedad y con su gravedad, y su detección y erradicación han mostrado una mejoría significativa de los síntomas de la ES y de la actividad de la enfermedad78,79. Se encuentran disponibles varios regímenes de erradicación, que deben ser considerados en función de la epidemiología local, las preferencias del paciente, los factores de riesgo y la opinión del médico80.
Otra condición con potencial de complicaciones infecciosas es el requerimiento de nutrición parenteral, derivado principalmente de un compromiso gastrointestinal, tal como pseudoobstrucción, malabsorción y desnutrición. Se considera una intervención segura, aunque la incidencia de bacteriemia presenta una tasa variable (0,19-1 en 1.000 días-catéter)81,82.
Infecciones oportunistas y otrasEl advenimiento de la terapia biológica y el uso tanto de glucocorticoides como de otros inmunosupresores en la práctica de la reumatología hacen que los pacientes que reciben estas terapias, para quienes se ha propuesto una definición específica, sean propensos a las IO83. En la actualidad, se considera que en la ES las IO son menos frecuentes que en otras enfermedades reumáticas, dado que la mayor parte de la información disponible se limita a reportes de casos. Por lo tanto, es difícil hacer recomendaciones para un enfoque profiláctico o diagnóstico, pero se deben considerar en los pacientes altamente inmunosuprimidos.
Se podrían considerar los datos extrapolados de IO en otras enfermedades en las que se utilizan terapias similares (p. ej., enfermedades reumáticas, enfermedades malignas, trasplantes, etc.). Este tipo de infecciones se ha descrito en pacientes con altos requerimientos de inmunosupresión, especialmente con altas dosis de glucocorticoides (≥30 mg/día), CYC o terapia biológica.
Se han reportado varias IO diferentes en la ES, tales como la neumonía por P. jirovecii (como se describió anteriormente)63-65; la candidiasis diseminada con altas dosis de glucocorticoides (es decir, prednisolona a una dosis de 40 mg/día, seguida de terapia con pulsos de metilprednisolona)84; criptococosis con compromiso pulmonar y extrapulmonar85,86; toxoplasmosis cerebral87; tenosinovitis, artritis séptica y abscesos cutáneos causados por micobacterias atípicas88-90; así como infecciones por Nocardia farcinica con abscesos subcutáneos o infecciones pulmonares91,92.
De manera similar, se han reportado reactivaciones de virus en pacientes con terapia altamente inmunosupresora. Las reactivaciones del citomegalovirus (CMV) presentan complicaciones similares a las descritas en otros grupos de alto riesgo, incluyendo rotura esplénica, neumonitis, pancreatitis, esofagitis o perforación duodenal, relacionadas principalmente con altas dosis de glucocorticoides y CYC93-96. Se ha detectado una reactivación asintomática del herpesvirus humano 6 (HHV6) en los pacientes con ES, aunque puede representar un epifenómeno vinculado a la inmunosupresión, sin relevancia clínica97. También hay reportes de pleuritis necrosante por el virus del herpes simple (VHS)-198 y alveolitis por parvovirus B19 asociadas con EPI99. Se pueden presentar reactivaciones del virus del herpes zóster (HZV) en el 5% de los pacientes, principalmente con compromiso cutáneo, pero se han reportado complicaciones tales como el síndrome de Guillain-Barré100. La prevalencia de la reactivación del virus de la hepatitis B (VHB) en la artritis reumatoidea se ha descrito en el 3-3,5%, pero no hay datos de su prevalencia en pacientes con ES. No obstante, cuando se consideran dosis altas de inmunosupresores como parte del tratamiento de la ES, los pacientes con un perfil de alto riesgo (es decir, trabajadores de la salud, actividad sexual de alto riesgo, pacientes en hemodiálisis, usuarios de drogas inyectables, múltiples parejas sexuales y contactos domésticos con individuos infectados con el VHB) deben ser evaluados para detectar una infección crónica con el VHB, y se les debe ofrecer profilaxis si está indicada101,102. Debe sospecharse una reactivación del VHB cuando se observa un aumento de las enzimas hepáticas, principalmente de la alanina aminotransferasa, especialmente en los pacientes con evidencia de infección anterior por el VHB (es decir, anticuerpos contra el núcleo del VHB positivos)102. Si se sospecha, se debe evaluar el ADN-VHB y es aconsejable una consulta con un especialista (p. ej., en gastroenterología, enfermedades infecciosas). Debe considerarse un bajo umbral de sospecha: aunque con frecuencia se observa hepatotoxicidad por medicamentos, la reactivación del VHB puede explicar este hallazgo y se debe descartar en los pacientes en riesgo.
Los datos sobre la incidencia de infección por el virus del papiloma humano (VPH) en la ES son contrastantes, pero se ha informado una incidencia hasta cinco veces mayor en comparación con la de los controles sanos de la misma edad103,104. Se debe considerar el tamizaje ginecológico de rutina con base en las directrices nacionales.
Inmunosupresores e infeccionesEn la actualidad, las estrategias de tratamiento están dirigidas al manejo del compromiso de órganos específicos y al alivio de los síntomas, siendo la inmunomodulación una estrategia fundamental para el manejo del compromiso cutáneo, pulmonar y articular9,10. En pacientes seleccionados, también están disponibles los procedimientos de trasplante, tales como el trasplante de células madre hematopoyéticas (TCMH), con el consiguiente riesgo de infección105. También es factible el trasplante de órganos sólidos y se ofrece especialmente para los pacientes con afectación de órganos específicos, incluyendo el de pulmón (EPI o HAP), corazón y riñón; e incluso es posible el trasplante de corazón-pulmón en casos seleccionados. Los desenlaces clínicos y la supervivencia son comparables a los observados en pacientes sin ES, incluyendo los eventos infecciosos106-109, para los cuales se han emitido directrices recientes110. Además, otras intervenciones frecuentes, especialmente los medicamentos intravenosos, tales como los prostanoides, pueden hacer que los pacientes con ES sean más propensos a las infecciones5. La tabla 1 resume las complicaciones/etiologías infecciosas potenciales por inmunosupresor en los pacientes con ES.
Posibles complicaciones infecciosas/etiologías por inmunosupresor en los pacientes con esclerosis sistémica
| Glucocorticoides (146,148) | • Bacterias: grampositivas, gramnegativas, Listeria monocytogenes, Nocardia spp, TB, micobacterias no-TB• Hongos: Candida spp., Aspergillus spp., Pneumocystis jirovecii, Cryptococcus, Histoplasma capsulatum• Virus: VHS, HZV, CMV, VEB, Influenza, Adenovirus• Parásitos: Toxoplasma, Cryptosporidium spp, Strongyloides spp |
| Ciclofosfamida (5,112,114,118–127,184,185) | • Bacterias: grampositivas, gramnegativas, micobacterias• Hongos: P. jirovecii, C. albicans, enfermedad fúngica invasiva• Virus: VHS, HZV, cistitis hemorrágica asociada al BK-virus y adenovirus, virus JC- /LMP, reactivación del VHB• Mayor riesgo de ITR superior, neumonía, ITU, infecciones de piel/tejidos blandos. |
| Metotrexato (102,125,126,144,145) | • Infecciones de piel y tejidos blandos, ITR• Virus: HZV (debatido) |
| Azatioprina (102,112,115,125,126,135–138) | • Virus: HZV, VHS, CMV, VEB |
| Micofenolato de mofetilo (113,116,117,129–132) | • ITR, ITU e infección de piel/tejidos blandos, HZV |
| Rituximab (102,125,153–155,157,158,160) | • Bacterias: Enterobacterias, grampositivas.• Hongos: P. jirovecii, A. fumigatus, Candida spp.• Virus: reactivación del VHB, HZV, CMV, virus JC/LMP |
| Tocilizumab (31,102,125,126,162–165,168) | • Bacterias: S. aureus (incluyendo infecciones diseminadas), E. coli, Streptococcus intermedius, micobacterias no-TB• Virus: HZV• Infecciones necrosantes de la piel y tejidos blandos• ITU, ITR, nasofaringitis |
| Abatacept (102,125,126,169–171,174) | • Virus: VHS• IRT Superior, neumonía, ITU•Rara vez vistas: IO (tuberculosis peritoneal, esofagitis fúngica, infección ocular fúngica, sinusitis fúngica y Candida spp.) |
| Inhibidores del TNF α (69,177–180) | • Bacterias: micobacterias no-TB• Virus: HZV, reactivación del VHB• Hongos: micosis endémicas, CMV, P. jirovecii, Aspergillus spp.• ITR, ITU, infecciones gastrointestinales, de piel/tejidos blandos. |
CMV: citomegalovirus; HZV: virus del herpes zóster; IO: Infección Oportunista; ITR: Infección del Tracto Respiratorio ITU: Infección del Tracto Urinario; LMP: Leucoencefalopatía Multifocal Progresiva; TB: Tuberculosis; TNF: Factor de Necrosis Tumoral; VHB: virus de la Hepatitis B; VEB: virus de Epstein-Barr; VHC: virus de la Hepatitis C; VHS: virus del herpes simple.
Esta tabla se basa en las referencias y en la experiencia del autor.
La CYC es un agente alquilante que inhibe la replicación del ADN, particularmente en las células hematopoyéticas y los linfocitos debido a su alta tasa de proliferación, produciendo finalmente su apoptosis111. La CYC aparece como una terapia de primera línea para el tratamiento de la EPI y es considerada en el compromiso cutáneo severo9. Este agente ha estado asociado con infecciones respiratorias, aunque no se debe pasar por alto la presencia de cambios estructurales en el pulmón que pueden explicar un mayor riesgo de infecciones5. Los datos sobre CYC e infecciones se abordarán desde dos puntos de vista: dosis regulares y dosis altas, ya que se espera que el riesgo de infección sea diferente. Aunque no hay una dosis estándar regular recomendada10, se acepta ampliamente una dosis mensual de 500-600 mg/m2, sobre la cual se discutirá en este subtítulo. Por el contrario, las dosis altas superan a estas dosis y se reportan principalmente en los ensayos sobre trasplante de células madre hematopoyéticas (TCMH), un tema que se tratará más adelante.
Los ensayos aleatorizados controlados que comparan la CYC con una variedad de intervenciones han arrojado luz sobre este tema. Ludici et al. reportaron infecciones del tracto urinario en seis pacientes (13,3%) e infecciones respiratorias en cuatro (8,8%)112. Un metaanálisis reciente de la CYC, en la EPI asociada con enfermedades del tejido conectivo, no encontró diferencias en las tasas de neumonía al compararla ya sea con placebo o con MMF113; solo se incluyeron dos estudios frente a placebo: un estudio reportó seis de 79 pacientes con neumonía como el único evento infeccioso registrado114, y el otro estudio no reportó diferencias en cuanto a infecciones entre los grupos, aunque el 13,6% (n = 3) de los pacientes en el grupo de intervención presentaron infección intercurrente del tracto respiratorio superior115 con una terapia inmunosupresora más intensa (es decir, glucocorticoides más CYC y posteriormente AZA). La comparación de la CYC frente al MMF encontró resultados similares113,116,117. En un metaanálisis de 18 estudios de la CYC para el compromiso pulmonar hasta el 2010, Poormoghim et al. reportaron solo una descontinuación de la CYC debida a neumonía y un solo episodio de HZV118.
Se han reportado algunas otras complicaciones infecciosas. Por ejemplo, uno de los eventos adversos frecuentes durante la terapia con CYC es la hematuria, que por lo general se considera secundaria a la CYC por sí misma118. Sin embargo, se ha reportado cistitis hemorrágica asociada al virus BK en un paciente con ES tratado con CYC, destacando así la necesidad de descartar una causa infecciosa119. Además, en un TCMH se describió un caso de cistitis hemorrágica asociada con adenovirus, probablemente secundaria a la movilización con CYC (considerada como una dosis alta)120.
Aunque las infecciones debidas a la CYC parecen ser bastante infrecuentes, la experiencia con otra enfermedad reumática debería generar conciencia. Woytala et al. reportaron infecciones en el 37% de los pacientes (n = 24) con diferentes enfermedades reumáticas que incluyeron la piel, el tracto respiratorio superior e inferior, e infecciones del tracto urinario (ITU); también se observaron algunos episodios de HZV (3%)121. La experiencia en el lupus eritematoso sistémico (LES) ha sugerido un mayor riesgo de infección por una variedad de etiologías122-124; la CYC ha sido considerada un medicamento de bajo riesgo para la leucoencefalopatía multifocal progresiva (LMP)125,126. Parece existir una asociación con el HZV en la artritis reumatoidea (AR) tratada con CYC126. Se ha reportado en la literatura una reactivación del VHB y se identificó un período para la reactivación más corto (ocho semanas) en comparación con otros inmunosupresores127.
En conclusión, un mayor riesgo de infecciones de las vías respiratorias superiores y probablemente de ITU parece estar asociado con la CYC. Sin embargo, no suele ser necesario interrumpir el tratamiento.
Micofenolato de mofetiloEl MMF es un potente inhibidor de la inosina monofosfato deshidrogenasa (IMPDH), que es esencial para la proliferación de los linfocitos T y B111,128. Se recomienda el MMF entre las terapias de primera línea para la EPI9, aunque su seguridad en el tratamiento de la ES aparece como un objetivo en la agenda de investigación10.
Una revisión sistemática de la seguridad del MMF en ES reportó 34 eventos de infección en 487 pacientes, incluyendo infecciones respiratorias (n = 11), de la piel (n = 4), e ITU (n = 2)129. Boulos et al. reportaron solamente una descontinuación debida a infecciones recurrentes después de cinco años de terapia en pacientes tratados con MMF (n = 74)130. Gordon et al.131. compararon el MMF solo vs. MMF más belimumab en 20 pacientes, con una aleatorización de 1:1. No se observaron diferencias en las tasas de infección. Naidu et al. reportaron una tasa de infección similar en comparación con placebo en pacientes de la India132.
Un metaanálisis reciente de la CYC en la EPI en ES, que incluyó dos estudios113,116,117, no encontró ninguna diferencia en las tasas de neumonía al comparar el MMF con la CYC.
Datos de pacientes con trasplante renal y LES han reportado una disminución de la producción de IgG e IgM, que aumenta el riesgo de infección y suprime la respuesta a algunas vacunas133.
Estos hallazgos respaldan un aceptable perfil de seguridad del MMF desde el punto de vista del riesgo infeccioso, y pueden apoyar su elección por encima de la CYC, aunque la evidencia de la nefritis lúpica parece no mostrar ninguna diferencia entre los dos fármacos134.
AzatioprinaLa azatioprina (AZA) es un agente citotóxico que interfiere con los ciclos del ADN y del ARN a través de la inserción del nucleótido de la 6-tioguanina111. La AZA es considerada un agente de segunda línea para la terapia de mantenimiento en la EPI9. La evidencia de infecciones en la ES es escasa y su seguridad en estos pacientes aparece como un objetivo en la agenda de investigación10. Ludici et al. no reportaron eventos infecciosos en 24 pacientes tratados con AZA112, mientras que Dheda et al. encontraron un episodio de TB en ocho pacientes evaluados115. No obstante, alguna evidencia del tratamiento de la enfermedad inflamatoria intestinal sugiere un riesgo tres veces mayor de IO con el uso de AZA, particularmente virales (es decir, HZV, VHS, CMV, virus de Epstein-Barr [VEB])135, y una frecuencia del 7% de eventos infecciosos136-138. Parece que hay una asociación con el HZV en la AR tratada con AZA126.
MetotrexatoEl metotrexato (MTX) es un análogo del ácido fólico que inhibe la actividad de la dihidrofolato reductasa, atenuando así la proliferación de los linfocitos y promoviendo un medio antiinflamatorio139. Se debe considerar el MTX para el manejo del compromiso cutáneo y articular en la ES9,10.
La evidencia de ensayos aleatorizados controlados en el manejo de la ES ha demostrado que las infecciones son un evento poco común en esta población con dosis hasta de 25 mg/semana140-143. La evidencia del tratamiento de la EII parece respaldar su seguridad138. El MTX se ha asociado con un leve aumento del riesgo de infección, particularmente de infecciones de piel, tejidos blandos y del tracto respiratorio, en pacientes con artritis reumatoidea (AR)144,145. Aunque se ha sugerido un mayor riesgo de HZV, un estudio nacional extenso basado en bases de datos en los Estados Unidos no encontró ninguna asociación126.
GlucocorticoidesLo glucocorticoides influyen en la respuesta inflamatoria a través de varias vías. Específicamente, mediante una reducción de la respuesta innata y de la producción de citoquinas inflamatorias, una inhibición de las vías tanto clásicas como alternativas del sistema del complemento, y una reducción de la capacidad de presentación de antígenos y de la proliferación y diferenciación de linfocitos; se genera un cambio hacia un fenotipo Th2146. Se han recomendado dosis bajas de glucocorticoides, basándose principalmente en la opinión de los expertos, para el manejo de los síntomas articulares9 y está disponible alguna evidencia para la miositis, aunque su uso es debatido; sin embargo, una amplia proporción de pacientes con ES los recibe como comedicación con otros inmunosupresores147. Las alteraciones inmunológicas explican el aumento del riesgo de eventos infecciosos debidos a microorganismos tanto intra- como extracelulares, incluyendo bacterias, hongos, virus, micobacterias y parásitos Z; las IO, tales como neumonía por P. jirovecii, TB y HZV son motivos de preocupación cada vez mayores148. Las dosis altas de glucocorticoides se han asociado con un mayor riesgo de infecciones fatales en los pacientes con enfermedades autoinmunitarias149,150.
Inmunosupresores biológicos como posibles intervenciones novedosas para la ESRituximabEl rituximab (RTX) es un anticuerpo monoclonal que está dirigido al CD20 y disminuye la mayoría de las células B preservando prácticamente las células plasmáticas, alterando así varias vías inmunológicas13,151. Aunque no está aprobado sin reparos por las agencias reguladoras para el tratamiento de la ES, el RTX es recomendado por los expertos para el tratamiento de la EPI refractaria y del compromiso articular9. Cada vez hay más evidencia que respalda su eficacia, ya sea solo o en combinación, para estos sistemas e incluso para el compromiso cutáneo152-155. El riesgo de enfermedad infecciosa parece depender del diagnóstico subyacente, ya que puede llegar al 50% en pacientes con linfoma o estar por debajo del 5% en pacientes con AR o vasculitis sistémica. La hipogamaglobulinemia es el principal causante de infección en estos pacientes, en quienes el riesgo más alto se presenta durante los primeros tres meses de tratamiento, aunque después existe un riesgo sustancial156. También se puede presentar neutropenia y se reporta neutropenia severa hasta en el 30% de los pacientes. La neutropenia temprana es rara, sin embargo, la así llamada neutropenia de inicio tardío se observa hasta en el 15% de los pacientes entre uno y cinco meses después de la finalización de la terapia. Todavía se desconoce su mecanismo, ya que se considera que es inmunomediada; puede persistir durante meses, resolverse en forma espontánea y, en los casos persistentes, su respuesta a la terapia con el factor estimulante de colonias de granulocitos es insuficiente o transitoria. Aún no se ha esclarecido su impacto en el riesgo de infección157. Se han reportado diferentes microorganismos como etiologías de eventos infecciosos en el tratamiento de enfermedades neoplásicas y autoinmunitarias con el RTX, particularmente por Enterobacteriaceae. Además, se han reportado IO incluyendo neumonía por P. jirovecii, A. fumigatus, Candida spp., HZV, CMV y LMP158, aunque para esta última, el RTX se ha considerado como un medicamento de bajo riesgo125. Sin embargo, la evidencia es contradictoria ya que los datos derivados de la AR no revelaron un mayor riesgo de IO ni de reactivaciones virales, aunque la falta de seguimiento a largo plazo dificulta la determinación de este riesgo159. En cuanto a datos específicos de la ES, Thibaut et al. informaron, en una revisión de la literatura, que los eventos infecciosos son frecuentes, pero por lo general no son graves153. Melsens et al. no reportaron complicaciones infecciosas en 17 pacientes con ES154. Cabe mencionar que los resultados preliminares de la Red EUSTAR reportaron infecciones en 76 de 248 (30%) pacientes con ES que utilizaron RTX155.
Una de las principales preocupaciones respecto al RTX es su mayor riesgo de reactivación de la infección latente por el VHB, que se considera el más alto entre todos los medicamentos biológicos disponibles: una tasa hasta del 16,9%, aunque esta información proviene de pacientes que reciben concomitantemente agentes antineoplásicos160. Este riesgo parece ser menor entre las enfermedades reumáticas (<10%), por lo tanto, se recomienda una estrecha vigilancia102.
TocilizumabEl tocilizumab es un anticuerpo monoclonal humanizado dirigido contra el receptor de la IL-6161. El TCZ es considerado una molécula prometedora para el tratamiento de la ES y se recomienda como alternativa en el compromiso articular9,13. El estudio FaSScinate, de fase 2, exploró su utilidad en la ES y reportó que hasta el 56% de los pacientes (n = 24) presentaron al menos un evento infeccioso. Cabe destacar que esta frecuencia no difirió de la del brazo placebo, aunque los eventos infecciosos graves fueron más frecuentes en el brazo del TCZ (16 vs. 5%). Se reportó una muerte debida a infección pulmonar. Las infecciones más frecuentes fueron nasofaringitis (n = 5), ITU (n = 3) y HZV (n = 3)31. Los datos del ensayo de fase 3 no informaron un mayor riesgo de infección en comparación con el placebo32. Vale la pena mencionar que Distler y Distler expresaron una preocupación relevante sobre el riesgo de enfermedad infecciosa: los autores del estudio reportaron dos eventos de osteomielitis de la articulación interfalángica proximal en pacientes que recibieron TCZ, probablemente asociados con úlceras digitales. Como se ha demostrado que la inhibición de la IL-6 por el TCZ atenúa la elevación de la PCR y probablemente los signos de infección, se justifica un bajo umbral de sospecha clínica162; desde la perspectiva de las enfermedades infecciosas, el seguimiento de la osteomielitis bajo inhibición de IL-6 puede representar un desafío importante. La evidencia de la experiencia en AR ha sugerido un mayor riesgo de infecciones cutáneas necrosantes, así como de infecciones diseminadas por S. aureus y micobacterias no TB163-166. Se observó neutropenia hasta en el 30% de los pacientes con AR en los estudios pivotales, aunque menos del 5% presentaron neutropenia severa. Su mecanismo aún se desconoce, aunque se ha propuesto una redistribución del compartimento de los neutrófilos. Sus consecuencias sobre el riesgo de infección no están claras, aunque los datos de los ensayos de AR no respaldan una asociación con un mayor riesgo; la interrupción de la dosis es una estrategia eficaz de mitigación del riesgo que produce una rápida recuperación de los recuentos de neutrófilos167,168.
AbataceptEl abatacept es una molécula de fusion soluble formada por el dominio extracelular de CTLA-4, que inhibe la activación de los linfocitos T a través de su unión con CD80 y CD86, bloqueando así la interacción con CD28161. Se ha sugerido que el ABA es eficaz en el manejo del compromiso cutáneo y articular en la ES13. Chakravarty et al. (n = 10) no encontraron diferencias estadísticas en las tasas de infección entre el grupo de intervención y el grupo control; se reportaron dos eventos de infección respiratoria alta en el grupo del ABA169. De manera similar, un estudio retrospectivo (n = 11) en pacientes con compromiso articular reportó tres eventos infecciosos: dos episodios de bronquitis y una infección por VHS170. Los resultados de un ensayo de fase 2 en ES sugirieron un perfil de riesgo de infección comparable entre e ABA y el placebo32. La evidencia combinada de los estudios de AR no sustenta un mayor riesgo de infección en comparación con otras terapias171-173, aunque el informe de extensión a largo plazo (cinco años) del estudio ACQUIRE mostró que el 70% de los pacientes experimentaron un evento infeccioso durante el seguimiento, primordialmente leve o moderado174.
BelimumabEn un estudio piloto, Gordon et al. compararon el MMF solo vs. el MMF más belimumab (BEL) en 20 pacientes, con una aleatorización de 1:1. Aunque no se observaron diferencias entre las intervenciones en los desenlaces evaluados, la evidencia científica respalda su uso potencial13 y los autores sugieren la realización de un ensayo clínico más extenso131. No se observaron diferencias en las tasas de infección, con 18 en el MMF/BEL vs. 16 en el MMF solo. Las infecciones más frecuentes en el grupo MMF/BEL fueron; compromiso del tracto respiratorio superior (n = 5), ITU (n = 3) y estomatitis por VHS (n = 2).
Inhibidores del factor de necrosis tumoral αLos inhibidores del Factor de Necrosis Tumoral (TNF) α podrían desempeñar un papel en el manejo del compromiso articular, aunque actualmente los expertos no los recomiendan como terapia de primera línea9,13,175. Se han reportado datos de estudios pequeños para etanercept, adalimumab e infliximab en pacientes con ES176,177. En cuanto al riesgo de enfermedades infecciosas, se ha informado una baja frecuencia de eventos: HZV no complicado (aunque este paciente recibió concomitantemente prednisona y AZA)177, UD infectada y un episodio de sepsis178. Lam et al. no reportaron ningún caso de IO en 18 pacientes179. Anecdóticamente, se reportó un caso de actinomicosis pulmonar con el infliximab69. Sin embargo, se deben considerar los problemas de seguridad basados en los datos de otras enfermedades autoinmunitarias/autoinflamatorias. Los pacientes tratados con inhibidores del TNF-α pueden presentar un doble riesgo de infecciones graves en comparación con el placebo180. Se han reportado varias complicaciones infecciosas, especialmente infecciones respiratorias, ITU, infecciones gastrointestinales, infecciones de piel y tejidos blandos, HZV, y reactivación del VHB180. Se han descrito IO, tales como micosis endémicas, CMV, neumonía por P. jirovecii, Aspergillus spp., entre otras, en las cuales se pueden observar manifestaciones atípicas180. Dado que la infección por TB es un motivo de preocupación importante con los inhibidores de TNF-α, se debe realizar un tamizaje activo antes de la aplicación de agentes biológicos. Se pueden observar infecciones por micobacterias no TB180.
Trasplante de células madre hematopoyéticas y altas dosis de CYCEl trasplante de células madre hematopoyéticas (TCMH) es una estrategia terapéutica emergente en pacientes seleccionados con ES. El procedimiento se realiza en tres fases principales: 1) movilización de las células madre de la médula ósea a la sangre periférica utilizando agentes de cebado (priming) (es decir, altas dosis de CYC), seguida de la recolección de las células madre movilizadas; 2) inmunoablación o mieloablación mediante la administración de regímenes de acondicionamiento (es decir, irradiación corporal total o agentes alquilantes); 3) infusión de células madre CD4 + autólogas, el así llamado «trasplante» 181,182.
Las complicaciones infecciosas son habituales en la gran mayoría de los procedimientos de trasplante y se han propuesto tres fases de riesgo. La primera fase se conoce como «pre-injerto temprano», que se produce durante las primeras 2-4 semanas anteriores al trasplante, y se caracteriza por infecciones debidas a mucositis y neutropenia. Las etiologías más frecuentes son bacterianas (grampositivas o gramnegativas), VHS y Candida spp. La segunda fase se conoce como «postinjerto temprano» y se produce desde el día 30 hasta el 100 después del «trasplante». Las etiologías más frecuentes son las infecciones bacterianas, fúngicas (p. ej., Aspergillus spp., P. jirovecii), y virales (p. ej., CMV, VEB). La última fase se conoce como «postinjerto tardío» y se caracteriza por infecciones debidas a bacterias encapsuladas, Nocardia spp., Aspergillus spp., P. jirovecii, CMV, VEB, entre otras. Sin embargo, hay una mayor incidencia de infecciones por virus respiratorios y complicaciones en todas las fases105. Estos períodos son aplicables en pacientes con enfermedades autoinmunitarias sistémicas refractarias que son sometidos a trasplante autólogo de células madre. Szodoray et al. informaron que la reconstitución inmunitaria comenzó con células CD56 + NK alrededor del día 30, seguida de CD8 + T alrededor del día 60 postrasplante. El número de células B y CD4 + T se normalizó en el curso de 150 días183.
La experiencia con el TCMH en la ES ha ilustrado el riesgo de infección. El ensayo SCOT comparó la CYC en un régimen de dosis alta (es decir, dosis inicial intravenosa de 500 mg/m2, seguida de 11 infusiones mensuales de 750 mg/m2) con el TCMH (que incluyó una dosis de movilización de CYC de 120 mg/kg), y reportó una tasa de infección similar en los dos grupos. En el grupo de CYC, el 84% de los pacientes (n = 31) presentaron una enfermedad infecciosa durante el seguimiento, aunque solo nueve pacientes tuvieron una infección grave. Las infecciones más frecuentes fueron ITU (40%) e infecciones del tracto respiratorio superior (21,6%); hasta el 10% de los pacientes presentaron una UD infectada. En contraste, en el grupo de TCMH, el 97% de los pacientes (n = 33) presentaron un episodio infeccioso y las infecciones graves fueron más frecuentes. Las infecciones más frecuentes fueron HZV (38,2%), infección del tracto respiratorio superior (26,5%) y neumonía (26,5%); se reportó bacteriemia en el 11,8% de los pacientes. Se presentó varicela zóster en 12 pacientes del grupo del TCMH comparado con uno del grupo de la CYC. Se observaron cinco casos de reactivación del CMV en el grupo del TCMH184.
El ensayo ASTIS comparó la CYC (750 mg/m2 mensualmente durante 12 meses) con el TCMH (dosis de movilización de CYC de 200 mg/kg por cuatro días); se registró la infección o la reactivación viral después de la aleatorización. Las infecciones fueron poco frecuentes en el grupo de CYC (n = 77) con solo un episodio de infección primaria por el VHS. En contraposición, 27,8% de los pacientes (n = 22) del grupo de TCMH presentaron una enfermedad infecciosa. La reactivación del VEB (12,5%), VHS (22%) y CMV recurrente (18,7%) fueron los fenómenos más frecuentes185.
El ensayo ASSIST comparó la CYC (1000 mg/m2 mensualmente durante 12 meses) con el TCMH (es decir, dosis de movilización de la CYC de 200 mg/kg durante cuatro días). Los autores solo informaron un episodio de celulitis con la CYC y un episodio de muestra de heces positiva para C. difficile en ambos grupos, se observó bacteriemia por Micrococcus y reactivación del CMV en el grupo del TCMH186.
Del Papa et al., en un estudio retrospectivo del TCMH en ES, registraron ocho casos de fiebre de origen desconocido, cinco casos de fiebre con hemocultivo positivo y tres casos de neumonía. Todas las infecciones observadas se resolvieron con un tratamiento antibiótico adecuado182.
Trasplante de órganos sólidosLos receptores de trasplantes de órganos sólidos también tienen un mayor riesgo de complicaciones infecciosas, en relación estrecha con la dosis y el tipo de medicamentos inmunosupresores utilizados. Otros factores relacionados incluyen complicaciones quirúrgicas, hospitalización prolongada, otros procedimientos invasivos y reactivaciones virales, principalmente del CMV, con un mayor riesgo de infecciones oportunistas, daño y rechazo del aloinjerto187,188.
En cualquier paciente postrasplante el riesgo de infección depende del estado neto de inmunosupresión. Como se describió en los receptores de trasplante de médula ósea, el riesgo de infección se ha dividido en tres períodos, el primero se denomina «periodo temprano», que incluye infecciones dentro del primer mes postrasplante y se caracteriza por infecciones relacionadas con la atención sanitaria, infecciones derivadas del donante (p. ej., VHS, rabia, VIH, Trypanosoma cruzi) e infecciones derivadas del receptor, por lo general relacionadas con colonización previa. El segundo período o «intermedio» incluye infecciones durante el período comprendido entre uno y seis meses después del trasplante; se caracteriza por el riesgo más alto de infecciones oportunistas, principalmente por microorganismos intracelulares, incluyendo P. jirovecii, TB, Cryptococcus neoformans, CMV, VEB, y Toxoplasma gondii, entre otros. El tercer período o «tardío» se presenta después del sexto mes postrasplante y se caracteriza por una mayor incidencia de infecciones adquiridas en la comunidad, principalmente neumonía e ITU. Se han descrito infecciones por Aspergillus spp., Zygomycota, CMV (colitis y retinitis) y trastornos linfoproliferativos postrasplante, que en la mayoría de los casos se asocian al VEB188.
En los receptores de trasplantes de órganos sólidos, el sitio de infección más frecuente es el aloinjerto. En los pacientes con ES, el órgano trasplantado con mayor frecuencia es el pulmón. La infección bacteriana es la complicación infecciosa más frecuente (35 a 66%) en los receptores de trasplante de pulmón unilateral o bilateral. Las infecciones bacterianas que se presentan en el período postrasplante inmediato por lo general muestran una relación con colonización pretrasplante, el procedimiento quirúrgico en sí y las complicaciones técnicas que lo acompañan, intubación o hopitalización prolongada. Las infecciones bacterianas de aparición tardía están relacionadas con un aumento de la inmunosupresión debido al rechazo, a procedimientos diagnósticos invasivos y al desarrollo de bronquiolitis obliterante189.
Otras terapias y su riesgo potencial de infecciónLa vía intravenosa de algunas terapias para el manejo de la ES debe crear conciencia sobre el potencial de complicaciones infecciosas. Los prostanoides (p. ej., epoprostenol, treprostinil) se recomiendan para el manejo de la HAP, el fenómeno de Raynaud y las UD9,10. Se han descrito celulitis y sepsis con su aplicación. Entre las etiologías más frecuentes de sepsis se encuentran el Staphylococcus epidermidis, Micrococcus spp., S. aureus, Pseudomonas spp., y Enterobacter spp190,191. Se ha sugerido una mayor tasa de infecciones con el treprostinil comparado con el epoprostenol5,192,193.
En los pacientes con enfermedad por reflujo gastroesofágico, o dismotilidad gastrointestinal, se recomienda el uso de altas dosis de IBP.9 Recientemente, el uso prolongado de IBP ha estado asociado con un mayor riesgo de infección por C. difficile73,194,195 y de neumonía adquirida en la comunidad, aunque la evidencia para esta última es contradictoria196-199.
En cuanto al manejo de la EPI con terapia antifibrótica, la evidencia actual respalda su eficacia en la ES. El nintedanib no se asocia con un mayor riesgo de infección en la ES o en otra población de pacientes200-203. Como se observa con la mayoría de los inhibidores de la tirosina-cinasa, un efecto secundario común es la diarrea, que no se ha asociado con una etiología infecciosa. Aunque aún se desconoce su causa, se ha propuesto una ocupación del receptor y daño directo de la mucosa204,205. Por otra parte, aunque carecemos de evidencia directa para la pirfenidona en la ES, existen ensayos en curso; Hasta la fecha, la pirfenidona no se ha asociado con un mayor riesgo de infección en otras poblaciones de pacientes206,207.
Otras estrategias terapéuticas dirigidas a varios dominios de la enfermedad no se han asociado con un mayor riesgo de infección en la ES. Estas incluyen los inhibidores de la fosfodiesterasa-5, bloqueadores de los canales de calcio, inhibidores de la enzima convertidora de la angiotensina, antagonistas de los receptores de angiotensina, antagonistas de los receptores de endotelina y riociguat10,208-213.
Prevención de infeccionesLas estrategias de manejo de riesgos, incluyendo la profilaxis y la vacunación se deben considerar dentro del paquete de atención. Las tablas 2 y 3 resumen las recomendaciones para el tamizaje, la posible profilaxis y las terapias profilácticas disponibles que se deben considerar en los pacientes con ES. Están disponibles varias guías de recomendaciones para la prevención de la infección en los pacientes que reciben tratamientos inmunosupresores157,168,214-223. Sin embargo, hay una falta de información en la literatura sobre la prevención de las enfermedades infecciosas en los pacientes con ES, probablemente debida a la baja incidencia de la enfermedad. Por lo tanto, se podrían considerar los datos extrapolados de otras enfermedades, en las que se utilizan terapias similares (p. ej., enfermedades reumáticas, enfermedades malignas, trasplantes, etc.). Al considerar la vacunación y la quimioprofilaxis para los pacientes con ES, el primer pensamiento que debe tener un reumatólogo es: ¿qué tan inmunosuprimido está mi paciente y cuál es el mecanismo de inmunosupresión? No hay que olvidar que existe un mayor riesgo de infección debido a la enfermedad en sí. Antes de la aplicación del agente inmunosupresor se debe llevar a cabo la vacunación, el tamizaje de infecciones latentes o activas, y otras medidas para la prevención de las infecciones215,223,224.
Recomendaciones para el tamizaje y terapias profilácticas disponibles propuestas para las enfermedades autoinmunitarias
| Recomendación por enfermedad infecciosa | Terapias disponibles |
|---|---|
| Tuberculosis (TB)Tamizaje: TST o IGRA (basado en las directrices locales).TST > = 5 mm o IGRA (+):1) Descartar TB activa (rayos X de tórax, frotis y cultivo de esputo).2) Se debe considerar la consulta con un especialista en EI/TB.3) Iniciar tratamiento para ITBLTST < 5 mm o IGRA (-):1) El tamizaje de rutina no se recomienda y se debe basar en síntomas sugestivos o en una posible exposición a la TB. | Isoniazida 300 mg VO/día + Piridoxina 50 mg VO/día durante nueve meses (270 dosis)Están disponibles otras terapias que se deben considerar basándose en la historia del paciente y en el concepto médico.Se deben administrar por lo menos durante un mes antes de la inmunosupresión |
| Neumonía por P. jiroveciiaSe debe considerar en los pacientes que reciben CYC, GC o RTX. | TMP/SMX 800 mg/160 mg VO en días alternos o 400 mg/80 mg VO todos los díasbEn caso de reacción adversa, se pueden considerar otras terapias-se debe considerar la consulta con un especialista en EI. |
| Virus de la hepatitis B (VHB)Se debe considerar el tamizaje en todos los pacientes antes de la terapia inmunosupresora.El perfil de referencia del VHB debe incluir: antiHbs, HbsAg, y antiHbc.1) antiHbs (-), HbsAg (-), antiHbc (-): se debe iniciar vacunación.2) antiHbs (-), HbsAg (+/-) antiHbc (+): se debe considerar la profilaxis.Se debe hacer un perfil completo, incluyendo:HbeAg, antiHbeAg, ALT, ADN del VHB en el suero.3) antiHbs (+), HbAg (-), antiHbc (+/-): el paciente está protegido (vacunación previa o infección resuelta. | Se debe considerar la consulta con un especialista en EI.Hay varias opciones disponibles, incluyendo lamivudina, tenofovir (TDF, TAF), entecavir.Principal preocupación: pacientes que reciben RTX. |
| Virus del Herpes ZósterSugerido por algunos autores para los pacientes expuestos a la CYC236. No hay un concepto disponible, los pacientes deben ser individualizados. | Se debe considerar la consulta con un especialista en EI.Valaciclovir? |
| Virus del Herpes SimpleNo hay un consenso disponible.Se debe considerar la terapia supresora si se presentan episodios recurrentes (> = 3/año).Los pacientes deben ser individualizados. | Se debe considerar la consulta con un especialista en EI.Aciclovir: dosis de terapia supresora. |
| Helmintos y amebasSe debe considerar la profilaxis antiparasitaria, especialmente si se planea una terapia biológica o con GC.Se ha propuesto la profilaxis de la amebiasis en las regiones endémicas; repitiéndola cada año si la inmunosupresión persiste o si hay una exposición potencial (p. ej., si todavía reside en una zona endémica). | Sobreinfeccion helmíntica:ivermectina (200 ug /kg/día [es decir, una gota por kg]), dos dosis con 15 días de diferencia, o albendazol 400 mg/día, durante 3 díasAmebiasis (regiones endémicas):secnidazol 2 g, dosis única |
antiHbc, anticuerpo total contra el núcleo del virus de la Hepatitis B; antiHbeAg, anticuerpo contra el antígeno E del virus de la Hepatitis B; antiHbs, anticuerpo de superficie contra el virus de la Hepatitis B; CYC, Ciclofosfamida; GC, Glucocorticoides; HbeAg, antígeno E del virus de la Hepatitis B; HbsAG, antígeno de superficie del virus de la Hepatitis B; EI, Enfermedades infecciosas; IGRA, Ensayo de Liberación del Interferón Gamma; ITBL, Infección tuberculosa latente; RTX, Rituximab; TAF, Tenofovir Alafenamida Fumarato; TDF, Tenofovir Disoproxil Fumarato; TMP/SMX, Trimetoprim/Sulfametoxazol; TNF, Factor de Necrosis Tumoral; TST, Prueba Cutánea de Tuberculina (en inglés, Tuberculin Skin Test).
Esta tabla se basa en las referencias y en la experiencia del autor.
Profilaxis potencial que se debe considerar en los pacientes con ES
| CYC | Glucocorticoides (GC) | RTX | Otrosf | |||
|---|---|---|---|---|---|---|
| < 15mg | 15 – 30mg | >30mg | ||||
| TB | Se debe hacer tamizaje a todos los pacientes. Se debe administrar tratamiento para los pacientes positivos para ITBL al menos una vez al mes antes de la inmunosupresión. Es aconsejable la consulta con un especialista en EI. | |||||
| PCPa | Y | N | Yb | Y | Y?c | N? |
| VHB | Se debe considerar la profilaxis en los pacientes con HbsAg (+/-) y antiHbc (+).Se debe consultar con un especialista en EI. | |||||
| HZV | ? | ? | ? | ? | ? | ? |
| VHS | Considerar si es recurrente (> = 3 por año). Se debe realizar una consulta con un especialista en EI. | |||||
| Parásitosd | Considerar especialmente cuando se planea un tratamiento con GC o con agentes biológicos. | |||||
| Otrose | No hay evidencia. Se deben individualizar los pacientes. Se debe realizar una consulta con un especialista en EI. | |||||
antiHbc: anticuerpos totales contra el VHB; CYC: Ciclofosfamida; GC: Glucocorticoides; HbsAg: antígeno de superficie del VHB; VHB, Virus de la Hepatitis B; VHS, Virus del Herpes Simple; HZV, Virus del Herpes Zóster; EI, Enfermedades infecciosas; ITBL, Infección tuberculosa latente; PCP: neumonía por Pneumocystis jirovecii; RTX: Rituximab; TB: Tuberculosis.
Esta tabla se basa en las referencias y en la experiencia del autor.
Factores de riesgo adicionales: linfopenia basal, bajo recuento de CD4, uso de CYC, inhibidores de TNF α o RTX, uso inicial de GC >60mg.
Se ha sugerido la profilaxis para los pacientes que reciben RTX basándose en un aparente mayor riesgo.
Como se indica, los inmunosupresores que se utilizan con mayor frecuencia en la ES pueden aumentar el riesgo de complicaciones infecciosas5. La experiencia con otras enfermedades autoinmunitarias ha sugerido el efecto protector de la quimioprofilaxis siempre que sea necesaria la inmunosupresión67.
Hay un particular interés y evidencia disponible para la neumonía por P. jirovecii, en la que se identifican incidencias contrastantes dependiendo de la enfermedad subyacente, desde una tan baja como el 0,1% en AR hasta una tan alta como el 12% en la granulomatosis con poliangitis225. Se debe considerar que la neumonía por P. jirovecii tiene una tasa baja entre los pacientes con enfermedades reumáticas, aunque su curso tiende a ser grave y potencialmente fatal226. Por ejemplo, las directrices recientes para el manejo de la vasculitis asociada a ANCA «incentivan el uso de profilaxis contra el P. jirovecii en todos los pacientes tratados con CYC, cuando no está contraindicada» 227,228. La evidencia creciente respalda la utilidad de la profilaxis en los pacientes tratados con glucocorticoides, especialmente en aquellos que reciben dosis altas (≥ 30 mg/día), ya que se observa un riesgo dependiente de la dosis67,229. Además, el uso del RTX también parece estar asociado con un mayor riesgo de neumonía por P. jirovecii y se ha reportado un efecto protector de la profilaxis230. Winthrop y Baddley propusieron recientemente un esquema de profilaxis individualizado para las diferentes enfermedades reumáticas autoinmunitarias tratadas con glucocorticoides, con el que se beneficiarían los pacientes con ES que reciben dosis ≥ 30 mg/día y no aquellos con dosis inferiores a 15 mg/día; los pacientes que reciben entre 15 mg y 30 mg/día deben ser evaluados en función del riesgo individual, basado en la presencia de al menos uno de estos factores: linfopenia basal, bajo recuento de CD4, uso de CYC, anti-TNF o RTX, dosis inicial de glucocorticoides ≥ 60 mg/día (tabla 3). No obstante, estas recomendaciones se basan en la opinión de los expertos y los autores abogan por más estudios67; algunos otros autores creen que «se necesitan evaluaciones de riesgo más personalizadas para informar la profilaxis de la neumonía por P. jirovecii», ya que los datos son contrastantes226. No hay estudios en ES que muestren estos resultados, probablemente debido a la dificultad de reunir grandes cohortes de pacientes con esta enfermedad. Sin embargo, hay reportes de pacientes de ES con estas terapias que desarrollan infecciones oportunistas por Mycobacterium avium intracelular y P. jirovecii231.
Como la dosis profiláctica óptima de TMP/SMX en las enfermedades reumáticas es poco clara, un ensayo aleatorizado controlado (RCT, del inglés, randomized controlled trial) abierto realizado en Japón exploró ese tema. Los pacientes fueron expuestos principalmente a glucocorticoides (>0,6 mg/kg/día) y recibieron diariamente una dosis baja de TMP/SMX (80 mg/400 mg, o 40 mg/200 mg, o dosis escalonadas de 8 mg/40 mg hasta alcanzar 40 mg/200 mg); no se observaron eventos de neumonía por P. jirovecii en ningún grupo. Los autores sugirieron una mejor tolerabilidad y seguridad con dosis de 40 mg/200 mg232. Los regímenes recomendados para la profilaxis de la vasculitis asociada a ANCA con CYC son: TMP/SMX 160 mg/800 mg en días alternos o 80 mg/400 mg todos los días. La pentamidina, la atovacuona o la dapsona son alternativas en caso de reacción adversa o contraindicación227,228, sin embargo, en Colombia solo está disponible esta última. En este escenario, es aconsejable una consulta con un especialista en enfermedades infecciosas. Como no hay evidencia de calidad disponible respecto a las dosis, se podrían extrapolar las dosis recomendadas para el virus de la inmunodeficiencia humana (VIH), a saber, dapsona 100 mg/día, o en situaciones en las que no se pueden administrar los agentes recomendados, o no son bien tolerados, clindamicina más primaquina233. Las guías británicas sobre vasculitis asociada a ANCA sugieren el uso de un régimen profiláctico similar en cualquier paciente con inmunosupresión, incluyendo el RTX234. Algunos autores han sugerido que no se debe depender únicamente del recuento de células CD4 como guía para la profilaxis de la infección por P. jirovecii en las enfermedades autoinmunes/inflamatorias235.
La incidencia de HZV en pacientes con inmunosupresión es un desafío creciente, sin embargo, la utilidad de la profilaxis entre los pacientes con enfermedades reumáticas autoinmunitarias no es clara y no hay datos de seguridad para la vacunación. Un estudio reciente en pacientes que recibieron CYC para el LES o la vasculitis exploró el efecto de la profilaxis antiviral con valaciclovir. Los autores reportaron un mayor riesgo de HZV en los pacientes con linfopenia < 500/μL al iniciar la CYC (HR 4,36, IC 0,51-37-31) y sugirieron que se debería considerar el valaciclovir en estos escenarios; ninguno de los 19 pacientes que recibieron valaciclovir presentó HZV. Interesantemente, se ha encontrado un mayor riesgo de HZV en el LES, lo que puede evidenciar un riesgo diferente basado en la enfermedad subyacente236. No hay datos para la ES.
Como se mencionó anteriormente, los pacientes con ES tienen un mayor riesgo de infección por TB (y probablemente por micobacterias no TB) debido a la enfermedad en sí (particularmente en presencia de compromiso pulmonar y HAP) y a la inmunosupresión farmacológica57,58. Los glucocorticoides y los inhibidores del TNF-α son factores de riesgo de TB bien conocidos237,238. Por lo tanto, el tamizaje de la infección por tuberculosis mediante una prueba cutánea de tuberculina o un ensayo de liberación de interferón gamma es la base de la prevención de la enfermedad activa y debe implementarse en pacientes que se van a someter a inmunosupresión215,224. Siempre que se detecta una infección de TB latente, se debe tratar de acuerdo con las directrices224,239. Las recomendaciones de los expertos para la AR sugieren el tamizaje para la detección de micobacterias pulmonares no TB antes de iniciar la terapia biológica en pacientes con anomalías estructurales pulmonares (en particular bronquiectasias) o en aquellos con tos crónica inexplicable. Aunque existe un mayor riesgo de infección por micobacterias no TB en los pacientes con EPI, tales como los de ES62, no hay datos disponibles que respalden la necesidad de profilaxis238.
VacunasAlgunas enfermedades infecciosas prevenibles, como la influenza y la neumonía neumocócica, se pueden manifestar en una forma más severa en los pacientes con ES. Por ejemplo, los pacientes con EPI que contraen la influenza tienen un mayor riesgo de presentar insuficiencia respiratoria y morbilidad. Por lo tanto, la vacunación se convierte en una importante estrategia de cuidado240. Sin embargo, la seguridad y la eficacia de la vacunación en pacientes que reciben terapia inmunosupresora y en pacientes con autoinmunidad siempre han preocupado a los médicos, ya que algunos estudios han demostrado que la terapia inmunosupresora puede impedir la respuesta inmunológica a la vacunación241,242. Estas creencias pueden explicar la baja tasa de vacunación contra la influenza en estos pacientes, como se describe en una cohorte francesa de pacientes con enfermedades autoinmunitarias sistémicas que reciben terapia inmunosupresora243.
InfluenzaInvestigaciones recientes sobre la vacunación contra la influenza en pacientes con ES han demostrado que las diferentes presentaciones de la vacuna contra la influenza no solo son seguras en esta población, sino que también son efectivas. En un estudio realizado por Sampaio-Barros et al., que evaluó los resultados de la vacunación contra la influenza H1N1, no se encontraron diferencias estadísticamente significativas en las tasas de seroprotección (83,7 vs. 76,1%; P = 0,20) o seroconversión (76,1 vs.72,8%; P = 0,61) entre los pacientes con ES y los controles sanos, a pesar de estar recibiendo diferentes medicamentos inmunosupresores. También se observó una incidencia similar de efectos colaterales sistémicos después de la vacunación (25 vs. 31,5%; P = 0,33)244. Otro estudio realizado por Setti et al., evaluó la efectividad de la vacuna contra la influenza AH3N2/AH1N1/B en individuos con ES comparados con un grupo de control sano. Aunque se observó una mayor efectividad en el grupo de control, los pacientes con ES alcanzaron una buena respuesta humoral sin una mayor incidencia de efectos adversos o alteraciones en el curso de la enfermedad, demostrando su seguridad y eficacia240.
Neumonía neumocócicaLas autoridades de salud pública recomiendan la vacunación contra el Streptococcus pneumoniae (PCV13 o PPVP23) en los adultos inmunocomprometidos245 y diferentes estudios han descrito una respuesta inmunitaria favorable a la vacuna contra el neumococo en los pacientes con ES. Un estudio realizado por Hesselstrand et al., que comparó la respuesta inmunitaria de los pacientes con ES, con o sin FARME (fármacos antirreumáticos modificadores de la enfermedad) frente a un grupo de control, quienes recibieron la vacuna antineumocócica PPVP23 o PCV13, encontró que la producción de anticuerpos contra serotipos de neumococos en los pacientes con ES que no recibieron FARME fue similar a la del grupo de control sano. No se describieron diferencias entre la vacuna PPVP23 y la PCV13. Sin embargo, los pacientes tratados con FARME tuvieron una menor producción de anticuerpos246. Otro estudio realizado por Mercado et al. describió la inmunogenicidad de diferentes antígenos neumocócicos después de la vacunación con PPVP23 en un grupo de 18 pacientes con ES. Ellos encontraron que después de la vacunación, los anticuerpos contra los diferentes antígenos aumentaron al doble en todos los pacientes a pesar de ser tratados con CYC. No se observaron diferencias entre la ES limitada y la ES difusa247.
En la tabla 4 se resumen las recomendaciones adicionales para la inmunización en pacientes con enfermedades inflamatorias reumáticas autoinmunitarias del CDC222, la Asociación Colombiana de Infectología (ACIN)222, la Sociedad Americana de Enfermedades Infecciosas (IDSA)222, la Asociación Colombiana de Reumatología (ASOREUMA216) y la Liga Europea contra el Reumatismo (EULAR)221. Se deben evaluar las intervenciones novedosas adaptadas para el contexto suramericano para futuras recomendaciones sobre vacunación en pacientes con enfermedades autoinmunitarias, tales como la vacunación contra el virus del dengue, la enfermedad meningocócica y la vacunación con la vacuna inactivada contra el HZV desarrollada recientemente (Shingrix), que ha demostrado ser más efectiva para la prevención del HZV y la neuralgia postherpética248.
Principales recomendaciones para la vacunación en pacientes con enfermedades reumáticas inflamatorias autoinmunitarias y pacientes con inmunocompetencia alterada
| Recomendación | EULAR (2011)221 | IDSA (2013)222 | ACIN (2016)223 | ASOREUMA (2016)216 | Pérez-Díaz et al. (2016)215 | CDC (2018)222 |
|---|---|---|---|---|---|---|
| • Evaluar qué vacunas se le administraron anteriormente al paciente | X | X | X | X | X | X |
| • Las vacunas vivas se deben administrar cuatro semanas antes de la inmunosupresión | X | X | X | |||
| • De acuerdo a la edad, se deben administrar todas las vacunas inactivadas > 2 semanas antes de la inmunosupresión | X | X | X | X | X | |
| • Se deben administrar las vacunas si la enfermedad inflamatoria y autoinmunitaria está estable | X | X | ||||
| • No se deben administrar vacunas vivas ni vivas atenuadas a pacientes con inmunosupresión de alto grado | X | X | X | X | X | X |
| • La vacunación se debe administrar antes de iniciar el rituximab o seis meses después de suspender el tratamiento | X | |||||
| • Se pueden administrar vacunas inactivadas a pacientes que reciben FARME y bloqueadores del TNF-α | X | X | X | |||
| • Se pueden administrar vacunas vivas un mes después de suspender las dosis altas de corticosteroides | ||||||
| • Los corticosteroides en dosis bajas no contraindican las vacunas vivas | ||||||
| •Se deben suspender las vacunas vivas durante los tres meses posteriores a la suspensión de los anticuerpos Anti-TNFα o las células B | ||||||
| • Quienes viven en un hogar con pacientes inmunocomprometidos deben vacunarse siguiendo las recomendaciones del esquema actualizado anualmente, excepto para la polio oral | X | X | X | |||
| • Se debe administrar la vacuna contra la varicela a los pacientes sin evidencia de inmunidad contra la varicela con bajo nivel de inmunosupresión o ≥4?semanas antes de la inmunosupresión | X | X | X | |||
| • Administrar la vacuna contra el Herpes Zóster a los pacientes ≥ 60 años antes de la terapia inmunosupresora o a aquellos con terapia inmunosupresora suave | X | X | X | X | ||
| • Administrar la vacuna contra el Herpes Zóster a los pacientes ≥50 años con inmunidad contra la varicela que van a tener un alto grado de inmunosupresión | X | X | X | |||
| • Se debe administrar anualmente la vacuna inactivada contra la influenza | X | X | X | X | X | X |
| • Se debe administrar la vacuna antineumocócica polisacárida PPSV23 y PCV13 | X | X | X | X | X | X |
| • Se debe administrar la vacunación con toxoide tetánico como en la población general seis meses después del rituximab | X | X | X | X | X | |
| • Se recomienda la vacunación contra Hepatitis A y B en los pacientes en riesgo de contraer estas enfermedades | X | X | X | X | ||
| • Se recomienda encarecidamente la vacuna contra la Hepatitis B | X | X | X | X | ||
| • Se recomienda vacunar contra el VPH del mismo modo que para la población general, especialmente a los pacientes con LES | X | X | X | X | ||
| • No vacunar con la vacuna BCG contra la tuberculosis | X | X | X | X | ||
| • No se recomienda la vacuna oral contra el polio | X | X | ||||
| • Evitar la vacuna contra la fiebre amarilla | X | X | X | X | X | |
| Inmunosupresión de alto grado:• Prednisona a dosis ≥ 20?mg/día o equivalente durante ≥ 14 días• Ciertos inmunomoduladores biológicos, bloqueadores del TNF-α o rituximab• Después del TCMH, la inmunosupresión de alto grado es variable y depende de:∘ Tipo de trasplante∘ Tipo de donante∘ Fuente de células madre∘ Complicaciones (EICH) | Inmunosupresión de bajo grado:• Metotrexato a dosis ≤ 0,4 mg/kg/semana• Azatioprina ≤ 3 mg/kg/día• 6 mercaptopurina ≤ 1,5 mg/kg/día• Prednisona < 20?mg/día o su equivalente durante menos de 14 días | |||||
ACIN: Asociación Colombiana de Infectología; ASOREUMA: Asociación Colombiana de Reumatología; BCG: Bacilo Calmette-Guerin; CDC: Centros para el Control de las Enfermedades (en inglés,Centers for Disease Control); EULAR: Liga Europea contra el Reumatismo; EICH: Enfermedad Injerto contra Huésped; FARMES: Fármacos antirreumáticos modificadores de la enfermedad; Hib: Haemophilus influenza b; IDSA: Sociedad Americana de Enfermedades Infecciosas; PCV: Vacuna neumocócica conjugada; PPSV: Vacuna neumocócica polisacárida; LES: Lupus eritematoso sistémico; TCMH: Trasplante de Células Madre Hematopoyéticas; TNF-α: Factor de necrosis tumoral α.
Se debe considerar un tamizaje basal para diferentes enfermedades infecciosas, ya que se espera una fuerte inmunosupresión en los pacientes con ES. La interpretación de las pruebas de tamizaje se ha discutido cuidadosamente en otra parte102,215,224. Este tamizaje se debe basar en la epidemiología local, que debe incluir siempre: TB, VIH, virus de la hepatitis A, VHB, virus de la hepatitis C, toxoplasma, VEB, CMV, virus de la varicela zóster, sífilis y un examen coprológico. Algunas otras entidades que se deben considerar son: Chagas (Trypanosoma cruzi) y el virus de los linfocitos T humanos 1-2215. El tamizaje rutinario para histoplasmosis no se recomienda y solo se debe considerar en las zonas endémicas215. Se debe considerar la profilaxis antiparasitaria, particularmente si se planea una terapia biológica o con glucocorticoides. Para prevenir una sobreinfección helmíntica se recomienda el uso de ivermectina (200 ug/kg/día [es decir, una gota por kg]) en dos dosis con 15 días de diferencia, o albendazol 400 mg/día durante tres días223. Se ha propuesto la profilaxis de la amebiasis en zonas endémicas utilizando dos gramos de secnidazol en una dosis única, repitiéndola cada año si persiste la inmunosupresión o si el paciente sigue viviendo en una zona endémica215.
ConclusiónLas infecciones son un motivo de preocupación cada vez mayor en el manejo de la ES, ya que la evidencia sugiere que son una causa creciente de hospitalización y mortalidad. La mayoría de los estudios sobre este tema provienen de los Estados Unidos y Europa, con pocos estudios de Asia, lo que puede no representar a las poblaciones latinoamericanas, por lo que se requieren estudios locales. Los pacientes con ES presentan un mayor riesgo de complicaciones infecciosas debido al daño estructural por la enfermedad y al tratamiento inmunosupresor. Los nuevos agentes terapéuticos han mostrado resultados prometedores; sin embargo, se puede esperar una incidencia creciente de infecciones como se ha observado en otras enfermedades reumáticas. No hay datos sobre los efectos de la profilaxis antimicrobiana y las estrategias de manejo de riesgos en la ES, aunque la experiencia con otras enfermedades autoinmunitarias puede arrojar luz sobre este tema. Se justifica crear más conciencia entre los especialistas tratantes, especialmente los reumatólogos. Es necesaria la adopción amplia de estrategias de manejo de riesgos, incluyendo medidas infrautilizadas tales como la vacunación.
FinanciaciónEl presente trabajo no recibió ninguna financiación.
Conflicto de interesesLos autores declaran que no existen conflictos de intereses relevantes para el presente manuscrito.
Agradecemos a la Dra. Diana Romero-Alvernia por sus valiosos comentarios sobre el manuscrito.