Las manifestaciones osteoarticulares (MOA) están presentes de forma frecuente en pacientes con esclerosis sistémica (SSc). Generan gran discapacidad funcional con un impacto importante en la calidad de vida de los pacientes, por lo que requieren especial atención por parte de los clínicos.
ObjetivosDeterminar la frecuencia de las MOA dentro de la SSc, su impacto en la condición general de los pacientes y las diferentes herramientas disponibles de diagnóstico y tratamiento.
MetodologíaSe realizó una revisión sistemática de la literatura disponible desde enero de 1970 hasta diciembre de 2018 en las bases de datos de Medline, Embase, Lilacs, Scielo, Cochrane y clinicaltrials.gov.
Resultados y conclusionesSe incluyeron un total de 116 artículos en esta revisión. Se determinaron el tipo y la prevalencia de las diferentes MOA reportadas en la literatura. Además de la evolución en los métodos diagnósticos de las mismas, cada vez existen más métodos validados para evaluar el impacto de las MOA en los pacientes con SSC. Se requieren ensayos clínicos aleatorizados que permitan establecer la mejor estrategia de tratamiento para estos pacientes.
Osteoarticular manifestations (OAM) are frequently present in patients with systemic sclerosis (SSc). These OAM are related to important functional disability and a severe impact on patient's life quality, therefore, they require special attention from clinicians.
ObjectiveDetermining the frequency of reported OAM in SSc patients, the general impact of osteoarticular manifestations in patient's condition and the tools available for diagnosis and treatment.
MethodologyA systematic review of the literature was performed for information published between January 1970 and December 2018 in the medical research databases of: Medline, Embase, Lilacs, Scielo, Cochrane and clinicaltrials.gov.
Results and conclusionsA total of 116 articles were included in this review. The type and prevalence of the different OAM reported in the literature were determined. In addition to the evolution of their diagnostic methods, there are more validated methods to assess the impact of OAM in patients with SSc. Randomized clinical trials are required to establish the best treatment strategy for these patients.
Las manifestaciones osteoarticulares (MOA) se presentan frecuentemente en los pacientes con esclerosis sistémica (SSc) con una prevalencia reportada del 40 al 80% de los casos1,2. Estas MOA están relacionadas con una discapacidad funcional importante y un impacto severo en la calidad de vida del paciente. Clements et al.3 advirtieron previamente sobre la brecha en el conocimiento relacionado con las MOA en la SSc y la necesidad de investigar más sobre ese tema.
Durante los últimos años la importancia de las MOA en la SSc ha crecido, aumentando la cantidad de literatura publicada sobre este tema. En vista de la cantidad de información nueva disponible, decidimos hacer una revisión sistemática de la literatura con el fin de determinar la frecuencia de las MOA en los pacientes con SSc reportada en la literatura, el impacto de las MOA en las condiciones del paciente y las herramientas disponibles para el diagnóstico y el tratamiento.
MetodologíaSe llevó a cabo una revisión sistemática de la literatura sobre la información publicada entre enero de 1970 y diciembre de 2018. La estrategia de búsqueda se realizó en las bases de datos de investigación médica de: Medline, Embase, Lilacs, Scielo, Cochrane y clinicaltrials.gov. Los términos utilizados fueron: «Scleroderma, Systemic», «CREST syndrome», «Scleroderma», «SSc», «Systemic sclerosis», «Joint diseases», «Musculoskeletal Diseases» y «Arthritis» (material suplementario, tabla S1). La búsqueda por idiomas se limitó al inglés y al español, y solo se incluyeron los artículos relacionados con seres humanos. La búsqueda incluyó artículos que discutían el diseño de la investigación, estudios de cohortes, de casos y controles y transversales de acuerdo al objetivo de la revisión. Los criterios de exclusión que se consideraron fueron: población pediátrica, reportes de casos individuales, estudios genéticos, revisiones narrativas, cartas al editor y artículos de opinión. Inicialmente, 3.613 artículos fueron tamizados por el contenido del título; posteriormente, dos investigadores independientes revisaron los documentos basándose en sus resúmenes. Los duplicados fueron descartados (fig. 1). En caso de desacuerdo con respecto a la inclusión de un artículo, dicho artículo fue revisado por los dos investigadores. En caso de no lograr un consenso, la decisión fue tomada por el investigador sénior. La primera fase dio como resultado 130 artículos para ser seleccionados mediante la investigación del texto completo (fig. 1). Después de leer los estudios relacionados con manifestaciones musculoesqueléticas (21 artículos) consideramos que se debía realizar una revisión sistemática independiente centrada en estas manifestaciones. Por esa razón excluimos esos artículos de la revisión actual. Se excluyeron 14 artículos adicionales con base en su contenido (tabla S2). Después de revisar los artículos relacionados y la bibliografía se incluyeron 21 documentos. Por lo tanto, se incluyeron en total 116 artículos en la presente revisión (tabla 1). La información a incluir fue extraída en forma separada por dos investigadores independientes. En caso de desacuerdo, se utilizó la misma metodología que en la selección de los estudios. La evaluación del riesgo de sesgo fue realizada por dos investigadores independientes (tablas S3-S6).
Artículos incluidos en la revisión sistemática
| Autor | Año | Diseño del estudio | n | Duración media de la enfermedad (años) | dcSSc (%) | lcSSc (%) | Principales hallazgos a nivel osteoarticular |
|---|---|---|---|---|---|---|---|
| Avouac et al.1 | 2012 | Revisión | − | − | − | − | El compromiso articular es frecuente en la SSc. Contribuye a la discapacidad y compromete la calidad de vida de los pacientes |
| Avouac et al.2 | 2010 | Transversal basado en datos | 7.286 | 10?±?9 | 42 | 58 | Se presenta sinovitis, TFR y JC en el 16, el 11 y el 31%, respectivamente. Están asociados con una enfermedad más severa e inflamación sistémica |
| Clements et al.3 | 2012 | Revisión sistemática | − | − | − | − | La mayoría de las herramientas que se utilizan para evaluar la artritis en los pacientes con SSc no han sido validadas y se requiere trabajo adicional para desarrollar un «conjunto central» de variables para evaluar la artritis en la SSc y su respuesta al tratamiento |
| Ostojić y Damjanov4 | 2006 | Transversal | 105 | 5,3 | 47 | 53 | El deterioro musculoesquelético es más común en los pacientes con dcSSc |
| Schmeiser et al.5 | 2012 | Transversal basado en datos | 58 | 12?±?9 | 24 | 76 | Se encontró artritis en el 31% de los pacientes, 19% clínicamente y 26% radiológicamente |
| Tager y Tikly6 | 1999 | Transversal | 63 | 3,6 | 65 | 35 | Se encontraron artralgias/artritis en el 68% de los pacientes sudafricanos de raza negra con SSc |
| Wangkaew et al.7 | 2018 | Transversal | 110 | 4,9±4,8 | 66 | 34 | Los pacientes con dcSSc presentaron complicaciones clínicas en las manos más severas que aquellos con lcSSc. El FR se asocia con artritis y el MRSS alto se asocia con contracturas de los dedos y úlceras digitales |
| Arias-Nuñez et al.8 | 2008 | Transversal basado en datos | 78 | 8,3 | 30 | 70 | Se encontraron artralgias en el 54% de los pacientes y artritis en el 12% |
| La Montagna et al.9 | 2005 | Transversal | 76 | 8 | 29 | 30 | Se encontraron artralgias en el 38% de los pacientes y artritis en el 13%. Se encontró TFR en el 13%. En compromiso articular es un determinante importante de discapacidad |
| Jaeger et al.10 | 2018 | Transversal | 944 | 14,8 | 37 | 57 | Se encontró artritis en el 11% de los pacientes, TFR en el 4,6% y JC en el 50%. Los pacientes con SSc perciben el dolor, las úlceras digitales y la debilidad muscular como algunos de los principales factores que generan su nivel de discapacidad |
| Misra et al.11 | 1995 | Transversal | 34 | 7,5 | 53 | 47 | Se observó sinovitis en el 88% de los pacientes. Se encontró FR en el 33% de los pacientes con SSc. |
| Allali et al.12 | 2007 | Transversal basado en datos | 46 | 10,5±6,5 | 65 | 35 | Los pacientes con SSc presentaron anomalías radiológicas en el 80% de los casos, incluyendo estrechamiento del espacio articular (37%) y erosiones (43%) |
| Lovell y Jayson13 | 1979 | Transversal | 24 | − | − | − | Las anomalías radiológicas en las articulaciones de los pacientes con SSc son frecuentes |
| Armstrong y Gibson14 | 1982 | Serie de casos | 4 | − | − | − | La artritis destructiva puede representar la coexistencia de AR y SSc |
| Horimoto y da Costa15 | 2016 | Transversal | 61 | − | 33 | 48 | Se observó artritis en 33% de los pacientes con SSc. La superposición con AR fue del 6,6%. Se encontraron anti-CCP positivos en el 20% de los pacientes con artritis versus ningún paciente con SSc sin artritis |
| Jinnin et al.16 | 2003 | Transversal | 173 | 8 | 37 | 63 | La superposición con AR estuvo presente en el 5,2% de los pacientes. Se observó artritis previa al fenómeno de Raynaud, un aumento de la PCR y FR elevado en los pacientes con AR con una incidencia significativamente mayor que en los que no presentaban AR |
| Baron et al.17 | 1982 | Transversal | 38 | 7,3 | − | − | La ocurrencia de artropatía es común. La enfermedad erosiva no se correlacionó con la duración de la enfermedad, la presencia de FRF, anticuerpos antinucleares, DTR, ni con el alcance de los cambios cutáneos de la esclerodermia |
| Avouac et al.18 | 2016 | De cohortes prospectivo | 1.301 | 2±1 | 38 | 62 | La sinovitis y el TFR son factores predictivos independientes para la progresión de la enfermedad en los pacientes con SSc temprana |
| Arslan Tas et al.19 | 2015 | Casos y controles | 175 | 7 | 67 | 33 | Se encontró sacroileítis en el 23% de los pacientes con SSc, y esta fue significativamente diferente de la de los grupos de AR y los controles sanos. Se encontró que el género masculino, el subtipo difuso, el dolor de espalda inflamatorio y los niveles elevados de proteínaC reactiva son factores de riesgo significativos para la sacroileítis |
| Bálint et al.20 | 2014 | De cohortes prospectivo | 131 | 7,8 | 31 | 69 | Las contracturas se desarrollan predominantemente durante los primeros años de la enfermedad. La inflamación y el compromiso de la piel son factores que contribuyen significativamente al desarrollo de contracturas. Un número alto de contracturas articulares podría ser un factor pronóstico desfavorable en la SSc |
| Ashida et al.21 | 2007 | Transversal | 350 | 7,8 | 43 | 57 | Se encontró CF en el 47% de los pacientes con SSc. La presencia de CF puede ser un marcador de compromiso esofágico, fibrosis pulmonar y afectación cardíaca |
| Wiese et al.22 | 2014 | De cohortes prospectivo | 200 | 1,6±1,4 | 100 | 0 | La evaluación de la salud global por el médico tuvo grandes correlaciones con el MRSS (r=0,60) y la escala analógica visual de afectación cutánea reportada por el médico en el último mes (r=0,74). Las variables de la piel respondieron más al cambio que las variables musculoesqueléticas durante un período de un año |
| Avouac et al.23 | 2011 | De cohortes prospectivo | 103 | 12 | − | − | El análisis de regresión de Cox multivariante no identificó ningún predictor de la progresión de la artritis erosiva. Se demostró que las úlceras digitales predicen en forma independiente la progresión de la acroosteólisis y la calcinosis (HR 12,43 y HR 3,16, respectivamente). Se demostró que la dcSSc es un predictor independiente de la progresión de la CFC (HR 7,52) |
| Khanna et al.24 | 2010 | Transversal basado en datos | 134 | 0,8 | 100 | 0 | Cuarenta y nueve (37%) pacientes tenían TFR al inicio del estudio, el 50% presentaron resolución de su TFR, mientras que el 21% desarrollaron un nuevo TFR. El cambio en el TFR (p=0,04) y en el MRSS inicial (p=0,03) predijo un cambio en el MRSS en un período de 12meses (modelo R2=0,14) |
| Steen y Medsger25 | 1997 | De cohortes prospectivo | 1.305 | 6 | 49 | 51 | Se detectó TFR con mayor frecuencia en la dcSSc. La presencia de 1 o más TFR fue un buen predictor tanto de la evolución a engrosamiento cutáneo difuso como de una menor supervivencia |
| Doré et al.26 | 2013 | De cohortes prospectivo | 287 | 1 | 100 | 0 | Los pacientes con TFR tuvieron un riesgo >2veces de desarrollar una crisis renal y cardíaca y complicaciones de enfermedad gastrointestinal. Los pacientes con TFR tuvieron peores tasas de supervivencia a 5 y a 10años |
| Tas et al.27 | 2012 | Transversal | 28 | 1,8 | 61 | 36 | Se encontró una correlación entre la artritis y el compromiso cardíaco, y el FTP se correlacionó con el compromiso pulmonar |
| Arana-Ruiz et al.28 | 2016 | Transversal | 40 | 7 | 30 | 70 | La acroosteólisis fue más frecuente en los pacientes con MSC más alta que en aquellos con MSC baja |
| Johnstone et al.29 | 2012 | Transversal | 101 | 13 | 30 | 70 | La acroosteólisis estuvo fuertemente asociada con isquemia digital severa. Los pacientes con acroosteólisis moderada/severa fueron más propensos a presentar calcinosis severa, pero esta no fue estadísticamente significativa después del ajuste para posibles factores de confusión |
| Koutaissoff et al.30 | 2011 | Transversal | 335 | 9 | 24 | 64 | Aunque se puede observar una artritis similar a la reumatoide o una artropatía por colapso en los pacientes con SSc, las artropatías son menos frecuentes que lo que se había reportado anteriormente |
| Morardet et al.31 | 2016 | Transversal | 155 | 9±8 | 42 | 58 | La acroosteólisis y la calcinosis están asociadas independientemente con el patrón tardío de la NVC y en particular con una pérdida capilar severa. Hubo mayor probabilidad de que la acroosteólisis severa se presentara con neoangiogénesis |
| Valenzuela et al.32 | 2016 | De cohortes retrospectivo | 5.218 | 13,5 | 38 | 62 | En el análisis multivariable las asociaciones más fuertes con calcinosis fueron las úlceras digitales (OR=3,9) y la osteoporosis (OR=4,2) |
| Avouac et al.33 | 2006 | Transversal | 120 | 6 | 43 | 57 | La contractura en flexión se asoció con discapacidad y se presentó en los pacientes con dcSSc. Tanto la calcinosis como la acroosteólisis se asociaron con complicaciones vasculares |
| La Montagna et al.34 | 2002 | De cohortes retrospectivo | 100 | 17,4±10,5 | 26 | 74 | El compromiso del pie en la SSc tiene un inicio más tardío que el de la mano, y es relativamente menos frecuente, pero puede ser incapacitante |
| Taccari et al.35 | 1989 | Reporte de caso | 2 | − | 100 | 0 | La osteonecrosis avascular podría estar relacionada con la progresión osteoarticular de la SSc de larga duración |
| Frerix et al.36 | 2016 | Serie de casos | 9 | 10,7 | 44 | 56 | La osteonecrosis del hueso semilunar es una manifestación frecuente y hasta ahora poco reconocida de la SSc que podría estar asociada a la vasculopatía relacionada con la SSc |
| Matsumoto et al.37 | 1999 | Reporte de caso | 3 | − | − | − | La osteonecrosis puede representar una causa poco reconocida de dolor en la muñeca en los pacientes con esclerodermia |
| La Montagna et al.38 | 1991 | Transversal | 90 | 9 | 38 | 38 | La menopausia temprana puede desempeñar un papel en la inducción de osteopenia en la SSc |
| Rios-Fernández et al.39 | 2012 | Transversal | 200 | 15,4±10,9 | 18 | 74 | La prevalencia de osteopenia/osteoporosis fue del 50% en la población de control y del 77% en la SSc. El estudio no pudo demostrar una relación entre la deficiencia de vitaminaD y una densidad mineral baja |
| Omair et al.40 | 2014 | Transversal | 45 | 7 | 40 | 60 | Se observó una baja DMO en el 62% de los pacientes. El 36% de ellos tenían OP. La DMO baja se asoció con la raza no caucásica, el estado postmenopáusico y un IMC bajo |
| Caimmi et al.41 | 2016 | Transversal | 106 | 10±5,8 | 35 | 65 | El estudio encontró una correlación positiva entre el IMC y el puntaje Z del fémur total y del cuerpo entero y entre la edad y el puntaje Z del cuello femoral. Se demostró que el compromiso pulmonar se correlacionó con un puntaje Z del cuerpo entero más bajo en el análisis multivariado |
| Frediani et al.42 | 2004 | Transversal | 55 | 10,9 | 36 | 34 | La DMO y el SI fueron más bajos en las mujeres con dcSSc. La DMO y el SI fueron más bajos en las mujeres en quienes uno o más órganos internos estaban comprometidos |
| Kilic et al.43 | 2016 | Transversal | 43 | 10,9±7,1 | 42 | 46 | Los pacientes con SSc tenían un IMC bajo y niveles bajos de vitaminaD comparados con los pacientes con AR. La DMO de la cadera total y del cuello femoral y el puntaje T en el cuello femoral y en la cadera total fueron significativamente más bajos en los pacientes con SSc versus aquellos con AR |
| Avouac et al.44 | 2012 | Transversal | 71 | 10±9 | 28 | 72 | La prevalencia de OP y fracturas en la SSc aumentó en comparación con la de las mujeres sanas y alcanzó la alta prevalencia asociada a la AR. La edad y la deficiencia de vitaminaD fueron identificadas como factores de riesgo de fractura en la SSc |
| Mok et al.45 | 2013 | Transversal | 84 | 7,8±6,4 | 21 | 79 | La DMO de la columna y la cadera es significativamente más baja en los pacientes con SSc que en los sujetos sanos, independientemente de la edad, el sexo, la menopausia, un IMC bajo y composición corporal alterada |
| Souza et al.46 | 2006 | Transversal | 43 | 13,2±8,0 | 91 | 9 | Se observó una mayor frecuencia de OP en la columna lumbar y en el cuello del fémur en los pacientes con SSc al compararlos con los controles. El análisis de regresión lineal múltiple reveló una asociación entre la presencia de SSc y una baja DMO |
| Atteritano et al.47 | 2013 | Transversal | 54 | 5±2 | 37 | 63 | Las fracturas vertebrales son frecuentes en los sujetos con SSc y sugieren que los niveles más bajos de 25(OH)D3 pueden desempeñar un papel en el riesgo de OP y fracturas vertebrales |
| Omair et al.48 | 2013 | Revisión sistemática | − | − | − | − | Los datos sugieren que los pacientes con SSc están en riesgo de presentar una baja DMO y fracturas, especialmente cuando están presentes otros factores de riesgo para OP |
| Yacoub et al.49 | 2012 | Transversal | 60 | 9,63±5,9 | 85 | 15 | Los pacientes marroquíes presentan una alta frecuencia de OP en comparación con los controles sanos. La pérdida ósea parece estar asociada con: duración prolongada de la enfermedad, compromiso articular severo, síndrome de malabsorción y el estado inmunológico |
| Sampaio-Barros et al.50 | 2005 | Transversal | 61 | − | 34 | 66 | Se observó una DMO baja en los sitios apendiculares en las pacientes fértiles y posmenopáusicas con SSc en comparación con un grupo de control sano, asociada con un IMC bajo. La DMO baja fue independiente de las variantes clínicas de la SSc, la raza y el uso previo de corticosteroides y ciclofosfamida |
| Koumakis et al.51 | 2015 | Transversal | 65 | 10,2±8,6 | 32 | 68 | El TBS fue significativamente menor en la SSc comparado con los controles y no difirió del de la AR, a pesar de una dosis acumulativa y diaria de GC más baja. Un TBS bajo se asoció independientemente con la dosis diaria de GC (OR 5,6) y un puntaje T ≤−2,5 DE (OR 5,0) en la SSc |
| Di Munno et al.52 | 1995 | Transversal | 43 | 5,9 | 21 | 58 | Los pacientes mostraron una DMO más baja que los controles en las determinaciones radial, lumbar y corporal total. Los pacientes con dcSSC presentaron valores más bajos que aquellos con lcSSc. Hubo una correlación negativa entre la DMO y la duración de la enfermedad |
| Fauny et al.53 | 2018 | Transversal | 70 | 10 | 23 | 77 | La prevalencia de FV en la TC fue baja (4,3%), aunque el 50% de los pacientes presentaron un SBAC-L1 ≤145HU. La presencia de calcinosis, calcificaciones periarticulares o acroosteólisis se asoció con un SBAC-L1 bajo y debería dar lugar a un tamizaje para osteoporosis, especialmente en los pacientes menores de 63años |
| Ruaro et al.54 | 2018 | Transversal | 84 | 9,8±7,9 | − | − | El estudio mostró una calidad ósea significativamente más baja (TBS y DMO más bajos) en los pacientes con SSc y AR comparados con los sujetos sanos. La calidad ósea pareció ser menor en los pacientes con SSc con una microvasculatura más alterada (patrón de NVC tardío) |
| Marot et al.55 | 2015 | Transversal | 33 | 9,5±8,4 | 9 | 79 | Los pacientes con SSc tuvieron una mayor prevalencia de OP y la HR-pQCT mostró un deterioro del compartimento trabecular óseo. El IMC bajo, la edad avanzada, las úlceras digitales y los AAC fueron identificados como factores de riesgo independientes para daño óseo |
| Polimeni et al.56 | 2012 | Transversal | 78 | 5 | 21 | 63 | La presencia de anti-CCP está asociada con la presencia de artralgias; sin embargo, no se asocia con artritis, presencia de FR o erosiones radiológicas |
| Morita et al.57 | 2008 | Transversal | 159 | − | 28 | 72 | En los pacientes con SSc-AR, los niveles séricos de anti-CCP fueron significativamente más altos que los observados en la SSc. La sensibilidad y la especificidad de los anti-CCP para el diagnóstico de SSc-AR fueron del 86 y del 97%, respectivamente |
| Santiago et al.58 | 2008 | Transversal | 242 | − | 39 | 54 | La presencia de anti-CCP en la SSc se correlacionó únicamente con la presencia de artritis |
| Stamenković et al.59 | 2012 | Transversal | 82 | − | 28 | 72 | Hubo una asociación estadísticamente significativa entre anti-CCP positivos y artritis y la presencia de erosiones óseas marginales |
| Ingegnoli et al.60 | 2007 | Transversal | 75 | − | 41 | 59 | Se encontró una asociación estadísticamente significativa entre la positividad de anti-CCP y la presencia de artritis y erosiones marginales |
| Ueda-Hayakawa et al.61 | 2010 | Transversal | 146 | − | 41 | 59 | El título sérico de anti-CCP es más alto en los pacientes con superposición SSc-AR que en los pacientes con SSc con o sin artralgias |
| Kamalaksha et al.62 | 2018 | De cohortes prospectivo | 132 | − | 25 | 67 | Se demostraron asociaciones estadísticamente significativas de doble positividad de anticuerpos (anti-CCp y FR) con artralgias y erosiones. También se confirmó una asociación significativa entre anti-CCP y erosiones |
| Laustriat et al.63 | 2018 | Metaanálisis | 1.231 | − | − | − | La prevalencia de anti-PCC en la esclerodermia es del 9,2%. El estudio encontró un mayor riesgo de artritis erosiva, fibrosis pulmonar, compromiso esofágico y compromiso cutáneo difuso en pacientes con SSc con anti-CCP positivo |
| Serup y Staun-Olsem64 | 1986 | De cohortes prospectivo | 117 | − | − | − | El estudio sugirió que el aumento de los anticuerpos anti-DNA y ANA en la esclerodermia localizada se asocia con manifestaciones articulares |
| Foocharoen et al.65 | 2016 | De cohortes prospectivo | 294 | − | 69 | 31 | La positividad de ATA se asoció con una alta frecuencia de deformidades de la mano (OR 7,01). La negatividad de AAC se asoció con una corta duración de la fibrosis pulmonar en la dcSSc y una menor frecuencia de RP en la lcSSc |
| Radić et al.66 | 2006 | Transversal | 28 | 3,3 | − | − | Los pacientes con contracturas en flexión en las articulaciones MCF y IFP tienen un nivel promedio de títulos de ATA más altos que los que no presentan contracturas. Los títulos de ATA están correlacionados positivamente con contracturas en flexión |
| Gheita y Hussein67 | 2012 | Transversal | 40 | 6,1 | 48 | 52 | El nivel de POMC fue más alto en las mujeres y significativamente más alto en los pacientes con SSc con artritis, comparado con los que no la presentaban |
| Yanaba et al.68 | 2012 | Transversal | 57 | 3,6 | 51 | 49 | Los niveles séricos de AH-FAP se encontraban aumentados en los pacientes con SSc y se asociaron con una menor frecuencia de cicatrices deprimidas/úlceras digitales y artritis/artralgias |
| La Montagna et al.69 | 2003 | Transversal | 40 | 12,3±9,5 | 22 | 32 | Los niveles séricos de YKL-40 aumentan en la SSc y se correlacionan con el compromiso articular |
| Bassett et al.70 | 1981 | Transversal | 55 | 11 | − | − | Se encontró la presencia de artropatía erosiva no reumatoide en el 22% de los pacientes con SSc |
| Blocka et al.71 | 1981 | De cohortes prospectivo | 65 | 14,5 | 85 | 15 | Todos los hallazgos de la ESP mostraron progresión, aunque se observó una reversibilidad aislada. El grupo de CREST mostró una frecuencia y una distribución similar de los hallazgos pero con menor tendencia hacia la progresión |
| Izquierdo et al.73 | 2016 | Revisión sistemática y metaanálisis | − | − | − | − | La prevalencia de resorción del DPTH fue del 28,3%, I2=80,4%. La prevalencia de calcinosis fue del 15,6%, I2=0%. Ningún estudio reportó proliferación de erosiones y solo un estudio describió esclerosis del DPTH en 5 individuos |
| Freire et al.73 | 2013 | Transversal | 44 | − | − | − | Se encontró sinovitis en el 39% de los pacientes, tenosinovitis en el 27%, y el 41% de los casos tenían un patrón en capas. Con la US se encontró calcinosis en el 39% de los pacientes, con una sensibilidad del 89%. Se encontró acroosteólisis en el 20% de los pacientes con la US, con una sensibilidad del 90% |
| Chitale et al.74 | 2010 | Transversal | 17 | − | 18 | 82 | El estudio encontró una artropatía periférica inflamatoria erosiva persistente, similar a la que se ve en la AR, en los pacientes con SSc con artralgias sin enfermedad inflamatoria articular manifiesta. La RM es más sensible que la US en este contexto |
| Abdel-Magied et al.75 | 2013 | De cohortes prospectivo | 16 | 5,4 | 31 | 69 | Al utilizar US y RM se encontró que los pacientes con SSc con artralgias que no presentaban artritis inflamatoria clínicamente manifiesta tenían una artropatía inflamatoria erosiva persistente en sus manos y muñecas |
| Cuomo et al.76 | 2009 | Transversal | 45 | 6 | 38 | 62 | Se encontró que la prevalencia de sinovitis detectada por US fue significativamente mayor que la encontrada en el examen clínico. La US indicó un número de articulaciones con osteófitos significativamente mayor que el detectado con los rayosX |
| Elhai et al.77 | 2012 | Transversal | 52 | 8,6±8,6 | 40 | 60 | El compromiso articular en la SSc se subestima con un simple examen clínico. Se caracteriza por cambios inflamatorios leves y los hallazgos específicos incluyen aspectos escleróticos en la US junto con calcinosis |
| Kilic et al.78 | 2015 | Transversal | 52 | 9,34±8,27 | 48 | 42 | Los pacientes con SSc tuvieron puntajes MASEI significativamente más altos que los controles sanos. A excepción de la aponeurosis plantar, los tendones y ligamentos fueron más gruesos en el grupo con SSc |
| Iagnocco et al.79 | 2013 | Transversal | 46 | 11,3 | 39 | 61 | El estudio se centró en la evaluación mediante USPD de anomalías inflamatorias y estructurales de las articulaciones de la mano y las muñecas en la SSc. Las muñecas fueron el sitio donde se presentaron con mayor frecuencia cambios inflamatorios. La presencia de hipertrofia sinovial, derrame articular, irregularidades corticales y TS fue significativamente mayor en los pacientes con SSc que en los controles sanos |
| Lescoat et al.80 | 2018 | Transversal | 103 | 7,6 | 33 | 67 | Los pacientes cumplieron los criterios de clasificación ACR/EULAR para la SSC 2013. Las dos principales características en el USPD fueron sinovitis inflamatoria/Doppler positiva y TS esclerosante. La TS esclerosante fue más frecuente en los hombres y se asoció con anticuerpos anti-RNA polimerasaIII, dcSSc y artralgia inflamatoria. La TS o la sinovitis se asociaron con niveles de PCR >5mg/l y artralgia inflamatoria |
| Akbayrak et al.81 | 2013 | Transversal | 26 | 7,9±5,3 | 23 | 77 | Las erosiones, el edema de la médula ósea, la sinovitis y los derrames articulares en la RM de bajo campo son frecuentes en los pacientes con SSc pura. Todos los huesos y articulaciones pueden verse afectados, pero la sinovitis y el edema de la médula ósea se presentaron predominantemente en la fila proximal de los huesos del carpo, afectando con mayor frecuencia al hueso semilunar |
| Low et al.82 | 2009 | Transversal | 17 | − | 59 | 41 | En la RM se encontraron hallazgos inflamatorios en el 59% de los pacientes, incluyendo sinovitis, erosiones, derrame articular y TS |
| Tehranzadeh et al.83 | 2006 | Transversal | 72 | − | − | − | Las imágenes de la mano y la muñeca por RM constituyen una técnica superior para la detección de la TS |
| Stoenoiu et al.84 | 2013 | Transversal | 15 | 7,5 | 100 | 0 | No se detectó artritis ni tenosinovitis clínicamente manifiesta. Se identificó sinovitis, TS y desgarro de tendón en 8, 4 y 2pacientes, respectivamente, tanto por US como por RM. Al utilizar la RM se encontraron infiltrados profundos de tejido conectivo rodeando los tendones en todos los sitios con TFR, pero solo en un paciente sin TFR |
| Stamm et al.85 | 2014 | Transversal con análisis cualitativo | 229 | 10 | − | − | Un gran número de problemas similares son mencionados como «típicos» por pacientes con diferentes afecciones reumáticas |
| Malcarne et al.86 | 2007 | Transversal | 114 | 4,3±2,9 | 64 | 36 | Para la incapacidad, las correlaciones significativas fueron la sensibilidad articular y el número de puntos sensibles determinados por el médico, el dolor articular con el movimiento reportado por el paciente, la contractura articular, las úlceras en las extremidades diferentes a las digitales y la disnea |
| Willems et al.87 | 2014 | Transversal | 537 | 8 | 36 | 55 | Los síntomas experimentados por ≥70% de los pacientes de todos los países fueron fatiga, RP, dolor articular y dolor muscular. Treinta síntomas tuvieron un impacto en las actividades diarias en ≥50% de los pacientes, quienes informaron que el síntoma estaba presente en todos los países |
| Bassel et al.88 | 2011 | Transversal | 464 | 10,9±9,4 | 13 | 36 | Los síntomas con calificación más alta en términos de frecuencia e impacto moderado a severo en las actividades diarias, respectivamente, fueron: fatiga (89 y 72%), RP (86 y 67%), rigidez de la mano (81 y 59%), dolor articular (81 y 64%) y dificultad para dormir (76 y 59%) |
| Kwakkenbos et al.89 | 2017 | De cohortes prospectivo | 696 | 11,6±8,7 | 42 | 57 | La presencia de contracturas articulares se asoció con decrementos significativos en siete dominios (tamaños de efecto pequeños o pequeños a moderados). Este estudio establece además la validez del PROMIS-29v2 en la SSc |
| Kwakkenbos et al.90 | 2018 | De cohortes prospectivo | 1.193 | 11,2±8,7 | 40 | 60 | La función de la mano se midió utilizando el CHFS. La presencia de contracturas moderadas o severas en las articulaciones pequeñas, la presencia de úlceras digitales y la severidad del RP tuvieron las mayores asociaciones con el deterioro funcional de la mano |
| Hyphantis et al.91 | 2007 | Transversal | 56 | 15,5±12,2 | 30 | 70 | El WHOQOL-BREF se utilizó para evaluar la HRQOL. La HRQOL percibida por los pacientes con SSc se vio afectada significativamente en comparación con los controles sanos. Los pacientes con SSc tuvieron un deterioro en la calidad de vida en cuanto a salud física comparados con los pacientes con AR, LES y SS cuando se tuvo en cuenta la edad, el dolor, la psicopatología y las estrategias de afrontamiento |
| Cole et al.92 | 2006 | Estudio de validación mediante análisis factorial confirmatorio | 387 | 2,2 | 84 | 16 | El HAQ-DI de factor único es apropiado para los ensayos en la SSc; además, los puntajes del HAQ-DI entre los pacientes con SSc y AR temprana se pueden comparar legítimamente entre sí |
| Johnson et al.93 | 2006 | Casos y controles | 350 | 7,1±5,9 | 49 | 51 | Los pacientes con SSc con compromiso articular tuvieron puntajes del HAQ-DI significativamente más bajos que los de los pacientes con PsA, y puntajes en la escala analógica visual del dolor más altos que los de los pacientes con AR. Los puntajes del Resumen del componente físico (Physical Component Summary) SF-36 y del HAQ-DI en los pacientes con SSc resultaron afectados negativamente por compromiso articular y ≥11 puntos sensibles |
| Peytrignet et al.94 | 2018 | De cohortes prospectivo | 326 | 1 | 100 | 0 | Los pacientes con dcSSc mostraron altos niveles de discapacidad, siendo el «agarre» y la «actividad» los más afectados. De las actividades evaluadas en la CHFS, las que implicaban movimientos finos de los dedos fueron las más afectadas. El HAQ-DI y la CHFS estaban altamente correlacionados. El empeoramiento del HAQ-DI en 12meses se asoció fuertemente con un aumento del MRSS, disminución de la función de la mano y aumento de la fatiga |
| Sandqvist et al.95 | 2009 | De cohortes prospectivo | 43 | 2 | 28 | 72 | La movilidad de la mano y la capacidad para realizar actividades de la vida cotidiana se mantuvieron durante los primeros años de la SSc. A nivel individual, el 72% de los pacientes mostraron un cambio en el puntaje HAMIS. La fuerza de agarre y la función percibida de la mano estaban moderadamente afectadas al inicio del estudio y durante el seguimiento |
| Cinar et al.96 | 2014 | Transversal con análisis cualitativo | 19 | 12 | 47 | 53 | El deterioro de la función de la mano afecta las actividades de la vida diaria de los pacientes con SSc, y los pacientes han desarrollado algunas estrategias de afrontamiento para superar estas dificultades |
| Torok et al.97 | 2010 | De cohortes prospectivo | 80a | 5,8±5,6b | 81 | 19 | El delta FTP es una medida fiable del movimiento de los dedos en los pacientes con SSc que supera al FTP |
| Schouffoer et al.98 | 2016 | Ensayo aleatorizado controlado | 53 | 9,2 | 57 | 43 | Se observaron correlaciones significativas entre el puntaje total del MHQ y el HAQ, HAMIS, SODA, SODA Pain y MRSS. El tamaño del efecto del puntaje total del MHQ dentro de la intervención fue mayor que el de todas las demás medidas de desenlace. Se obtuvieron resultados similares para el promedio de respuesta estandarizada |
| Roberts-Thomson et al.99 | 2006 | Transversal | 30 | 23,6c | 40 | 60 | El HAI fue confirmado como una medida confiable que distinguió claramente a los pacientes con deformidad creciente de la mano. El HAI se correlacionó significativamente con las medidas de deterioro funcional global, la fuerza de la mano y la capacidad de agarre prensil |
| Erol et al.100 | 2018 | Transversal | 101 | 10,1±7,1 | 42 | 58 | El DHI reveló una pérdida funcional similar y se correlacionó con varias mediciones relacionadas con la HRQOL en los pacientes con SSc y AR. En la SSc, el alcance de la mano (palmo), la fuerza de la mano y el MRSS tuvieron una influencia importante en las funciones de la mano |
| Poole et al.101 | 2013 | De cohortes retrospectivo | 156 | 12,2±9,7 | − | − | Los participantes con SSc y AR tuvieron un pellizco más débil, disminución del movimiento articular y más limitaciones para la actividad que los grupos con DMII y OA. No se encontraron diferencias significativas entre los grupos en cuanto a la fuerza de agarre de la mano derecha y la destreza con el tablero perforado, y la destreza aplicada |
| Lóránd et al.102 | 2016 | De cohortes prospectivo | 77 | 10,5±9,5 | 65 | 35 | El DAS-28-ESR, el DAS-28-CRP, el SDAI y el CDAI mostraron una correlación significativa con el EScSG-AI, el HAQ-DI, el CHFS y el componente físico del SF-36. A excepción del DAS-28-CRP, los otros tres índices también discriminaron entre los subgrupos de SSc basándose en el valor del EScSG-AI. El DAS-28-ESR mostró el mejor desempeño en cuanto a fiabilidad y validez de constructo |
| Choi et al.103 | 2017 | Transversal | 835 | − | − | − | Se encontró que la prevalencia de FM en los pacientes con enfermedades reumatológicas estaba entre el 1,4 y el 25% |
| Overman et al.104 | 2016 | Transversal | 6120 | − | − | − | La prevalencia de fatiga severa en los pacientes con SSc fue del 48%. La fatiga severa se asoció con el hecho de tener fibromialgia, enfermedades reumáticas múltiples sin fibromialgia, ser menor edad y un nivel de educación más bajo |
| Thombs et al.105 | 2008 | Revisión sistemática | 106 | 11,9±7,9 | 26 | 74 | Los puntajes de IGF en la SSc fueron significativamente más altos que en dos muestras grandes de población y que en dos muestras de pacientes con cáncer en remisión. Los puntajes IGF en SSc fueron similares a los de los pacientes con AR, AS y LES, así como a los puntajes de seis estudios de pacientes con cáncer en tratamiento activo |
| Bruni et al.106 | 2017 | Casos y controles | 20 | − | − | − | En los pacientes con SSc con compromiso articular después de un promedio de 10,8±2,1 meses de tratamiento con hidroxicloroquina, la salud global mejoró en forma estadísticamente significativa, con una tendencia a la mejoría de la sinovitis en la US |
| Nacci et al.107 | 2007 | Estudio piloto | 7 | 3,6±2,5 | 29 | 71 | Después de 6 meses de tratamiento con inmunoglobulinas intravenosas el dolor y la sensibilidad en las articulaciones disminuyeron significativamente y la función de la mano mejoró en forma significativa, junto con la calidad de vida |
| Omair et al.108 | 2011 | De cohortes retrospectivo | 10 | 24 | 60 | 40 | A los 12 meses, la mediana del recuento de articulaciones inflamadas y del recuento de articulaciones sensibles disminuyó significativamente de 10 a 0 y de 15 a 3, respectivamente. La mediana del puntaje de dolor disminuyó de 6 a 3,5. La mediana del puntaje de la piel se mantuvo sin cambios a los 6meses. Un paciente desarrolló herpes zóster no complicado. Después de 30meses, 3pacientes (30%) desarrollaron malignidad. No se observaron muertes ni otros eventos adversos |
| Distler et al.109 | 2011 | Consenso de expertos | − | − | − | − | La mayoría de los expertos no recomiendan el uso rutinario de antagonistas del TNF-α en la SSc. La artritis podría ser una indicación potencial en la SSc, aunque se requieren ensayos clínicos controlados con antagonistas del TNF-α antes de que se puedan dar recomendaciones generales |
| Elhai et al.110 | 2013 | De cohortes prospectivo | 20 | 5±13d | 60 | 40 | Después de 5 meses, el tocilizumab indujo una mejoría significativa en el DAS-28 y sus componentes, con 10/15 pacientes que lograron una buena respuesta según los criterios de EULAR. Después de 11meses de tratamiento de los pacientes con abatacept, los parámetros articulares mejoraron significativamente, con 6/11 pacientes que cumplieron con los criterios de buena respuesta de EULAR |
| Allanore111 | ND | Ensayo aleatorizado controlado | 22 | − | − | − | En curso |
| DeLea et al.112 | 2011 | De cohortes prospectivo | 12 | − | − | − | Los pacientes con SSc respondieron a la inyección en el 83,3% de los casos. La duración terapéutica fue de 4,0±2,2 meses. En el 83% de los sujetos hubo una reducción de los ataques de Raynaud y cicatrización de las úlceras digitales |
| Seeger et al.113 | 1987 | De cohortes prospectivo | 19 | 2 | − | − | No hubo evidencia de que el uso de férulas sirviera para mantener la extensión de la IFP en comparación con la mano de control |
| Norris y Brown114 | 1985 | Serie de casos | 6 | 11 | − | − | En esta serie se realizaron 20 artroplastias. La función de la mano se evaluó en 8 pacientes, y en 6 de ellos hubo una mejoría cualitativa de la función. La tasa de complicaciones postoperatorias fue baja |
| Bogoch y Gross115 | 2005 | Revisión sistemática | − | − | − | − | Los objetivos de la cirugía para la SSc avanzada que afecta la mano son limitados e incluyen el alivio del dolor mediante simpatectomía y una mayor perfusión, reposicionamiento del dedo, proporcionar una posición funcional de fusión y una modesta movilización mediante artroplastia de resección |
| Gilbart et al.116 | 2004 | Serie de casos | 10 | − | − | − | Los resultados de la cirugía de la mano para la SSc son confiables, pero los objetivos deben ser limitados y las expectativas del paciente deben ser modestas |
Duración media de los pacientes tratados con tocilizumab y abatacept, respectivamente.
−: No hay datos.
AAC: anticuerpos anticentrómero; AH-FAP: acetilhidrolasa del factor activador de las plaquetas; ANA: anticuerpos antinucleares; anti-CCP: anticuerpos antipéptido cíclico citrulinado (cyclic citrullinated peptide antibodies); AR: artritis reumatoide; ATA: anticuerpo anti-topoisomerasaI; CDAI: índice de actividad clínica de la enfermedad (Clinical Disease Activity Index); CF: contractura de falanges; CHFS: escala de función de la mano de Cochin (Cochin Hand Function Scale); DAS-28-CRP: puntaje de actividad de la enfermedad 28 usando CRP (Disease Activity Score 28 using CRP); DAS-28-ESR: puntaje de actividad de la enfermedad 28 usando ESR (Disease Activity Score 28 using ESR); dcSSc: SSc difusa; DHI: índice de la mano de Duruöz (Duruöz Hand Index); DMII: diabetes mellitus tipo2; DMO: densidad mineral ósea; DPTH: penacho de la falange distal de la mano (distal phalanx tuft of the hand); DTR: resorción del penacho de la falange distal (distal tuft resorption); EA: espondilitis anquilosante; EScSG-AI: índice de actividad del Grupo de Estudio Europeo Sobre Esclerodermia (European Scleroderma Study Group Activity Index); ESP: esclerosis sistémica progresiva; FM: fibromialgia; FR: factor reumatoide; FTP: dedo a palma (finger-to-palm); GC: glucocorticoides; HAI: índice anatómico de la mano (Hand Anatomic Index); HAMIS: movilidad de la mano en la esclerodermia (Hand Mobility in Scleroderma); HAQ-DI: cuestionario de evaluación de la salud-índice de discapacidad (Health Assessment Questionnaire-Disability Index); HR-pQCT: tomografía computarizada cuantitativa periférica de alta resolución (High-Resolution peripheral Quantitative Computed Tomography); HRQOL: calidad de vida relacionada con la salud (Health-Related Quality Of Life); HU: unidades Hounsfield; IFP: interfalángica proximal; IGF: índice general de fatiga; IMC: índice de masa corporal; JC: contracturas articulares (joint contractures); lcSSc: SSc limitada; LES: lupus eritematoso sistémico; MASEI: índice ecográfico de entesitis de Madrid (Madrid Sonography Enthesitis Index); MCF: metacarpofalángica; MHQ: cuestionario de la mano de Michigan (Michigan Hand Questionnaire); MRSS: puntaje de la piel de Rodnan modificado (modified Rodnan skin score); MSC: escala de severidad de Medsger (Medsger Severity Scale); NVC: videocapilaroscopia del lecho ungueal (nailfold videocapillaroscopy); OA: osteoartritis; OP: osteoporosis; POMC: proteína oligomérica de la matriz del cartílago; PROMIS: sistema de medición de resultados reportados por los pacientes (Patient-Reported Outcomes Measurement Information System); PsA: artritis psoriásica;
RM: resonancia magnética; RP: fenómeno de Raynaud (Raynaud's phenomenon); SBAC-L1: coeficiente escanográfico de atenuación ósea de la primera vértebra lumbar (scanographic bone attenuation coefficient of the first lumbar vertebra); SDAI: índice simplificado de actividad de la enfermedad (Simplified Disease Activity Index); SF-36: cuestionario de salud, forma corta36 (Short Form-36 Health Survey); SI: índice de rigidez (Stiffness Index); SODA: evaluación de la destreza ocupacional secuencial (Sequential Occupational Dexterity Assessment); SS: síndrome de Sjögren; SSc: esclerosis sistémica (systemic sclerosis); SSc-AR: superposición de SSc con AR; TBS: puntaje de hueso trabecular (trabecular bone score); TFR: roces de fricción del tendón (tendon friction rubs); TS: tenosinovitis; US: ultrasonografía; USPD: ultrasonido Power Doppler; WHOQOL-BREF: instrumento de calidad de vida de la Organización Mundial de la Salud, forma corta (World Health Organization Quality of Life Instrument, Short-Form).
La SSc puede tener diferentes niveles de MOA que afectan directamente a las unidades articulares o a su tejido adyacente (tabla 2). Las MOA se observan con mayor frecuencia en la variedad difusa de la SSc y su desarrollo tiene relación con los biomarcadores de severidad del compromiso vascular, muscular y pulmonar2,4.
Prevalencia de MOA en SSc
| n= | Artralgias (%) | Sinovitis (%) | JC (%) | TFR (%) | Calcinosis (%) | |
|---|---|---|---|---|---|---|
| Avouac et al.2 | 7.286 | − | 1.196 (16) | 2.264 (31) | 802 (11) | − |
| Ostojić y Damjanov4 | 105 | 50 (48) | 17 (16) | 52 (49) | 16 (15) | − |
| Schmeiser et al.5 | 58 | − | 18 (31) | − | − | 16 (28) |
| Tager y Tikly6 | 68 | − | 43 (68) | − | − | 12 (19) |
| Wangkaew et al.7 | 110 | 34 (30) | 10 (9) | 42 (47) | 1 (1) | − |
| Arias-Nuñez et al.8 | 78 | 42 (54) | 9 (12) | − | − | 23 (30) |
| La Montagna et al.9 | 76 | 29 (38) | 10 (13) | 40 (52) | 10 (31) | − |
| Jaeger et al.10 | 944 | − | 107 (11) | 477 (50) | 43 (5) | − |
| Misra et al.11 | 34 | − | 30 (88) | − | − | 15 (44) |
| Mok et al.45 | 84 | − | 60 (71) | 39 (46) | − | 29 (35) |
| Malcarne et al.86 | 114 | 70 (61) | 69 (60) | 58 (50) | 17 (15) | 15 (13) |
| Bassel et al.88 | 464 | 375 (81) | 282 (61) | − | − | − |
−: No hay datos.
JC: contractura articular; MOA: manifestaciones osteoarticulares; TFR: roce de fricción del tendón.
La artritis y la sinovitis son manifestaciones frecuentes durante el curso de la enfermedad. La literatura reporta del 9 al 70% de MOA entre los pacientes con estadios tempranos y tardíos de la enfermedad similares2,4-11 (fig. 2). La manifestación más frecuente es la artritis leve con erosiones pequeñas y discretas11-13. Sin embargo, se ha reportado la presencia de artritis erosiva similar a la que se observa en los pacientes con artritis reumatoide (AR) (fig. 3), lo que abre el debate respecto a la presencia de una superposición clínica entre la AR y la SSc o una manifestación aislada de esta última11,14,15. La superposición es altamente sospechosa en los pacientes que desarrollan manifestaciones articulares y fenómeno de Raynaud16. La monoartritis, la oligoartritis o el compromiso poliarticular17 se ven con mayor frecuencia en la SSc difusa comparada con la variedad limitada2, aunque algunos estudios informan que las manifestaciones de artritis deformante son más prevalentes en la variedad limitada de la SSc11. Las MOA también están relacionadas con los reactantes de fase aguda con un OR de 2,1 (IC95%: 1,67-2,64)2. Además, la presencia de artritis es un factor predictivo para: progresión de la enfermedad general, disminución de la función del ventrículo izquierdo, desarrollo de úlceras digitales y empeoramiento del puntaje de Rodnan18, lo que la hace una característica de severidad altamente valiosa para evaluar en todos los pacientes con SSc18. Las manifestaciones de la articulación sacroilíaca no son inusuales, y la presencia de niveles elevados de proteínaC reactiva (PCR) o dolor de espalda deben alertar al clínico sobre la posibilidad de sacroileítis19.
Detección de compromiso inflamatorio de articulaciones y tendones con RM (flechas).
Adaptado con permiso de Avouac et al.1.
Artritis radiográfica erosiva caracterizada por erosiones y estrechamiento del espacio articular que compromete las articulaciones IFP e IFD (flechas).
Adaptado con permiso de: Avouac et al.1.
Las contracturas articulares son muy frecuentes durante el curso de la enfermedad, con una prevalencia del 30 al 80% en todos los pacientes a lo largo de todas las etapas de la enfermedad2,4,9,10,20-22. Las unidades articulares involucradas son principalmente la primera y la segunda articulación metacarpofalángica (MCF) con daño descrito hasta en el 82% de los pacientes con contractura articular. Por lo general se describe el compromiso de las muñecas, los hombros y la segunda y la tercera articulación interfalángica proximal (IFP)20 (fig. 4), mientras que las caderas, las rodillas y los codos rara vez están involucrados. Los pacientes con SSc difusa, títulos positivos de anti-topoisomerasaI y compromiso pulmonar, cardíaco y esofágico son más propensos a presentar contracturas articulares2,7,20,21. Adicionalmente, la variedad difusa de la SSc es un predictor independiente de progresión de la contractura23. Además, se ha descrito que los pacientes con más de cuatro articulaciones afectadas por mano tienen una tasa de supervivencia más baja; por lo tanto, las contracturas articulares se pueden interpretar como un marcador de severidad de la enfermedad20.
Contractura en flexión que compromete las manos.
Adaptado con permiso de Tas et al.27.
Los roces de fricción del tendón (TFR) también aparecen en los pacientes con SSc con una prevalencia reportada del 5 al 37%, presentándose más a menudo en aquellos con SSc difusa2,4,10,22,24. Los TFR se manifiestan principalmente en las manos, los codos y los tobillos24,25. Se encuentran con mayor frecuencia en los pacientes jóvenes y durante las etapas tempranas de la enfermedad (OR: 2,58; IC95%: 1,87-3,56), y su presencia está relacionada con una progresión de la enfermedad y otras manifestaciones severas, tales como el compromiso pulmonar, renal y vascular2,18,24,26. Adicionalmente, los pacientes con SSc difusa temprana que desarrollan TFR tienen una menor supervivencia a 5 a 10años y un compromiso más severo de su calidad de vida24.
En general, las sinovitis, las contracturas articulares y los TFR se manifiestan juntos; por lo tanto, la presencia de cualquiera de las MOA es un factor de riesgo para el desarrollo de otra afectación osteoarticular2.
AcroosteólisisLa resorción ósea de las falanges distales, o acroosteólisis, es otra MOA frecuente que se observa hasta en el 25% de los pacientes27 (fig. 5). Algunos estudios han descrito que esta manifestación está relacionada con un compromiso más severo y sistémico de la SSc28. Además, la acroosteólisis se asocia con la severidad de la isquemia digital29,30, así como con la presencia de patrones videocapilaroscópicos avanzados, especialmente con pérdida capilar y angiogénesis31. De manera similar, la presencia de úlceras digitales es un predictor independiente de la progresión de la acroosteólisis23. Por lo tanto, la resorción ósea distal puede corresponder a una manifestación isquémica de la SSc.
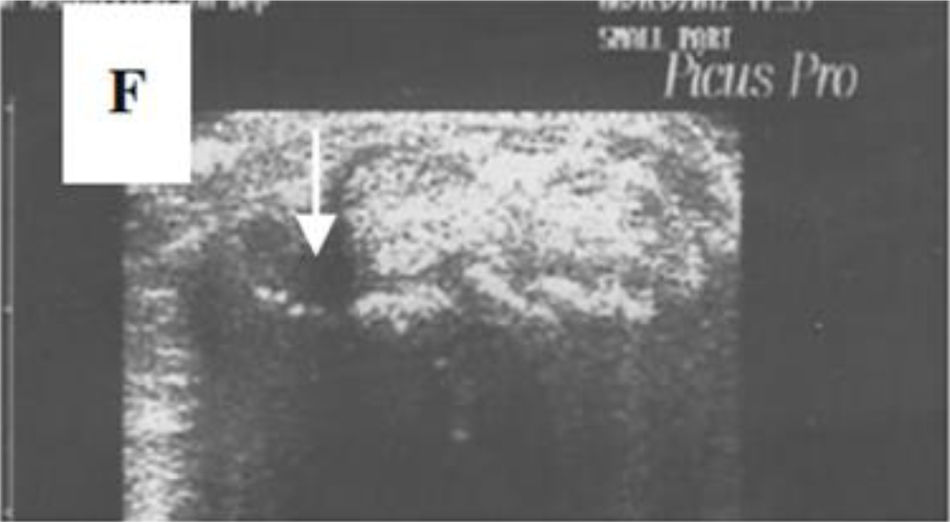
Acroosteólisis del dedo índice en un paciente con SSc. A)Radiografía simple. B)Ecografía.
Adaptado con permiso de Freire et al.73.
La calcinosis, que se ha descrito hasta en el 25% de los pacientes, se observa más frecuentemente en los pacientes mayores y está relacionada con la presencia de osteoporosis y úlceras digitales32,33 (fig. 6). Adicionalmente, las úlceras digitales son un factor independiente de progresión de la calcinosis23. Algunos estudios sugieren un posible papel del daño vascular en la patogénesis de la calcinosis, ya que está asociada con patrones videocapilaroscópicos avanzados y úlceras digitales31.
Calcinosis del dedo índice en un paciente con SSc. A)Radiografía simple. B)Ecografía.
Adaptado con permiso de Freire et al.73.
Las MOA en los pies tienden a aparecer más tarde en el curso de la enfermedad y causan discapacidad severa. En el momento del diagnóstico de la SSc las contracturas articulares, los TFR y el compromiso de acroosteólisis en los pies son mucho menos frecuentes que en las manos; no obstante, las artralgias de los pies pueden ser una queja común34. Más aún, el compromiso de los pies empeora durante el curso de la enfermedad, a diferencia del compromiso de las manos, que tiende a permanecer estable una vez que se ha manifestado34.
Necrosis avascularLa necrosis avascular de la cabeza del fémur ha sido reportada como una MOA poco frecuente, aunque severa, en los pacientes con SSc. En las etapas tempranas de la enfermedad los pacientes pueden estar asintomáticos. Sin embargo, a medida que esta progresa, el síntoma cardinal es el dolor en la ingle, los muslos y las nalgas35. Se han reportado algunos casos raros que involucran los huesos del carpo, y a pesar de todo, la necrosis del hueso semilunar puede ser subestimada y frecuentemente malinterpretada como carpitis (artritis erosiva de la muñeca)36,37.
Densidad mineral ósea en la esclerosis sistémicaLos pacientes con SSc tienen múltiples factores de riesgo conocidos para el desarrollo de osteoporosis, es decir, inflamación crónica, uso de esteroides, inmovilidad y menopausia precoz38. Se ha reportado una baja densidad mineral ósea (DMO) en alrededor del 27 al 62% de los pacientes con SSc38-45, mientras que se ha informado que la osteoporosis varía entre el 10 y el 51% de los pacientes dependiendo de las poblaciones estudiadas41-48 (tabla 3). En los pacientes con SSc la DMO baja se observa con mayor frecuencia en el cuello femoral en comparación con la columna lumbar (0,829 ±0,126mg/cm2 vs. 1,078 ±0,197mg/cm2)41. El cambio en la DMO parece estar influenciado por el índice de masa corporal más bajo reportado en este grupo de pacientes comparado con la población normal41,42,46.
Valores de DMO, puntajes T y puntajes Z de pacientes con SSc
| Columna lumbar (L1-L4) | Cuello femoral | Cadera Total | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| n | Edad promedio (años) (DE) | Sexo femenino (%) | Posmenopáusicas (%) | DMO (g/cm2) (DE) | Puntaje T (DE) | Puntaje Z (DE) | DMO (g/cm2) (DE) | Puntaje T (DE) | Puntaje Z (DE) | DMO (g/cm2) (DE) | Puntaje T (DE) | Puntaje Z (DE) | |
| Rios-Fernández et al.39 | 100 | 56,49 (13,3) | 100 | 76 | − | −1,4 (1,4) | 0,3 (1,5) | − | −1,3 (1,4) | −0,3 (1,2) | − | − | − |
| Caimmi et al.41 | 106 | 58,7 (12,5) | 85 | 63 | 1,078 (0,197) | −0,9 (1,5) | 0,164 (1,36) | 0,829 (0,126) | −1,5 (0,9) | −0,358 (0,831) | 0,892 (0,144) | −1,0 (1,1) | − |
| Frediani et al.42 | 85 | 54,1 (14,1) | 100 | 54 | 0,980 (0,177) | −2,48 | −1,10 | 0,832 (0,125) | −1,69 | −0,55 | − | − | − |
| Kilic et al.43 | 43 | 50,3 (11,4) | 100 | 51 | 0,878 (0,14) | −1,53 (1,27) | −0,65 (1,08) | 0,719 (0,14) | −1,17 (1,23) | −0,63 (1,11) | 0,796 (0,15) | −1,20 (1,22) | −0,65 (1,06) |
| Mok et al.45 | 84 | 49,4 (11,3) | 89 | 60 | 0,893 (0,154) | − | −0,93 (1,21) | 0,674 (0,125) | − | −0,82 (0,96) | 0,787 (0,139) | − | −0,79 (0,99) |
| Souza et al.46 | 43 | 62,2 (7,7) | 100 | 100 | 0,83 (0,12) | − | − | 0,64 (0,11) | − | − | − | − | − |
| Atteritano et al.47 | 54 | 54,43 (1,73) | 100 | 100 | 0,78 (0,08) | −2,2 (0,30) | − | 0,56 (0,04) | −2,6 (0,20) | − | − | − | − |
| Yacoub et al.49 | 60 | 49,44 (13,2) | 100 | 43 | −2,97 (0,25) | − | − | −1,93 (0,32) | − | − | − | − | − |
| Sampaio-Barros et al.50 | 61 | 35,79 (6,77)a/54,21 (6,43)b | 100 | 49 | 1,00 (0,21) | − | − | 0,81 (0,15) | − | − | − | − | − |
| Koumakis et al.51 | 65 | 61,6 (11) | 100 | 89 | 1,00 (0,179) | − | − | 0,784 (0,142) | − | − | 0,844 (0,137) | − | − |
| Ruaro et al.54 | 84 | 65 (9) | 100 | 100 | 0,998 (0,161) | − | − | 0,784 (0,212) | − | − | 0,827 (0,182) | − | − |
| Marot et al.55 | 33 | 63,2 (10,2) | 100 | 85 | 0,918 (0,157) | − | − | 0,694 (0,122) | − | − | 0,796 (0,127) | − | − |
−: No hay datos
En un estudio en la población marroquí realizado por Yacoub et al.49 la población con SSc tuvo una DMO más baja, así como niveles más bajos de vitaminaD en comparación con los controles sanos. Además, hubo una asociación entre la DMO baja y los niveles bajos de vitaminaD con la presencia de compromiso articular severo. Del mismo modo, en dos poblaciones españolas la presencia de SSc y la mayor duración de la enfermedad se asociaron con una DMO más baja comparada con la de un grupo de mujeres sanas. Sin embargo, la deficiencia de vitaminaD no se asoció con una DMO más baja39.
Se encontraron resultados similares en la densidad ósea del cuello femoral en un grupo de 43 pacientes con SSc en comparación con los controles pareados con AR43; sin embargo, en un estudio previo con un mayor número de pacientes no se encontró esta diferencia44. La dosis acumulativa de esteroides no es un factor de riesgo para el desarrollo de osteoporosis o fracturas en la SSc cuando se evalúa con densitometría ósea44,50, aunque los pacientes que reciben dosis de prednisona de 5mg o más por día tienen una microarquitectura ósea alterada cuando se evalúan mediante tomografía51. En un estudio prospectivo de 50 pacientes canadienses con SSc, los que no eran caucásicos tenían una DMO más baja que los caucásicos40. La presencia de calcinosis también parece influir en la aparición de la osteoporosis32; no obstante, este hallazgo no es reproducible en todas las series52. Una DMO baja en los pacientes con SSc no se asocia con la severidad del compromiso de otros órganos45.
La presencia de fracturas por fragilidad no es despreciable. Omair et al.40 reportaron fracturas por fragilidad hasta en el 14% de los pacientes. En un estudio anterior, hasta el 24% de los pacientes tenían una fractura vertebral documentada, con predominio de fracturas de grado1 según la clasificación de Genant47. Avouac et al.44 encontraron que el 35% tenían fracturas por fragilidad en una cohorte de 71 pacientes con SSc, el número de fracturas fue similar al encontrado en pacientes con AR y fue mayor que el reportado en otras cohortes de SSc, probablemente debido a la mayor edad de los pacientes de esta cohorte.
Fauny et al.53 encontraron que, a pesar del mayor riesgo de alteración de la DMO, solo el 43% de los pacientes con SSc son estudiados mediante absorciometría con rayosX de energía dual (DEXA). Además, existen estrategias complementarias aplicadas a la tomografía que permiten determinar el riesgo de fractura en pacientes con SSc, que parecen ser más sensibles que la DEXA en esta población específica53. El Puntaje de hueso trabecular (Trabecular Bone Score [TBS]), una herramienta reciente para evaluar la microarquitectura ósea, se ha utilizado en pacientes con SSc con buenos resultados51,54. Ruaro et al.54 informaron que el TBS es capaz de discriminar a los pacientes con una microestructura ósea alterada que aumenta el riesgo de fractura. Además, el TBS parece estar más alterado en pacientes con patrones videocapilaroscópicos activos o tempranos, lo que sugiere una correlación entre el daño microvascular y el compromiso óseo54. En un estudio previo realizado por Marot et al.55 se encontró un compromiso importante del hueso trabecular que parece estar relacionado con la presencia de úlceras digitales. La caracterización de la microestructura ósea mediante el TBS abre la posibilidad para su uso potencial como una herramienta diagnóstica complementaria para el compromiso óseo secundario al uso de corticosteroides, y por lo tanto el TBS se podría utilizar con la DEXA para detectar la osteoporosis inducida por corticosteroides51.
Marcadores serológicosAnticuerpos antipéptido cíclico citrulinado (anti-CCP)Varios estudios han analizado la relación de los anti-CCP con el desarrollo de manifestaciones articulares en la SSc. Se reporta positividad de anti-CCP entre el 3 y el 14% de los pacientes con SSc según la generación de prueba y el punto de corte utilizados56-59. En la población latinoamericana se ha descrito positividad de anti-CCP hasta en el 12% de los casos de SSc; sin embargo, su asociación con artritis en este grupo demográfico no es completamente clara56. Debido a la alta especificidad de estos anticuerpos para el diagnóstico de la AR, existe controversia respecto a la utilidad de los anti-CCP para diagnosticar la superposición de SSc con AR (SSc-AR). Santiago et al.58 encontraron una asociación significativa entre los títulos positivos de anti-CCP y la aparición de artritis, aunque no hubo una asociación estadísticamente significativa entre la presencia de estos anticuerpos y el diagnóstico de SSc-AR, a diferencia de otros estudios en los que los anti-CCP fueron considerados útiles para identificar a los pacientes con SSc-AR57,60,61. Stamenković et al.59 también reportaron una relación significativa entre los anti-CCP y la artritis clínicamente evidente. De manera similar, un estudio reciente encontró que la presencia de anti-CCP está relacionada con la aparición de erosiones óseas, y cuando se asocia con la presencia de factor reumatoide (FR) positivo tiene relación con el desarrollo de artralgias en los pacientes con SSc62. Un metaanálisis realizado por Laustriat et al.63 reportó que, además de conferir un alto riesgo de artritis erosiva (OR: 22,48; IC95%: 10,71-47,21), la positividad de anti-CCP en los pacientes con SSc aumenta el riesgo de fibrosis pulmonar, así como el de compromiso esofágico y cutáneo difuso.
Otros anticuerposLa presencia de anticuerpos antinucleares y anti-DNA de doble cadena (ANA y anti-dsDNA, respectivamente) en los pacientes con SSc limitada parece estar relacionada con manifestaciones articulares11,64. Los anticuerpos contra SCL-70 (anti-SCL-70) son más altos entre los pacientes con DMO baja39-41. Además, se ha reportado una asociación de los anti-SCL-70 con el desarrollo de contracturas articulares y deformidad en las manos (OR: 7,01; IC95%: 1,02-48,69), aunque no se asocian con la presencia de artralgias o de TFR21,65. Existe algún debate sobre si la presencia de anticuerpos anti-topoisomerasa I se asocia con la presencia de manifestaciones articulares, especialmente de contracturas articulares, ya que algunos de los estudios que han establecido la asociación tienen sesgos de selección66.
Proteína oligomérica de la matriz del cartílagoLa proteína oligomérica de la matriz del cartílago (POMC), una proteína que se encuentra en el cartílago y que se cree que es un regulador importante del mantenimiento de las fibras de colágeno tipoI yII, ha sido estudiada como un posible marcador de artritis en la SSc. Un estudio de 40 pacientes con SSc encontró que los niveles de POMC estaban relacionados con la actividad de la enfermedad, la presencia de artritis y anticuerpos anti-CCP y anti-SCL-7067. Sin embargo, un número significativo de pacientes presentan POMC positiva, por lo que esta no parece ser muy específica para identificar la artritis67.
Acetilhidrolasa del factor activador de plaquetasLos niveles normales de acetilhidrolasa del factor activador de plaquetas (AH-FAP) corresponden a un factor de riesgo de artralgias o artritis (OR: 19,8; IC95%: 2,4-164 y OR: 1,86; IC95%: 1,33-2,59, respectivamente), lo que sugiere que la presencia de AH-FAP elevada tiene un posible papel protector contra el compromiso articular68.
YKL-40 o glicoproteína de cartílago humano 39 (HC gp-39)La YKL-40 fue evaluada en un estudio de 40 pacientes con SSc por La Montagna et al.69, quienes reportaron que los niveles de YKL-40 se encuentran elevados en los pacientes con artralgias o artritis, lo que sugiere que puede ser un posible marcador serológico de compromiso articular en la SSc.
Evaluación radiológicaRadiografía convencionalLa radiografía convencional es una herramienta útil para abordar el compromiso articular en la SSc que se utiliza conjuntamente con el FR y los anticuerpos anti-CCP, especialmente en los casos en que existen dudas sobre una posible superposición con AR27. Los hallazgos se pueden dividir en tres patrones: daño articular degenerativo, cambios fibróticos periarticulares o compromiso articular inflamatorio, aunque esta es una clasificación que no es reproducible en todos los estudios9.
Uno de los hallazgos más frecuentes que se describen en los rayosX simples es la desmineralización yuxtaarticular, reportada hasta en el 42% de los casos de SSc. La disminución del espacio articular y las erosiones articulares pequeñas y discretas son comunes hasta en el 33 y el 31%, respectivamente12,27,33,70,71 (fig. 7). Las deformidades en flexión están presentes en un número considerable de pacientes70. Pueden aparecer calcificaciones extraarticulares hasta en 18% de los casos12,27,30,33 (tabla 4). A diferencia de la AR, el compromiso de la apófisis estiloides es raro y solo se presenta en el 2% de los pacientes12. En el penacho de la falange distal (distal phalangeal tuft [DPT]) el hallazgo descrito con mayor frecuencia corresponde a una resorción del DPT, reportada hasta en el 28% de los casos12,30,70,72. Otros hallazgos reportados son la calcinosis (hasta en el 12%)30, así como proliferación o erosiones del DPT, aunque con menor frecuencia72.
Hallazgos típicos en la mano en una radiografía simple de un paciente con SSc.
Flecha blanca: erosiones yuxtaarticulares con pérdida del espacio articular; asterisco: acroosteólisis, numeral: calcinosis.
Adaptado con permiso de: Avouac et al.1.
Cambios radiográficos en las manos de los pacientes con SSc
| n= | JE (%) | EEA (%) | JS (%) | BD (%) | BR (%) | AO (%) | DUR (%) | JO (%) | CTB (%) | PC (%) | CF (%) | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Wangkaew et al.7 | 110 | 10 (9) | 17 (16) | 18 (16) | 103 (93) | 63 (57) | 63 (57) | 7 (6) | 102 (93) | 8 (7) | 27 (24) | 12 (11) |
| La Montagna et al.9 | 76 | 4 (5) | 41 (53) | 7 (9) | − | − | 22 (29) | 2 (3) | 35 (46) | 12 (16) | 5 (7) | 31 (41) |
| Allali et al.12 | 46 | 14 (31) | 15 (33) | − | 15 (33) | − | 8 (18) | 1 (2) | − | 5 (12) | − | − |
| Baron et al.17 | 38 | 15 (40) | 13 (34) | − | − | − | 14 (37) | 3 (7) | 16 (42) | 19 (50) | − | − |
| Tas et al.27 | 28 | 7 (25) | 5 (18) | − | 12 (49) | − | 7 (25) | − | − | 5 (18) | − | 8 (29) |
| Koutaissoff et al.30 | 167 | 7 (4) | 23 (14) | − | − | − | 33 (20) | − | − | − | 16 (10) | − |
| Avouac et al.33 | 120 | 25 (21) | 35 (29) | − | 28 (33) | 28 (33) | 26 (22) | 2 (2) | − | 28 (23) | − | 32 (27) |
| Basett et al.70 | 55 | 12 (22) | − | − | − | − | 28 (51) | 6 (11) | − | 14 (25) | − | 45 (81) |
| Blocka et al.71 | 55 | 5 (9) | 7 (13) | 4 (7) | − | − | − | − | 2 (4) | 25 (46) | − | 49 (89) |
| Elhai et al.77 | 52 | 6 (11) | − | 10 (19) | 11 (21) | − | 12 (23) | 1 (2) | − | 19 (36) | − | 11 (21) |
−: No hay datos.
AO: acroosteólisis; BD: desmineralización ósea (bone demineralization); BR: reabsorción ósea (bone resorption); CF: contractura en flexión; CTB: calcificación de tejidos blandos; DUR: reabsorción cubital distal (distal ulnar resorption); EEA: estrechamiento del espacio articular; JE: erosión articular (joint erosion); JO: osteopenia yuxtaarticular (justa-articular osteopenia); JS: subluxación articular (joint subluxation); PC: calcificación paraarticular.
Cuando se evalúan las radiografías de los pies hay una menor frecuencia de acroosteólisis, erosiones y calcinosis en comparación con las manos. Sin embargo, no hay diferencias significativas en la desmineralización, la disminución del espacio articular o las subluxaciones articulares34.
UltrasonografíaDebido a la baja sensibilidad de la radiografía convencional para detectar los hallazgos tempranos de compromiso articular, se ha evaluado el papel de la ultrasonografía (US) en este escenario (tabla 5). Freire et al.73 evaluaron los hallazgos US a nivel articular en pacientes con diagnóstico reciente de SSc. Se encontró sinovitis en el 39% de los pacientes, en su mayoría leve. Además, el 27% de los pacientes presentaron tenosinovitis con mayor afectación en las vainas de los tendones extensores que en las de los flexores73 (fig. 8). El US puede identificar la artritis y la tenosinovitis durante el seguimiento de la enfermedad en los pacientes con SSc con artralgias sin cambios inflamatorios evidentes, aunque no es igualmente útil para identificar las erosiones74-76. La tenosinovitis esclerosante y las calcificaciones de los tejidos blandos son hallazgos específicos de la SSc que permiten la diferenciación de otras patologías, tales como AR77. Del mismo modo, la US tiene una sensibilidad aceptable para detectar la calcinosis y la acroosteólisis, con un valor del 89 y del 90%, respectivamente73, y puede detectar la presencia de entesopatía en los pacientes con SSc78.
Cambios en la US en las articulaciones de pacientes con SSc
| n | S (%) | TS (%) | CA (%) | AO (%) | BE (%) | HS (%) | EEA (%) | PD (%) | |
|---|---|---|---|---|---|---|---|---|---|
| Freire et al.73 | 44 | 17 (39) | 12 (27) | 17 (39) | 9 (20) | − | − | − | − |
| Chitale et al.74 | 17 | 3 (23) | 8 (47) | − | − | − | − | − | − |
| Abdel-Magied et al.75 | 16 | 4 (25) | 8 (50) | − | − | 1 (6) | − | − | − |
| Cuomo et al.76 | 45 | 22 (49) | − | 15 (33) | − | 5 (11) | 19 (42) | 10 (22) | 11 (24) |
| Elhai et al.77 | 52 | 24 (46) | 14 (27) | 21 (40) | − | − | − | − | − |
| Iagnocco et al.79 | 46 | 25 (54) | 72 (6)a | − | − | − | 21 (46) | − | 18 (43) |
| Lescoat et al.80 | 103 | 18 (18) | 20 (19) | − | − | − | − | − | − |
Proyección ultrasonográfica transversal del tendón extensor común a nivel de la muñeca mostrando en escala de grises tenosinovitis en forma de derrame (flecha).
Adaptado con permiso de Abdel-Magied et al.75.
Iagnocco et al.79 evaluaron la prevalencia de hallazgos anormales en US combinada con Power Doppler en las articulaciones del carpo y de la mano de los pacientes con SSc. Al igual que en los estudios publicados anteriormente, se reportó una alta prevalencia de hallazgos anormales en comparación con la población sana. Los hallazgos más frecuentes descritos fueron: hipertrofia sinovial, derrame articular y tenosinovitis. Además, el uso del US Power Doppler mejora la capacidad de reconocer los signos inflamatorios locales, a menudo en ausencia de sinovitis clínicamente evidente79. Lescoat et al.80 confirmaron estos resultados en un estudio reciente reportando sinovitis inflamatoria en el 17,5% de los pacientes y tenosinovitis esclerosante hasta en el 18,5%. Estos hallazgos se asociaron con elevación de la PCR, sinovitis clínicamente evidente y pericarditis. A su vez, la tenosinovitis esclerosante se observó con mayor frecuencia en los hombres y se asoció con compromiso pulmonar, anticuerpos contra la RNA polimerasaIII y SSc de tipo difuso80.
Imágenes por resonancia magnéticaEl interés en la utilidad de la resonancia magnética (RM) para detectar el compromiso articular en pacientes con SSc ha aumentado en los años recientes. Se describe predominantemente la sinovitis con erosiones leves y derrame articular asociado con la presencia de edema de médula ósea (tabla 6)81,82. La RM articular es más sensible que el ultrasonido para identificar el compromiso articular en pacientes con artralgias sin sinovitis clínicamente evidente74,75. A diferencia de la US y la radiografía, la RM es capaz de identificar los cambios tempranos, especialmente a nivel del carpo con compromiso predominante del hueso semilunar, que parece ser una característica distintiva de la enfermedad81.
Cambios en la RM en las manos de los pacientes con SSc
| n | S (%) | EMO (%) | BE (%) | TS (%) | JE (%) | |
|---|---|---|---|---|---|---|
| Chitale et al.74 | 8 | 8 (100) | 5 (63) | 6 (75) | − | − |
| Abdel-Magied et al.75 | 16 | 14 (88) | 12 (75) | 10 (62) | 13 (81) | − |
| Akbayrak et al.81 | 26 | 18 (68) | 10 (37) | 23 (87) | 6 (24) | 15 (58) |
| Low et al.82 | 17 | 8 (47) | 9 (53) | 7 (41) | 8 (47) | 7 (41) |
−: No hay datos.
BE: erosiones óseas (bone erosions); EMO: edema de la médula ósea; JE: derrame articular (bone effusion); S: sinovitis; TS: tenosinovitis.
La RM tiene un alto rendimiento para identificar la tenosinovitis que compromete las manos en los pacientes con artritis83, al igual que los cambios en los pacientes con SSc, en quienes la sinovitis se describe hasta en el 88% de los que presentan artralgias74,75. Del mismo modo, en los pacientes con evidencia de TFR, la RM identifica la tenosinovitis hasta en un 50% de los casos84.
Clinimetría y su impacto en la funcionalidad general y la calidad de vidaLa calidad de vida de los pacientes con SSc se ve afectada en diferentes niveles85, en gran parte debido a la afectación de la piel86 y al compromiso osteoarticular que dificulta el desarrollo de las actividades diarias en un grado de moderado a severo10,87-89. Además, el estrés psicológico y la percepción de discapacidad afectan negativamente la calidad de vida en estos pacientes90. Hay múltiples factores que se asocian con la pérdida de función de la mano, especialmente la presencia de contracturas articulares, úlceras digitales y fenómeno de Raynaud severo91.
El índice de discapacidad (DI) del Cuestionario de evaluación de la salud (Health Assessment Questionnaire [HAQ]), el Puntaje del componente físico (PCS) y el Puntaje del componente mental (MCS) de la Forma corta 36 (SF-36) han sido validados en la SSc92. Wiese et al22. documentaron que existe una correlación entre el HAQ DI y el SF36 PCS (r?=?−0,79), así como entre el HAQ DI y las mediciones globales de salud determinadas por los médicos y los pacientes con SSc difusa temprana (r=0,43 y r=0,57, respectivamente). Estas mediciones tuvieron una importante asociación con el puntaje de Rodnan modificado, aunque no tuvieron la misma asociación con manifestaciones musculoesqueléticas o MOA22. Adicionalmente, utilizando los mismos instrumentos, la discapacidad generada por el compromiso articular es mayor que la que se presenta en los pacientes con artritis psoriásica, con un dolor más intenso que en los pacientes con AR93. En un estudio posterior de 326 pacientes con SSc difusa temprana se encontró que la pérdida de función de la mano, determinada mediante la Escala de funcionalidad de la mano de Cochin (Cochin Hand Function Scale [CHFS]), también contribuye significativamente a la discapacidad generada por la SSc94.
Kwakkenbos et al.89 validaron en una cohorte de 696 pacientes el PROMIS-29v2, una herramienta que evalúa siete dominios relacionados con la calidad de vida además de la intensidad del dolor en los pacientes con SSc. Ellos encontraron que la SSc tiene un impacto negativo en la calidad de vida debido en gran parte a contracturas articulares y a síntomas gastrointestinales89.
La prueba de movilidad de la mano en SSc (Hand Mobility Test In SSc [HAMIS]) fue evaluada en un estudio longitudinal de 43 pacientes con SSc con una duración de la enfermedad de menos de 3años95. Se hizo un seguimiento durante por lo menos 4años, que reportó que aunque varió en el 72% de los pacientes, no se presentaron cambios significativos en la movilidad de la mano durante los primeros años de la enfermedad95. A su vez, en los pacientes con una duración más prologada de la enfermedad hay una limitación importante para realizar movimientos que involucren agarre o torsión96. La prueba del delta dedo a palma (delta finger-to-palm test) también ha sido validada para evaluar la movilidad de las manos en los pacientes con SSc97, así como el Michigan Hand Questionnaire (MHQ)98. Del mismo modo, el índice anatómico de la mano (Hand Anatomic Index [HAI]) corresponde a una herramienta útil para evaluar en forma objetiva la deformidad de la mano y el deterioro funcional secundario en los pacientes con SSc99.
Erol et al.100 utilizaron el Cuestionario sobre calidad de vida relacionada con la salud (Health-Related Quality of Life [HRQoL]) con el Índice de la mano de Duruöz (Duruöz Hand Index [DHI]) para evaluar la función de la mano en 44 pacientes con SSc en comparación con pacientes con AR. Ellos describieron que la pérdida de función de la mano en la SSc no solo es similar a la que se presenta en la AR, aunque los cambios articulares en ambas enfermedades son diferentes, sino que tiene una influencia importante en la calidad de vida de estos pacientes100. Un estudio anterior que utilizó la prueba HAMIS y la Escala de Cochin (Cochin Scale [CS]) reportó hallazgos similares101.
Además, Lóránd et al.102 validaron la utilidad del Puntaje de actividad de la enfermedad 28 (Disease Activity Score28 [DAS-28]) utilizando el PCR y el ESR, así como el Índice de actividad de la enfermedad simplificado (Simplified Disease Activity Index [SDAI]) y el Índice clínico de actividad de la enfermedad (Clinical Disease Activity Index [CDAI]), para evaluar el compromiso articular en la SSc. Ellos reportaron que aunque los cuatro instrumentos son válidos para determinar la severidad de la afectación articular en los pacientes con SSc, el DAS-28-ESR mostró el mejor desempeño en cuanto a confiabilidad y validez de constructo102.
Los niveles de fatiga reportados en los pacientes con SSc, medidos por medio del Índice general de fatiga (IGF), son similares a los reportados por pacientes con neoplasias, AR o lupus eritematoso sistémico (LES)103. Además, la fatiga tiene un impacto negativo en muchos niveles diferentes en los pacientes con enfermedades autoinmunes, incluyendo la SSc104. La fibromialgia, una enfermedad que frecuentemente se asocia con altas tasas de fatiga, es muy común en los pacientes con SSc y se presenta entre el 57 y el 72%105.
TratamientoExisten pocos estudios sobre el tratamiento específico de las MOA en la SSc. Los tratamientos de primera línea para el manejo de la sinovitis son adaptados de los esquemas de manejo de la AR. Un estudio retrospectivo pequeño con pacientes de la base de datos EUSTAR sugiere un efecto beneficioso de la hidroxicloroquina en el manejo del compromiso articular inflamatorio en la SSc106. Los pacientes que desarrollan contracturas en los primeros años de la enfermedad podrían beneficiarse del uso de ciclofosfamida, metotrexato o leflunomida20. La inmunoglobulina, utilizada en un esquema de tratamiento durante 6meses, podría ser efectiva para reducir los síntomas articulares y el impacto secundario en la calidad de vida en los pacientes con SSc con compromiso articular severo refractario a los tratamientos de primera línea107.
El posible papel de los anti-TNF-α en el manejo de la SSc ha aumentado el interés de diferentes grupos en todo el mundo. Existen reportes de estudios que le asignan un posible papel a este grupo de tratamientos en el manejo de la artritis en la población con SSc108. En un estudio realizado por EUSTAR en el 2011 en centros especializados en el manejo de la SSc se evidenció que la mayoría de los expertos de esta sociedad recomendaron el uso de moléculas anti TNF-α solamente en ensayos clínicos aleatorizados, ya que no se conocen sus posibles efectos adversos sobre la enfermedad109. Sin embargo, debido a la dificultad para realizar un ensayo clínico aleatorizado con medicamentos biológicos, solo se han publicado estudios observacionales en este campo.
Elhai et al.110 evaluaron en un estudio observacional el efecto del tocilizumab, un anticuerpo humanizado contra el receptor de la IL-6, y del abatacept, una proteína recombinante de fusión que modula la coestimulación de las célulasT mediada por CTLA4, en el manejo de la miopatía o la poliartritis refractaria asociada con la SSc. Se utilizaron el DAS-28 para evaluar la respuesta al tratamiento y el HAQ-DI para evaluar su impacto en la calidad de vida, sugiriendo que ambos medicamentos pueden mejorar la poliartritis secundaria a la SSc110. Actualmente está en curso un estudio en fase3 para evaluar la respuesta al rituximab en comparación con placebo en los pacientes con SSc con MOA que no responden a los tratamientos de primera línea111.
En los pacientes con SSc con manos dolorosas de origen multicausal, incluyendo el compromiso osteoarticular, la hidrodisección del túnel carpiano con lidocaína guiada por US, asociada a la inyección local de corticoides, reduce los puntajes de dolor hasta en un 67%, con una duración sostenida hasta de 6meses112.
El manejo ortésico para las contracturas articulares puede ser ineficaz en las etapas tardías de la enfermedad, no solo porque exacerba síntomas tales como el fenómeno de Raynaud, sino porque no produce un alivio significativo en las deformidades generadas por contracturas113. Por el contrario, se puede considerar el manejo quirúrgico para reducir el dolor en los pacientes con enfermedad avanzada refractaria a otros tratamientos114. Se han practicado procedimientos como: simpatectomía, resección de calcinosis, artroplastias o capsulotomías, pero los beneficios reales son pocos, por lo que han caído en desuso115,116.
En conclusión, las MOA son frecuentes en la SSc. También tienen un impacto importante en la calidad de vida del paciente, especialmente debido a la limitación de la funcionalidad de la mano. El tratamiento es difícil y requiere un enfoque multidisciplinario. Debido a lo anterior, las MOA en la SSc requieren una identificación y una intervención tempranas. Además, se requiere más investigación, que incluya ensayos clínicos aleatorizados de buena calidad, para establecer la mejor estrategia de tratamiento para estos pacientes.
Conflicto de interesesNinguno.