La crisis renal es una condición que afecta aproximadamente a 4-6% de los pacientes con esclerosis sistémica, especialmente con compromiso difuso. Las manifestaciones clínicas son variables, representando un reto diagnóstico en la práctica clínica.
ObjetivoEl objetivo del estudio fue describir y analizar los diferentes tratamientos farmacológicos disponibles para el manejo de la crisis renal en esclerosis sistémica.
Materiales y métodosUna revisión sistemática de la literatura fue desarrollada con base en estudios observacionales y ensayos clínicos sobre el tratamiento de la crisis renal, utilizando monoterapia o terapias combinadas. Los estudios fueron identificados utilizando bases de datos científicas que incluyeron MEDLINE PUBMED y EMBASE, que estuvieran en inglés y publicados entre enero de 1990 y agosto de 2019.
ResultadosOnce estudios fueron incluidos (10 estudios observacionales y un ensayo clínico abierto). De estos, siete fueron cohortes, una serie de casos y dos estudios de casos y controles. En total, 1113 pacientes fueron incluidos en los estudios analizados. Todos los estudios utilizaron inhibidores de enzima convertidora de angiotensina como exposición, definición de caso y/o comparador en ensayo clínico. Sobre la necesidad de diálisis, aproximadamente 53,9% de los pacientes la requirieron de forma temporal o permanente. Aproximadamente 6-27% de pacientes requirieron diálisis temporal y 19-78% requirieron diálisis permanente. El rango de sobrevida al año fue de 64-84%; a dos años 53-74%; a cinco años 40-90%, y a diez años 35-47%.
ConclusionesLos inhibidores de enzima convertidora de angiotensina continúan siendo la primera línea de tratamiento de crisis renal en esclerosis sistémica, al contribuir en la reducción de la mortalidad a corto plazo. Sin embargo, opciones terapéuticas alternativas son requeridas, al continuar muy elevado el porcentaje de requerimiento de diálisis. Ensayos clínicos futuros son necesarios para evaluar la eficacia y seguridad de diferentes opciones terapéuticas.
Scleroderma renal crisis is a condition that affects approximately 4–6% of patients with systemic sclerosis, especially with diffuse compromise. Clinical manifestations are variable, representing a diagnostic challenge.
ObjectiveThe study aims to describe and analyze the different pharmacological treatments available for the management of scleroderma renal crisis.
Materials and methodsA systematic literature review was done based on observational studies and clinical trials about the treatment of scleroderma renal crisis, using monotherapy or combined therapy. The studies were identified using electronic scientific databases, including MEDLINE PUBMED and EMBASE, in English, published between January 1990 and August 2019.
ResultsEleven studies were included (ten observational studies and one open clinical trial). Of them, seven were cohorts, one case series, and two case–control studies. Overall, 1113 patients were included in the analyzed studies. All studies used angiotensin-converting enzyme inhibitors as exposition, case definition, and/or comparison in the clinical trial. Regarding the need for dialysis, approximately 53.9% of patients required it temporarily or permanently. Approximately 6–27% of patients required temporal dialysis, and 19–78% required permanent dialysis. One-year survival range was between 64 and 84%; two-year survival was between 53 and 74%; five-year survival between 40 and 90%, and finally ten–year survival between 35 and 47%.
ConclusionsAngiotensin-converting enzyme inhibitors continue to be the first line of treatment for scleroderma renal crisis by contributing to a decrease in short-term mortality. However, alternative therapeutic options are required as a high percentage of patients still require dialysis. Future clinical trials are necessary to assess the effectiveness and safety of different therapeutic options.
La esclerosis sistémica es una enfermedad autoinmune multisistémica crónica que se caracteriza por depósitos excesivos de colágeno, hiperreactividad vascular y fenómenos microvasculares obstructivos1. Esta afección se clasifica según la tasa de progresión, el compromiso cutáneo y visceral, en enfermedad limitada o difusa. Tres procesos principales caracterizan la fisiopatología de la enfermedad: (1) disfunción de los fibroblastos que aumenta los depósitos de matriz extracelular, (2) producción de autoanticuerpos y (3) vasculopatía2.
Las manifestaciones de lesión vascular incluyen el fenómeno de Raynaud, isquemia digital, hipertensión arterial pulmonar y crisis renal. Esta última se desarrolla principalmente en los pacientes con esclerosis sistémica difusa (compromiso cutáneo proximal)1.
La crisis renal esclerodérmica es la manifestación primaria de compromiso renal en los pacientes con esclerosis sistémica, y se considera una emergencia médica. Se desarrolla en aproximadamente el 4,2% de los pacientes con enfermedad difusa, y en el 1,1% de los pacientes con enfermedad limitada; la mayoría de los casos se presentan durante las fases tempranas (los primeros años) de la enfermedad3,4.
No hay una definición estándar aceptada para la crisis renal esclerodérmica5. Esta se caracteriza por la aparición reciente de hipertensión arterial rápidamente progresiva (definida como: presión arterial sistólica por encima de 140 mmHg y presión arterial diastólica por encima de 90 mmHg, o aumento de la presión sistólica de por lo menos 30 mmHg, o un aumento de la presión diastólica de por lo menos 20 mmHg, o el desarrollo de encefalopatía hipertensiva) y/o falla renal aguda (definida como un aumento de más del 50% respecto al valor basal de la creatinina sérica o del 120% por encima del límite superior del rango normal, o proteinuria ≥ 2 + en el análisis de orina confirmado mediante el cociente proteína/creatinina por encima del valor normal, o hematuria ≥ 2 + o 10 hematíes por campo), sin otra causa que la explique, y/o hemólisis microangiopática (plaquetas < 100.000/mm3, esquistocitos, aumento del recuento de reticulocitos)3,5,6.
La fisiopatología de la crisis renal esclerodérmica sigue siendo poco clara. Se cree que se inicia en una íntima vascular renal que presenta células endoteliales lesionadas, produciendo un engrosamiento de la íntima y proliferación de las arterias arciformes e interlobulares, que causa una reducción del lumen vascular y del flujo sanguíneo renal. También puede haber vasoconstricción local, similar al fenómeno de Raynaud («fenómeno de Raynaud renal»), que contribuye a la reducción de la perfusión renal. El flujo sanguíneo renal reducido produce hiperplasia del aparato yuxtaglomerular y un aumento de la producción de renina, activando la vía renina-angiotensina-aldosterona. Como estos cambios vasculares renales y la hiperreninemia están presentes en los pacientes con esclerosis sistémica, y no todos ellos sufren una crisis renal, otros factores podrían estar involucrados en el desarrollo de una crisis renal. La endotelina-1 es un potente vasoconstrictor y mediador de fibrosis que está involucrado en las manifestaciones vasculares de la esclerosis sistémica, y se han documentado niveles elevados en los pacientes con crisis renal esclerodérmica y en aquellos con hipertensión arterial pulmonar. Se ha documentado una mayor expresión de los receptores A y B de entotelina-1 presentes en los riñones de los pacientes con crisis renal. El uso de cocaína, ciclosporina y glucocorticoides (prednisona ≥15 mg/día durante más de tres meses) podría precipitar el desarrollo de la crisis renal1,3,7.
Aproximadamente el 90% de los pacientes tienen hipertensión arterial (presión arterial > 150/90 mmHg), con manifestaciones clínicas dadas por hipertensión maligna con encefalopatía hipertensiva, que se caracteriza por un inicio agudo o subagudo, acompañada de letargo, fatiga, confusión, cefalea, alteraciones visuales y convulsiones (focales o generalizadas). Del 11 al 14% de los pacientes con crisis renal no desarrollan hipertensión. Los pacientes con crisis renal con presión normal, por lo general han recibido tratamiento con glucocorticoides, las dos terceras partes presentan microangiopatía trombótica y su pronóstico es peor que el de los pacientes con crisis renal hipertensiva1,3,7.
Antes de la introducción de los inhibidores de la enzima convertidora de angiotensina (IECA), el pronóstico de los pacientes con crisis renal esclerodérmica era ominoso y constituía la primera causa de muerte entre los pacientes con esclerosis sistémica. La introducción de los IECA en 1979 mejoró la evolución de los pacientes con crisis renal esclerodérmica, mediante la reducción de la mortalidad del 76 al 15%8. Sin embargo, a pesar de que el tratamiento con IECA mejora los desenlaces de los pacientes con crisis renal, el pronóstico de los pacientes que presentan esta complicación sigue siendo reservado, apuntando a la necesidad de nuevos agentes terapéuticos, además de los IECA.
En la actualidad, no hay una evidencia científica sustancial que demuestre el uso de otros agentes terapéuticos; sin embargo, se ha documentado el uso de antagonistas de los receptores de endotelina y de otras moléculas como posibles alternativas.
Este estudio tuvo como objetivo desarrollar una revisión sistemática de la literatura sobre las diferentes opciones de tratamiento farmacológico disponibles para los pacientes con crisis renal esclerodérmica.
MétodosCriterios de inclusión- ∘
Idioma: inglés.
- ∘
Fechas de publicación: desde enero de 1990 hasta agosto de 2019.
- ∘
Tipos de estudios: observacional, descriptivo, ensayos clínicos y revisiones sistemáticas.
- ∘
Búsqueda: tratamiento farmacológico de la crisis renal esclerodérmica como monoterapia o terapia combinada en cualquier forma de administración. Los agentes farmacológicos incluidos fueron:
- •
Inhibidores de la enzima convertidora de angiotensina (IECA).
- •
Bloqueadores de los canales de calcio (BCC).
- •
Antagonistas de los receptores de angiotensina II (ARA).
- •
Antagonistas de los receptores de la endotelina.
- •
Inhibidores de la renina.
- •
Análogos de la prostaciclina.
- •
Minoxidil.
- •
Labetalol.
- •
Tipos de estudios: reportes de casos.
El estudio fue diseñado con base en las guías de elementos de reporte preferidos para revisiones sistemáticas y metaanálisis PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-analyses)9. La búsqueda se hizo en las siguientes bases de datos electrónicas científicas: MEDLINE PUBMED y EMBASE, utilizando como términos de búsqueda las siguientes palabras clave: («scleroderma renal crisis» OR «acute renal failure») y términos MeSH que incluyen «scleroderma, systemic», «angiotensin-converting enzyme inhibitors», «angiotensin receptor antagonists», «calcium channel blockers», «endothelin receptor antagonists» y algunos agentes específicos como «prostacyclin analogues» (incluyendo «epoprostenol», «treprostinil», «iloprost», «beraprost»), «labetalol», «minoxidil» y «aliskiren». Los resultados se filtraron basándose en los criterios de inclusión y exclusión antes mencionados, incluyendo las fechas de publicación (enero/1990 a agosto/2019), el diseño del estudio (se excluyeron los estudios descriptivos, tales como los reportes de casos) y el idioma de publicación (inglés). Una vez realizada la búsqueda de literatura, se hizo una búsqueda manual mediante la comprobación de las referencias bibliográficas de los artículos de revisión sobre la crisis renal esclerodérmica.
Proceso de recolección de datosDos investigadores (AZ y JF) hicieron el tamizaje de los estudios en forma separada. Cada uno hizo el proceso de selección aplicando los criterios de inclusión. Una vez concluido este proceso, se compararon los resultados de cada investigador para identificar las similitudes y las diferencias. En caso de encontrar disparidades, en cuanto a la inclusión de un estudio, se llevó a cabo un consenso entre los investigadores. Si no se llegó a un acuerdo, un tercer investigador con amplia experiencia en epidemiología y métodos de investigación (GQ), resolvió el asunto.
Se recopiló la siguiente información de los estudios seleccionados: información acerca de las características de cada estudio (año de publicación, autores, diseño del estudio), la cantidad de pacientes con crisis renal esclerodérmica, la exposición y/o intervención y los desenlaces primarios (número de pacientes que requirieron diálisis temporal y permanente y tasa de supervivencia).
Calidad y riesgo de sesgoTodos los estudios incluidos fueron evaluados con el fin de identificar la calidad metodológica y el riesgo de sesgo. La calidad de los estudios se evaluó de acuerdo con el diseño de cada referencia. Para los ensayos clínicos, la evaluación se llevó a cabo siguiendo las recomendaciones del Manual Cochrane de Revisiones Sistemáticas de Intervenciones10. Para los estudios de cohortes y de casos y controles, se aplicó la lista de verificación de la Red de Guías Intercolegiadas Escocesas (SIGN, Scottish Intercollegiate Guidelines Network)11. Finalmente, para los estudios de series de casos, se utilizó una herramienta de valoración crítica desarrollada por el Instituto Joanna Briggs de la Universidad de Adelaida12.
MetaanálisisCon base en los resultados cuantitativos disponibles y en la homogeneidad de los desenlaces de los estudios incluidos en esta revisión sistemática, se evaluó la posibilidad de desarrollar un metaanálisis. Sin embargo, debido a la diversidad de los desenlaces informados y a la cantidad limitada de evidencia disponible, no fue posible realizar este tipo de tratamiento estadístico de los datos.
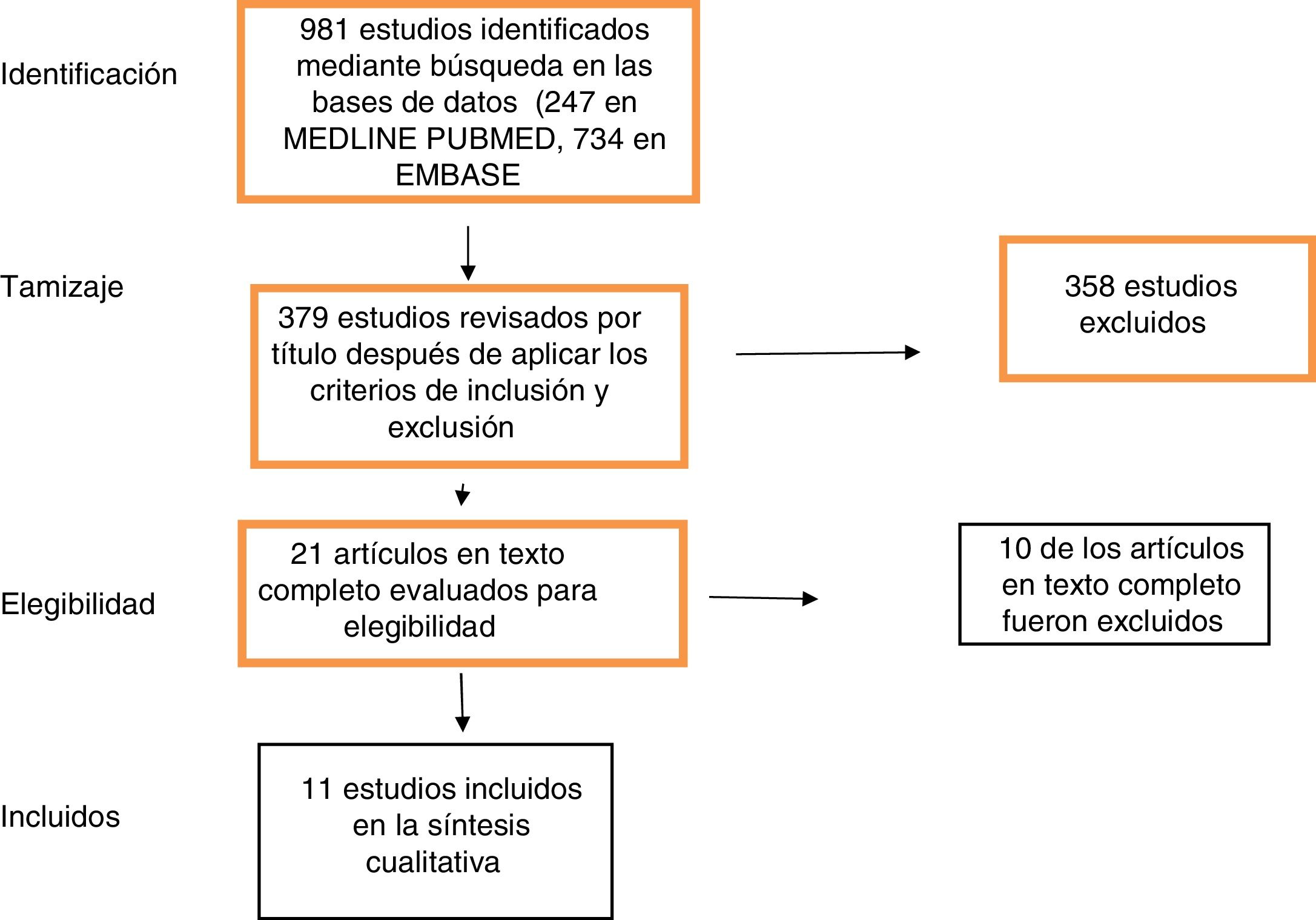
ResultadosLa búsqueda identificó 247 estudios en MEDLINE PUBMED y 734 en EMBASE. Se aplicaron filtros basados en los criterios de inclusión y exclusión descritos anteriormente, obteniendo 379 estudios. Después de evaluar las referencias por título y resumen, se seleccionaron 21 estudios para la evaluación del texto completo. Finalmente, se incluyeron 11 estudios en la revisión (fig. 1). Las características de los estudios incluidos se describen en la tabla 1.
Características de los estudios incluidos en la revisión
| Autor | Año de publicación | Diseño del estudio | Número de pacientes | Exposición/intervención | Resultados |
|---|---|---|---|---|---|
| Guillevin et al.13 | 2012 | Estudio observacional retrospectivo multicéntrico de casos y controles. | 518 pacientes: 91 casos y 427 controles | IECA y/o ARA | 53,8% de los pacientes requirieron diálisis, 11 (22%) pacientes con diálisis temporal y 38 (78%) con diálisis permanente o fallecieron. Las tasas de supervivencia de los pacientes con crisis renal esclerodérmica a uno, dos, cinco y 10 años fueron 70,9%, 66,6%, 60%, y 41,9%, respectivamente. |
| Steen y Medsger14 | 2000 | Observacional, de cohortes prospectivo. | 145 pacientes | IECA | 64% de los pacientes requirieron diálisis, 34 pacientes (23%) con diálisis temporal y 28 pacientes (19%) con diálisis permanente. La tasa de supervivencia a cinco años de los pacientes con crisis renal esclerodérmica fue del 90%. |
| Penn et al.15 | 2007 | Observacional, serie de casos retrospectivo. | 110 pacientes | IECA | 64% de los pacientes requirieron diálisis, 24 pacientes (23%) con diálisis temporal y 44 pacientes (42%) con diálisis permanente. La tasa de supervivencia a un año fue del 82%, la supervivencia a dos años fue del 74%, la supervivencia a los tres años fue de 59% y la supervivencia a los 10 años fue del 47%. |
| Teixeira et al.16 | 2008 | Observacional, de cohortes retrospectivo con análisis multivariado y análisis de supervivencia (regresión de Cox, cociente de riesgo). | 50 pacientes | IECA, BCC, beta-bloqueadores, beta bloqueadores alfa y beta, Urapidil, Iloprost y plasmaféresis. | 56% de los pacientes requirieron diálisis, ocho pacientes (16%) con diálisis temporal y 11 pacientes (22%) con diálisis permanente. La tasa de supervivencia a un año fue del 78% (IC 95% 66–90) y la tasa de supervivencia a cinco años fue del 69% (IC 95% 55–83). |
| Steen et al.17 | 1990 | Observacional, de cohortes prospectivo. | 108 pacientes | IECA | Grupo de IECA: el 32% de los pacientes con requerimiento de diálisis temporal o permanente. La tasa de supervivencia a un año fue del 76% y la tasa de supervivencia a los cinco años fue del 65%. Grupo sin IECA: 9/49 (18%) de los pacientes con requerimiento de diálisis permanente. La tasa de supervivencia a un año fue del 15% y la tasa de supervivencia a cinco años fue del 10%. |
| Hudson et al.5 | 2014 | Observacional, multicéntrico de cohortes prospectivo | 75 pacientes | IECA antes del desenlace | 27 pacientes (36%) fallecieron durante el primer año, y 19 pacientes (25%) sobrevivieron, pero continuaron con diálisis al finalizar el primer año. |
| Cozzi et al.18 | 2012 | Observacional, de cohortes retrospectivo. | 20 pacientes | IECA y plasmaféresis | 11 pacientes (55%) desarrollaron insuficiencia renal terminal al finalizar el primer año. En el segundo año, otros dos pacientes requirieron diálisis (65%), 10 pacientes fueron tratados con plasmaféresis además del IECA. La tasa de supervivencia a los cinco años fue del 50%. |
| Walker et al.19 | 2003 | Observacional, de cohortes retrospectivo. | 16 pacientes | IECA | 31% de los pacientes requirieron diálisis, un paciente (6%) con diálisis temporal y cuatro pacientes (25%) con diálisis permanente. La tasa de supervivencia a los cinco años para los pacientes con crisis renal esclerodérmica fue del 90%. |
| Codullo et al.20 | 2009 | Observacional, retrospectivo multicéntrico de cohortes. | 46 pacientes | IECA | 26 pacientes (62%) requirieron diálisis, 27% pacientes con diálisis temporal y 50% con diálisis permanente. Las tasas de supervivencia a uno, dos, cinco y 10 años para los pacientes con crisis renal esclerodérmica fueron 64%, 53%, 40% y 35%, respectivamente. |
| Wangkaew et al.21 | 2017 | Estudio observacional retrospectivo de casos y controles. | 19 pacientes | IECA | 15 pacientes (78,9%) requirieron diálisis, seis pacientes (40%) requirieron diálisis permanente; 10 pacientes (52,6%) fallecieron. |
| Penn et al.22 | 2013 | Ensayo clínico piloto abierto no aleatorizado. | 6 pacientes | Bosentán (todos tratados con IECA) | Tres a seis pacientes (50%) requirieron diálisis, dos de cinco pacientes continuaron con diálisis después de 12 meses. Hubo un fallecimiento (16%) después de un año en el grupo del Bosentán. |
Las principales razones para la exclusión de los estudios fueron: no mencionar el agente farmacológico utilizado para el tratamiento de la crisis renal esclerodérmica, o no reportar como desenlaces el requerimiento de diálisis temporal o permanente, o no reportar la tasa de supervivencia, o informes preliminares con el estudio final ya publicado.
Se incluyeron en total 1.113 pacientes, el estudio realizado por Guillevin et al. contribuyó con la mayor parte de los pacientes (518 pacientes). Los datos muestran que 824 pacientes eran mujeres (74,03%), lo cual es consistente con la distribución por género reportada para la esclerosis sistémica. La edad promedio en el momento del diagnóstico de la crisis renal esclerodérmica fue de 52,4 años13, y el estudio de Walker et al. reportó las edades más extremas19. Más de la mitad de los pacientes con crisis renal esclerodérmica tenían esclerosis sistémica difusa, aproximadamente el 56% (faltaron los datos del estudio realizado por Steen et al. en 1990, respecto a la proporción de pacientes con la forma difusa de la enfermedad)17.
Después de desarrollar la búsqueda y analizar la información de 11 estudios, se pudo concluir que la mayoría de los estudios disponibles son observacionales, descriptivos de casos y controles, o de cohortes. Solo un estudio tuvo un diseño metodológico diferente, ya que se realizó un estudio piloto que comparó la efectividad del bosentán en el manejo de pacientes con crisis renal esclerodérmica. Todos los estudios analizados utilizaron IECA como exposición, definición de caso y/o comparación en un ensayo clínico. Los desenlaces primarios evaluados en los estudios fueron el requerimiento de iniciar diálisis como tratamiento temporal o permanente, y la supervivencia a uno, 2, 5 o 10 años.
En un estudio retrospectivo multicéntrico de casos y controles publicado por Guillevin et al., cuyo objetivo fue describir las características, los tratamientos, el pronóstico y los desenlaces de los pacientes con crisis renal esclerodérmica, ellos encontraron que la crisis renal fue más frecuente en las mujeres, por lo general durante los primeros tres años posteriores al diagnóstico de la esclerosis sistémica, y que fue más frecuente en los pacientes con esclerosis sistémica difusa que en aquellos con enfermedades limitadas (78 pacientes [85,7%] vs. 145 pacientes [34%]; p > 0,001). En cuanto al tratamiento, 83 de 91 casos (91,2%) fueron tratados con IECA, y 18 casos (19,8%) recibieron ARA; 23 pacientes recibieron un IECA antes del inicio de la crisis renal; 9 de 23 pacientes (39,1%) que recibieron un IECA antes del inicio de la crisis renal fallecieron vs. 28 de 68 pacientes (41,2%) que recibieron bosentán; 14 de 23 pacientes (60,1%) tratados con IECA requirieron diálisis; siete pacientes no recibieron IECA o ARA, y tres de ellos fallecieron durante el siguiente mes después del diagnóstico de crisis renal; 51 pacientes (56%) recibieron tanto IECA como ARA. En cuanto al grupo de control, 82 pacientes (19,2%) recibieron IECA. El desenlace clínico de este grupo de pacientes fue malo, ya que 49 pacientes (53,8%) requirieron diálisis, la cual fue temporal para 11 pacientes, mientras que 38 requirieron diálisis permanente o fallecieron. Treinta y siete pacientes (40,7%) fallecieron, comparados con 46 pacientes (10,8%) del grupo de control (p < 0,001). Considerando los casos de mortalidad, 24 pacientes se encontraban en terapia de reemplazo renal o la requirieron en algún momento durante la enfermedad. Las muertes fueron más frecuentes en los pacientes que nunca recuperaron la función renal. Trece pacientes que nunca requirieron diálisis fallecieron. Las tasas de supervivencia de los pacientes con crisis renal esclerodérmica a uno, dos, cinco y diez años fueron del 70,9, 66,6, 60 y 41,9%, respectivamente. El tiempo promedio de supervivencia después del diagnóstico de la crisis renal fue de 99 meses. Las tasas de supervivencia libre de diálisis después de uno, dos y cinco años fueron del 55,3, 44,4 y 33,7%, respectivamente. Los desenlaces fueron mejores en los pacientes con hipertensión arterial (73,8%), comparados con los pacientes normotensos (58%)13.
Otro estudio de cohortes prospectivo, publicado por Steen y Medsger tuvo como objetivo evaluar los factores de riesgo, la historia natural y los desenlaces de los pacientes con crisis renal esclerodérmica tratados con IECA. Ellos evaluaron a todos los pacientes con esclerosis sistémica de la Universidad de Pittsburgh entre 1979 y 1996. De 807 pacientes con esclerosis sistémica difusa, 145 desarrollaron crisis renal esclerodérmica y recibieron IECA (no se mencionó el IECA específico, la dosis ni la vía de administración)14. Los pacientes fueron divididos en cuatro grupos, de acuerdo con sus desenlaces:
- •
Aquellos que no requirieron diálisis durante el primer año después del diagnóstico de la crisis renal, considerado como un desenlace favorable.
- •
Aquellos que requirieron diálisis temporal (requirieron diálisis y fue suspendida al menos durante un año).
- •
Aquellos que requirieron diálisis permanente.
- •
Aquellos que fallecieron temprano (definidos como aquellos pacientes que fallecieron durante los primeros seis meses después del diagnóstico de la crisis renal).
El 75% de los pacientes tenía síntomas de esclerosis sistémica durante por lo menos cuatro años, la edad promedio en el momento del diagnóstico fue de 50 años, el 75% de los pacientes eran mujeres, el 92% eran de raza caucásica y 88% tenían esclerosis sistémica difusa14.
Considerando la función renal del grupo de pacientes que no requirieron diálisis (55 pacientes [38%]), dos pacientes presentaron empeoramiento progresivo de la función renal y requirieron diálisis después de cuatro y seis años, respectivamente. Los 55 pacientes continuaron recibiendo IECA y un paciente desarrolló hipertensión maligna e insuficiencia renal, a pesar de estar recibiendo captopril. Treinta y cuatro pacientes (23%) recibieron diálisis temporal, la cual se suspendió entre dos y 18 meses después del inicio de la crisis renal. Los 34 pacientes continuaron el tratamiento con IECA. Treinta y dos pacientes (tres del grupo sin diálisis y uno del grupo con diálisis temporal) recibieron diálisis permanente (nueve con diálisis peritoneal y 23 con hemodiálisis). Veintiocho pacientes fallecieron por enfermedad temprana (19%), después de un período promedio de tres meses desde el diagnóstico. La mayoría de los pacientes de este grupo eran hombres (33%), mayores (54 años vs. 46 años) y tenían niveles iniciales de creatinina sérica más altos. De ellos, el 64% requirió diálisis. En cuanto a la supervivencia, fue similar en los pacientes del grupo sin diálisis que en los del grupo con diálisis temporal. La tasa de supervivencia acumulada después de cinco años fue del 90% y del 80-85% después de ocho años14.
Un estudio desarrollado por Penn et al. describió las características clínicas y patológicas de los pacientes con crisis renal esclerodérmica y las correlacionó con los desenlaces renales y la mortalidad. Se incluyeron en total 110 pacientes, 24 pacientes (22%) con la forma limitada y 86 pacientes (78%) con la forma difusa de esclerosis sistémica. La frecuencia calculada de crisis renal en este centro fue del 2% para los pacientes con esclerosis sistémica limitada y del 12% para los pacientes con esclerosis sistémica difusa. La edad promedio en el momento del diagnóstico fue de 50,7 años (rango 24-80 años); el 79% fueron mujeres; la duración media de la esclerosis sistémica en el momento del diagnóstico de la crisis renal fue de 7,5 meses (rango 0-200 meses); 69 pacientes (66%) desarrollaron la crisis renal durante el primer año del diagnóstico de esclerosis sistémica. Los pacientes con crisis renal normotensiva no fueron incluidos en este estudio. La mayoría de los pacientes recibieron IECA, a excepción de dos (una estaba embarazada y fue tratada con metildopa y un betabloqueador y el otro paciente fue tratado con un betabloqueador y un BCC). En al menos 46 pacientes se administraron análogos de la prostacilina por vía intravenosa (no hubo información acerca del agente específico, la dosis o la duración del tratamiento). La información sobre la necesidad de terapia de reemplazo renal estuvo disponible en 106 de 110 pacientes. De ellos, 38 (36%) no requirieron diálisis. De este grupo, solo tres requirieron diálisis más adelante (uno debido a nefrectomía para el tratamiento de un carcinoma renal después de 10 años de presentar la crisis renal esclerodérmica; otro con empeoramiento progresivo de la función renal que requirió diálisis siete años después de presentar la crisis renal esclerodérmica; y el último con requerimiento de diálisis ocho años después de presentar la crisis renal). Veinticuatro pacientes (23%) requirieron diálisis en el momento del diagnóstico, con posterior recuperación de la función renal, lo que permitió la suspensión de la diálisis (dos de ellos requirieron diálisis posteriormente: uno estuvo en diálisis durante 13 meses, sin diálisis durante seis meses y luego la reinició, y el otro estuvo en diálisis durante 18 meses y siete años después del diagnóstico de la crisis renal requirió diálisis durante 10 días). Cuarenta y cuatro pacientes (42%) requirieron diálisis en el momento del diagnóstico y nunca recuperaron la función renal (43 pacientes), o no aceptaron la terapia de reemplazo renal y fallecieron (tres pacientes). Diecinueve pacientes fallecieron durante la diálisis y tres recibieron un trasplante renal. El tiempo promedio de recuperación de la función renal (descontinuación de la diálisis) fue de 11 meses (rango 1-34 meses). Después de 24 meses, la recuperación fue menos frecuente. El 63% de los pacientes requirieron diálisis al comienzo de la crisis renal, y el 33% de los sobrevivientes continuaron recibiendo diálisis después de cinco años. De los pacientes que requirieron diálisis al inicio de la crisis renal, el 35% pudo descontinuar la terapia. El 7% de los pacientes que requirieron diálisis y pudieron recuperar la función renal tuvieron que reiniciar la diálisis más adelante15.
En cuanto a la mortalidad, 44 pacientes fallecieron después de la crisis renal. Las tasas de supervivencia a uno, dos, tres y diez años fueron del 82, 74, 59 y 47%, respectivamente. Las muertes fueron más frecuentes en el grupo de pacientes que recibieron diálisis y nunca recuperaron la función renal15.
El estudio publicado por Teixeira et al. describió la presentación y los desenlaces de los pacientes con crisis renal esclerodérmica. Ellos incluyeron pacientes con crisis renal, definida como una insuficiencia renal oligúrica rápidamente progresiva sin otra explicación y/o hipertensión arterial rápidamente progresiva, que se presenta durante la esclerosis sistémica. La crisis renal normotensiva se definió como un aumento de la creatinina sérica de más del 50% del valor inicial, o de más del 20% por encima del límite superior normal de la creatinina y una de las siguientes cinco características:
- •
Proteinuria con dos o más +.
- •
Hematuria con dos o más +, o 10 o más hematíes por campo.
- •
Trombocitopenia por debajo de 100.000 plaquetas/nm.
- •
Hemólisis (anemia, esquistocitos, recuento alto de reticulocitos).
- •
Biopsia renal con hallazgos sugestivos de crisis renal.
Los pacientes fueron divididos en cuatro grupos, basándose en sus desenlaces: sin diálisis, diálisis temporal, diálisis permanente o muerte. De 50 pacientes, la edad promedio fue de 53,3 años y la proporción mujeres:hombres fue de 2:5. Cuarenta y tres pacientes tenían esclerosis sistémica difusa. Diez pacientes estaban recibiendo dosis bajas de IECA en el momento del diagnóstico de crisis renal. Cuarenta y siete pacientes (94%) recibieron un IECA. De ellos, diez ya estaban recibiendo IECA (se aumentaron las dosis). De 37 pacientes, dos tenían una crisis renal normotensiva y 14 fallecieron. Solamente cuatro pacientes recibieron IECA solo, 23 recibieron IECA + BCC, cinco recibieron IECA + betabloqueador, dos con IECA + alfa y betabloqueadores. En cinco pacientes que recibieron IECA + BCC, se incluyó urapidil. Se requirió plasmaféresis en cinco pacientes. Solo un paciente necesitó iloprost. Después de 47 meses de seguimiento, 28 pacientes (56%) requirieron diálisis. Se requirió diálisis temporal en ocho pacientes (la duración media de la terapia fue de nueve meses), y se requirió diálisis permanente en 11 pacientes. En total, nueve pacientes (18%) fallecieron durante la diálisis. Ningún paciente recibió un trasplante renal. La tasa de supervivencia a un año fue del 78% (IC del 95% = 66-90%), y la supervivencia a cinco años fue del 69% (IC del 95% = 55-83%). El análisis multivariado reveló que una edad > 53 años en el momento del diagnóstico de la crisis renal, así como la crisis renal normotensiva, fueron predictores independientes de una menor supervivencia libre de diálisis crónica. Una limitación de este estudio fue el origen de la información, ya que los casos se obtuvieron de reportes previos de casos de crisis renal16.
Otro estudio publicado en 1990 evaluó los desenlaces de los pacientes con crisis renal esclerodérmica, antes y después de la introducción del IECA como tratamiento, e identificó los factores de riesgo asociados con malos desenlaces. La crisis renal se definió como un aumento incidental de la presión diastólica por encima de 110 mmHg, acompañado de al menos dos de los siguientes criterios:
- •
Cambios en el fondo del ojo grado III o IV, según la clasificación de Keith-Wagener.
- •
Convulsiones.
- •
Proteinuria.
- •
Hematuria.
- •
Anemia hemolítica microangiopática.
- •
Azotemia o hiperreninemia.
Se incluyeron pacientes que no tenían hipertensión diastólica si presentaban insuficiencia renal rápidamente progresiva sin otra explicación, y al menos dos de los criterios clínicos mencionados anteriormente. Cincuenta y tres pacientes con crisis renal esclerodérmica no recibieron IECA y 55 pacientes recibieron IECA: 47 pacientes recibieron captopril, uno recibió enalapril. Siete pacientes desarrollaron toxicidad por captopril (erupción cutánea), requiriendo un cambio a enalapril. Para el análisis, los pacientes fueron divididos en dos grupos: los que recibieron IECA como tratamiento y aquellos que no lo recibieron. También fueron divididos según los desenlaces: favorable (aquellos con una supervivencia de por lo menos seis meses después del inicio de la crisis renal, y que no requirieron diálisis, o quienes tuvieron una recuperación exitosa de la función renal) o desfavorable (supervivencia de menos de seis meses o requerimiento de diálisis permanente), obteniendo los siguientes resultados:
- •
Recibieron IECA +desenlace favorable: 31 pacientes. Veinte sobrevivieron seis meses o más y 11 sobrevivieron y requirieron diálisis temporal (tres-15 meses).
- •
No recibieron IECA+desenlace favorable: cuatro pacientes. Todos ellos sobrevivieron más de seis meses sin diálisis.
- •
Recibieron IECA +desenlace desfavorable: 24 pacientes. Quince sobrevivieron menos de seis meses, y nueve requirieron diálisis permanente.
- •
No recibieron IECA+desenlace desfavorable: 49 pacientes. Cuarenta sobrevivieron menos de seis meses y nueve requirieron diálisis permanente.
El 18% de los pacientes que no estuvieron expuestos a un IECA requirieron diálisis permanente. Los demás pacientes, es decir el 82%, sobrevivieron menos de seis meses y no tuvieron un registro de requerir terapia de reemplazo renal. De 53 pacientes que no recibieron IECA, la supervivencia a un año fue del 15%, y la supervivencia a cinco años fue del 10%. En cambio, los pacientes que recibieron IECA tuvieron una supervivencia a un año del 76% y una supervivencia a cinco años del 65%17.
Hudson et al. publicaron un estudio en el año 2014 en el que determinaron los desenlaces de los pacientes con crisis renal esclerodérmica y compararon los desenlaces de los pacientes que recibieron IECA frente a los de aquellos que no recibieron IECA antes del inicio de la crisis renal. Un año después de que se identificó el caso, se hizo un seguimiento para establecer si el paciente requirió diálisis, o si falleció. La muestra final incluyó 75 casos nuevos de crisis renal esclerodérmica, de los cuales 70 eran hipertensos y cinco eran normotensos. La edad promedio en el momento del diagnóstico fue de 53 años, 67% eran mujeres, 77% eran de raza caucásica y 75% tenían esclerosis sistémica difusa. Dieciséis pacientes (21%) recibieron IECA antes del inicio de la crisis renal y tuvieron mayores probabilidades de presentar una crisis renal normotensiva. Los que estuvieron expuestos a IECA antes del inicio de la crisis renal eran mayores (57 años vs. 51 años), fue menos frecuente en las mujeres (50 vs. 71%) y estuvieron expuestos a dosis más bajas de glucocorticoides, en comparación con los pacientes que no estuvieron expuestos a IECA (9,2 mg/día vs. 18,2 mg/día de prednisona). Veintisiete pacientes (36%) fallecieron durante el primer año y 19 pacientes (25%) sobrevivieron y continuaron con diálisis al final del primer año. La tasa de incidencia acumulada de muerte durante el primer año después del inicio de la crisis renal en los pacientes expuestos a IECA fue de 1,56 (IC 95% = 0,68-3,57), comparada con la de aquellos que no estuvieron expuestos a IECA. No se encontraron diferencias en cuanto a la tasa de diálisis durante el primer año (tasa de incidencia acumulada = 0,94, IC 95% = 0,43-2,05). Después de hacer los ajustes basados en la dosis inicial de prednisona, el riesgo de muerte en los pacientes expuestos a IECA antes del inicio de la crisis renal fue de más del doble, comparado con el de aquellos que no estuvieron expuestos y la diferencia fue estadísticamente significativa (HR: 2,42, IC 95%: 1,02-5,75, p < 0,05). Los desenlaces después del diagnóstico de la crisis renal fueron malos, con un 60% de muertes, el 25% siguió requiriendo diálisis después de finalizar el primer año y el 15% recuperó la función renal. Una posible explicación del mayor riesgo de mortalidad en los pacientes expuestos a IECA podría ser que la medicación podría enmascarar el desarrollo de la crisis renal. Además, la presencia de hipertensión arterial sistémica y comorbilidades cardíacas podría contribuir a este comportamiento. Es posible que los pacientes tratados con IECA para la hipertensión durante el comienzo de la esclerosis sistémica hayan presentado una crisis renal no diagnosticada, y que el tratamiento pudo haberla resuelto. A 10 pacientes se les realizó biopsia renal. Las muestras no fueron examinadas en la misma institución; sin embargo, el patólogo les diagnosticó a todos ellos crisis renal5.
En un estudio desarrollado por Cozzi et al., se evaluó el pronóstico de los pacientes con crisis renal esclerodérmica. Consistió en una cohorte de pacientes con esclerosis sistémica entre los años 1980 y 2005. De 606 pacientes con diagnóstico de esclerosis sistémica, 20 pacientes (3,3%) desarrollaron crisis renal, definida como un inicio abrupto de insuficiencia renal rápidamente progresiva (duplicación de los niveles de creatinina sérica por encima del nivel basal, sin otra explicación) y/o hipertensión maligna (presión sistólica por encima de 160 mmHg o presión diastólica por encima de 110 mmHg, medida en dos oportunidades). Siete pacientes con crisis renal tenían anemia hemolítica microangiopática. Después del diagnóstico de crisis renal, todos los pacientes continuaron su tratamiento establecido y dosis crecientes de IECA (captopril, enalapril y ramipril). Tres pacientes no toleraron las dosis altas de IECA y desarrollaron hipotensión sin presentar mejoría de la función renal. Estos tres pacientes y otros siete (que sufrían de anemia hemolítica microangiopática) requirieron tratamiento con plasmaféresis, además del IECA. Los desenlaces evaluados en este estudio incluyen el desarrollo de insuficiencia renal en etapa terminal (requerimiento de diálisis permanente), supervivencia, mortalidad y mortalidad debida a crisis renal. De 20 pacientes que desarrollaron crisis renal, 14 fueron mujeres y seis fueron hombres. El promedio de edad en el momento del diagnóstico de esclerosis sistémica fue de 45,5 ± 14,9 años y para el diagnóstico de la crisis renal fue de 49,0 ± 12,1 años. La duración media de la esclerosis sistémica al inicio de la crisis renal fue de 3,7 ± 4,8 años. Dieciséis pacientes tenían esclerosis sistémica difusa con un puntaje de Rodnan promedio de 20,5 (rango 15-32) y cuatro pacientes tenían enfermedad limitada (puntaje de Rodnan promedio: 5.5; rango: 5-7). Doce pacientes tenían enfermedad pulmonar intersticial, seis pacientes con compromiso cardíaco y 13 pacientes con compromiso gastrointestinal. En el momento del diagnóstico de la crisis renal, cinco pacientes estaban utilizando d-penicilamina, cuatro ciclosporina, uno ciclofosfamida, uno azatioprina y uno metotrexato. Diez pacientes estaban utilizando glucocorticoides en dosis bajas (siete con dosis inferiores a 15 mg/día, y tres con una dosis de 25 mg/día). Además, 15 pacientes utilizaron vasodilatadores orales y cinco utilizaron prostanoides intravenosos. Durante el primer año del diagnóstico de la crisis renal, 11 pacientes (55%) desarrollaron insuficiencia renal terminal y seis pacientes (30%) fallecieron debido a complicaciones de la crisis renal. La tasa de supervivencia a cinco años fue del 50% y la mortalidad relacionada con la crisis renal fue del 35%. Diez pacientes fueron tratados con plasmaféresis e IECA, debido a intolerancia a altas dosis de IECA o por el desarrollo de anemia hemolítica microangiopática. La duración de la plasmaféresis varió entre uno y 10 meses, con un promedio de 28 ± 12 sesiones. Después del primer año del diagnóstico de la crisis renal, siete de 10 pacientes conservaron o recuperaron la función renal, que fue suficiente para evitar la necesidad de diálisis, dos pacientes desarrollaron enfermedad renal terminal, requirieron diálisis permanente y recibieron un trasplante renal. Un paciente falleció como consecuencia de complicaciones de la crisis renal. En este grupo de pacientes, la supervivencia a los cinco años desde el inicio de la crisis renal fue del 70% y la mortalidad relacionada con la crisis renal fue del 10%. Otros dos pacientes que mejoraron inicialmente murieron de cáncer después de 15 y 18 meses, respectivamente. Estos resultados confirman el mal pronóstico de la crisis renal esclerodérmica, ya que el 55% de los pacientes desarrollaron insuficiencia renal terminal y el 30% falleció durante el primer año después del diagnóstico. El pronóstico a corto plazo ha mejorado, pero el pronóstico a largo plazo sigue siendo reservado18.
Otro estudio publicado por Walker et al. en el año 2003, determinó la frecuencia y los desenlaces de los pacientes con crisis renal esclerodérmica. Los autores también determinaron la duración media de la enfermedad desde el inicio de esta complicación, los predictores clínicos y serológicos del desarrollo de la crisis renal y la terapia farmacológica utilizada. Ellos encontraron 16 pacientes; 11 eran mujeres; el tiempo promedio para el inicio de la crisis renal desde la aparición del primer síntoma de esclerosis sistémica fue de 15 meses. En el momento del inicio de la crisis renal, la mayoría de los pacientes (94%) presentaron hipertensión arterial, 56% insuficiencia cardíaca y 81% anemia hemolítica microangiopática. Todos ellos presentaron insuficiencia renal rápidamente progresiva con hematuria, proteinuria y presencia de cilindros celulares. La edad promedio de inicio de la esclerosis sistémica en los pacientes con la crisis renal fue de 54,5 años (rango: 47,6-61,3). A siete pacientes se les hizo biopsia renal y a tres pacientes se les hizo autopsia. Los desenlaces fueron malos en estos pacientes, a pesar de que recibieron un tratamiento antihipertensivo agresivo. A 13 pacientes se les administró IECA (a dos pacientes se les suspendió debido a hipotensión). Otro paciente recibió captopril y desarrolló una reacción cutánea severa que requirió la suspensión del medicamento. Cinco pacientes fallecieron a los pocos días o semanas después del desarrollo de la crisis renal como consecuencia directa de la misma. Los otros cinco pacientes requirieron diálisis permanente (dos requirieron trasplante renal) y la creatinina sérica volvió a los niveles normales en dos pacientes. Se logró suspender la diálisis a un paciente después de seis meses19.
Codullo et al. desarrollaron un estudio retrospectivo multicéntrico para describir las características de pacientes italianos con crisis renal esclerodérmica, con un interés especial en el perfil serológico. Se incluyeron en total 46 pacientes, de los cuales, 38 eran mujeres y ocho hombres. Cuarenta pacientes presentaron una enfermedad difusa. La edad promedio al inicio de la esclerosis sistémica fue de 52,8 años y la edad promedio en el momento del diagnóstico de la crisis renal fue de 55,4 años. A cinco pacientes se les hizo biopsia renal con hallazgos típicos de crisis renal en la patología. Los pacientes se dividieron en:
- •
Aquellos con un diagnóstico de crisis renal durante los primeros 18 meses desde el inicio de la enfermedad.
- •
Aquellos con diagnóstico entre los 18 y los 48 meses desde el inicio de la enfermedad.
- •
Aquellos con diagnóstico después de 48 meses desde el inicio de la enfermedad.
El 62% de los casos con crisis renal se presentaron durante los primeros 18 meses, 18% entre los 18 y los 48 meses y 20% después de 48 meses. Los pacientes con crisis renal antes de los 18 meses a partir del diagnóstico de esclerosis sistémica eran mayores que los pacientes que desarrollaron la crisis renal después de 48 meses. La estrategia de tratamiento utilizada estuvo disponible en 42 pacientes. Treinta y tres pacientes (78%) recibieron un IECA tan pronto como se estableció el diagnóstico de crisis renal, 26 pacientes (62%) requirieron diálisis. La diálisis se suspendió en siete de 26 pacientes (27%). Tres pacientes recibieron un trasplante renal después de un período promedio de 140 ± 54 meses desde el inicio de la crisis renal. Un paciente desarrolló hipertensión arterial pulmonar y requirió el uso de un antagonista no selectivo de los receptores de endotelina-1. Las tasas de supervivencia acumulada a uno, dos, cinco y diez años fueron del 64, 53, 40 y 35%, respectivamente. El 80% de los pacientes desarrollaron crisis renal durante los primeros cuatro años posteriores al diagnóstico de esclerosis sistémica20.
Wangkaew et al. publicaron un estudio de casos y controles en el año 2017 para determinar la prevalencia, los factores de riesgo y los desenlaces en pacientes tailandeses con crisis renal esclerodérmica. Ellos incluyeron a los pacientes con esclerosis sistémica que cumplieron con los criterios de clasificación de la ACR de 1980, mediante la revisión de las historias clínicas entre enero de 1990 y diciembre de 2015. Los casos de crisis renal esclerodérmica se identificaron basándose en los Criterios del Estudio de Crisis Renal Esclerodérmica. Los controles fueron seleccionados en la base de datos de pacientes consecutivos con esclerosis sistémica sin crisis renal. Se equipararon los controles basándose en una duración de la enfermedad de ± un año. La proporción entre los pacientes con crisis renal esclerodérmica y los controles fue de 1:4. Los datos clínicos obtenidos de las historias clínicas fueron: edad, género, subtipo de esclerodermia, duración de la enfermedad, compromiso de órganos, resultados de laboratorio, medicamentos utilizados y desenlace. Se registraron los resultados de laboratorio y la medicación actual, a partir de la primera fecha desde el diagnóstico de la crisis renal esclerodérmica. En el grupo de control, estas variables fueron registradas y equiparadas en el tiempo de duración de la enfermedad en los casos. La definición de crisis renal esclerodérmica se basó en la del Grupo Internacional de Estudio de la Crisis Renal Esclerodérmica y los pacientes fueron divididos en dos grupos:
- •
Crisis renal esclerodérmica hipertensiva: presencia de cualquiera de las siguientes situaciones, tales como presión arterial sistólica > 140 mmHg o presión arterial diastólica > 90 mmHg o aumento de la presión arterial sistólica > 30 mmHg, en comparación con el valor inicial o aumento de la presión arterial diastólica > 20 mmHg, en comparación con el valor inicial, más una de las siguientes características: aumento de la creatinina sérica > 50% por encima del valor inicial o creatinina sérica > 120% del límite superior del valor normal, hematuria > 2 + por tira reactiva (dipstick) o > 10 hematíes por campo, trombocitopenia < 100.000 plaquetas/mm3, presencia de esquistocitos o aumento del número de reticulocitos o encefalopatía hipertensiva.
- •
Crisis renal esclerodérmica normotensiva: presencia de creatinina sérica elevada > 50% por encima del valor inicial o creatinina sérica > 120% del límite superior del valor normal, hematuria > 2 + por tira reactiva (dipstick) o > 10 hematíes por campo, trombocitopenia < 100.000 plaquetas/mm3, presencia de esquistocitos o aumento del número de reticulocitos o encefalopatía hipertensiva21.
Se evaluaron en total 637 pacientes con esclerosis sistémica. Diecinueve pacientes (3,13%) desarrollaron crisis renal: 12 de ellos hipertensiva y siete normotensiva. Como controles, se incluyeron 76 pacientes. Considerando la crisis renal, nueve pacientes (47,4%) fueron hombres, la edad promedio en el momento del diagnóstico de la esclerosis sistémica fue de 56,2 ± 13,8 años, la duración media de la enfermedad fue de cinco meses (rango: 3-22 meses) y 17 pacientes (89,5%) tenían esclerosis sistémica difusa. En cuanto al grupo de control, 25 pacientes (32,9%) fueron hombres, la edad promedio en el momento del diagnóstico de la esclerosis sistémica fue de 50,4 ± 11,2 años y 61 pacientes (80,3%) tenían esclerosis sistémica difusa. En comparación con los controles, los pacientes con crisis renal presentaron una mayor proporción de compromiso orgánico asociado con esclerosis sistémica, y requirieron dosis más altas de glucocorticoides. Los resultados del análisis de regresión logística condicional multivariante identificaron los siguientes factores de riesgo independientes para el desarrollo de crisis renal: presencia de gangrena digital, dosis actual de glucocorticoides > 15 mg/día, albúmina sérica < 3 mg/dL y compromiso cardíaco. En cuanto a los desenlaces de los pacientes con crisis renal, durante una mediana del período de seguimiento de un mes después del diagnóstico, 12 pacientes (63.2%) recibieron IECA y 15 pacientes (78,9%) requirieron diálisis. En tres pacientes no se utilizó IECA debido a hipotensión concurrente. De los pacientes que requirieron diálisis, 6 (40%) necesitaron la terapia durante más de tres meses y posteriormente requirieron diálisis a largo plazo. Tres pacientes (20%) que requirieron diálisis se perdieron en el seguimiento dentro de los tres meses posteriores a la diálisis. Diez pacientes (52,6%) con crisis renal fallecieron. La mediana del tiempo desde el diagnóstico de la crisis renal hasta la muerte fue de 17,5 días (rango: 3,5-40,2). Las limitaciones de este estudio incluyen el hecho de que el número de pacientes con crisis renal era pequeño, lo que afectó la significancia estadística. Además, la duración mediana del seguimiento de los pacientes fue corta, lo que afectó la evaluación de los desenlaces a largo plazo21.
El estudio publicado por Penn et al. en el año 2013 es el único estudio piloto que se encontró. El objetivo fue medir la expresión de endotelina-1 y los receptores A y B de la endotelina en pacientes con crisis renal esclerodóermica y evaluar la posibilidad y la seguridad de adicionar el tratamiento con bosentán durante seis meses a un tratamiento con IECA durante las primeras seis semanas desde el diagnóstico de la crisis renal. La razón fundamental para utilizar bosentán como parte del tratamiento de la crisis renal es que este agente ha demostrado ser efectivo para el manejo de otras complicaciones vasculares de la esclerosis sistémica, incluyendo las úlceras digitales y la hipertensión arterial pulmonar. Estas complicaciones y la crisis renal tienen similitudes microscópicas importantes debido al éxito clínico del bloqueo de la actividad de la endotelina-1 en dos de estas manifestaciones vasculares (hipertensión pulmonar y úlceras digitales). La crisis renal esclerodérmica se definió como hipertensión arterial de inicio reciente por encima de 150/85 mmHg, medida por lo menos en dos oportunidades en 24 horas, o el desarrollo de deterioro de la función renal, definido como una reducción de la tasa de filtración glomerular de por lo menos 30%. Las siguientes características fueron consideradas como evidencia que sustenta el diagnóstico de crisis renal, si estaban presentes: anemia hemolítica microangiopática, retinopatía por crisis hipertensiva, hematuria de aparición reciente, edema pulmonar agudo, oliguria o anuria, biopsia renal con cambios definitorios. Los casos incluidos en este estudio fueron confirmados entre los años 2000 y 2004, en los que estaban disponibles los exámenes de sangre y la biopsia renal de 27 pacientes y seis pacientes más fueron incluidos en el ensayo «Bosentán en la enfermedad renal» (BIRD-1, «Bosentan in renal disease-1»). Para poder incluir los resultados de los casos incluidos en el ensayo BIRD-1, en el contexto de otros casos de crisis renal tratados en el mismo centro, se hizo un análisis comparativo de los casos de crisis renal y se tomaron 49 casos como comparador. Los desenlaces evaluados fueron la mortalidad y la función renal a los seis y a los 12 meses (incluyendo la necesidad de diálisis). Todos los pacientes fueron tratados con bosentán 62,4 mg, dos veces al día, y luego se aumentó la dosis a 125 mg dos veces al día durante otros cinco meses, junto con un IECA22.
En cuanto a los seis pacientes incluidos en el estudio, el 100% eran de raza caucásica. Un paciente estaba recibiendo terapia inmunomoduladora antes del inicio de la crisis renal (micofenolato de mofetilo). Dos pacientes fueron tratados con glucocorticoides (uno con dosis altas por sospecha de glomerulonefritis y otro con dosis bajas de prednisona). Ninguno de los pacientes recibió IECA o ARA antes del inicio de la crisis renal. Un paciente que recibía bosentán se retiró del estudio debido a la necesidad de diálisis después de diez días de tratamiento. Otro paciente descontinuó el bosentán después de cinco semanas desde el inicio del tratamiento22.
En relación con los resultados, tres de seis pacientes requirieron diálisis y dos pacientes continuaron en diálisis 12 meses después del diagnóstico. Treinta y cuatro de 49 pacientes de la cohorte que se utilizó como comparación necesitaron diálisis en algún momento durante el seguimiento, y 25 pacientes permanecieron en diálisis después de 12 meses desde el diagnóstico. En cuanto a la mortalidad a un año, uno de seis pacientes (16%) del grupo que recibió bosentán falleció, y seis de 49 pacientes (12%) de la cohorte de comparación fallecieron. Con base en esto, los autores concluyeron que no se encontraron diferencias significativas en las tasas de mortalidad o en la necesidad de diálisis entre el grupo que recibió bosentán y el grupo de control. Se encontró un aumento de los niveles plasmáticos de endotelina-1 en los pacientes con crisis renal, comparados con los controles sanos (el nivel promedio de los controles sanos fue de 0,5 pg/mL vs. 1,48 pg/mL en los pacientes con crisis renal). Los niveles promedio de endotelina-1 en la cohorte BIRD-1 no fueron significativamente diferentes a los del grupo de control. Los pacientes tratados con bosentán tenían niveles elevados de endotelina-1. No se registraron eventos adversos importantes. En conclusión, este estudio confirma el papel potencial de la endotelina-1 y su receptor en la fisiopatología de la crisis renal esclerodérmica y proporciona información respecto a la seguridad del uso de antagonistas no selectivos de los receptores de endotelina, combinado con la terapia estándar en el contexto de los pacientes con crisis renal22.
La evaluación de la calidad de la evidencia para cada estudio encontró los siguientes aspectos:
- •
En cuanto a los ensayos clínicos, el único disponible es un ensayo abierto no cegado, que presenta un mayor riesgo de sesgo de selección, asignación y realización debido al diseño del estudio. Existe un riesgo de deserción poco claro, ya que no hay información sobre la estrategia utilizada en caso de pérdida en el seguimiento o retiro de los participantes en el estudio.
- •
La evaluación de la calidad de las cohortes utilizando la lista de verificación SIGN se presenta en la tabla 2. La calidad general de los estudios muestra que desarrollaron una pregunta de investigación adecuada, y las poblaciones objetivo para la selección de los participantes fueron adecuadas. Sin embargo, no suministraron información sobre la cantidad de pacientes a quienes se les pidió que participaran, y la comparación entre los participantes y los no participantes. En general, los estudios definieron claramente los desenlaces, los métodos de medición, y en algunos casos, las referencias para sustentar la confiabilidad de los métodos utilizados. Sin embargo, ningún estudio proporciona información sobre el cegamiento del estado de exposición. Otra debilidad que se identificó es que solo pocos estudios tienen en cuenta la presencia de posibles factores de confusión durante el diseño y el análisis.
Tabla 2.Evaluación de la calidad de la evidencia de los estudios de cohortes utilizando la lista de verificación SIGN
Lista de verificación SIGN para la valoración crítica de la evidencia en los estudios de cohortes Estudios Steen, VD (2000) Teixeira, L (2008) Steen, VD (1990) Hudson, M (2014) Cozzi, F (2012) Walker, JG (2002) Codullo, V (2009) El estudio aborda una pregunta apropiada y claramente enfocada. Sí Sí Sí Sí Sí Sí Sí – Selección de los sujetos Los dos grupos que están siendo estudiados son seleccionados de poblaciones de origen que son comparables en todos los aspectos, excepto en el factor que se está investigando. Sí Sí Sí Sí Sí Sí Sí El estudio indica cuántas de las personas a quienes se les pidió que tomaran parte lo hicieron, en cada uno de los grupos que están siendo estudiados. No N/A No No N/A No N/A La probabilidad de que algunos sujetos elegibles pudieran tener el desenlace en el momento de la inscripción se evalúa y se tiene en cuenta en el análisis. Sí N/A No Sí N/A No N/A ¿Qué porcentaje de individuos o grupos reclutados en cada brazo del estudio se retiró antes de que terminara el estudio? N/A N/A No está claro No está claro N/A No N/A Se hizo una comparación entre todos los participantes y los que se perdieron en el seguimiento, por estado de exposición. No N/A No No N/A No N/A – Evaluación Los desenlaces estaban claramente definidos. Sí Sí Sí Sí Sí Sí Sí La evaluación del desenlace se hace cegada al estado de exposición. Si el estudio es retrospectivo esto puede no ser aplicable. No N/A No está claro No está claro N/A No está claro N/A Cuando no fue posible el cegamiento, hay algún reconocimiento de que el conocimiento del estado de exposición podría haber influido en la evaluación del desenlace. N/A No No No No No No El método de evaluación de la exposición es confiable. No está claro Sí Sí Sí Sí Sí Sí Se utiliza la evidencia de otras fuentes para demostrar que el método de evaluación de los desenlaces es válido y confiable. No No No No Sí Sí Sí El nivel de exposición o el factor pronóstico se evalúan más de una vez. Sí Sí Sí Sí Sí No Sí – Factores de confusión Se identifican los principales confusores potenciales y se tienen en cuenta en el diseño y el análisis. No está claro Sí Sí Sí No No No – Análisis estadístico ¿Se han suministrado intervalos de confianza?_______________________________________ No Sí Sí Sí No Sí Sí - •
La evaluación de la calidad de los estudios de casos y controles utilizando la lista de verificación SIGN se presenta en la tabla 3. En general, los estudios de casos y controles incluidos en la revisión sistemática fueron de buena calidad. La única debilidad fue que no suministraron información acerca del porcentaje de individuos que participaron de la población total a la que se le pidió que participara en el estudio. Además, no se hizo una comparación entre los participantes y los no participantes. Adicionalmente, el estudio de Wangkaew et al. no mencionó que ellos hubieran considerado posibles factores de confusión durante el diseño y el análisis.
Tabla 3.Evaluación de la calidad de la evidencia de los estudios de casos y controles utilizando la lista de verificación SIGN
Lista de verificación SIGN para la valoración crítica de la evidencia en los estudios de casos y controles Estudios Guillevin et al. (2012) Wangkaew, S. et al. (2017) El estudio aborda una pregunta apropiada y claramente enfocada. Sí Sí – Selección de los sujetos Los casos y los controles se toman de poblaciones comparables. Sí Sí Se utilizan los mismos criterios de inclusión tanto para los casos como para los controles. Sí Sí ¿Qué porcentaje de cada grupo (casos y controles) participó en el estudio? No está claro No aplica Se hace una comparación entre los participantes y los no participantes para establecer sus similitudes y diferencias. No No aplica Los casos están claramente definidos y diferenciados de los controles. Sí Sí Está claramente establecido que los controles no son casos. Sí Sí – Evaluación Se han tomado medidas para evitar que el conocimiento de la exposición primaria influya en la determinación del caso. Sí Sí El estado de exposición se mide de una manera estándar, válida y confiable. Sí Sí – Factores de confusión Se identifican los principales confusores potenciales y se toman en cuenta en el diseño y el análisis. Sí No – Análisis estadístico Se suministran intervalos de confianza. Sí Sí - •
La evaluación de la calidad de las series de casos mediante la herramienta de valoración crítica desarrollada por el Instituto Joanna Briggs de la Universidad de Adelaida se presenta en la tabla 4. El único estudio de esta categoría, en general, cumple con los criterios para ser considerado de calidad adecuada. Sin embargo, no hubo suficiente información sobre la inclusión consecutiva o completa de participantes.
Tabla 4.Evaluación de la calidad de la evidencia en los estudios de series de casos utilizando la herramienta de valoración crítica desarrollada por el Instituto Joanna Briggs de la Universidad de Adelaida
Lista de Verificación de JBI para la Valoración Crítica de las Series de Casos Estudio Penn, H. (2007) ¿Había criterios claros para la inclusión en la serie de casos? Sí ¿La afección fue medida de forma estándar y confiable para todos los participantes incluidos en la serie de casos? Sí ¿Se utilizaron métodos válidos para la identificación de la afección para todos los participantes incluidos en la serie de casos? Sí ¿La serie de casos tuvo una inclusión consecutiva de los participantes? No está claro ¿La serie de casos tuvo una inclusión completa de los participantes? No está claro ¿Hubo un informe claro de las características demográficas de los participantes en el estudio? Sí ¿Hubo un reporte claro de la información clínica de los participantes? Sí ¿Se informaron en forma clara los desenlaces o los resultados del seguimiento de los casos? Sí ¿Hubo un reporte claro de la información demográfica, clínica y del sitio o los sitios de presentación? Sí ¿El análisis estadístico fue apropiado? Sí
La crisis renal esclerodérmica es una complicación grave y poco frecuente de la esclerosis sistémica, que aún presenta una baja tasa de supervivencia a uno, dos, cinco y diez años, con un alto porcentaje de pacientes que requieren terapia de reemplazo renal temporal o permanente.
Se encontró que aproximadamente el 54,9% de los pacientes analizados requirieron diálisis temporal o permanente. Aproximadamente 6-27% de los pacientes requirieron diálisis temporal y 19-78% de los pacientes requirieron diálisis permanente. Los rangos son amplios, lo cual refleja que las muestras de datos disponibles son insuficientes para los estudios, una situación que no permite el desarrollo de análisis estadísticos más precisos. Sin embargo, los resultados muestran una clara correlación entre el desarrollo de la crisis renal y la necesidad de diálisis permanente.
En cuanto a la supervivencia, el análisis muestra datos relevantes que se podrían sintetizar de la siguiente manera: la supervivencia a un año fue del 64 al 84%, la supervivencia a dos años fue del 53 al 74%, la supervivencia a cinco años fue del 40 al 90%, y la supervivencia a los 10 años fue del 35 al 47%. Fue evidente que la supervivencia a los diez años se redujo de manera significativa, en comparación con las demás. Durante el análisis no se encontró ninguna justificación específica para explicar este comportamiento. Sin embargo, esto se puede explicar por el tipo de enfermedad crónica (su progresión, el compromiso orgánico) y el proceso natural de envejecimiento.
El análisis muestra que el 91% de los pacientes analizados estaban recibiendo tratamiento farmacológico en el momento del diagnóstico. Conforme a las recomendaciones de las directrices, los agentes prescritos con mayor frecuencia fueron los IECA (88,75% = 81,4% como monoterapia, y 7,35% combinados con otros agentes). La combinación observada con mayor frecuencia fue la de IECA + ARA (4,6%). Todas las referencias descritas anteriormente apuntan al beneficio de aplicar IECA debido a la mejora de las tasas de supervivencia comparadas con las de los pacientes que no recibieron el tratamiento. Esta evidencia respalda la afirmación de que la introducción de este medicamento en el manejo de la crisis renal cambió la historia natural de la enfermedad en cuanto a la supervivencia a corto plazo. Sin embargo, el uso de esta terapia no fue suficiente en todos los casos para restaurar o mantener la función renal sin requerir diálisis. La efectividad del tratamiento con IECA se asocia con la interrupción del sistema renina-angiotensina-aldosterona, reduciendo la vasoconstricción por la angiotensina-II y disminuyendo la degradación de la bradiquinina, lo que aumenta la vasodilatación renal23.
Una observación importante fue que el uso previo de IECA antes del inicio de la crisis renal parece ser un factor de riesgo de mortalidad. Esto podría explicarse por un encubrimiento temprano del desarrollo de la crisis renal, que inicialmente podría ser diagnosticada erróneamente como hipertensión arterial sistémica primaria. Esta situación respalda las recomendaciones presentadas en revisiones recientes, en las que no se apoya la prescripción profiláctica de IECA debido al mayor riesgo de daño. Sin embargo, se requiere más evidencia para desarrollar una recomendación más sólida23.
Desafortunadamente, no todos los estudios mencionaron el IECA específico utilizado; sin embargo, el que se utilizó con mayor frecuencia fue el captopril, seguido del enalapril. El captopril se ha utilizado como el IECA de elección porque tiene un inicio de acción rápido, una vida media corta y permite una escalada rápida de la dosis cuando es necesario23.
Otro medicamento que muestra un gran potencial para aumentar la tasa de supervivencia de los pacientes y reducir la necesidad de terapia de reemplazo renal fue el bosentán. Sin embargo, la evidencia disponible es limitada y el número de casos analizados en esta revisión fue pequeño (0,5% de los pacientes) para poder sacar conclusiones definitivas. Se requieren más estudios en este campo24,25.
Los demás agentes farmacológicos utilizados, tales como ARA, BCC y bloqueadores adrenérgicos parecen funcionar en el tratamiento, pero en combinación con IECA. En el caso de los ARA, los beneficios de su uso como terapia de primera línea siguen siendo poco claros ya que algunos autores reportaron un beneficio limitado, mientras que otros afirman que el uso exclusivo de ARA no es capaz de controlar la enfermedad y se asocia con un mayor riesgo de falla renal. Los informes iniciales indican un beneficio al combinar IECA y ARA; sin embargo, la evidencia reciente desaconseja esta combinación debido al riesgo de eventos adversos, tales como hiperpotasemia y empeoramiento de la tasa de filtración glomerular25.
No se encontraron estudios sobre el uso de análogos de la prostaciclina para el tratamiento de la crisis renal esclerodérmica. Los estudios disponibles tienen como objetivo establecer el efecto del uso crónico de estos medicamentos en pacientes con esclerosis sistémica. La evidencia disponible sugiere que el uso de análogos de la prostaciclina ha reducido la incidencia de crisis renal en los pacientes con esclerosis sistémica25. Esta afirmación está respaldada por el estudio publicado por Caramaschi et al. en el 2012, que tiene como objetivo evaluar la incidencia de complicaciones vasculares graves, tales como la crisis renal esclerodérmica en pacientes que reciben iloprost intravenoso cíclico durante tres años como mínimo. De 115 pacientes con esclerosis sistémica, ninguno de ellos desarrolló crisis renal26. Sin embargo, se requieren más estudios para respaldar el uso de análogos de la prostaciclina como profilaxis contra esta complicación grave, y también el uso potencial como tratamiento, con el fin de desarrollar una recomendación más sólida.
En los últimos años no se han publicado estudios observacionales ni analíticos sobre el uso de nuevos agentes terapéuticos para el tratamiento de esta entidad, para ser incluidos en la revisión. Sin embargo, una revisión reciente publicada por Zanatta et al., en el año 2018, proporciona información sobre el papel del sistema del complemento en la fisiopatología de la falla renal esclerodérmica, ya que los estudios de inmunofluorescencia realizados en biopsias de riñón de pacientes con esta enfermedad muestran depósitos de C1q, C3b, C4d, y C5b-9 en el endotelio de las arteriolas y los glomérulos renales25. Okrój et al. publicaron un estudio en el 2016 respecto a la expresión de biomarcadores del complemento en la esclerosis sistémica, observando que los pacientes con crisis renal esclerodérmica expresan un patrón diferente de marcadores de activación del complemento, comparados con los pacientes con esclerosis sistémica y ausencia de compromiso renal. Ellos presentan mayores cantidades de C4d y niveles de C3bBbP y sTCC más bajos. Tanto el C3bBbP como el sTCC son marcadores de actividad hemolítica, lo que indica que la activación del complemento está presente durante una crisis renal esclerodóermica27.
Se han publicado dos reportes de casos relacionados con el uso potencial de eculizumab (un anticuerpo monoclonal humanizado contra C5). Thomas et al. publicaron un reporte en el que describen el caso de una mujer de 46 años con enfermedad pulmonar intersticial no especificada, quien estaba presentando empeoramiento de la disnea durante el último año, y llevaba un mes con hinchazón de las extremidades y debilidad muscular proximal. El examen físico mostró hipertensión arterial, disminución de los ruidos respiratorios y debilidad proximal. Durante el ingreso se realizaron varios exámenes de laboratorio, que mostraron consumo de plaquetas, frotis de sangre periférica con esquistocitos, disminución de la haptoglobina y niveles elevados de LDH compatibles con hemólisis. Además, se encontraron niveles elevados de creatinina sérica, análisis de orina con presencia de sangre y proteínas, ANA positivos (> 1:2.560) con patrón moteado, anticuerpos anti-PM-ScL-100 y RNA polimerasa III positivos e hipocomplementemia. El diagnóstico inicial fue púrpura trombocitopénica trombótica, la cual fue tratada con glucocorticoides y plasmaféresis. Sin embargo, la función renal empeoró y también se presentó hemólisis. Finalmente, dada la presencia de enfermedad pulmonar intersticial, la capilaroscopia positiva para el patrón de esclerodermia, la debilidad muscular y el perfil de autoanticuerpos, se sospechó el diagnóstico de síndrome de superposición de esclerodermia/polimiositis, con crisis renal esclerodérmica en curso. Como los glucocorticoides pueden empeorar la crisis renal, se disminuyó la dosis gradualmente y se administró enalapril con aliskiren, sin mejoría. Debido al consumo constante del complemento, se administraron 900 mg de eculizumab. Después de 24 horas, los signos de hemólisis se estaban resolviendo, y después de una semana, la función renal y la presión arterial fueron mejorando28. Devresse et al. reportaron otro caso en el año 2016, de una mujer embarazada de 28 años (28 semanas de gestación), quien fue admitida en el servicio de urgencias debido a hipertensión arterial severa, signos de microangiopatía trombótica e insuficiencia renal aguda. La paciente tenía un diagnóstico previo de esclerosis sistémica. Los laboratorios mostraron trombocitopenia severa, anemia hemolítica microangiopática, niveles normales de enzimas hepáticas, creatinina sérica elevada, hipocomplementemia y uroanálisis con evidencia de proteinuria macroscópica. Se hizo una operación cesárea, seguida de lisinopril, nicardipino y plasmaféresis. La función renal se redujo hasta que se presentó anuria, requiriendo diálisis. Este comportamiento descartó una preeclampsia. La ecografía mostró hipoperfusión renal. Se hizo una biopsia renal, que mostró cambios vasculares severos, necrosis, isquemia glomerular y depósitos de complemento en el endotelio vascular. Se hizo un diagnóstico de crisis renal esclerodérmica. Después de 18 días, se decidió iniciar eculizumab, logrando un buen control de la presión arterial y la recuperación de la función renal. Sin embargo, la paciente presentó insuficiencia cardíaca de aparición reciente, seguida de edema pulmonar agudo y paro cardíaco, falleciendo a pesar de los esfuerzos de reanimación29. Ambas experiencias muestran un beneficio potencial al utilizar este agente como terapia para la insuficiencia renal por esclerodermia, pero se necesita más investigación.
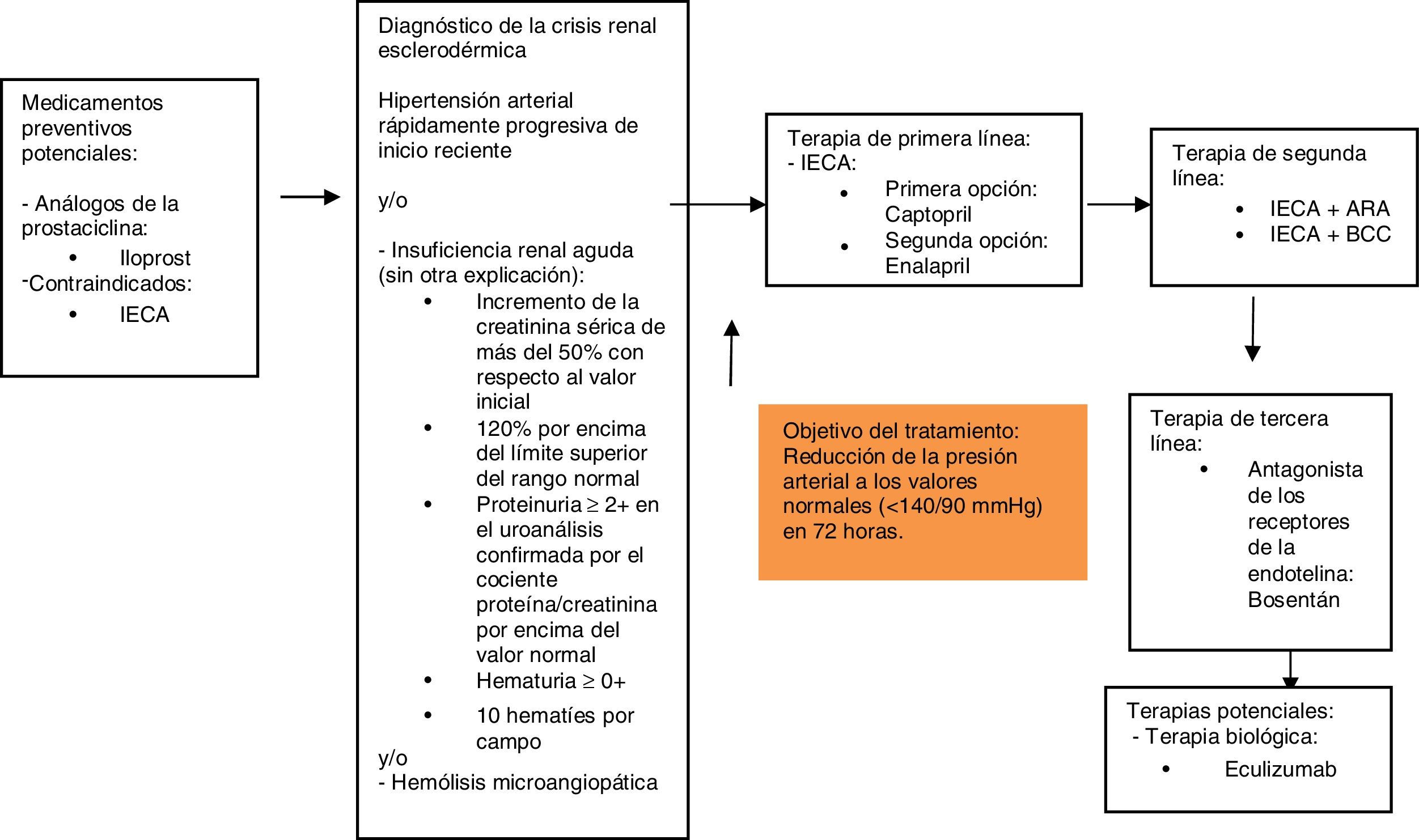
Basándose en los resultados y la discusión presentada anteriormente, se construyó el siguiente diagrama sobre el manejo farmacológico de la crisis renal esclerodérmica (fig. 2).
Todos los estudios que se incluyeron tenían limitaciones relacionadas con el número de pacientes incluidos. La mayoría de los estudios encontrados fueron observacionales, descriptivos y retrospectivos, por lo cual están enfocados en la descripción de características epidemiológicas y no evalúan la efectividad y la seguridad de los tratamientos farmacológicos. Solo se incluyó un ensayo clínico en la revisión. En la mayoría de los estudios incluidos en esta revisión, no se mencionó el agente farmacológico específico que se utilizó (especialmente el IECA o el ARA utilizado), la dosis, o la vía de administración. Esta situación aumenta la necesidad de más estudios analíticos, con el fin de contar con una evidencia sólida de la efectividad y la seguridad de los tratamientos farmacológicos. Estas limitaciones representan un desafío importante para el logro del objetivo de la revisión, ya que no se pueden establecer conclusiones significativas con la evidencia disponible.
ConclusionesEsta revisión permite establecer las siguientes conclusiones:
- •
La crisis renal esclerodérmica es una complicación severa y poco frecuente de la esclerosis sistémica.
- •
La crisis renal esclerodérmica es la complicación renal primaria en esta población.
- •
Los agentes IECA siguen siendo la primera línea de tratamiento en la crisis renal esclerodérmica, especialmente el captopril. Sin embargo, el uso profiláctico o el uso antes del inicio de la crisis renal se asocia con tasas de mortalidad más altas.
- •
El pronóstico a corto plazo de los pacientes con crisis renal esclerodérmica ha mejorado debido a la introducción de la terapia con IECA, pero el pronóstico a largo plazo sigue siendo un desafío.
- •
La terapia de reemplazo renal es un requerimiento común en el tratamiento de estos pacientes. Este procedimiento es considerado una intervención de alto costo, que puede limitar el acceso de los pacientes a esta terapia.
- •
Considerando el conocimiento actual de la fisiopatología de la crisis renal, se deben utilizar nuevos agentes farmacológicos con diferentes mecanismos de acción, con el fin de aumentar la efectividad de la terapia farmacológica.
- •
Se deben promover más estudios sobre esta enfermedad con el fin de mejorar los tiempos para el inicio del tratamiento.
- •
Se requieren más estudios analíticos y ensayos clínicos para tener una evidencia sólida de la efectividad y la seguridad de las diferentes opciones farmacológicas disponibles para el tratamiento de la crisis renal esclerodérmica.
Este trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.