La percepción global de la salud (PGA) es una parte de los instrumentos compuestos utilizados para determinar la actividad de la artritis reumatoide (AR). Por lo general, se mide por medio de la escala visual análoga (EVA). En nuestra práctica clínica y en la literatura se han observado dificultades en la aplicación de la EVA. Este estudio se llevó a cabo luego de considerar la necesidad de definir el desempeño de las diferentes escalas usadas para evaluar la PGA, determinar la facilidad de su uso y proponer una nueva escala.
MétodosSe trata de un estudio basado en desenlace de pacientes con diagnóstico de AR a los que se aplicaron cuatro tipos de escalas para evaluar la PGA: escala 1 (EVA), escala 2 (escala de rostros) y una propuesta de escala visual en dos versiones: escala 3 (escala visual compuesta en orientación horizontal) y escala 4 (similar a la escala 3, pero en orientación vertical). Se analizó su correlación y la frecuencia con la que los pacientes las entendieron.
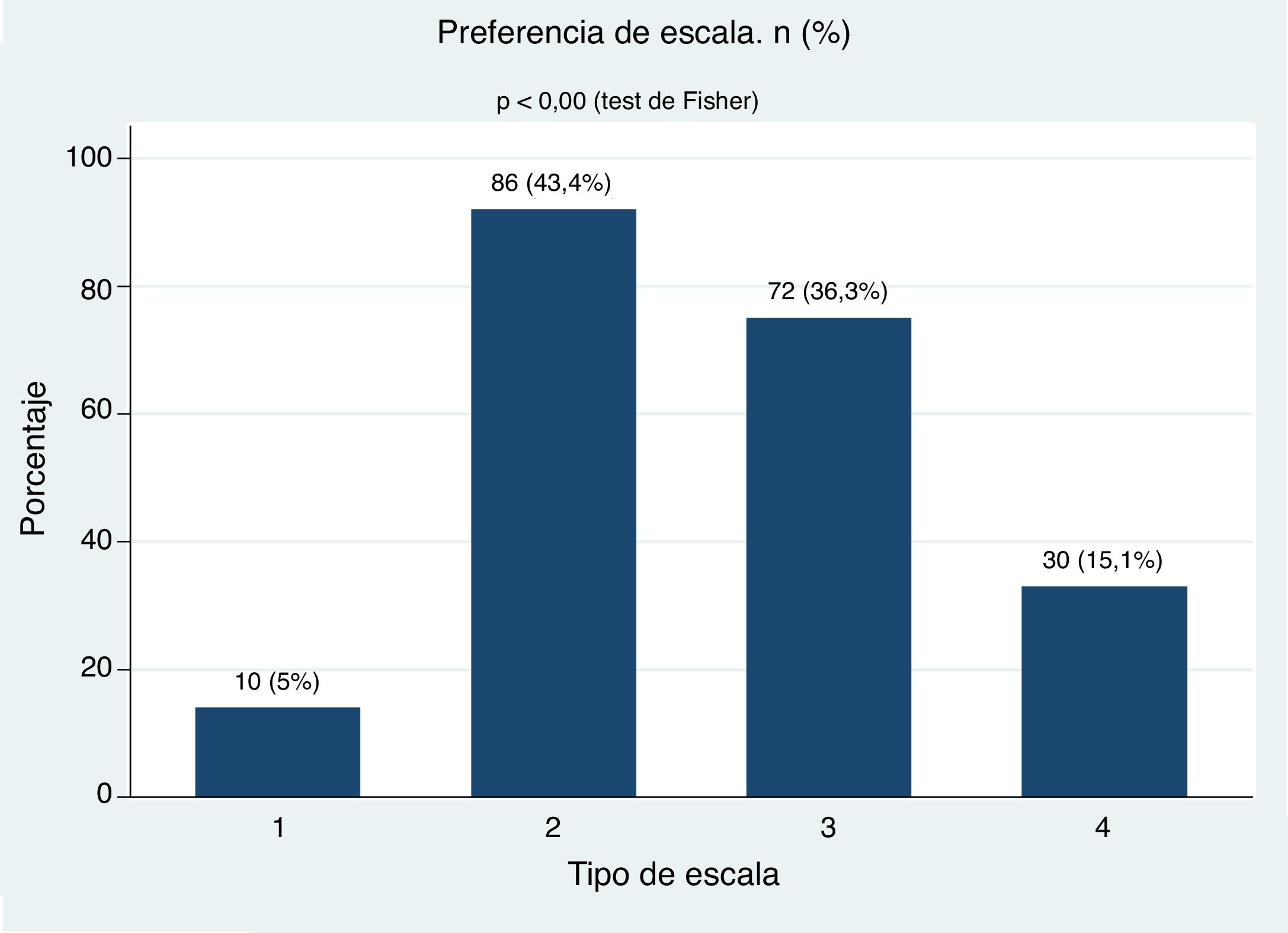
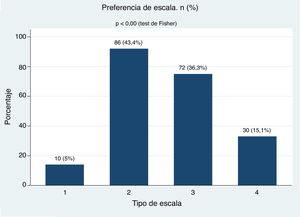
ResultadosSe incluyeron 198 pacientes, 169 mujeres (85,3%) y 29 hombres (14,6%), y la edad media fue de 54,2 años. El 59,6% de los pacientes no entendió la escala 1. La mayoría de los pacientes entendió las escalas 2, 3 y 4. Aproximadamente el 80% de los pacientes prefirió las escalas 2 (43,4%) y 3 (36,3%) (p < 0,00). Ninguna variable clínica predijo la selección de la escala. Se observó una buena correlación y una aceptable reproducibilidad de las escalas 2, 3 y 4.
ConclusionesLa mayoría de los pacientes no entendió la EVA; la mayoría de nuestros pacientes entendió y prefirió las escalas propuestas, que podrían ser útiles en la práctica clínica de los pacientes con AR.
The overall perceived health (OPH) is part of the composite tools used to determine the activity of Rheumatoid Arthritis (RA). It is usually measured using a Visual Analogue Scale (VAS). Difficulties in applying the VAS have been observed in clinical practice and in the literature. This study was carried out after considering the need to define the performance of the different scales used to evaluate OPH, and determine their ease of use, as well as to propose a new scale.
MethodsThe study based on the outcome of patients, subjects diagnosed with RA, to whom 4 types of scales were applied to evaluate OPH: Scale 1 (VAS), Scale 2 (face scale), a proposal of a visual scale in two versions: Scale 3 (composite visual scale in horizontal orientation), and Scale 4, similar to 3 in vertical orientation.
ResultsOf the 198 patients included, 169 (85.3%) were women, and 29 (14.6%) were men. The mean age was 54.2 years, and 59.6% of the patients did not understand the Scale 1. The majority of the patients understood the Scales 2, 3, and 4. Approximately 80% of the patients preferred the Scales 2 (43.4%) and 3 (36.3%) (P<.00), but no clinical variable predicted the selection of the scale. A good correlation and an acceptable reproducibility were observed for scales 2, 3, and 4.
ConclusionsAlthough the majority of patients did not understand the VAS, the majority of our patients understood and preferred the proposed scales that could be useful in the clinical practice of RA patients.
La artritis reumatoide (AR) es una enfermedad inflamatoria articular crónica, caracterizada por sinovitis, rigidez, edema, dolor e inflamación sistémica1-3 que puede tener complicaciones extraarticulares4-6. En la valoración clínica del paciente con AR y como parte fundamental del proceso de control de la enfermedad es importante la estimación de la actividad de la enfermedad7,8. Los desenlaces reportados por el paciente (DRP) exploran directamente el dolor, la funcionalidad y percepción global de la salud (PGA)9. La PGA hace parte de los instrumentos compuestos utilizados para determinar la actividad de la enfermedad o clinimetría. La clinimetría ha demostrado beneficio en la estrategia treat to target10,11. Las herramientas de medición compuestas y validadas para la clinimetria en AR son: el DAS o Disease Activity Score12; el DAS28 o Disease Activity Score, que evalúa 28 articulaciones13; el SDAI o Simplified Disease Activity Index14 y el CDAI o Clinical Disease Activity Index15,16. Todos estos instrumentos incluyen la PGA, ya sea la escala visual análoga (EVA), la numérica, la verbal o la de rostros. OMERACT recomienda que la medición se haga usando EVA horizontal de 10 cm o con una escala de tipo Likert17-19.
En la práctica clínica diaria de la consulta se observó que la EVA no es bien comprendida por la mayoría de los pacientes, contrariamente a las escalas de rostros que mostraban un mejor desempeño. Por esta razón, el presente estudio se propuso determinar el desempeño de las diferentes escalas en la evaluación de la PGA y proponer una escala compuesta (EC), en dos versiones similares, con diferente orientación: horizontal y vertical.
El objetivo general de este estudio fue determinar la percepción global de la enfermedad en pacientes con artritis reumatoide mediante diferentes escalas. Por su parte, los objetivos específicos fueron: definir la escala que más entienden los pacientes, determinar la preferencia de las diferentes escalas por los pacientes y determinar la correlación de las diferentes escalas para evaluar la percepción global del paciente sobre la enfermedad.
Materiales y métodosSe realizó un estudio observacional de tipo transversal, de evaluación de escalas para determinar los desenlaces reportados por pacientes. La población objeto de estudio correspondió a adultos del régimen subsidiado de salud provenientes del área urbana que asistían a consulta de reumatología del Hospital Simón Bolívar de Bogotá, Colombia, desde junio del 2015 hasta noviembre de l 2016. Se incluyeron pacientes adultos con AR que cumplían los criterios del ACR de 198720 o del ACR/EULAR del 201021 y con disposición a realizar las escalas como parte de su valoración en la consulta. Se excluyeron los pacientes analfabetos o que tuviesen imposibilidad de leer las tarjetas por razones neurológicas, visuales o de discapacidad. Como había anotado en el Word, esta frase requiere revisión pues no se entiende.
Las escalas se usaron impresas, de 8 × 21 cm cada una. Todas siguen las recomendaciones para los instrumentos compuestos, como los usados en ensayos clínicos (línea horizontal, extremo izquierdo no actividad, extremo derecho la mayor actividad)18,19, excepto la tarjeta 4 que se modificó en un esquema vertical, siendo el extremo inferior sin actividad y el extremo superior como la mayor actividad. La tarjeta 1 (fig. 1) representa la EVA empleada y recomendada para la realización del DAS2,22, en tanto que la tarjeta 2 (fig. 2) representa la escala de dolor con rostros de la International Association for the Study of Pain (IASP)23,24. La escala propuesta, denominada escala compuesta, tiene dos versiones: la tarjeta 3 (fig. 3), que es una escala visual con números en extremos y con 11 iconos de rostros, distribuidos de manera suficiente y proporcionada para que el paciente pudiera indicar con su dedo el grado en que se encontraba, y con fondo transparente, a color, con progresión de verde a rojo; y la tarjeta 4 (fig. 4), que tiene el mismo modelo de la tarjeta 3, pero se presenta de manera vertical. En las tarjetas 3 y 4 los iconos y colores utilizados fueron desarrollo propio, utilizando para ello el programa Corel Draw®. El número de las tarjetas se usó exclusivamente para su identificación.
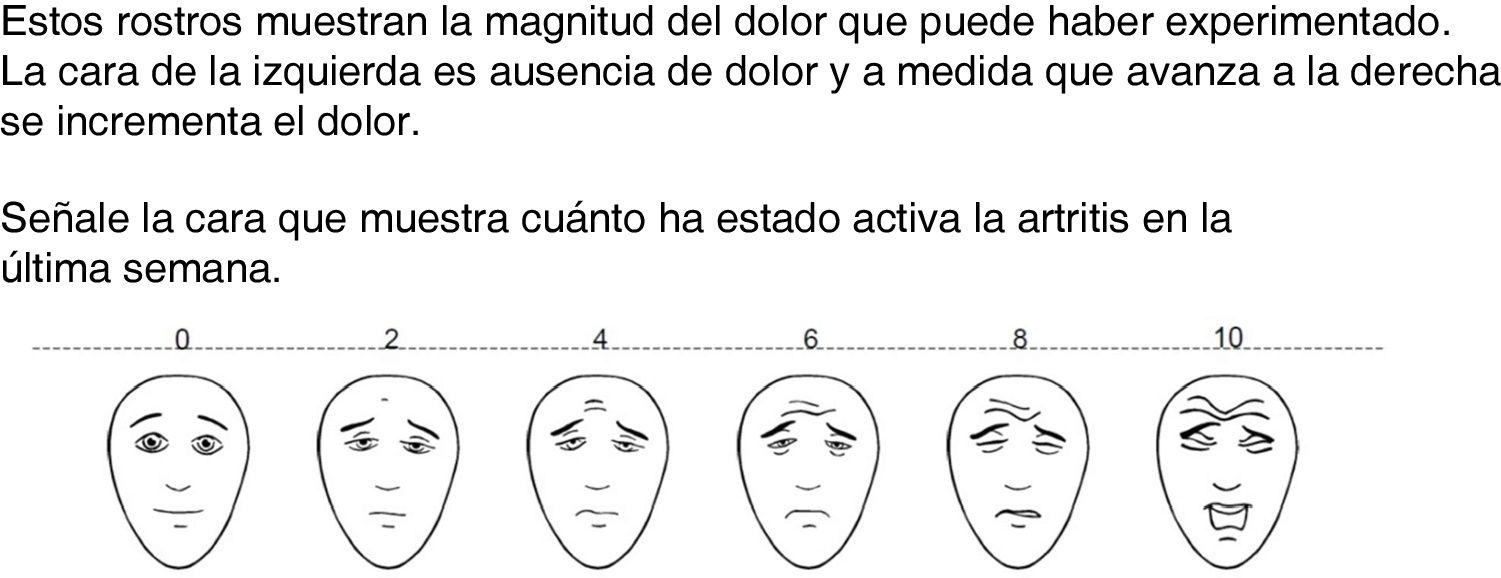
Escala de rostros de la Asociación Internacional para el Estudio del Dolor. Estos rostros muestran la magnitud del dolor que puede haber experimentado. La cara de la izquierda es ausencia de dolor y a medida que avanza a la derecha se incrementa el dolor.
Señale la cara que muestra cuánto ha estado activa la artritis en la última semana.
La intención del estudio fue aplicar las escalas a los pacientes para determinar la frecuencia de compresión y obtener un valor útil en la valoración clínica. Además, la preferencia de una de estas escalas, de ser posible. Adicionalmente, se buscó estudiar la correlación entre las escalas.
Se consideró que un paciente no había entendido la escala cuando este mismo lo expresara o cuando se notara la imposibilidad de obtener un resultado de utilidad clínica en la valoración de su enfermedad.
El protocolo se sometió al comité de ética de la Facultad de Medicina de la Universidad Nacional de Colombia; dicho comité dio la aprobación para su desarrollo.
Prueba pilotoSe realizó una prueba piloto en 20 pacientes empleando las cuatro tarjetas y escalas descritas. Se determinó la aplicación de las escalas de manera autoadministrada y aleatoria; los pacientes siguieron las instrucciones descritas en cada tarjeta.
Análisis estadísticoLos datos se recopilaron en STATA® 13.0 y las variables cuantitativas se analizaron con medidas de tendencia central y dispersión, según su distribución estadística. Por otro lado, las variables cualitativas se presentaron en forma de proporciones, números absolutos y porcentajes.
Para evaluar la correlación entre las diferentes escalas se utilizó el coeficiente de correlación de Pearson. A fin de analizar la reproducibilidad relacionada con el tiempo, se evaluó un grupo de 30 pacientes con AR que completó las cuatro escalas en dos observaciones separadas de 48 horas (prueba de test re-test), lo cual se determinó con la prueba de coeficiente de correlación intraclase. Se llevó a cabo análisis univariado y multivariado con regresión logística multinomial de modelo asociativo para determinar la influencia de las variables con respecto a la preferencia de las escalas. La variable dependiente se tomó como la preferencia por un tipo de escala, en tanto que la variable independiente fue la edad, y las covariables que se planeó incluir fueron sexo, escolaridad y años de duración de la AR. Se hizo el análisis bivariado a fin de observar significación estadística, para luego considerar el análisis multivariado paso a paso. Todas las variables obtenidas con una p < 0,05 se consideraron estadísticamente significativas. El tamaño muestral se calculó asumiendo que hay una diferencia entre los que prefieren una escala a otra de 10%, con un alfa de 5% y un poder del 80%, lo cual dio un tamaño muestral de 158 pacientes.
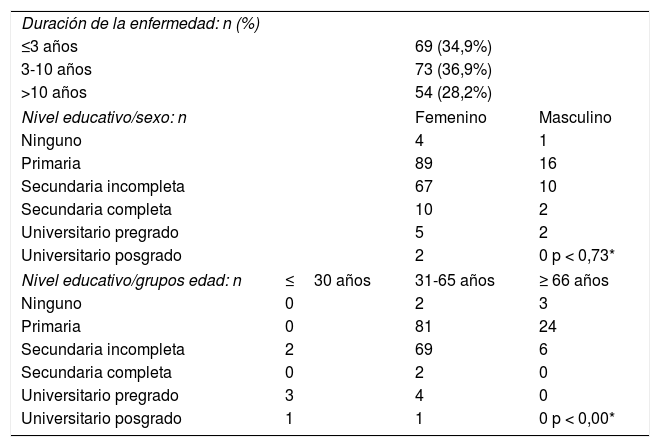
ResultadosSe incluyeron 198 pacientes adultos, con edad media de 54,2 años (desviación estándar, DE = 12,1), 169 mujeres (85,3%) y 29 hombres (14,5%). La mediana de la duración de la enfermedad fue de seis años (rango intercuartílico, RIQ = 10). El nivel de escolaridad se distribuyó así: 105 pacientes con básica primaria (53%), 77 con secundaria incompleta (38,8%), 7 con nivel universitario de pregrado (3,5%), 5 sin escolaridad (2,5%), 2 con secundaria completa (1%) y 2 con posgrado (p < 0,00). La mediana de las articulaciones inflamadas fue de 7,0 para cada paciente (RIQ = 8) y la de articulaciones dolorosas fue de 6,0 para cada paciente (RIQ = 10). La mediana de la escala DAS 28 de los pacientes fue de 3,26 (RIQ = 5), distribuida así: 63 pacientes en remisión (31,8%), 17 con actividad leve (8,5%), 73 con actividad moderada (36,8%) y 45 con actividad alta (22,7%). Los reactantes de fase aguda obtenidos, como proteína C reactiva (PCR mg/L) y velocidad de sedimentación globular (VSG mm/h), tuvieron medianas de 12,0 (RIQ = 22) y 16,0 (RIQ = 28), respectivamente. El nivel de escolaridad según los años evolución de la AR no mostró diferencias estadísticamente significativas (p < 0,43, prueba de Fisher). En la tabla 1 se pueden apreciar otras características.
Otras características de la población con artritis reumatoide
| Duración de la enfermedad: n (%) | |||
| ≤3 años | 69 (34,9%) | ||
| 3-10 años | 73 (36,9%) | ||
| >10 años | 54 (28,2%) | ||
| Nivel educativo/sexo: n | Femenino | Masculino | |
| Ninguno | 4 | 1 | |
| Primaria | 89 | 16 | |
| Secundaria incompleta | 67 | 10 | |
| Secundaria completa | 10 | 2 | |
| Universitario pregrado | 5 | 2 | |
| Universitario posgrado | 2 | 0 p < 0,73* | |
| Nivel educativo/grupos edad: n | ≤30 años | 31-65 años | ≥ 66 años |
| Ninguno | 0 | 2 | 3 |
| Primaria | 0 | 81 | 24 |
| Secundaria incompleta | 2 | 69 | 6 |
| Secundaria completa | 0 | 2 | 0 |
| Universitario pregrado | 3 | 4 | 0 |
| Universitario posgrado | 1 | 1 | 0 p < 0,00* |
La prueba piloto se llevó a cabo satisfactoriamente; no se realizaron ajustes posteriores a su realización.
Con respecto a la medición de la PGA, se analizó la compresión de las diferentes escalas y se obtuvieron los siguientes resultados: la escala 1 la entendieron 80 pacientes (40,4%); la escala 2 la entendieron 188 pacientes (94,9%); la escala 3 fue entendida por 184 pacientes (92,9%); y la escala 4 fue comprendida por 186 pacientes (93,9%) (tabla 2).
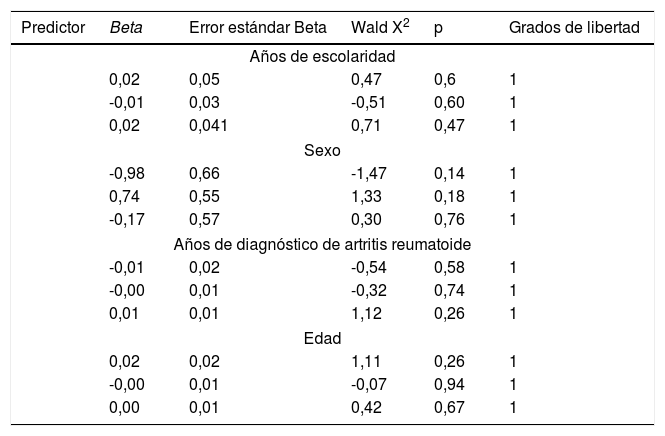
El análisis de preferencia de las diferentes escalas se presenta en la figura 5. En el análisis bivariado con nivel de escolaridad, sexo, años de AR, por grupos de edad, duración de la enfermedad según los años evolución, estas variables no influyeron en la preferencia de las escalas y tampoco en el análisis multivariado de la regresión logística multinomial (tabla 3).
Análisis de regresión logística multinomial bivariante. Variable dependiente: preferencia de la escala (se tomó la categoría 2 como base de comparación), n = 198
| Predictor | Beta | Error estándar Beta | Wald X2 | p | Grados de libertad |
|---|---|---|---|---|---|
| Años de escolaridad | |||||
| 0,02 | 0,05 | 0,47 | 0,6 | 1 | |
| -0,01 | 0,03 | -0,51 | 0,60 | 1 | |
| 0,02 | 0,041 | 0,71 | 0,47 | 1 | |
| Sexo | |||||
| -0,98 | 0,66 | -1,47 | 0,14 | 1 | |
| 0,74 | 0,55 | 1,33 | 0,18 | 1 | |
| -0,17 | 0,57 | 0,30 | 0,76 | 1 | |
| Años de diagnóstico de artritis reumatoide | |||||
| -0,01 | 0,02 | -0,54 | 0,58 | 1 | |
| -0,00 | 0,01 | -0,32 | 0,74 | 1 | |
| 0,01 | 0,01 | 1,12 | 0,26 | 1 | |
| Edad | |||||
| 0,02 | 0,02 | 1,11 | 0,26 | 1 | |
| -0,00 | 0,01 | -0,07 | 0,94 | 1 | |
| 0,00 | 0,01 | 0,42 | 0,67 | 1 | |
Se encontró una buena correlación entre las escalas 2, 3 y 4, que también mostraron una aceptable reproducibilidad (CCI: > 0,5). No fue posible analizar la escala 1 porque la mayoría de los pacientes no la entendieron (tabla 4).
Correlación y reproducibilidad de las escalas. CCI: coeficiente correlación intraclase: Pearson
La PGA presenta inconvenientes en su evaluación, algunas de sus escalas son de difícil comprensión y aplicabilidad. En nuestro estudio encontramos que una mayoría de los pacientes entendió la escala de rostros y la EC en sus dos versiones, de manera significativa (> 90%), contrariamente a lo que se presenta con la EVA. Casi la totalidad prefiere la escala de rostros y la EC en sus dos versiones, lo que contrasta con que solo el 5% prefiere la EVA. Clark et al.25 evaluaron la preferencia entre la EVA y la escala verbal (EV) en 113 pacientes, el 85% con AR, y encontraron que la EV fue la preferida por la mayoría de ellos. La principal razón fue la facilidad para entender y expresar su dolor a través de palabras, en lugar de números. En el estudio también se describe que los pacientes con menor nivel de escolaridad prefirieron la escala verbal a la EVA (65,1% vs. 15,7%, respectivamente). Joyce et al.26 compararon la EVA y una escala visual de cuatro intervalos fijos de números (EFN) en 74 pacientes con dolor crónico y la mayoría de ellos prefirió esta última por ser más comprensible, más exacta y con una mejor indicación de cómo era su dolor. Van Tubergen et al.27, que trabajaron con un grupo de 536 pacientes con espondilitis anquilosante, encontraron que la mayoría (87%) prefería la escala numérica o tipo Likert, comparada con la EVA, para responder los cuestionarios de clinimetría.
En nuestro estudio, los niveles de escolaridad más frecuentes fueron primaria y secundaria incompleta; sin embargo, el análisis univariado y multivariado de las variables (grupos de edad, años de AR, sexo, nivel de escolaridad) no demostraron asociación con la selección de las diferentes escalas, en contraste con el estudio de Clark et al.25.
Nuestro estudio cuenta con varias ventajas: una muestra relevante, en comparación con estudios previos con similar objetivo; fue exclusivo de pacientes con AR; se valoraron cuatro tipos de escalas; no hubo diferencias en la distribución de los años de evolución de la enfermedad; y se enfocó en la evaluación de la PGA, contrariamente a los demás estudios con desenlaces similares, en los cuales el dolor es la principal variable objeto de evaluación25-30.
En nuestro estudio se confirmó la correlación y la reproducibilidad de la escala de rostros, la EC versiones horizontal y vertical para evaluar la PGA en pacientes con AR, hallazgo replicado en investigaciones anteriores25,30-32. Lo anterior confirma que estas técnicas son útiles en la práctica clínica y que para nuestros pacientes son mejores que la EVA, recomendada por los grupos desarrolladores del DAS19.
A manera de conclusión, consideramos que la escala de rostros y las escalas propuestas demostraron ser válidas y reproducibles; la mayoría de nuestros pacientes no entendió la EVA, pero sí entendió y prefirió la escala de rostros y escalas propuestas; ninguna variable predijo su selección y podrían ser útiles en la práctica clínica de los pacientes con AR.
LimitacionesEn nuestro estudio no se analizó la validez y la reproducibilidad de la escala visual análoga, debido a su poca comprensión por los sujetos evaluados. No hubo disposición completa de los valores de la proteína C reactiva y velocidad de sedimentación globular, lo cual no llegó a influir en el logro de los objetivos propuestos.
FinanciaciónEl proyecto fue financiado por la Asociación Colombiana de Reumatología.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.