Se presenta el caso de una paciente adulta con diagnóstico de interstitial pneumonia with autoinmune features (IPAF) basado en dominios serológico y morfológico, según el consenso diagnóstico, en quien se destaca la positividad adicional de un autoanticuerpo no considerado hasta el momento dentro del dominio serológico como lo es el anticuerpo anticitoplasma de neutrófilos (ANCA)-C. La paciente tuvo falla en múltiples tratamientos. En la literatura médica hay un creciente interés por definir la utilidad de incluir los ANCA como autoanticuerpos útiles en el diagnóstico de IPAF. Este es el primer caso reportado en Colombia.
We present the case of an adult female patient with a diagnosis of interstitial pneumonia with autoimmune features (IPAF) based on serological and morphological domains according to the diagnostic consensus, in whom the additional positivity of an autoantibody not considered until now within the serological domain is highlighted, namely antineutrophil cytoplasmic antibodies (ANCA)-C. The patient failed multiple treatments. In the medical literature, there is growing interest in defining the usefulness of including ANCA as a significant autoantibody in the diagnosis of IPAF. This is the first case reported in Colombia.
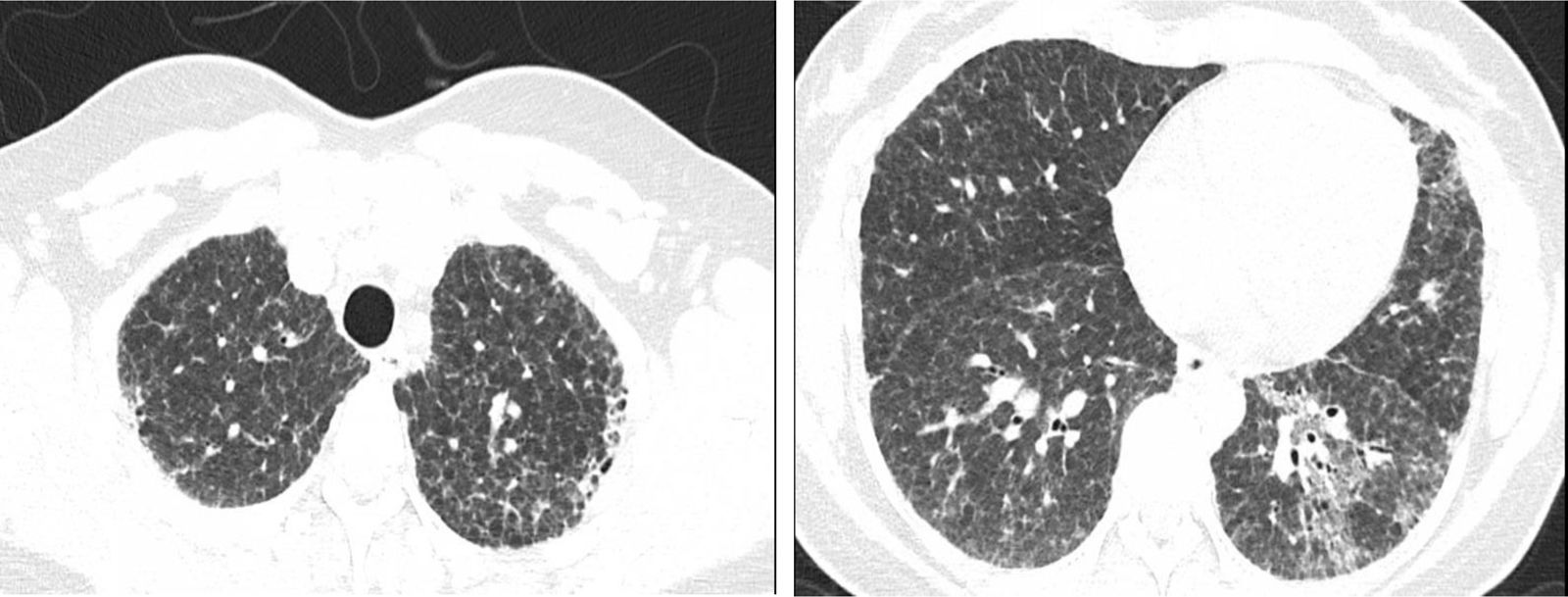
Mujer de 44 años derivada a reumatología (desde neumología) por dos años de tos con esputo blanquecino y disnea de esfuerzo progresiva (2/4 mMRC [modified Medical Council Research] al momento de la valoración reumatológica). Luego de descartarse otras causas de enfermedades pulmonares intersticiales (EPI) idiopáticas, la paciente es remitida desde neumología con diagnóstico de interstitial pneumonia with autoinmune features (IPAF) (dominio clínico: no presenta; dominio serológico: anticuerpos antinucleares [ANA] 1:80 patrón AC-4; dominio morfológico: patrón tomográfico intersticial no clasificable [fig. 1]). La paciente presentaba criobiopsia transbronquial con neumonía organizativa. Mediante estudios de lavado broncoalveolar (tinciones de Gram, ZN, tinta china, KOH, cultivos para gérmenes comunes y Mycobacterium tuberculosis, y reacción en cadena de polimerasa para M.tuberculosis), se descartaron infecciones, así como sangrado y malignidad por citología.
Tomografía de tórax de alta resolución de la paciente con hallazgos de enfermedad intersticial pulmonar (patrón de neumonía intersticial usual no clasificable). Distribución difusa de opacidades reticulares sin gradiente ápico-basal, micronódulos aleatorios en lóbulos superiores y bronquiolectasias.
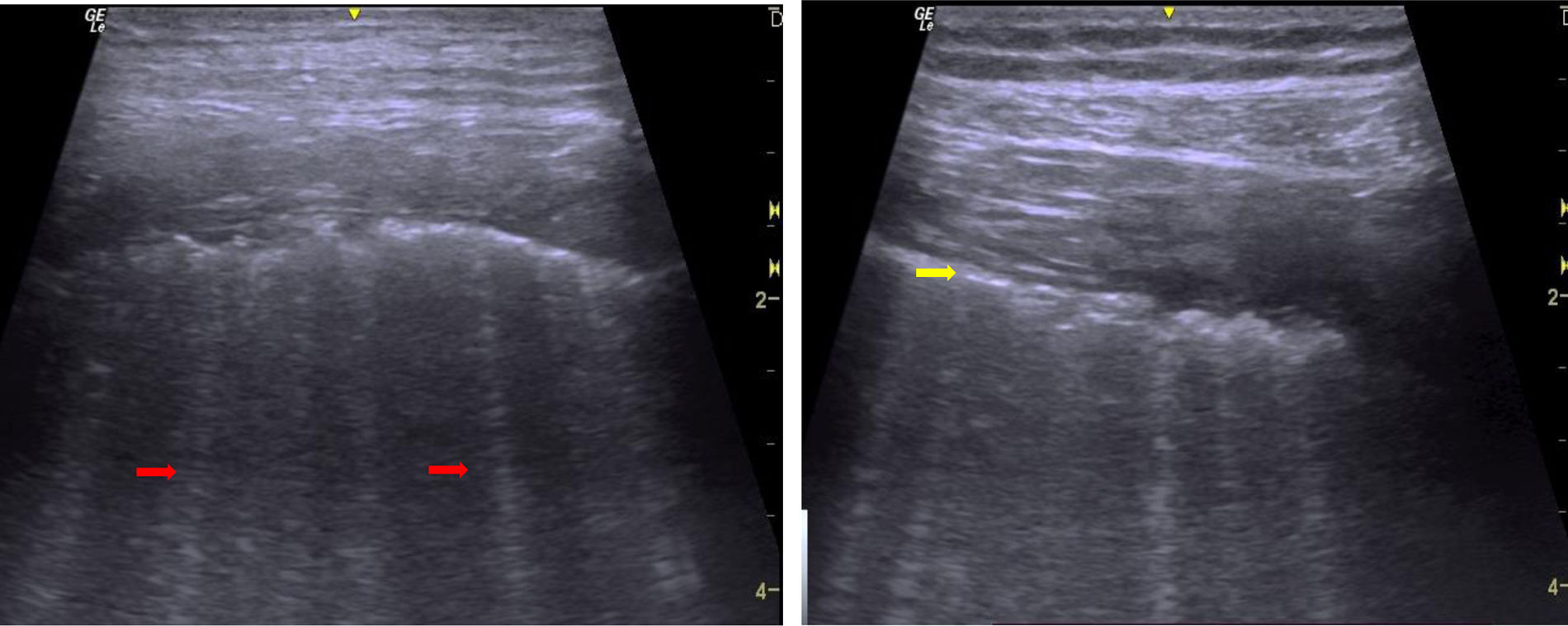
Como antecedentes presentaba hipotiroidismo tratado con levotiroxina. Negaba antecedentes ocupacionales o exposicionales. A la revisión por sistemas, negó ortopnea, disnea paroxística nocturna, edemas, dolor torácico, ronquidos nocturnos, fiebre, fenómeno de Raynaud, sangrados, alopecia, fotosensibilidad, úlceras, debilidad muscular, síntomas secos, artralgias y rigidez matinal. Al examen físico presentaba estertores pulmonares bilaterales finos (no tenía lesiones cutáneas, hipocratismo digital o anormalidades en signos vitales), y en ultrasonografía pulmonar presentó pleura granular y líneasB (fig. 2).
Los estudios de autoinmunidad se describen en la tabla 1. Como pruebas de función pulmonar (PFP) tenía: espirometría, con fecha 23 de diciembre de 2021, con capacidad vital forzada (CVF) del 74%, y volumen espiratorio forzado en 1 segundo (VEF1) del 83%. Control del 9 de noviembre de 2022 con CVF: 53%, y VEF1: 63%. Capacidad de difusión de CO (diffusing capacity of lungs for carbon dioxide [DLCO]) ajustada a volumen alveolar del 23 de diciembre de 2021 del 72%, y del 9 de noviembre de 2022 del 49%. Hasta el momento había recibido 6 meses de prednisolona 1mg/kg/día y azatioprina 50mg cada 12horas, sin mejoría sintomática.
Perfil de estudios de autoinmunidad de la paciente
| Estudios de autoinmunidad | |
|---|---|
| Positivos | Negativos |
| ANA: 1:80 patrón nuclear granular fino (AC-4)Anticuerpos anticitoplasma de neutrófilos × inmunofluorescencia indirecta: patrón citoplasmático (ANCA-C) en 1:40 diluciones | Factor reumatoide, antipéptido cíclico citrulinado |
| Anti MPO, anti-PR3 (método ELISA) | |
| Anti-Ro, anti-La, anti-RNP, anti-Sm | |
| Anti-DNA de doble cadena | |
| Anti-Scl70 | |
| Panel específico para miositis (16 anticuerpos: Mi2α, Mi2β, TIF1γ, MDA5, NXP2, SAE1, Ku, PM/Scl75, PM/Scl75, Jo1, SRP, PL7, PL12, EJ, OJ, Ro52) | |
Reumatología consideró que la paciente tenía IPAF, sin vasculitis ANCA, pues no había evidencia de vasculitis de pequeño o mediano vaso, y solo presentaba ANCA-C1: 40 diluciones como manifestación de dichas vasculitis. Venía con CVF y DLCO con detrimento progresivo y disnea sin mejoría, a pesar del tratamiento con esteroide y azatioprina. Se presentó ante un equipo multidisciplinario (reumatología-neumología-patología-radiología), donde se replanteó la criobiopsia como neumonía intersticial no específica-fase fibrótica con inflamación aguda (fig. 3) + bronquiolectasias.
Imágenes histopatológicas de la paciente con hallazgo de neumonía intersticial no específica. Representación del parénquima pulmonar con engrosamiento homogéneo de septos interalveolares sin distorsión de la arquitectura, y con ligero infiltrado inflamatorio linfoplasmocitario. En las fotografías de microscopia proveídas por patología no está representado el componente fibrótico que se evidenció en otras áreas del tejido de estudio.
Por deterioro progresivo de PFP y disnea persistente, se ordenó ciclofosfamida (CYC) 0,75g/m2 de superficie corporal intravenosa mensual. En control tras la tercera dosis de CYC, hubo incremento de disnea (3/4mMRC), CVF 50% y DLCO-VA 47%. Por lo anterior, y ante el empeoramiento de su EPI, sin mejoría con esteroides, azatioprina, CYC y rehabilitación pulmonar, se indicó nintedanib 150mg cada 12horas. La paciente desarrolló diarrea como efecto secundario, por lo que se redujo a 100mg cada 12horas con mejor tolerancia. Después de 3meses de nintedanib, la paciente no presentó mejoría de la disnea, razón por la cual, multidisciplinariamente, se derivó a la junta de trasplante pulmonar.
DiscusiónLa IPAF es un concepto relativamente reciente con áreas de discusión1. En este caso particular se resalta la selección de autoanticuerpos en los criterios clasificatorios de IPAF, pues se tuvieron en cuenta solo algunos, que no representan todos los implicados en la patología inmunomediada de la EPI2-4. Ejemplo de lo anterior es el presente caso de IPAF, ya que la paciente presentaba ANA (incluidos en dominio serológico) y ANCA-C (no incluidos en dicho dominio). Esto trae a discusión el papel que puedan tener los ANCA en la IPAF, ya que su presencia en los pacientes con vasculitis se relaciona con mayor probabilidad de afectación pulmonar intersticial (principalmente en forma de neumonía intersticial usual). Adicionalmente, es necesario hacer precisiones sobre la relación ANA-ANCA5-8:
- •
Está descrita la probable interferencia de ANA en la medición de ANCA, pero en la forma de ANCA-P no de ANCA-C (patrón que presentaba la paciente).
- •
Los ANCA como falsos positivos en pacientes con ANA suelen darse asociados a otros autoanticuerpos específicos: antiSM, antiRNP o antiDNA, los cuales resultaron negativos en la paciente del caso.
- •
Se ha descrito presencia de ANA y otros anticuerpos como antiDNA en sujetos con vasculitis ANCA con frecuencias de hasta 50% para ANA, pero principalmente en casos de vasculitis ANCA-P/MPO.
La EPI puede iniciarse temprano, en promedio 2,2años antes del diagnóstico formal de una vasculitis ANCA, y puede verse con mayor frecuencia en pacientes mayores de 60años y con anti-MPO9-11. No se encuentra descrito en lo revisado si existen puntos de corte de títulos de ANCA para considerar un mayor o menor riesgo de EPI.
Los sueros de pacientes con ANCA-C reaccionan contra la proteinasa-3 (PR-3) en el 80-90% de casos, pudiendo también reaccionar contra otros antígenos como la MPO, elastasa, proteína catiónica 57 o catepsinaG en el 10-20% restantes de sueros. Los sueros ANCA-P suelen reaccionar contra MPO en el 40-70% de los casos; el resto reaccionan contra la elastasa, la catepsinaG, la azurocidina, la lactoferrina o la lisozima12. Se destaca que la paciente, a pesar de la positividad para ANCA-C, en su seguimiento no ha tenido ninguna manifestación vasculítica que permitiera clasificarla como tal.
La prevalencia de EPI en vasculitis ANCA se ha descrito con rangos entre 2,7% (Europa) y 39,1% (Asia), situación que puede reflejar diferencias étnicas o en la búsqueda de la enfermedad13,14. Paralelamente, también se ha descrito que sujetos inicialmente considerados con fibrosis pulmonar han desarrollado luego vasculitis ANCA, lo cual pudiera reforzar la teoría de que la EPI puede ser una manifestación infrecuente, precoz y aislada de actividad vasculítica limitada a pulmón15. La presentación de EPI y ANCA (sin diagnóstico de vasculitis) se encuentra en la literatura como reportes escasos16-18.
La importancia de una adecuada interpretación de los ANCA en la EPI radica en que, una vez se instaura el cuadro completo (26% de los casos con vasculitis ANCA desarrollan EPI), se sabe que: a)la mortalidad puede ser de hasta el 22% para los ANCA-C positivos y del 16% para los ANCA-P positivos; b)los ANCA-C y anti-MPO suelen tener fenotipo fibrosante progresivo, y c)los ANCA-P se relacionan más con fenotipos inflamatorio y fibrosante progresivo19. Dada la relevancia de los ANCA en la EPI, puede ser meritoria su consideración en los criterios de IPAF, así como en el seguimiento de estos pacientes por la posibilidad de evolucionar hacia una vasculitis. También es destacable la utilidad de la ultrasonografía pulmonar para el diagnóstico de IPAF y otras EPI, al ser práctica, reproducible, de bajo costo y baja exposición radiactiva, como también la utilidad de los equipos multidisciplinarios que se consolidan como estándar de oro para el manejo integral de las EPI20-22.
ConclusiónSe aporta información a la creciente data sobre la relación entre ANCA (sin diagnóstico de vasculitis) e IPAF, situación que debe profundizarse ante la probable necesidad de incluir los ANCA dentro del dominio serológico de IPAF, debido a su asociación con progresión a vasculitis en este tipo de pacientes.
FinanciaciónLos autores declaran que la elaboración del presente reporte de caso fue financiada con recursos propios de los autores.
Consideraciones éticasEste informe de caso cuenta con el respectivo consentimiento informado por parte del paciente para el manejo de la información clínica y la publicación respectiva, respetando la confidencialidad y el anonimato de sus datos. Se ha considerado que, al ser un informe de caso médico, requiere concepto por un comité de ética en investigación en salud (ver anexo al final del presente documento), una vez que se obtiene la firma del consentimiento informado directamente del paciente. Este informe no contiene información o imágenes personales que permitan identificar al paciente del caso.
Conflicto de interesesLos autores del presente reporte de caso declaran que no presentan conflicto de intereses para la publicación del documento.