La sarcoidosis es una enfermedad multisistémica de causa desconocida, secundaria a una reacción inmunitaria determinada genéticamente y desencadenada por factores ambientales, que conlleva la formación de granulomas no caseosos. El compromiso ocular es el segundo más frecuente después del pulmonar. El hallazgo más común es la uveítis granulomatosa anterior; también se puede evidenciar uveítis posterior, periflebitis retiniana, coriorretinitis, conjuntivitis, escleritis y neuritis óptica. Describimos el caso de una paciente pediátrica con una enfermedad de compromiso multisistémico de larga data, en quien la demostración de granulomas no caseificantes en la biopsia conjuntival permitió establecer el diagnóstico presuntivo de sarcoidosis.
Sarcoidosis is a multisystemic disease of unknown cause, secondary to a genetically determined immune reaction triggered by environmental factors, which leads to the formation of non-caseating granulomas. Ocular involvement is the second most frequent after pulmonary involvement. The most common finding is anterior granulomatous uveitis, but posterior uveitis, retinal peri-phlebitis, chorioretinitis, conjunctivitis, scleritis and optic neuritis can also be seen. We describe the case of a paediatric patient with long-standing multisystem involvement disease, in whom the demonstration of non-caseating granulomas in the conjunctival biopsy allowed a presumptive diagnosis of sarcoidosis.
La sarcoidosis es una enfermedad multisistémica de causa desconocida, al parecer secundaria a una reacción inmunitaria determinada genéticamente y desencadenada por factores ambientales, que conlleva la formación de granulomas no caseosos en cualquier tejido, principalmente en pulmón, ganglios linfáticos intratorácicos, piel, glándulas parótidas y ojos1. Según diversos estudios, la prevalencia es mayor en adultos que en niños y predomina en la raza afroamericana y en el sexo femenino2–4.
El compromiso ocular es el segundo más frecuente después del pulmonar5,6; ocurre aproximadamente en el 30 a 60%7,8 de los casos. Puede ser la primera manifestación hasta en el 20%9 de los pacientes. El hallazgo más frecuente es la uveítis anterior granulomatosa, sin embargo, también se puede evidenciar uveítis posterior, periflebitis retiniana, coriorretinitis10, conjuntivitis, queratoconjuntivitis sicca, escleritis y neuritis óptica, lo que configura un reto diagnóstico por las múltiples entidades que pueden cursar con estos hallazgos, como son la tuberculosis, la sífilis y el linfoma intraocular11.
En la conjuntiva la manifestación más típica son los nódulos, los cuales aparecen en el 7 al 17% de la sarcoidosis ocular12. Clínicamente, se observa como nódulos amarillentos de tamaño variable que pueden ubicarse en el fondo de saco inferior o en la superficie posterior del párpado inferior1. A continuación, se presenta el caso clínico de una paciente pediátrica cuya biopsia conjuntival cumplió un papel muy importante en su diagnóstico y el posterior manejo.
Caso clínicoSe trata de una paciente femenina de 10 años, de raza mestiza, con antecedente de comunicación interauricular con hipertensión pulmonar secundaria que requirió corrección quirúrgica, quien ingresó a un hospital de alta complejidad por cuadro clínico que inició a los 3 años consistente en síndrome broncoobstructivo e infecciones respiratorias recurrentes, asociado con diarrea crónica y retraso pondoestatural.
Los primeros estudios que se realizaron fueron la radiografía y la TAC de tórax, con compromiso difuso del parénquima y múltiples adenopatías prevasculares, pretraqueales, subcarinales en ventana aortopulmonar, e hiliares bilaterales; tuberculina de 0mm; lavado broncoalveolar con celularidad linfocitaria, sin evidencia de infecciones fúngicas ni micobacterias; y elastasa fecal dentro de rangos de normalidad.
Inicialmente hubo sospecha de fibrosis quística, pero con iontoforesis cuantitativa negativa, hallazgos tomográficos no compatibles, sin insuficiencia pancreática y estudios genéticos ampliados que incluyeron exoma en trío, lo que descarta dicha condición (CFTR sin mutaciones patogénicas), pero reporta mutación causal de inmunodeficiencia 32B (tabla 1).
Reporte de resultados de ayudas diagnósticas realizadas
| Fecha | Ayudas diagnósticas | Resultado |
|---|---|---|
| Febrero del 2015 | TACAR de tórax | Patrón en mosaico de atenuación, bronquiectasia del segmento anterior del lóbulo superior derecho, língula y lóbulo inferior izquierdo, micronódulos de distribución aleatoria inespecíficos |
| Abril del 2015 | Iontoforesis | 37mmol/NaCl |
| Mayo del 2015 | Prueba cutánea de derivado proteico purificado (tuberculina) | 0mm |
| Febrero del 2018 | Iontoforesis por conductividad eléctrica | 104mmol/l |
| Marzo del 2018 | Secuenciación de próxima generación gen CFTR | Negativo para mutaciones patogénicas |
| Abril del 2018 | Iontoforesis | 84mmol/NaCl |
| Octubre del 2018 | Exoma trío (GenCell) | Mutación en heterocigosis compuesta en el gen IRF8 c.602C>T; p.Ala201Val mutación splicing/c.1169_1170delTG; p.Val390Aspfs*79, causal de inmunodeficiencia 32B; no se identificaron mutaciones patogénicas en el gen CFTR |
| Noviembre del 2018 | Broncoscopia con lavado broncoalveolar | Gram, baciloscopias, cultivos para aerobios, KOH, tinta china y cultivo hongos y micobacterias negativos |
| Diciembre del 2018 | Subpoblaciones linfocitarias (lavado broncoalveolar) | Linfocitos totales 26,9%Monocitos CD45/CD14 10/5Relación CD4/CD8 2/9 |
| Enero del 2019 | TAC contrastada de tórax | Múltiples adenopatías prevasculares, pretraqueales, subcarinales en ventana aortopulmonar, e hiliares bilaterales, hipodensas, heterogéneas sin calcificaciones ni necrosis; ambos pulmones con patrón de vidrio esmerilado de distribución en parches, comprometiendo parcialmente los lóbulos superiores de forma bilateral y asimétrica y en menor proporción los lóbulos inferiores. Marcado engrosamiento del intersticio peribroncovascular de forma difusa con engrosamiento de septos inter e intralobulillares |
| Elastasa pancreática en heces | >500μg/g | |
| Enzima convertidora de angiotensina | 85,8U/l | |
| VIH | No reactivo | |
| AgSHB | No reactivo | |
| Marzo del 2019 | Electroforesis de proteínas | Hipergammaglobulinemia policlonal |
| IgG antirubeola | 48,92 | |
| Julio del 2019 | Biopsia de pulmón derecho | Infiltrado linfoide intersticial con presencia de granulomas pobremente conformados |
| Endoscopia vías digestivas altas | Duodenitis activa, linfangiectasia intestinal | |
| Octubre del 2019 | Inmunoglobulinas | IgE 6,58mg/dlIgG 5.194,3mg/dlIgM 162,1mg/dlIgA 53mg/dl |
| Marzo del 2020 | 25-hidroxivitamina D | 11,8ng/ml |
| Alfa-1 antitripsina | 0,42μmol/l | |
| Albúmina | 3,3g/dl | |
| Diciembre del 2020 | ANA | 1:320, patrón moteado, sustrato células HELLP |
| Electroforesis de proteínas | Hipergammaglobulinemia policlonal | |
| Enzima convertidora de angiotensina | 84,8U/l | |
| Calcio en orina 24h | 31mg/24h | |
| Enero del 2021 | ENA | Negativo |
| Endoscopia vías digestivas altas | Esófago nodular, pliegue retropilórico eritematoso, duodeno con aspecto indicativo de linfangiectasiaBiopsia: dentro de límites de normalidad | |
| Colonoscopia | Hiperplasia nodular ileal, eritema en ciegoBiopsia: macrófagos en infiltrado inflamatorio linfoplasmocitario, sin formación de granulomas | |
| Ecografía de tejidos blandos en cuello | Lesión nodular en la región supraclavicular derecha (estación iv), no palpable. Glándulas parótidas de apariencia heterogénea con múltiples áreas hipoecoicas intraparenquimatosas consistentes con probable sialectasia | |
| Biopsia glándula salivar | Dentro de límites normales | |
| Biopsia conjuntiva bulbar superior nasal ojo derecho e izquierdo | Conjuntivitis granulomatosa crónica |
Fuente: autores, a partir de los datos de la historia clínica.
Ante la presencia de adenopatías mediastinales múltiples y alteraciones patológicas del parénquima pulmonar, sin un diagnóstico claro, la paciente fue llevada a staff multidisciplinario, donde se decidió practicar biopsias pulmonares y gastrointestinales para descartar enfermedades granulomatosas como la sarcoidosis.
Asimismo, se realizó biopsia pulmonar derecha videoasistida, con hallazgos que apuntan a infiltrado linfoide intersticial con presencia de granulomas pobremente conformados, como también estudios endoscópicos con aplanamiento de vellosidades e infiltración linfoplasmocitaria importante.
Durante el estudio, a su hermana mayor se le diagnosticó sarcoidosis; la diferencia fue que esta última presentaba hipertrofia de parótidas, xerostomía, poliartralgias sin artritis y síntomas gastrointestinales, estos últimos infrecuentes en la sarcoidosis, por lo cual reumatología no descartaba la presencia de inmunodeficiencia o síndrome de Sjögren como enfermedad primaria.
Se llevaron a cabo nuevos paraclínicos, con el resultado de enzima convertidora de angiotensina elevada, electroforesis de proteínas con hipergammaglobulinemia policlonal (predominio IgG), calciuria en rango normal, 25-hidroxivitamina D bajo, anticuerpos antinucleares positivos, antígenos nucleares extraíbles negativos y biopsia de parótidas sin focos de infiltrado mononuclear, atrofia, fibrosis, depósito de amiloide (con tinción de rutina y con tinción Rojo Congo) ni granulomas (tabla 1).
Debido al agravamiento de sus síntomas respiratorios, ingresó nuevamente en el servicio de urgencias, por lo que reumatología decidió iniciar inmunosupresión urgente, con prednisolona y azatioprina a dosis de 1mg/kg y 1,15mg/kg, respectivamente, y solicitó valoración por oftalmología para evaluar hallazgos compatibles con sarcoidosis ocular.
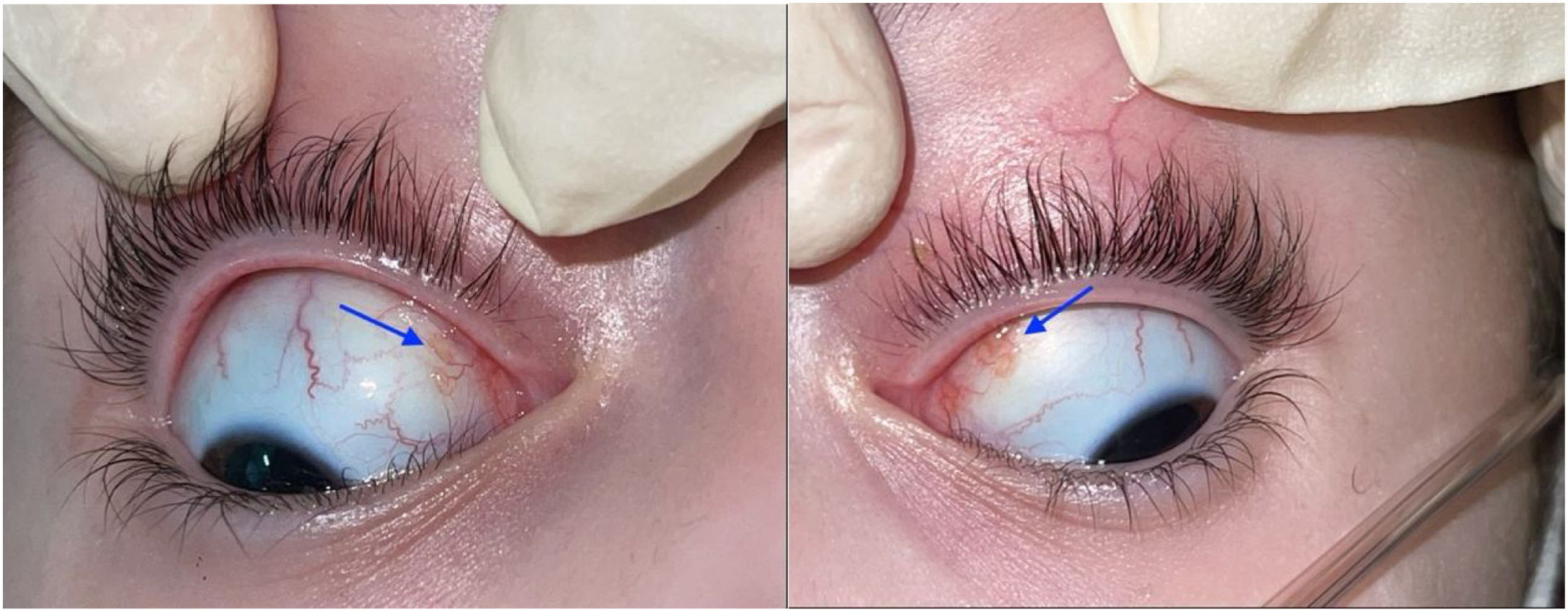
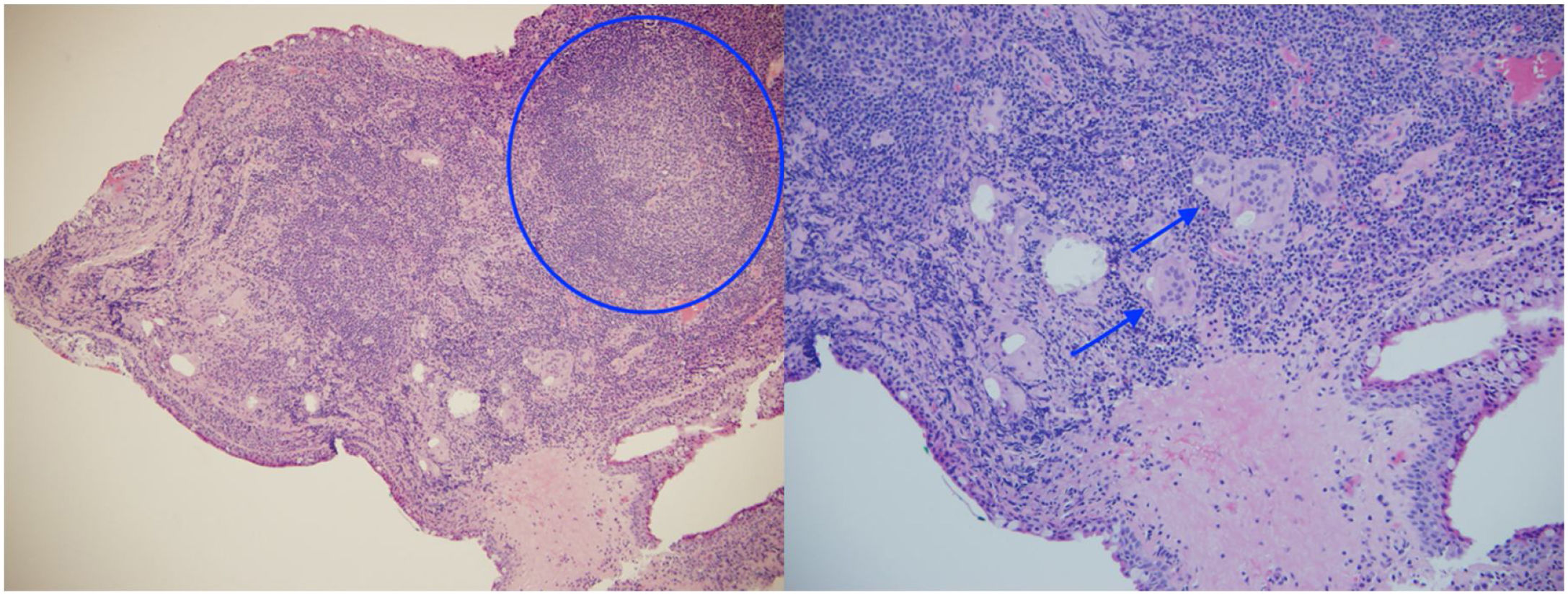
En el examen oftalmológico se encontró agudeza visual 20/25 en ambos ojos y micronódulos en conjuntiva bulbar superior nasal a 7mm del limbo en ambos ojos (fig. 1), además de remanente de membrana pupilar. No se hallaron células en la cámara anterior, precipitados queráticos, flare ni sinequias. Bajo dilatación farmacológica, no se observó vitreítis, en tanto que el nervio y la mácula se encontraron sanos. No se detectaron anormalidades vasculares, media periferia ni lesiones. Ante la ausencia de un diagnóstico confirmado, se decidió tomar biopsia de conjuntiva, la cual reportó conjuntivitis crónica granulomatosa con granulomas no necrosantes ni supurativos (fig. 2).
A pesar de que los hallazgos histopatológicos pulmonares no fueron concluyentes para sarcoidosis, el síndrome clínico, la evidencia de granulomas no caseificantes en la biopsia conjuntival, los niveles altos de enzima convertidora de angiotensina, la hipergammaglobulinemia de presentación temprana y el antecedente familiar de hermana mayor con diagnóstico de sarcoidosis llevaron al diagnóstico presuntivo de sarcoidosis.
Hasta el día de hoy, la paciente continúa en seguimiento multidisciplinario por neumología pediátrica, genética, reumatología, gastroenterología y oftalmología. Después de 10 meses de tratamiento inmunosupresor asociado con gammaglobulina humana, ha tenido una evolución satisfactoria; no tiene lesiones vasculíticas, adenopatías cervicales ni parotidomegalia; solo ha presentado una exacerbación pulmonar por infección por Pseudomonas aeruginosa, sin necesidad de reingresos hospitalarios. En cuanto a lo oftalmológico, continúa sin compromiso intraocular, sin nuevas lesiones en la superficie ocular y sin ningún tipo de tratamiento tópico.
Debido a las manifestaciones atípicas ya mencionadas, está en proceso evaluar el estudio genético de la hermana y de los padres, para comparar posibles variantes genéticas que pudieran explicar la similitud del cuadro clínico en ambas pacientes.
DiscusiónEl diagnóstico de la sarcoidosis sistémica es un importante reto para la medicina, especialmente en el campo de la pediatría, ya que no existen pruebas específicas de ella, sino que se requiere la suma de diversos aspectos que incluyen manifestaciones clínicas, pruebas bioquímicas, hallazgos en imágenes diagnósticas y estudios histopatológicos13.
Presentamos el caso clínico de una paciente femenina, escolar, con enfermedad primaria compleja que inició con compromiso pulmonar y gastrointestinal descrito, en quien se logró descartar fibrosis quística y otras enfermedades granulomatosas, como tuberculosis, sífilis, infecciones fúngicas o infecciones por micobacterias.
Durante el estudio, la presencia de síntomas gastrointestinales (infrecuentes en la enfermedad mencionada) y los hallazgos no concluyentes en la biopsia pulmonar dificultaron el reconocimiento temprano de la sarcoidosis, sin embargo, los hallazgos tomográficos, asociados con los biomarcadores (enzima convertidora de angiotensina elevada, hipergammaglobulinemia y tuberculina negativa en individuo residente en zona endémica de tuberculosis, lo que evidencia anergia asociada a sarcoidosis), y especialmente al resultado histopatológico de la biopsia conjuntival que confirmó la presencia de granulomas no necrosantes, hicieron plantear el diagnóstico probable de la enfermedad en cuestión.
En la población pediátrica el compromiso en la sarcoidosis es más de tipo extrapulmonar, con manifestaciones oculares, cutáneas y reumatológicas14, como es el caso de la paciente. Las lesiones intraoculares más frecuentes son la uveítis, manifestada como iritis, perivasculitis retinal y nódulos en el trabéculo15, y asimismo es común encontrar compromiso en la superficie ocular, principalmente en la conjuntiva y la glándula lagrimal. Se debe tener en cuenta que el impacto visual puede llegar a ser severo, hasta desarrollar ceguera, lo que habitualmente se explica por el edema macular quístico16.
En muchas ocasiones, en la infancia no existe una sintomatología ocular específica. Es ahí donde la búsqueda exhaustiva de signos al examen oftalmológico podrá brindar la información necesaria para establecer un diagnóstico. Es importante realizar una correcta valoración de la superficie ocular, incluyendo la exposición de conjuntiva bulbar y tarsal, en la que se pueden observar lesiones conjuntivales ocultas por los párpados. El compromiso conjuntival se puede observar desde el 6% hasta el 40% de los pacientes con sarcoidosis, principalmente como lesión nodular17, por lo general asintomática. Estas lesiones conjuntivales cobran importancia por ser un sitio de fácil acceso para el estudio histopatológico, que resulta ser una opción muy atractiva para los diferentes estudios anatomopatológicos para confirmar la sarcoidosis18, con un rendimiento diagnóstico que puede variar del 24% al 75%19–21.
La biopsia de conjuntiva se considera un procedimiento seguro, más simple y económico que otros estudios histopatológicos. Los pacientes con biopsia conjuntival positiva podrían ahorrarse un total aproximado de 17 procedimientos, con un costo para el 2012 que oscila en torno a los 843 dólares, en comparación con los 1.774 dólares de una biopsia transbronquial y los 5.447 dólares de una mediastinoscopia con biopsia22. Por lo anterior, desde un análisis de costoefectividad, se podría considerar la biopsia conjuntival como uno de los primeros sitios para toma de muestra histopatológica en los pacientes con sospecha de sarcoidosis.
En la actualidad la sarcoidosis sigue siendo un reto diagnóstico, ya que por su variedad de presentación y compromiso multisistémico puede simular diferentes enfermedades, por lo que suele considerarse un diagnóstico de exclusión. La biopsia de conjuntiva debería clasificarse como un estudio de primera línea, por su fácil acceso, menor invasión, menor morbilidad22 e importante rendimiento diagnóstico ante una sospecha clínica de hasta el 75%21. Debido a ello, es de gran ayuda en casos complejos en los cuales el diagnóstico no es muy claro y se requieren estudios de tejidos para definir la entidad.
FinanciaciónLos autores declaran que no han recibido ningún tipo de financiación ni becas para la realización de este articulo.
Conflicto de interesesLos autores declaran que no tienen conflictos de intereses ni recibieron dinero de ninguna institución. El Hospital Pablo Tobón Uribe ofreció al grupo investigador todo el apoyo logístico necesario para llevar a cabo la recolección de datos, el análisis y la elaboración del artículo de investigación.