El lupus eritematoso sistémico es el prototipo de las enfermedades autoinmunes no órgano-específicas, con un curso fluctuante entre periodos de remisión y crisis. La complejidad de sus mecanismos fisiopatológicos mantiene la necesidad de desarrollar nuevos tópicos de investigación que faciliten su entendimiento y generen potenciales blancos terapéuticos. La vía de señalización Wnt y su principal inhibidor la proteína Dickkopf-1 tienen un rol trascendental en fenómenos biológicos como la homeostasis ósea. Sin embargo, estudios recientes en lupus eritematoso sistémico han permitido reconocer otros procesos extraóseos regulados por la proteína Dickkopf-1. Entre ellos: la preservación de la integridad de las membranas glomerulares a nivel renal, reversión de rasgos de senescencia de células mesenquimales de interés en la optimización de los planes de trasplante como medida terapéutica; y la homeostasis articular. Alrededor de estos resultados han de suscitarse nuevas investigaciones sobre la proteína Dickkopf-1 y lupus eritematoso sistémico, que consoliden la información obtenida dado el gran potencial clínico y terapéutico que implica.
Systemic lupus erythematosus is the prototype of non-organ specific autoimmune diseases, with a fluctuating course between remission and crisis. The complexity of pathophysiological mechanisms opens up the possibility to develop multiple research topics to facilitate their understanding and generate potential therapeutic targets. The Wnt signalling pathway and its main inhibitor, Dickkopf-1 protein, have a major role in biological phenomena, such as bone homeostasis. However, recent studies have enabled other extra-osseous processes regulated by Dickkopf-1 to be recognised. These include: preserving the integrity of kidney glomerular membranes, senescence reversal characteristics of mesenchymal cells of interest in optimising transplantation plans as a therapeutic measure, and joint homeostasis. Some of these results have led to further research into Dickkopf-1 and systemic lupus erythematosus, in order to consolidate the information obtained given the great clinical and therapeutic potential involved.
El lupus eritematoso sistémico (LES) es el prototipo de las enfermedades autoinmunes no órgano-específicas, caracterizado por un proceso inflamatorio crónico, debido principalmente al depósito de complejos inmunes y a la activación del sistema de complemento; lo que se refleja en un curso clínico variable entre períodos de exacerbación y remisión1,2.
El compromiso articular afecta del 50 al 70% de los pacientes con LES, con un espectro clínico de manifestaciones que incluye sinovitis, tenosinovitis, hipertrofia sinovial, capsulitis y artritis erosiva3. Esta última presente en el 2% de los pacientes con artritis por LES4. Paralelo a ello, el compromiso óseo, consecuencia del contexto inflamatorio crónico de la enfermedad, está directamente relacionado con un mayor riesgo de osteoporosis, independiente de los efectos que el tratamiento pueda tener5,6. De acuerdo con lo anterior, cobra interés la caracterización de biomarcadores que faciliten la identificación fisiológica de las vías7, que si bien no permiten un daño tan severo como en la artritis reumatoide (AR) a nivel óseo y articular, sí están relacionadas con un desbalance en el proceso de remodelado del hueso1,8.
Otro de los compromisos más frecuentes, en especial en afrodescendientes e hispanoamericanos, es el renal9, entre ellos está descrito que el 53% de los pacientes con LES colombianos pueden tenerlo10, especialmente con clasificaciones grado III y IV de lesión glomerular, siendo una de las mayores causas de morbimortalidad11. Aunque la aparición de los esteroides en 1950 y posteriormente de la ciclofosfamida y otros elementos farmacológicos cambiaron la historia de la enfermedad12, aún se mantiene activa la búsqueda de herramientas controladoras e incluso curativas; nuevos blancos moleculares y el trasplante de médula ósea son algunas de las propuestas13,14; sin embargo, requieren que se profundice en el entendimiento de la fisiopatología de esta entidad.
La vía de señalización Wingless (Wnt), y uno de sus principales inhibidores, la proteína Dickkopf-1 (DKK1), se han convertido recientemente en objeto de múltiples investigaciones, dadas sus importantes implicaciones en diferentes procesos fisiológicos y patológicos. Como consecuencia de sus acciones sistémicas, especialmente en la organogénesis, angiogénesis, biología del hueso y regulación inmune15,16; se han generado propuestas de blancos terapéuticos que buscan regular la excesiva activación de esta vía de señalización en diferentes tipos de cáncer, osteoporosis, enfermedades neurológicas y trastornos autoinmunes17,18. Con respecto a estos últimos la atención se ha centrado en fibrosis pulmonar por esclerosis sistémica19, AR20,21, espondilitis anquilosante22 y en el compromiso osteoarticular y renal del LES23.
Esta revisión de tema tiene como finalidad la recopilación de información sobre el estado del arte de la expresión de DKK1 en relación con la presentación clínica del LES, en modelos murinos y humanos.
Estrategia de búsquedaPara la presente revisión de tema se evaluaron ensayos clínicos, estudios observacionales, trabajos originales y revisiones de tema, realizados en humanos y modelos animales, publicados en idiomas inglés y español, sin límite en el tiempo de publicación. Se hizo una búsqueda primaria en Pubmed utilizando los términos MeSH: lupus eritematoso sistémico, DKK1, dkk1, proteína dickkopf-1, vía de señalización Wnt (systemic erythematosus lupus, DKK1, dkk1, dickkopf-1 protein, Wnt signaling pathway). Adicionalmente, se realizó una búsqueda secundaria de la literatura con términos libres en relación con el tema de interés del proyecto.
Vía de señalización WntEstudios en modelos murinos con cáncer y retrovirus oncogénicos, permitieron el descubrimiento del gran número de ligandos glicoprotéicos solubles que conforman la familia de moléculas Wnt, que comparten la presencia de múltiples residuos de cisteína24. Son varias las vías de señalización que activan, todas evolutivamente conservadas, que dependen del acople a uno de sus más de 10 receptores conocidos hasta ahora de la familia Frizzled (fz)25. La abreviatura Wnt proviene de la unificación de Wg (Wingless) e Int1 (integration) que fueron los nombres asignados a los genes codificadores de las moléculas Wnt en la mosca Drosophila y en el humano correspondientemente, pero que hacían referencia a un mismo gen26.
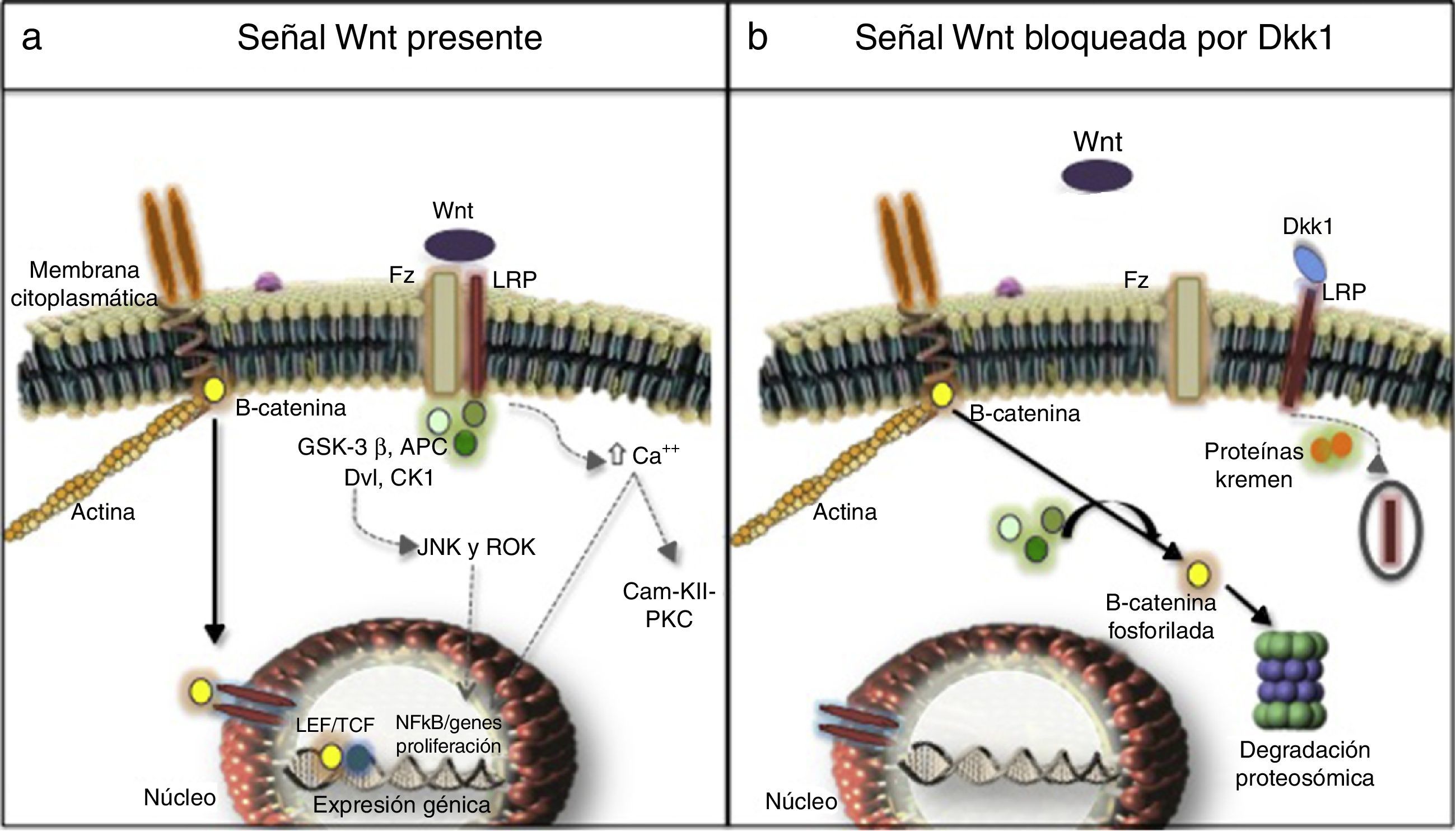
Se han descrito 3 vías de señalización activadas por las moléculas Wnt: la vía canónica o dependiente de β-catenina; la vía no canónica dependiente de calcio y la vía no canónica dependiente de la proteína Disheveled (DVL)27,28 (fig. 1). Resultados de una investigación en modelos murinos (Yu et al., 2015) evidenciaron que algunas moléculas Wnt tienen predilección por la activación de una o varias vías de señalización. Por ejemplo, en dicha investigación se encontró que Wnt4 activó solo la vía no canónica e impidió la translocación de NFκB al núcleo con efectos muy bondadosos en hueso y control de inflamación. En contraste Wnt5 con un efecto dual, fue activador de la vía canónica al interactuar con el receptor Ror2 determinándose como agente proinflamatorio, y también fue activador de la vía no canónica con inducción de osteoclastogénesis29,30.
a) Vía canónica (flecha continua) y no canónica (flechas discontinuas) de señalización. b) Bloqueo mediado por Dkk1. Receptor Freezled (Fz), proteína receptora de lipoproteínas de baja densidad o LDL (LRP), Disheveled (Dvl), glucógeno sintasa cinasa 3β (GSK-3β), poliposis adenomatosa coli (APC), y caseína cinasa 1 (CK1), factores de transcripción como el factor estimulador linfoide (LEF) y de célula T (TCF), proteína cinasa C (PKC), calmodulina cinasa II (Cam-KII), kinasas (JNK, ROK) Dickopff-1 (Dkk1).
Después de secretadas, las moléculas Wnt se unen al receptor Frizled (Fz), lo cual permite la heterodimerización del receptor con la proteína receptora de lipoproteínas de baja densidad o LDL (LRP), desencadenando la cascada de señalización, en la que participan elementos como: DVL, glucógeno sintasa cinasa 3β (GSK-3β), poliposis adenomatosa coli (APC), y caseína cinasa 1 (CK1). En estado de reposo, la β-catenina es fosforilada por la GSK-3β, lo cual permite la formación de un complejo con APC, CK1 y anexina, favoreciendo la marcación mediante ubiquitinación para ser llevada a proteólisis. En cambio, en estado de activación, cuando se encuentran acoplados Wnt y el complejo Fz/lRP, la proteína DVL es activada para inhibir a GSK-3β; lo cual favorece la acumulación de β-catenina en el citoplasma y su translocación al núcleo para interactuar con genes de respuesta específicos, en colaboración con factores de transcripción como el factor estimulador linfoide y de célula T (TCF)23–26. En hueso las células blanco son osteoblastos y osteocitos y el grupo de genes que activan son los que participan en la osteoformación como c-myc, twist, fibronectina, c-jun, axina 2, ctgf, entre otros. Una excesiva regulación negativa de la señalización de la vía Wnt por exceso de DKK1 se ha relacionado con el curso erosivo de la AR27. Recientemente en riñón se encontró hiperactivación de la vía en las células del epitelio tubular con un aumento en la producción de matriz extracelular y fibrosis, a la par de un aumento en la actividad de metaloproteinasas, y por ello, incremento en el remodelado de la matriz extracelular con un efecto deletéreo en la integridad de la membrana31–33.
Vías no canónicasSon vías independientes de β-catenina, una de ellas es la dependiente de calcio: por un lado el anclaje de las moléculas de Wnt provoca la liberación del catión al citoplasma, con la consecuente activación de la proteína cinasa C y de la calmodulina cinasa II (Cam-KII), y por otro: facilita la activación del NFkB con su efecto proinflamatorio. Otra de las vías es la dependiente de DVL que al activarse moviliza GTPasas que estimulan cinasas como JNK y ROK encargadas de regular el crecimiento y proliferación celular, debido a su función organizacional del citoesqueleto23,34.
Regulación de la vía canónica y DKK1Los mecanismos más estudiados son extracelulares mediados por el acople a LRP de ligandos como el DKK1 y esclerostina que impiden la formación del complejo Wnt-Fz/LRP 5/6 e inducen la internalización de LRP en presencia de las proteínas Kremen34. DKK1, codificado por el gen dkk1 en el brazo largo del cromosoma 1035, es codificado por los genes blanco de la vía Wnt activada, es decir, hace parte de un mecanismo de retroalimentación negativa en osteoblastos y osteocitos. Por otro lado, el ensamble de 2 moléculas de Wnt con las proteínas solubles relacionadas con el Fz (sFRP) también puede evitar el anclaje a su receptor de superficie de membrana. Otros inhibidores son: el factor inhibidor del Wnt y Cerberus36. La regulación intracelular con menor información, hasta la fecha, se relaciona con los niveles de DVL, GSK-3β, APC, CK1, axina, y los factores de transcripción nuclear37,38.
DKK1 y compromiso articular por LESLas implicaciones fisiopatológicas de la vía Wnt y uno de sus principales inhibidores el DKK1 en el compromiso articular del LES, nacen en el marco de una gran cantidad de información generada sobre los genes inducidos por interferón (GII), unos de los principales mediadores de la enfermedad que se han planteado como los principales responsables del comportamiento no erosivo39.
Por ejemplo, en la Universidad Católica de Louvain, en Bélgica, (Toukap et al., 2007), analizaron 3 grupos de pacientes: 6 con LES, 7 con AR y 6 con osteoartrosis, quienes tenían en común sinovitis de rodilla y antes de recibir cualquier tipo de tratamiento se sometieron al estudio de esta articulación: líquido y tejido sinovial, y marcadores séricos. De este modo, se encontraron 40 genes incrementados relacionados con los GII, especialmente los del IFI27, IFI44, IFI44L, TLR-2, y STAT 1; y 34 disminuidos relacionados con la homeostasis en la formación de matriz extracelular como el proteoglicano condroitin sulfato 2, la proteína 2 de unión al factor de crecimiento transformante beta (LTBP-2), versican y la proteína de activación fibroblástica alfa (FAP), en comparación con los otros grupos40. Los GII se han etiquetado como un mediador clave en LES, pues una vez los inmunocomplejos son interiorizados en las células dendríticas, especialmente las profesionales, estas activan la transcripción de IFN tipo I que facilita la diferenciación de linfocitos B a células plasmáticas productoras de anticuerpos, la activación de células T y la maduración de más células dendríticas39. Nuevas terapias en investigación, como rontalizum, sifalimumab y α-quinoide tienen como blanco el bloqueo especialmente de interferón-α (INF-α), con lo cual prometen lograr un control adecuado de la enfermedad, sin aumentar el riesgo de deterioro óseo cuya protección depende más de interferón-β (INF-β) por ser 100 veces más potente inhibidor de la osteoclastogénesis, que INF-α41.
En concordancia con lo anterior, en una cohorte de 90 sujetos (Baker LePain et al., 2011): niños y adolescentes, se evidenció una correlación negativa con la resorción ósea y la actividad del LES, y se propuso también al INF-β como un factor protector, al inhibir directamente al c-fos, uno de los segundos mensajeros implicados en la diferenciación de los osteoclastos, lo que deriva en la disminución de la generación de fosfatasa ácida resistente al tartrato (TRAP) necesaria para la resorción ósea42. Aunque lo previo supondría que el LES se constituye como un factor protector contra la osteoporosis, no es así, otros mediadores inflamatorios elevados como el factor de necrosis tumoral, la interleucina 1 y el ligando del receptor activador del factor nuclear kappa B (RANK-L) explican el deterioro en la densidad mineral ósea (DMO) vista en estos pacientes5. Así lo ilustra un estudio (Tang et al., 2013) en el que compararon la DMO de pacientes con LES sin tratamiento con esteroides en los últimos 10 años previos a la valoración y la DMO de pacientes sanos; el primer grupo fue el que tuvo valores más bajos de DMO medida por TAC de alta resolución43.
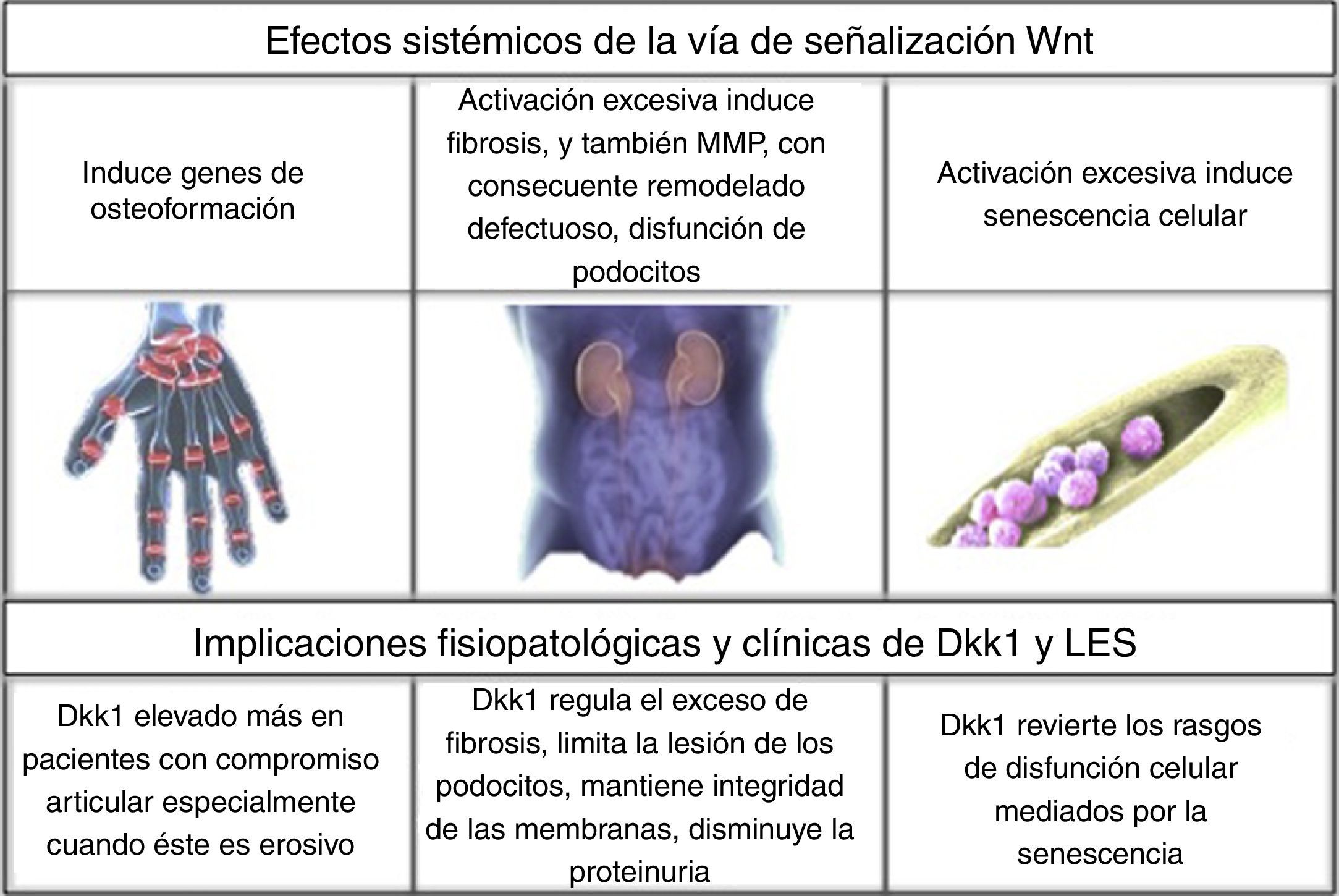
Establecer el vínculo entre los genes inducidos por interferón, la vía de señalización Wnt y su inhibidor DKK1; necesitará la generación de nuevas investigaciones, que permitan ampliar el conocimiento sobre el curso predominantemente no erosivo de la artritis lúpica. Por ahora, la información existente ha estado orientada a determinar la asociación puntual entre DKK1 y LES23 (fig. 2).
En un estudio (Li Long et al., 2010), se configuraron 3 grupos: 130 pacientes con LES, 100 pacientes con AR y 50 sanos, y se encontró que DKK1 estaba elevado 2 a 3 veces más en los pacientes con LES y compromiso articular vs. los que no tenían dicho compromiso o no tenían LES, y especialmente elevado en los pocos con comportamiento erosivo; en este último caso, con valores equiparables a los de pacientes con AR. Además, los niveles de anticuerpos antipéptidos citrulinados (anti-CCP) estuvieron más elevados en pacientes con artritis lúpica vs. aquellos con la enfermedad pero sin artritis. En quienes hubo negatividad para dichos anticuerpos, DKK1 estuvo significativamente elevado; con lo cual se postula que pudiera llegar a ser más sensible que los primeros como marcador pronóstico, propuesta novedosa que requiere estudios adicionales. En esta publicación, no hubo relación entre la actividad de la enfermedad medida por SELENA SLEDAI (por sus siglas en inglés: Safety of Estrogens in Lupus Erythematosus National Assessment - Systemic Lupus Erythematosus Disease Activity Index) y los niveles de DKK144.
DKK1 y compromiso renal por LESNo solo en el compromiso articular se ha evaluado la influencia de DKK1, también en el compromiso renal. En 97 pacientes con LES referidos a un Hospital de Shanghai (Wang X-d et al., 2014) para realización de biopsia renal, se encontró hiperactivación de la vía Wnt en comparación con individuos sanos y con pacientes con algún tipo de tumor renal. Lo anterior se demostró por un aumento en la intensidad de tinción de β-catenina por inmunohistoquímica de glomérulos en las biopsias, niveles elevados por Western blot y por reacción en cadena de la polimerasa con transcriptasa inversa (RT-PCR, del inglés reverse transcription polymerase chain reaction); al igual que incremento de la AXINA-2 y DKK1, que hacen parte de los elementos de respuesta al final de la vía de señalización; y por último, aumento de DKK1 sérico medido por ensayo por inmunoabsorción ligado a enzimas (ELISA, del inglés Enzyme-Linked ImmunoSorbent Assay). Sin embargo, la relación fue inversamente proporcional al grado de fibrosis intersticial, los niveles de anticuerpos antiácido desoxirribonucleico (anti-ADN) y complemento C3; sin correlación con la actividad medida por SLEDAI probablemente por lo inespecífico de su puntuación global. Esto permitió deducir que la hiperactivación Wnt induce una síntesis exponencial de colágeno y proteínas de matriz extracelular que promueven la fibrosis, mientras los niveles de DKK1 elevados pueden tener, en este contexto, un rol protector del deterioro renal al disolver el exceso de depósito matricial45.
Del mismo modo, otro estudio (Dai et al., 2009) en modelo murino demostró que la activación excesiva de la vía Wnt promovía la disfunción de los podocitos por inhibición en la producción de nefrina, con lo cual se aumentó la presencia de proteinuria, mientras el aumento de DKK1 impedía la lesión glomerular en modelos murinos sin lupus46.
En contraste con lo anterior, un estudio (Tveita et al., 2011) en modelos murinos de nefritis lúpica (NZB/NZW), encontró algo diferente, una correlación negativa entre la presencia de DKK1 en células mesangiales y tubulares, y la integridad celular. DKK1 se relacionó con un aumento en factores proapoptóticos como la caspasa 3, mayor generación de residuos antigénicos derivados de la apoptosis y, por ello, un sucesivo aumento en los niveles de anticuerpos anti-ADN47. Una de las postulaciones que explicaría las discrepancias en los hallazgos, podría ser que los efectos opuestos fuesen consecuencia de tipos diferentes de moléculas Wnt; sin embargo, se requerirán más estudios para precisar la información. Conocer el papel que juega el DKK1 en la nefritis lúpica puede abrir las puertas a nuevos blancos terapéuticos para este compromiso de órgano que aún cobra la mayor morbimortalidad en LES48.
DKK1 y médula ósea en LESOtro rol de DKK1 en LES fue dilucidado en un hospital afiliado a la Universidad de Nantong, China (Gu et al., 2014) en relación con células mesenquimales de médula ósea. Son rasgos de senescencia de estas células: la disminución en la proliferación y, por ende, en la división celular, aumento en el tamaño, trastornos en el citoesqueleto; pues bien, en pacientes con LES estos rasgos de senescencia estuvieron marcados a diferencia de los hallazgos en individuos sanos. Ello, explicado por la mayor activación en la vía de señalización Wnt, por el aumento de β-catenina en citoplasma y núcleo, disminución en la GSK-3β, e incremento en la actividad de la β-galactosidasa (marcador de senescencia) y de la vía p53/p21 supresora del ciclo celular, que se propone sea el principal mediador de envejecimiento inducido por dicha hiperactivación. La aplicación de 100ng/ml de DKK1 en las placas de cultivo durante 48 h suprimió todos estos rasgos, y especialmente disminuyó los niveles de elementos de la vía p53/p2149. Dado que el trasplante de médula ósea es una de las herramientas que se encuentra en continua exploración en LES, es clave entender las condiciones celulares al respecto, pues ofrece una explicación a por qué el donante alogénico es la elección y qué factores deberían vigilarse para tener éxito; uno de ellos: la adecuada funcionalidad de DKK1 encargado, en este caso, de la integridad de las células mesenquimales de médula ósea50.
ConclusionesEn la actualidad, el LES sigue siendo un reto para el clínico, por lo tanto es importante en investigación, por la diversidad de sus manifestaciones y lo fluctuante que puede ser su curso; todo ello consecuencia del extenso campo de rutas inmunológicas, genéticas y biológicas que pueden estar alteradas. En pro de encontrar nuevos blancos terapéuticos de la enfermedad que mejoren la calidad de vida de los pacientes y disminuyan notoriamente la morbimortalidad derivada de ella; y con el propósito de postular biomarcadores de diagnóstico y pronóstico más eficientes y precisos, es necesaria la profundización en el estudio de dichas rutas fisiopatológicas. De forma novedosa hallazgos sobre el rol de la vía de señalización Wnt y su principal inhibidor DKK1 incursionan en medio de la información generada en relación con diferentes aspectos moleculares del LES, dando indicios de un notorio papel en el desbalance del remodelado óseo con efectos sobre la integridad de las superficies articulares sinoviales; y un notorio papel en la homeostasis renal. Niveles elevados de DKK1 se han encontrado deletéreos para la preservación osteoarticular; y en contraste protectores a nivel renal por limitación del proceso de fibrosis y de lesión de los podocitos, esto último con algunos resultados ambiguos. En médula ósea también con un efecto protector, DKK1 revierte los rasgos de senescencia de las células mesenquimales, con implicaciones positivas en el trasplante como plan terapéutico. Alrededor de estos resultados habrán de suscitarse nuevos trabajos sobre DKK1, que consoliden la información obtenida, por los beneficios potenciales como biomarcador e incluso como blanco terapéutico.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.