Evaluar la asociación entre los autoanticuerpos con las manifestaciones clínicas (extraglandulares y glandulares) y los hallazgos histopatológicos de la biopsia de glándula salival menor en el síndrome de Sjögren primario (SSp).
Materiales y métodosEstudio observacional, descriptivo, de corte transversal. Se incluyeron 47 pacientes con diagnóstico de síndrome de Sjögren primario por criterios ACR/EULAR 2016. Se hizo una encuesta presencial, así como una revisión de la historia clínica y la medición de los autoanticuerpos anti-Ro 52, anti-Ro 60, anti-La, anticuerpos antinucleares, factor reumatoide IgA, IgG e IgM y anti-alfa-fodrina IgA e IgG. Se hizo la caracterización de la población y el análisis de la asociación entre las características clínicas, los autoanticuerpos y la histopatología.
ResultadosSe encontró asociación de autoanticuerpos anti-alfa-fodrina IgA y anti-Ro 52 con el compromiso pulmonar (p=0,014 y p=0,031, respectivamente) y de los anticuerpos anti-La con manifestaciones hematológicas, específicamente leucopenia (p=0,011), linfopenia (p=0,023) y anemia (p=0,09). No se halló asociación entre los hallazgos histopatológicos de la biopsia de glándula salival menor y las manifestaciones extraglandulares.
ConclusionesLa activación de las células B, que se refleja en una mayor producción de autoanticuerpos, se relaciona con manifestaciones extraglandulares en el síndrome de Sjögren primario, las cuales se observan con mayor frecuencia en pacientes con diagnóstico más temprano.
To evaluate the association between autoantibodies with clinical manifestations (extraglandular and glandular) and histopathological findings of minor salivary gland biopsy in primary Sjögren's syndrome.
Materials and methodsObservational, descriptive, and cross-sectional study. Forty-seven patients with primary Sjögren's syndrome according to the ACR/EULAR 2016 criteria were included. A face-to-face survey, a review of medical records, and the measurement of autoantibodies anti-Ro 52, anti-Ro 60, anti-La, antinuclear antibodies, rheumatoid factor IgA, IgG and IgM, and anti-alpha fodrin IgA and IgG were done. Characterization of the population and analysis of the association between clinical characteristics, autoantibodies, and histopathology were performed.
ResultsAssociation of anti-alpha fodrin IgA and anti-Ro 52 Ab was found with pulmonary involvement (P=.014 and P=.031 respectively) and anti-La antibodies with haematological manifestations, specifically leukopenia (P=.011), lymphopenia (P=.023), and anaemia (P=.09). We found no association between the histopathological findings of the minor salivary gland biopsy and extraglandular manifestations.
ConclusionsThe activation of B cells, reflected in the increased production of autoantibodies, is related to extraglandular manifestations in primary Sjögren's syndrome, which is observed more frequently in patients with earlier diagnosis.
El síndrome de Sjögren (SS) es una enfermedad autoinmune sistémica causada por infiltración linfocítica en las glándulas exocrinas, se asocia con anticuerpos circulantes por hiperactividad de los linfocitos B y se denomina SS primario (SSp) cuando no se presenta concomitantemente con otra enfermedad autoinmune1,2.
En los estudios de prevalencia de las enfermedades reumatológicas en la población colombiana se ha estimado un rango entre 0,08% (IC 95%: 0,02-0,27%)3 y 0,12%4, similar a la prevalencia descrita en otros países de Latinoamérica como, por ejemplo, Brasil (0,17%; IC: 0,02-0,59)5.
El SSp afecta de manera especial a las mujeres, en la población colombiana la relación mujer:hombre aproximada es de 4,63:1, y en diferentes estudios se ha demostrado que la incidencia aumenta a partir de los 50 años4,6.
El SSp presenta un espectro clínico amplio, desde la afección de un órgano específico, sobre todo las glándulas salivales, hasta el compromiso multisistémico que puede presentarse en el 30-40% de los casos. Las manifestaciones extraglandulares reflejan una actividad sistémica de la enfermedad y pueden presentarse en muchos órganos. Se ha descrito compromiso en los sistemas musculoesquelético, hematológico, vascular, pulmonar, renal, cutáneo y sistema nervioso central y periférico7,8.
La identificación de marcadores para predecir la aparición de manifestaciones extraglandulares es de interés reciente, puesto que refleja los fenotipos del SSp con mayor gravedad de la enfermedad y mayor riesgo de morbimortalidad. Diferentes estudios han abordado este tema, con resultados controvertidos, debido a la diferencia poblacional, el número de pacientes estudiados y los diferentes criterios de clasificación aplicados1,3,4.
En este estudio se planteó evaluar la asociación entre los autoanticuerpos (Ac), las manifestaciones clínicas (extraglandulares y glandulares) y los hallazgos histopatológicos de la biopsia de glándula salival menor en el SSp. En nuestro conocimiento, este es el primer estudio de tales características en población latinoamericana.
Materiales y métodosSe llevó a cabo un estudio observacional, analítico, transversal. Se incluyeron pacientes mayores de 18 años que asistieron a la Fundación Instituto de Reumatología e Inmunología Fernando Chalem, en Bogotá (Colombia), con diagnóstico de SSp, de acuerdo con los criterios de clasificación del American College of Rheumatology (ACR) / Liga Europea contra el Reumatismo (EULAR) de 2016, entre junio de 2018 y junio de 2019. Las biopsias de glándula salival menor se llevaron a cabo mediante la disección abierta descrita por Caporali et al.9. Se obtuvieron como mínimo 4 glándulas salivales menores con un tamaño mayor a 2mm, según los criterios estandarizados de Fisher et al.10. Las muestras se fijaron y procesaron en parafina, se obtuvieron secciones de 4um, las cuales se tiñeron con hematoxilina y eosina. En cada sección se hizo la puntuación de los infiltrados linfocíticos, la cual fue reportada por los patólogos, de conformidad con la clasificación de Chisholm-Mason. Se tomaron como positivas para sialoadenitis linfocítica focal las puntuaciones grado 3 y 4 del sistema de clasificación Chisholm-Mason11.
Se excluyeron pacientes con otras enfermedades autoinmunes, pacientes que estuvieran participando en protocolos de investigación o que no asistieran para la toma de la muestra y el diligenciamiento de la encuesta sociodemográfica.
Se realizó la toma de la muestra serológica para procesamiento de Ac por la técnica de inmunofluorescencia indirecta para anticuerpos antinucleares (AAN) y mediante ensayo por inmunoadsorción ligado a enzimas o Elisa (por sus siglas en inglés) para factor reumatoide (FR) IgA, IgG e IgM, Ac antipéptidos citrulinados, anti-alfa-fodrina IgA e IgG, anti-Ro 60, anti-Ro-52, anti-La, anti-ADN, anti-histona, anti-Sm, anti-ribosomas, anti-SCL 70, anti-RNP, anti-M2 y anti-Ku. La medición de los autoanticuerpos y la biopsia de glándula salival menor fueron realizadas en diferentes momentos de la enfermedad del paciente.
La información sobre los pacientes se obtuvo mediante una encuesta presencial y la historia clínica electrónica. Se diligenciaron los datos sociodemográficos, las manifestaciones clínicas y los resultados histopatológicos de la biopsia de glándula salival menor.
Análisis estadísticoSe hicieron análisis univariados para describir la población estudiada. Las variables categóricas se analizaron por medio de frecuencias, en tanto que para las variables cuantitativas continuas se emplearon pruebas de normalidad, principalmente la de Kolmogorov-Smirnov. Los datos paramétricos se expresan como medias y desviación estándar (DE), mientras que los datos no paramétricos se describen como medianas y rangos intercuartílicos.
Se llevaron a cabo análisis bivariados para evaluar la asociación entre el grado de compromiso glandular y extraglandular, y la presencia de los autoanticuerpos. Se analizaron subgrupos según el sexo, la media de edad del diagnóstico y su relación con la presencia de autoanticuerpos. Debido a la mayor incidencia del SSp en pacientes>50 años, se realizó un análisis de subgrupos y se comparó el perfil de anticuerpos en pacientes con diagnóstico temprano de la enfermedad (<50 años) con el de aquellos con diagnóstico tardío (≥50 años).
Se hizo la prueba de χ2 o prueba exacta de Fisher cuando la variable independiente fue dicotómica. Se consideró como significación estadística una p<0,05. Todos los análisis se realizaron mediante el sistema operativo Stata/SE 14.0
Consideraciones éticasLos autores han obtenido el consentimiento informado por escrito de los pacientes o sujetos mencionados en el artículo. El autor correspondiente está en posesión de este documento.
La investigación cumple con la normativa vigente en investigación bioética y se obtuvo la autorización del comité de ética del Instituto de Reumatología Fernando Chalem.
ResultadosCaracterísticas demográficas y clínicasDe los 88 (N: 88) pacientes incluidos en el estudio, 41 fueron excluidos, por no firmar el consentimiento informado, no acudir a la toma de la muestra y el diligenciamiento de la encuesta sociodemográfico, o no haber contestado a las llamadas telefónicas o al correo electrónico.
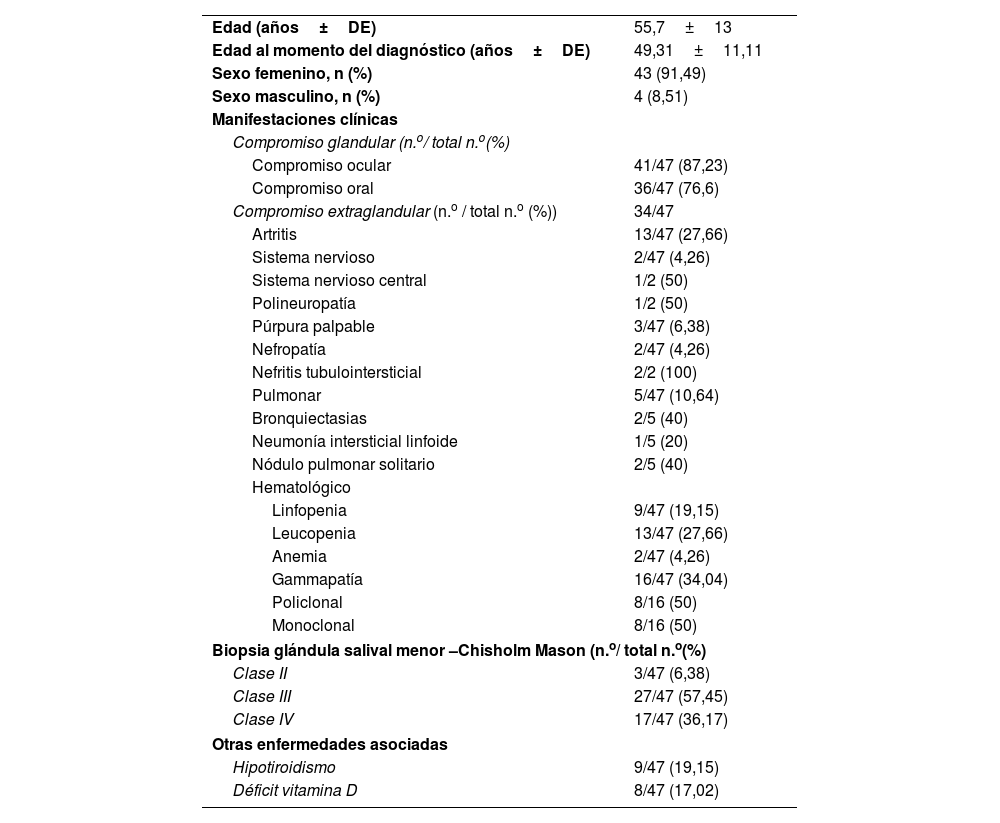
El promedio de edad fue de 55,7 años (DE±13 años), y la edad en el diagnóstico de SSp tuvo una media de 49,3 años (DE±11,11). Un 91,49% de los pacientes (N=43) fueron mujeres (tablas 1 y 2).
Características sociodemográficas
| Edad (años±DE) | 55,7±13 |
| Edad al momento del diagnóstico (años±DE) | 49,31±11,11 |
| Sexo femenino, n (%) | 43 (91,49) |
| Sexo masculino, n (%) | 4 (8,51) |
| Manifestaciones clínicas | |
| Compromiso glandular (n.o/ total n.o(%) | |
| Compromiso ocular | 41/47 (87,23) |
| Compromiso oral | 36/47 (76,6) |
| Compromiso extraglandular (n.o / total n.o (%)) | 34/47 |
| Artritis | 13/47 (27,66) |
| Sistema nervioso | 2/47 (4,26) |
| Sistema nervioso central | 1/2 (50) |
| Polineuropatía | 1/2 (50) |
| Púrpura palpable | 3/47 (6,38) |
| Nefropatía | 2/47 (4,26) |
| Nefritis tubulointersticial | 2/2 (100) |
| Pulmonar | 5/47 (10,64) |
| Bronquiectasias | 2/5 (40) |
| Neumonía intersticial linfoide | 1/5 (20) |
| Nódulo pulmonar solitario | 2/5 (40) |
| Hematológico | |
| Linfopenia | 9/47 (19,15) |
| Leucopenia | 13/47 (27,66) |
| Anemia | 2/47 (4,26) |
| Gammapatía | 16/47 (34,04) |
| Policlonal | 8/16 (50) |
| Monoclonal | 8/16 (50) |
| Biopsia glándula salival menor –Chisholm Mason (n.o/ total n.o(%) | |
| Clase II | 3/47 (6,38) |
| Clase III | 27/47 (57,45) |
| Clase IV | 17/47 (36,17) |
| Otras enfermedades asociadas | |
| Hipotiroidismo | 9/47 (19,15) |
| Déficit vitamina D | 8/47 (17,02) |
DE: desviación estándar.
Presencia y niveles de autoanticuerpos
| Anticuerpo | Positivos, N, (%) | Mediana - rango IC |
|---|---|---|
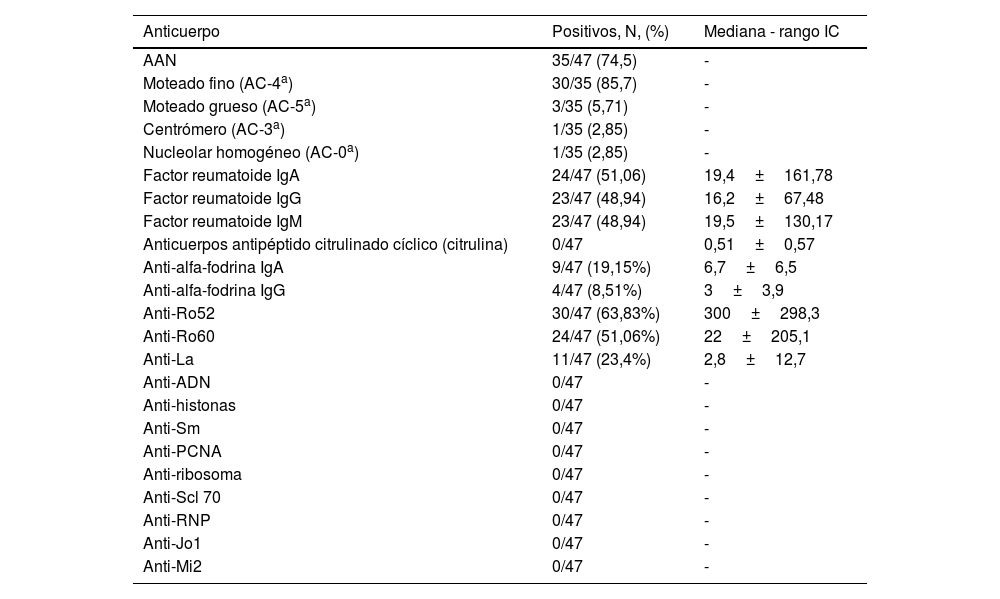
| AAN | 35/47 (74,5) | - |
| Moteado fino (AC-4a) | 30/35 (85,7) | - |
| Moteado grueso (AC-5a) | 3/35 (5,71) | - |
| Centrómero (AC-3a) | 1/35 (2,85) | - |
| Nucleolar homogéneo (AC-0a) | 1/35 (2,85) | - |
| Factor reumatoide IgA | 24/47 (51,06) | 19,4±161,78 |
| Factor reumatoide IgG | 23/47 (48,94) | 16,2±67,48 |
| Factor reumatoide IgM | 23/47 (48,94) | 19,5±130,17 |
| Anticuerpos antipéptido citrulinado cíclico (citrulina) | 0/47 | 0,51±0,57 |
| Anti-alfa-fodrina IgA | 9/47 (19,15%) | 6,7±6,5 |
| Anti-alfa-fodrina IgG | 4/47 (8,51%) | 3±3,9 |
| Anti-Ro52 | 30/47 (63,83%) | 300±298,3 |
| Anti-Ro60 | 24/47 (51,06%) | 22±205,1 |
| Anti-La | 11/47 (23,4%) | 2,8±12,7 |
| Anti-ADN | 0/47 | - |
| Anti-histonas | 0/47 | - |
| Anti-Sm | 0/47 | - |
| Anti-PCNA | 0/47 | - |
| Anti-ribosoma | 0/47 | - |
| Anti-Scl 70 | 0/47 | - |
| Anti-RNP | 0/47 | - |
| Anti-Jo1 | 0/47 | - |
| Anti-Mi2 | 0/47 | - |
El compromiso glandular más frecuente fue el ocular, en un 87,23% (N=41), seguido del compromiso oral en un 76,6% (N=36). Las manifestaciones extraglandulares se presentaron en un 72% de los pacientes. Las manifestaciones más frecuentes fueron las hematológicas, principalmente gammapatía policlonal (n=16; 34%) y leucopenia (n=13; 27,6%), seguidas del compromiso articular, en un 27,66% (n=13). Los otros sistemas comprometidos fueron: pulmonar (n=5; 10,64%), nervioso (n=2; 4,26%), cutáneo (n=3; 6,38%) y renal (n=2; 4,26%). Con respecto a la biopsia de glándula salival menor, el subtipo histológico más frecuente fue el grado iii por clasificación de Chisholm Mason, en un 57,45% de los casos.
Al evaluar las comorbilidades, un 19,15% de los pacientes presentaba hipotiroidismo y un 17,02% déficit de vitamina D (tabla 1).
Presencia y niveles de anticuerposLos anticuerpos más frecuentemente positivos en la población fueron los AAN (74%), y de ellos el patrón más observado fue el moteado fino (N=35; 85,7%), seguido por el moteado grueso (N=3; 5,71%).
El subtipo de FR más prevalente fue el IgA (N=24; 51,6%) y el subtipo más frecuente de los anticuerpos anti-alfa-fodrina fue la IgA (N=9; 19,15%). El anticuerpo anti-Ro52 (N=30; 63,83%) se encontró con más frecuencia que el anti-Ro60 (N=24; 51,06%). Once pacientes (23,4%) presentaban anticuerpos anti-La positivos. Los anticuerpos anti-CCP, anti-ADN, anti-histonas, anti-Sm, anti-PCNA, anti-ribosoma, anti-Scl70, anti-RNP, anti-Jo1 y anti-Mi2 fueron negativos (tabla 2).
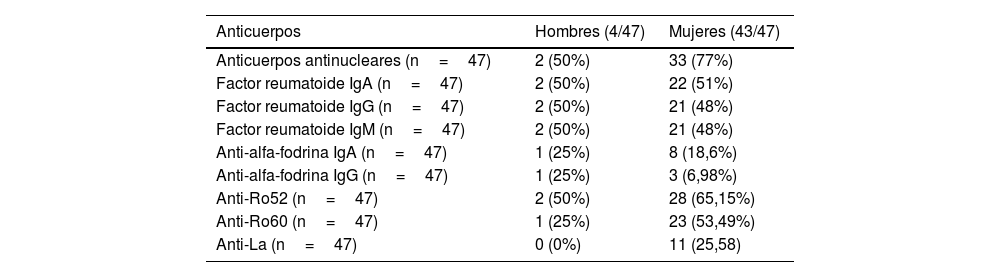
Las pacientes mujeres presentaron un mayor porcentaje de seropositividad para AAN (M=33, 77% vs. H=2, 50%), FR IgA (M=22, 51% vs. H=2, 50%), anti-Ro52 (M=28, 65,15% vs. H=2, 50%) y anti-La (M=11, 25,58%) (tabla 3).
Comparación perfil anticuerpos en hombres y mujeres
| Anticuerpos | Hombres (4/47) | Mujeres (43/47) |
|---|---|---|
| Anticuerpos antinucleares (n=47) | 2 (50%) | 33 (77%) |
| Factor reumatoide IgA (n=47) | 2 (50%) | 22 (51%) |
| Factor reumatoide IgG (n=47) | 2 (50%) | 21 (48%) |
| Factor reumatoide IgM (n=47) | 2 (50%) | 21 (48%) |
| Anti-alfa-fodrina IgA (n=47) | 1 (25%) | 8 (18,6%) |
| Anti-alfa-fodrina IgG (n=47) | 1 (25%) | 3 (6,98%) |
| Anti-Ro52 (n=47) | 2 (50%) | 28 (65,15%) |
| Anti-Ro60 (n=47) | 1 (25%) | 23 (53,49%) |
| Anti-La (n=47) | 0 (0%) | 11 (25,58) |
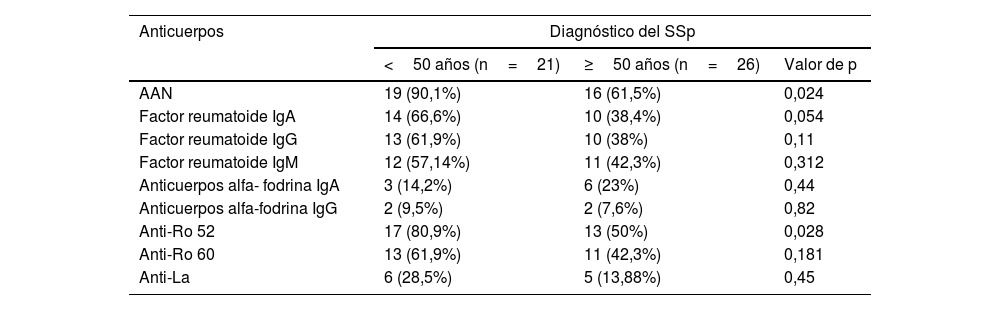
Se llevó a cabo un análisis de subgrupos en pacientes con un diagnóstico temprano de la enfermedad (<50 años), y en ambos grupos se comparó el perfil de los anticuerpos. Los pacientes con un diagnóstico más temprano presentaron un mayor porcentaje en la positividad de todos los anticuerpos, excepto anticuerpos anti-alfa fodrina IgA. Los AAN (N=19; 90,1% vs. N=16; 61,5%) y los anticuerpos anti-Ro52 (N=17; 80,9% vs. N=13; 50%) fueron los únicos que presentaron una diferencia estadísticamente significativa al comparar ambos subgrupos (tabla 4).
Perfil de los anticuerpos, diagnóstico antes y después de los 50 años
| Anticuerpos | Diagnóstico del SSp | ||
|---|---|---|---|
| <50 años (n=21) | ≥50 años (n=26) | Valor de p | |
| AAN | 19 (90,1%) | 16 (61,5%) | 0,024 |
| Factor reumatoide IgA | 14 (66,6%) | 10 (38,4%) | 0,054 |
| Factor reumatoide IgG | 13 (61,9%) | 10 (38%) | 0,11 |
| Factor reumatoide IgM | 12 (57,14%) | 11 (42,3%) | 0,312 |
| Anticuerpos alfa- fodrina IgA | 3 (14,2%) | 6 (23%) | 0,44 |
| Anticuerpos alfa-fodrina IgG | 2 (9,5%) | 2 (7,6%) | 0,82 |
| Anti-Ro 52 | 17 (80,9%) | 13 (50%) | 0,028 |
| Anti-Ro 60 | 13 (61,9%) | 11 (42,3%) | 0,181 |
| Anti-La | 6 (28,5%) | 5 (13,88%) | 0,45 |
Entre los diferentes autoanticuerpos estudiados no se encontró asociación estadísticamente significativa con las manifestaciones glandulares; los anticuerpos con mayor frecuencia de positividad fueron los AAN, los anti-Ro52 y los anti-Ro60.
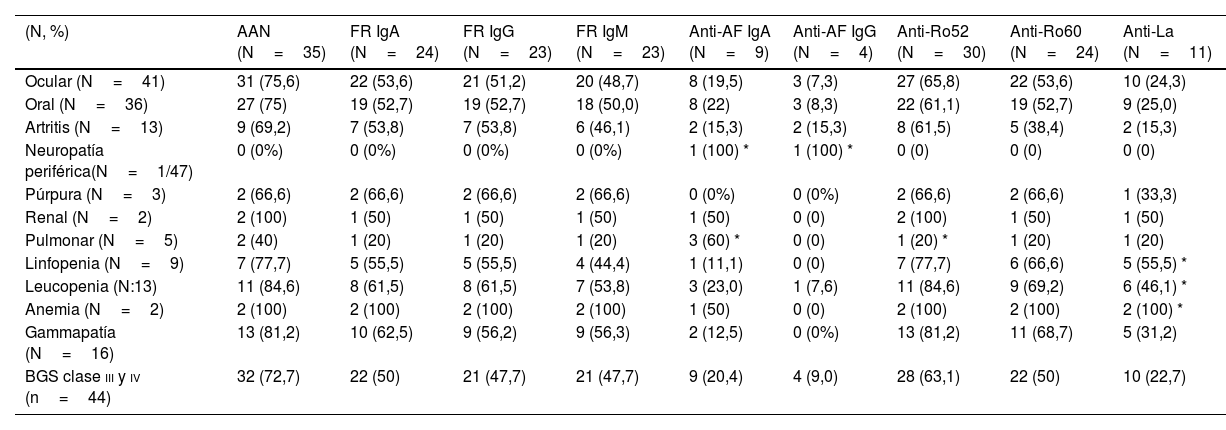
Con respecto al compromiso extraglandular, si bien la polineuropatía se relacionó de manera significativa con los anticuerpos anti-alfa-fodrina IgA (p=0,0378) e IgG (p=0,01), solo se encontró en un paciente del estudio. El compromiso pulmonar se asoció de manera significativa con los anticuerpos anti-alfa-fodrina IgA (p=0,014) y anti-Ro52 (p=0,031). El compromiso hematológico (linfopenia, leucopenia y anemia) se asoció significativamente con los anticuerpos anti-La (p<0,05). Según los criterios clasificatorios, se tomaron los resultados de biopsia Chisholm Mason III y IV como positivos (estos fueron positivos en 44 de 47 de pacientes), y se comparó con la clase ii sin encontrar relación importante con la presencia de autoanticuerpos. Las otras manifestaciones extraglandulares no tuvieron asociación con los anticuerpos en la población estudiada (tabla 5).
Relación de los autoanticuerpos con manifestaciones glandulares y extraglandulares
| (N, %) | AAN (N=35) | FR IgA (N=24) | FR IgG (N=23) | FR IgM (N=23) | Anti-AF IgA (N=9) | Anti-AF IgG (N=4) | Anti-Ro52 (N=30) | Anti-Ro60 (N=24) | Anti-La (N=11) |
|---|---|---|---|---|---|---|---|---|---|
| Ocular (N=41) | 31 (75,6) | 22 (53,6) | 21 (51,2) | 20 (48,7) | 8 (19,5) | 3 (7,3) | 27 (65,8) | 22 (53,6) | 10 (24,3) |
| Oral (N=36) | 27 (75) | 19 (52,7) | 19 (52,7) | 18 (50,0) | 8 (22) | 3 (8,3) | 22 (61,1) | 19 (52,7) | 9 (25,0) |
| Artritis (N=13) | 9 (69,2) | 7 (53,8) | 7 (53,8) | 6 (46,1) | 2 (15,3) | 2 (15,3) | 8 (61,5) | 5 (38,4) | 2 (15,3) |
| Neuropatía periférica(N=1/47) | 0 (0%) | 0 (0%) | 0 (0%) | 0 (0%) | 1 (100) * | 1 (100) * | 0 (0) | 0 (0) | 0 (0) |
| Púrpura (N=3) | 2 (66,6) | 2 (66,6) | 2 (66,6) | 2 (66,6) | 0 (0%) | 0 (0%) | 2 (66,6) | 2 (66,6) | 1 (33,3) |
| Renal (N=2) | 2 (100) | 1 (50) | 1 (50) | 1 (50) | 1 (50) | 0 (0) | 2 (100) | 1 (50) | 1 (50) |
| Pulmonar (N=5) | 2 (40) | 1 (20) | 1 (20) | 1 (20) | 3 (60) * | 0 (0) | 1 (20) * | 1 (20) | 1 (20) |
| Linfopenia (N=9) | 7 (77,7) | 5 (55,5) | 5 (55,5) | 4 (44,4) | 1 (11,1) | 0 (0) | 7 (77,7) | 6 (66,6) | 5 (55,5) * |
| Leucopenia (N:13) | 11 (84,6) | 8 (61,5) | 8 (61,5) | 7 (53,8) | 3 (23,0) | 1 (7,6) | 11 (84,6) | 9 (69,2) | 6 (46,1) * |
| Anemia (N=2) | 2 (100) | 2 (100) | 2 (100) | 2 (100) | 1 (50) | 0 (0) | 2 (100) | 2 (100) | 2 (100) * |
| Gammapatía (N=16) | 13 (81,2) | 10 (62,5) | 9 (56,2) | 9 (56,3) | 2 (12,5) | 0 (0%) | 13 (81,2) | 11 (68,7) | 5 (31,2) |
| BGS clase iii y iv (n=44) | 32 (72,7) | 22 (50) | 21 (47,7) | 21 (47,7) | 9 (20,4) | 4 (9,0) | 28 (63,1) | 22 (50) | 10 (22,7) |
AAN: anticuerpos antinucleares, FR: factor reumatoide, anti-AF: anticuerpos anti-alfa-fodrina BGS: biopsia glándula salival.
El SSp es una enfermedad autoinmune sistémica compleja, se ha descrito una prevalencia entre 0,01 y 0,6%, con una incidencia entre 1,1 y 5,3 casos por cada 100.000 habitantes12. Las características de la enfermedad varían según el sexo (más frecuente en mujeres) y la etnia (mayor compromiso en población caucásica, pero diagnóstico más temprano en población negra)13. La mortalidad es mayor en hombres, y se ha relacionado con el compromiso extraglandular14–16.
El presente estudio caracterizó a la población y evaluó la asociación entre las manifestaciones clínicas y la presencia de autoanticuerpos en el SSp. El promedio de edad al momento del diagnóstico de 49,3 años. La relación mujer:hombre fue de 11:1. En el estudio de Maciel et al., la edad promedio fue de 64,6 años, y la duración de la enfermedad promedio fue de 10 años17, con un 86% de mujeres. En las mujeres posmenopáusicas se presenta una rápida disminución de los niveles de estrógenos que conduce a una reducción de viabilidad de las células glandulares, muerte celular, liberación de autoantígenos, formación de autoanticuerpos y daño del órgano18,19.
El 19,15% de los pacientes presentó hipotiroidismo y un 17,02% déficit de vitamina D. En nuestra cohorte no se realizó el estudio de la etiología del hipotiroidismo, por tanto, no se puede descartar un origen autoinmune. La clasificación de SS secundario se consideró inicialmente en pacientes con síntomas sicca y artritis reumatoide, pero fue ampliada posteriormente para incluir otras entidades autoinmunes sistémicas como el lupus eritematoso sistémico y la esclerosis sistémica. No es claro si se debe clasificar como SS secundario cuando se produce el solapamiento con enfermedades autoinmunes órgano-específicas como la tiroiditis autoinmune20. El estudio de Dai et al. evaluó la presencia de anticuerpos antitiroideos en pacientes con SS y encontró una positividad de 18,9% para anticuerpos antiperoxidasa y 25,6% para antitiroglobulina. Los pacientes con hipotiroidismo presentaban con mayor frecuencia autoanticuerpos, menores niveles de hemoglobina, aumento de reactantes de fase aguda y disminución de C4. Por lo mencionado, consideramos importante para futuros estudios la evaluación de la etiología del hipotiroidismo y determinar el valor de incluir a estos pacientes en el grupo SS secundario, debido a las diferencias en el curso clínico de la enfermedad21.
Las manifestaciones extraglandulares ocurren en aproximadamente un tercio de los pacientes, casi cualquier órgano puede verse afectado; las más frecuentes se han descrito en los sistemas musculoesquelético, gastrointestinal, pulmonar y hematológico22. El compromiso pulmonar, el hematológico y el neuropático se han visto relacionados con aumento de la mortalidad y disminución de la calidad de vida23–25.
El estudio de Zhao et al. reportó una prevalencia mayor (65,3%) en personas con más de una comorbilidad y mayor actividad de la enfermedad medida por ESSDAI26.
Las manifestaciones hematológicas, que incluyen anemia, citopenias, gammapatías y trastornos linfoproliferativos, han reportado una frecuencia de 25-50% en el SSp, siendo la más frecuente la anemia crónica, seguida por la leucopenia27. La gammapatía monoclonal o policlonal se ha reportado entre el 22 y el 49% en el SSp, y se considera un marcador directo de activación de linfocito B. Su presencia es un predictor de riesgo para neoplasias hematológicas28,29.
En nuestro estudio, la manifestación hematológica más frecuente fue la gammapatía, la cual se halló en el 34% de los pacientes, de los cuales un 50% de presentó patrón monoclonal, en tanto que la leucopenia fue la segunda manifestación extraglandular más frecuente, con una frecuencia del 27,6%. Por su parte, la anemia fue la tercera manifestación hematológica más frecuente, al presentarse en el 4,26% de los pacientes. Aunque en otras cohortes la presencia de AAN, anti-Ro y anti-La se ha relacionado con un mayor riesgo de anemia30, en nuestra cohorte no se encontró esta asociación.
El compromiso pulmonar relacionado con SSp se ha descrito entre el 11 y el 29% de los pacientes31, y al hacer una búsqueda activa con tomografía de tórax la prevalencia puede aumentar hasta un 70%32. El compromiso intersticial presenta una frecuencia del 20%, en tanto que la neumonía intersticial no específica es el patrón radiológico más comúnmente encontrado23,33. En nuestro estudio, las manifestaciones pulmonares se presentaron con una frecuencia del 10%, y las más recurrentes fueron el nódulo pulmonar solitario, las bronquiectasias y la neumonía intersticial linfoide. Estos resultados fueron similares a los que se obtuvieron en las cohortes reportadas por Lohrman et al. y Gardiner34,35.
Las manifestaciones del sistema nervioso se han descrito entre el 20 y el 25% de los pacientes con SSp, siendo la polineuropatía periférica, en especial la sensorial, la más frecuente36. En la cohorte estudiada, el compromiso en el sistema nervioso fue menor que el reportado en otros estudios, se presentó en el 4,26% de los casos. Mientras que un 50% tuvo neuropatía periférica, otro 50% experimentó afectación en sistema nervioso central.
Las otras manifestaciones extraglandulares se encontraron en menos del 10% de los pacientes. El compromiso renal (nefropatía intersticial) se encontró en un 4%, y el cutáneo en un 6% de los casos. Estos últimos resultados concordaron con lo otras cohortes37.
Los AAN, positivos en el 77% de los casos, fueron los más frecuentemente encontrados en nuestra población. Otras cohortes latinoamericanas estudiadas muestran una positividad promedio de 74%, mucho menor que la observada en el resto de las poblaciones. Los patrones más frecuentemente encontrados fueron moteado fino, moteado grueso, centrómero y nucleolar homogéneo (tabla 2)13,38.
El FR fue positivo en el 50% de los pacientes, con una frecuencia similar entre hombres y mujeres. Estos resultados difieren de otras cohortes, que muestran una seropositividad mayor en hombres39. Mientras que otros estudios han reportado asociación del isotipo del FR IgA con la xerostomía, la tasa de flujo salival no estimulado y los AAN40,41, nuestro estudio no mostró asociación entre los isotipos de FR y las manifestaciones glandulares y extraglandulares.
Los anticuerpos anti-fodrina IgA e IgG fueron positivos en el 19,15% y en el 8,51% de los casos. Su utilidad se ha visto asociada como un marcador diagnóstico de baja sensibilidad y alta especificidad42 y se ha relacionado con mayor riesgo de parotiditis43,44.
En nuestro estudio encontramos asociación de anticuerpos alfa-fodrina IgA (p=0,0378) e IgG (p=0,01) con el compromiso de sistema nervioso periférico (neuropatía), y de anticuerpos anti-alfa-fodrina IgA con compromiso pulmonar (p=0,014), sin embargo, por el bajo número de casos no se puede realizar una conclusión de aumento de riesgo.
Los autoanticuerpos anti-Ro52, positivos en el 63,8%, se asociaron con el compromiso pulmonar (p=0,031). Y los anticuerpos anti-La, positivos en el 23,4%, se asociaron con el compromiso hematológico (leucopenia (p=0,011), linfopenia (p=0,023) y anemia (p=0,09).
En el estudio de Menor Almagro et al., los anticuerpos anti-Ro52, anti-Ro60 y anti-La se relacionaron con hipergammaglobulinemia, hipocomplementemia y alopecia45. Otros estudios han encontrado asociación entre anti-Ro60, polineuropatía, linfoadenopatía, compromiso renal y miopatía; estas asociaciones no se observaron en nuestro estudio41,46,47.
Los pacientes diagnosticados con SSp antes de los 50 años presentaron mayor carga de AAN, FR IgA y anti-Ro 52. Datos similares han sido reportado en otras cohortes, en las cuales la instauración temprana de síntomas (<35 años) se asoció con una mayor positividad de AAN, anti-Ro, anti-La y factor reumatoide39,40.
LimitacionesSe requieren estudios con mayor tamaño de muestra para afirmar con mayor seguridad los hallazgos encontrados, debido al reducido tamaño de la muestra de nuestra población. La clasificación del SSp no se realizó con el sistema de Focus score sugerido por los criterios ACR/EULAR 2016, consideramos importante para próximos estudios evaluar su realización con las manifestaciones extraglandulares y glandulares.
El hipotiroidismo fue frecuente, no se hicieron estudios de su etiología, pero no se puede descartar un origen autoinmune. Como se explicó, se desconoce si estos pacientes deben ser clasificados como SSp o SS secundario, como también su utilidad en la presentación clínica.
ConclusionesNuestro estudio indica que distintos perfiles de autoanticuerpos se relacionan con diferentes manifestaciones extraglandulares. La presencia de anticuerpos anti-La puede asociarse con manifestaciones hematológicas, en tanto que los anticuerpos anti-alfa-fodrina y anti-Ro 52 se relacionan con manifestaciones pulmonares. Además, los pacientes con diagnóstico más temprano presentan una mayor carga de autoanticuerpos. No encontramos una asociación de la biopsia de glándula salival menor con manifestaciones extraglandulares del SSp.
El estudio representa la mayor cohorte de SSp con el mayor número de autoanticuerpos medido en Colombia, sin embargo, se llevó a cabo en un único centro de referencia, por lo cual los resultados deben ser evaluados con estudios multicéntricos para una mayor representación poblacional. Se requieren estudios adicionales para comprender el papel individual de cada uno de los anticuerpos en las manifestaciones extraglandulares.
Conflicto de interesesLos kits para los autoanticuerpos fueron suministrados por el laboratorio AESKU GROUP. Los recursos necesarios para la toma de la muestra y el procesamiento de las muestras por parte del laboratorio clínico fueron financiados por el Instituto de Reumatología Fernando Chalem.
Agradecemos al laboratorio AESKU Group, en Colombia, la donación de los kits de autoanticuerpos, y al laboratorio de la Fundación Instituto de Reumatología e Inmunología Fernando Chalem, en Bogotá (Colombia), la toma y el procesamiento de las muestras.