La intoxicación por consumo de hongos es un fenómeno estacional que se produce con relativa frecuencia en áreas geográficas donde es habitual su consumo, en especial de especies silvestres. Dependiendo del tipo de hongo ingerido pueden aparecer distintos cuadros clínicos (gastrointestinal, nefrotóxico, alucinatorio, etc.). El cuadro más grave es el hepatotóxico, asociado a una alta mortalidad, y causado por hongos que contienen amatoxinas (síndrome ciclopeptídico). Presentamos una revisión actualizada de las características de las amatoxinas, su cinética y mecanismo de acción, los métodos utilizados para su determinación analítica, así como las diferentes opciones para el tratamiento de la intoxicación.
Mushroom poisoning is a seasonal phenomenon that occurs relatively frequently in geographical areas where its consumption is common. Depending on the type of fungus ingested different clinical symptoms (gastrointestinal, nephrotoxic, hallucinatory, etc.) can occur. Hepatotoxic syndrome caused by fungi containing amatoxins is the most serious condition, associated to high mortality. We present an updated review of amatoxins characteristics, kinetics, mechanism of action, methods used for analytical determination, as well as the different options for the treatment of poisoning.
La intoxicación por ingestión de hongos silvestres no comestibles puede ser grave y potencialmente mortal. Aunque es poco frecuente, algunos autores apuntan a un aumento de la incidencia de casos de intoxicación1–3.
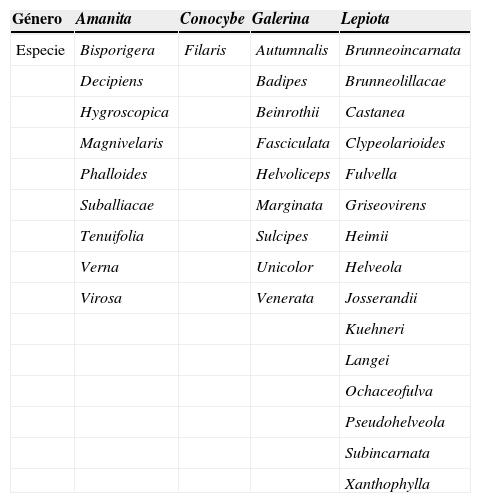
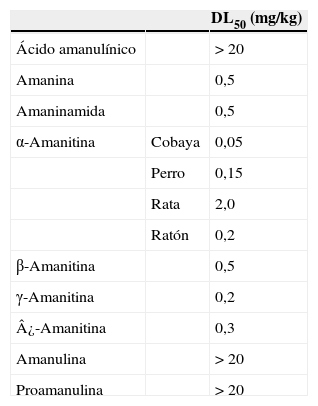
De las más de 5.000 especies de hongos conocidos aproximadamente unos 50 son tóxicos. Varios grupos de toxinas procedentes de estos hongos son causantes de cuadros clínicos graves: ciclopéptidos, giromitrina, muscarina, coprina, ácido iboténico, muscimol, psilocibina, orellanina, norleucina alénica, miotoxinas, etc. Entre los géneros de hongos responsables de la mayoría de muertes están Amanita, Conocybe, Galerina y Lepiota (tabla 1)4,5. A. phalloides contiene una mayor proporción de toxinas por peso entre las que se encuentran varias familias de ciclopéptidos: falotoxinas, virotoxinas y amatoxinas6. Las falotoxinas son heptapéptidos cíclicos térmicamente poco estables de aproximadamente 800 de masa molecular relativa. Actúan fijándose a la actina globular G impidiendo su polimerización en filamentos de actina F, lo que conduce a una desorganización del citoesqueleto y a la muerte celular7. La lesión de la membrana celular de los enterocitos explicaría las náuseas, vómitos y diarrea que constituyen los primeros síntomas clínicos de la intoxicación8. No obstante, su escasa biodisponibilidad limitaría considerablemente su contribución al cuadro tóxico9–11. Las virotoxinas (viroidina, viroisina, desoxiviroidina y desoxiviroisina) son heptapéptidos monocíclicos característicos de A. virosa, pero presentes igualmente en la A. phalloides. Poseen actividad biológica y toxicidad similar a las falotoxinas, con algunas diferencias estructurales como la presencia aminoácidos insólitos como 2,3-trans-3,4-dihidroxi-L-prolina y 2’-(metilsulfonil)-L-triptófano o que en las virotoxinas se halla una D-serina en lugar de la L-cisteína de las falotoxinas. Por último, las amatoxinas son octapéptidos bicíclicos que actúan de forma más lenta y mucho más intensa que los heptapéptidos, resultando ser unas 10 a 20 veces más tóxicas6. Desde el punto de vista toxicológico, la α- y la β-amanitina destacan entre los más de 40 miembros de la familia de las amatoxinas por ser responsables de un 90% de las intoxicaciones letales, muy por encima de otros que poseen una toxicidad limitada (tabla 2)12,13. Son sustancias liposolubles y termoestables que no se descomponen ni se desnaturalizan si se congelan, cuecen o procesan de otras formas. Su potencial letal es grande, ya que pueden estar presentes en una cantidad superior a los 0,1-0,3mg/kg, valor considerado como dosis mortal para seres humanos14–16, de modo que el consumo de una sola seta puede ser fatal17. El contenido de amanitinas en hongos es muy variable (entre 2 y 7g/kg de peso seco). Alrededor de un 50% corresponde a β-amanitina, un 40% a α-amanitina y el resto a la γ-amanitina18. La α-amanitina, a diferencia de la β-amanitina, presenta un grupo amino en vez de un hidroxilo en el residuo aspártico.
Especies productoras de amatoxinas. En el género Lepiota se incluyen solo las especies que se ha comprobado que contienen amatoxina, aunque posiblemente otras 8 especies puedan también producir amatoxinas
| Género | Amanita | Conocybe | Galerina | Lepiota |
|---|---|---|---|---|
| Especie | Bisporigera | Filaris | Autumnalis | Brunneoincarnata |
| Decipiens | Badipes | Brunneolillacae | ||
| Hygroscopica | Beinrothii | Castanea | ||
| Magnivelaris | Fasciculata | Clypeolarioides | ||
| Phalloides | Helvoliceps | Fulvella | ||
| Suballiacae | Marginata | Griseovirens | ||
| Tenuifolia | Sulcipes | Heimii | ||
| Verna | Unicolor | Helveola | ||
| Virosa | Venerata | Josserandii | ||
| Kuehneri | ||||
| Langei | ||||
| Ochaceofulva | ||||
| Pseudohelveola | ||||
| Subincarnata | ||||
| Xanthophylla |
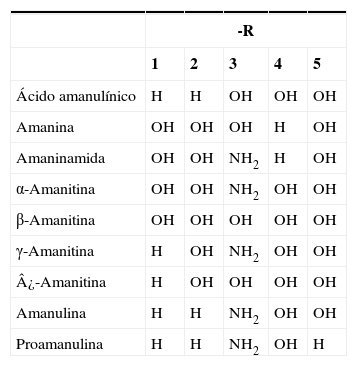
Amatoxinas más frecuentes y estructura química
| -R | |||||
| 1 | 2 | 3 | 4 | 5 | |
| Ácido amanulínico | H | H | OH | OH | OH |
| Amanina | OH | OH | OH | H | OH |
| Amaninamida | OH | OH | NH2 | H | OH |
| α-Amanitina | OH | OH | NH2 | OH | OH |
| β-Amanitina | OH | OH | OH | OH | OH |
| γ-Amanitina | H | OH | NH2 | OH | OH |
| ¿-Amanitina | H | OH | OH | OH | OH |
| Amanulina | H | H | NH2 | OH | OH |
| Proamanulina | H | H | NH2 | OH | H |
Se tiene noticia de intoxicaciones ciclopeptídicas desde la antigüedad19. Posiblemente el primer informe de intoxicación por ingesta de hongos lo escribiera Eurípides (430 a. C.) relatando la muerte de su esposa y 3 hijos20. Se da por seguro la intoxicación y muerte del papa Clemente VII, San Carlos Borromeo, El zar Alejandro Miguel, Carlos IV de Alemania y también se especula que Buda murió por comer un plato de amanitas, pero se duda del rigor histórico de algunos casos famosos, como el asesinato del emperador Claudio21. En ciertas circunstancias estacionales favorables las intoxicaciones por hongos pueden presentar características epidémicas, como sucedió en 1918 cerca de Poznan, en Polonia, donde murieron 31 niños al comer un plato preparado en la escuela con A. phalloides22.
La incidencia de intoxicaciones por hongos en España se ha estimado en 200-400 casos al año. La mitad aproximadamente presentaría síntomas lo bastante alarmantes como para motivar el ingreso en un departamento de urgencias hospitalarias. De estos ingresos un tercio corresponderían a intoxicaciones ciclopeptídicas propias de las amanitas23. Históricamente la mortalidad de la intoxicación por hongos era superior al 30%. En la actualidad se estima en alrededor del 7% entre pacientes tratados y un 30% entre los no tratados24. Un informe de 2003 de la Asociación Americana de Centros de Control de Intoxicaciones señalaba a los menores de 6 años como el colectivo más vulnerable, con un 90% de intoxicaciones registradas en jóvenes por debajo de los 19 años12,16,25–28.
En el que quizás sea el primer modelo animal de insuficiencia hepática fulminante se ha utilizado amatoxina intraperitoneal para conseguir sintomatología clínica y lesiones patológicas en la biopsia semejantes a las observadas en las necropsias29.
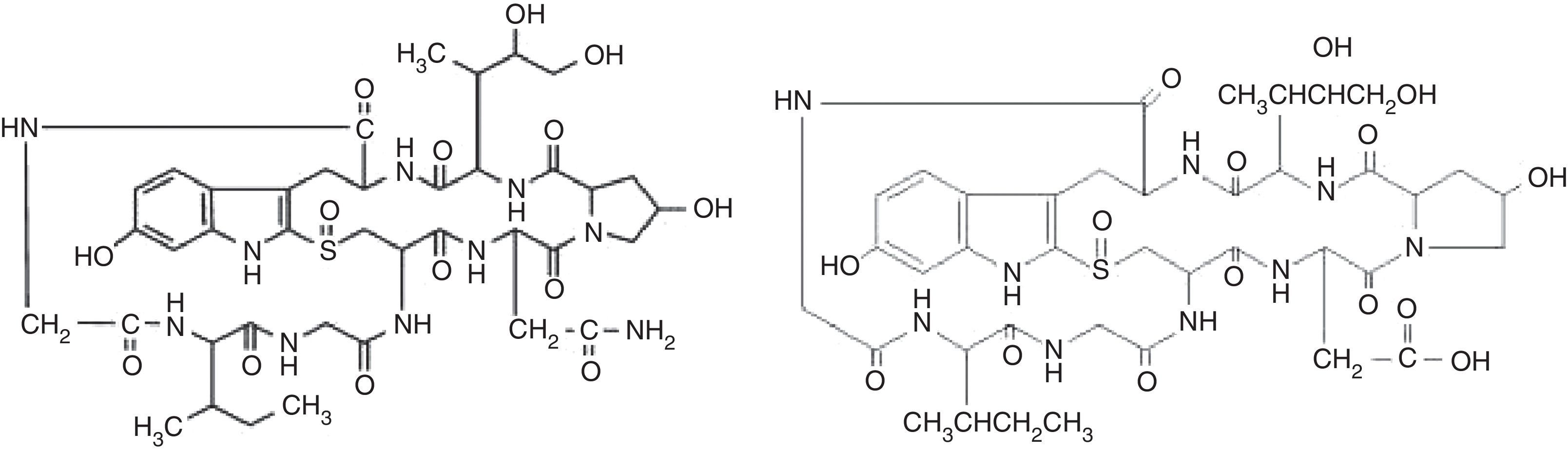
Estructura química y biosíntesisLas amanitinas son péptidos cíclicos con una masa molecular de unos 900Da. El primer ciclo está formado por la unión peptídica entre los extremos amino y carboxílico de la molécula, a diferencia de los péptidos cíclicos que habitualmente se forman en los animales mediante puentes disulfuro30. El segundo ciclo interno se forma por la unión del residuo indol de un triptófano a una cisteína. El grupo–NH2 de la α-amanitina le confiere un carácter reactivo neutro, mientras que el grupo–OH de la β-amanitina le da un carácter ácido26. Se considera que la estructura bicíclica y la presencia del grupo gamma hidroxilo en la dihidroxi isoleucina son determinantes en la toxicidad de las amatoxinas (fig. 1) (tabla 3).
Características químicas de la α -amainitina y β -amanitina
| Masa molecular relativa | Fórmula química | Denominación IUPAC | Código CAS | |
|---|---|---|---|---|
| α-amanitina | 918,97 | C39H54N10O14S | (ciclo(L)-asparaginil-4-hidroxi-L-proli-(R)-4,5-dihidroxi-L-isoleucil-6-hidroxi-2-mercapto-L-triptofilglicil-lisoleucilglicil-L-cisteinil) ciclo(4 → 8)-sulfuro(R)-S-óxido | 23109-05-9 |
| β-amanitina | 919,95 | C39H53N9O15S | 1-L-ácido aspártico alfa-amanitina | 103085710 |
Fuente: Frimmer8.
La α-amanitina, codificada por el gen AMA-1, presente solo en especies tóxicas, se sintetiza como proproteína de 35 aminoácidos por una sintasa ribosómica y seguidamente se escinde por una prolil oligopeptidasa (y no por peptidasas de arginina o lisina, como sucede con frecuencia en los animales)30.
El contenido en amatoxina de A. phalloides puede variar como consecuencia de las condiciones climáticas y ambientales31. Las amanitinas están presentes en todo el hongo, aunque su distribución no es homogénea. Por ejemplo en A. phalloides la α-amanitina se halla en concentraciones crecientes en micelio (hifas), esporas, volva, pedúnculo (pie, estipe), píleo (sombrero) y láminas. Estas diferencias pueden ser relevantes para orientar sobre la cantidad de toxina ingerida31,32, el principal factor de mortalidad en la intoxicación por hongos33.
Aspectos toxicológicos y clínicosToxicodinamiaEl mecanismo principal de toxicidad de las amatoxinas es la inhibición de la ARN polimerasa ii dependiente de ADN extra nucleolar (RNAP II), deteniendo la síntesis del mARN, y por lo tanto causando la muerte celular de los hepatocitos. Entre otros mecanismos adicionales está la sinergia con mediadores de apoptosis, como el factor de necrosis tumoral y la participación en la oxidación celular11,34–36. De hecho, la α-amanitina se viene utilizando desde hace tiempo como herramienta de laboratorio para inhibir eficientemente la RNAP II35,37–39 sin afectar otras RNAP nucleolares o extranucleolares39,40. Mediante cristalografía de rayos X se ha observado cómo la α-amanitina bloquea la síntesis proteica uniéndose de forma no covalente a la subunidad de 140kDa de la RNAP II, inhibiendo la elongación esencial para la trascripción. Como consecuencia disminuye la flexibilidad de las cadenas helicoidales de ADN y se reduce la velocidad de translocación de la RNAP II a solo varios nucleótidos por minuto. La inhibición no es completa debido a la limitada afinidad de la polimerasa por el nucleósido trifosfato, por lo que aún queda margen para que se puedan formar enlaces fosfodiéster41. La constante de inhibición del proceso de trascripción de ADN por la RNAP II es de 2×10−4 en células eucariotas42. Una concentración de 10μg/l de amanitina inhibe un 60-70% de la actividad RNAP II33. Como consecuencia se produce una disminución del contenido de mARN y una marcada inhibición de la síntesis proteica desde la primera hora después de la ingestión que progresa durante las siguientes 24h, y que se manifiesta como perturbaciones nucleares y citoplasmáticas que acaban con la muerte celular10,43,44. Cronológicamente los principales tejidos afectados son los que integran la mucosa intestinal, hepatocitos y células de los túbulos proximales del riñón3,45. La lesión más grave es la necrosis centrolobulillar hepática, evidenciando cambios celulares que causan su fragmentación y segregación26. Estudios en animales de experimentación muestran también un efecto tóxico directo sobre el riñón46–47. Otros órganos que también acaban afectándose son el páncreas, el adrenal y el testículo48.
Se ha documentado la interacción sinérgica entre α-amanitina y citoquinas endógenas como el factor de necrosis celular, que resulta en un aumento del complejo TNF-mARN hepático, e induce la apoptosis de los hepatocitos34,45.
Las amatoxinas también participan en el estrés oxidativo celular aumentando la actividad de enzimas prooxidantes que pueden contribuir a agravar la hepatoxicidad. La exposición de cultivos de hepatocitos a α-amanitina aumenta la actividad superóxido dismutasa, la peroxidación lipídica y disminuye la actividad catalasa. Estos cambios suponen un aumento de la generación de peróxido de hidrógeno acompañado de una reducción de la depuración de radicales de oxígeno49. La presencia de sustancias como N-acetil-L-cisteína o la silibinina protegen de la peroxidación lipídica más efectivamente que otros antídotos como la bencilpenicilina, carentes de propiedades antioxidantes50.
Las amatoxinas no atraviesan la barrera placentaria, por lo que no es de esperar que se produzcan lesiones fetales51–53. Sin embargo, se han descrito efectos teratógenos en exposiciones producidas durante el primer trimestre del embarazo54,55.
La LD50 de las amatoxinas en ratones es 0,3-0,7mg/kg frente a 1,5-3mg/kg de la falotoxina10,56,57 y de 2,5mg/kg de las virotoxinas58. La LD50 de la α-amanitina es 0,1-0,3mg/kg y de la β-amanitina de 0,5mg/kg33,59.
El mecanismo de acción de algunos antídotos de la intoxicación por α-amanitina, como penicilina o silibinina, se basa en la disminución de la captación hepatocelular de esta sustancia60,61. Desde su primer paso por el hígado la α-amanitina es captada por el hepatocito a través de transportadores de ácidos biliares dependientes de sodio (proteína transportadora de Na+/taurocolato)61,62 y de polipéptidos solubles transportadores de aniones orgánicos (OATP) (relacionadas con el transporte de hormonas tiroideas, prostaglandinas, esteroides…) independientes de sodio63–65. De las 3 proteínas OATP localizadas en la membrana basolateral del hepatocito, se ha demostrado que la denominada OATP1B3 (antigua OATP8)66–69 es el transportador humano preferente de amatoxinas70. Esto explicaría que inhibidores competitivos de la OATP1B3, como la rifampicina, pudieran desempeñar un papel terapéutico70,71.
ToxicocinéticaEn el ser humano las amatoxinas se absorben rápidamente y se detectan en orina a los 90-120min de la ingesta72. En algunos animales (por ejemplo ratas y ratones) la absorción es lenta e incompleta, mientras que en otros (como cobayas, perros o gatos) es rápida y completa y como consecuencia extremadamente mortal.
El volumen de distribución de la α y γ amanitina son similares al volumen del espacio extracelular. La distribución en otros compartimentos es relativamente rápida con un tiempo de semivida en plasma de 27-50min. Las amatoxinas no se unen significativamente a proteínas plasmáticas, sino que circulan libremente en el plasma73.
No se han observado metabolitos intermedios de estas toxinas74,75.
Un 80% de la cantidad ingerida es eliminada por la orina, la vía más importante de excreción, en un periodo de 6h, pero que puede prolongarse hasta 2-3 días. El modesto 7-10% excretado por vía biliar74 es sin embargo relevante por el hecho de que la circulación enterohepática mantiene las concentraciones plasmáticas de sustancia tóxica durante más tiempo76. En fases precoces de la intoxicación las concentraciones de amanitina en orina son 10-100 veces superiores a la concentración en plasma, donde apenas se detectan a las 36-48h de la ingesta debido a su mayor capacidad de fijación por el tejido renal. Posteriormente pueden ser detectadas en plasma como consecuencia del daño renal producido por la intoxicación16,77.
El aclaramiento renal es similar al de la creatinina74,77.
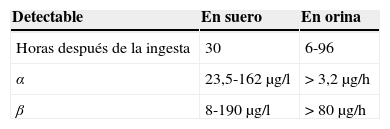
La presencia de amatoxinas en líquidos biológicos se produce en función del tiempo. Se han hallado elevadas concentraciones de amatoxinas en contenido gastroduodenal entre 12 y 72h después de la ingestión76, o incluso transcurrido más tiempo77. La circulación enterohepática de la toxina prolonga su presencia en el organismo78 y durante algunos días se pueden localizar cantidades importantes en el tejido hepático y en las heces77 (tabla 4).
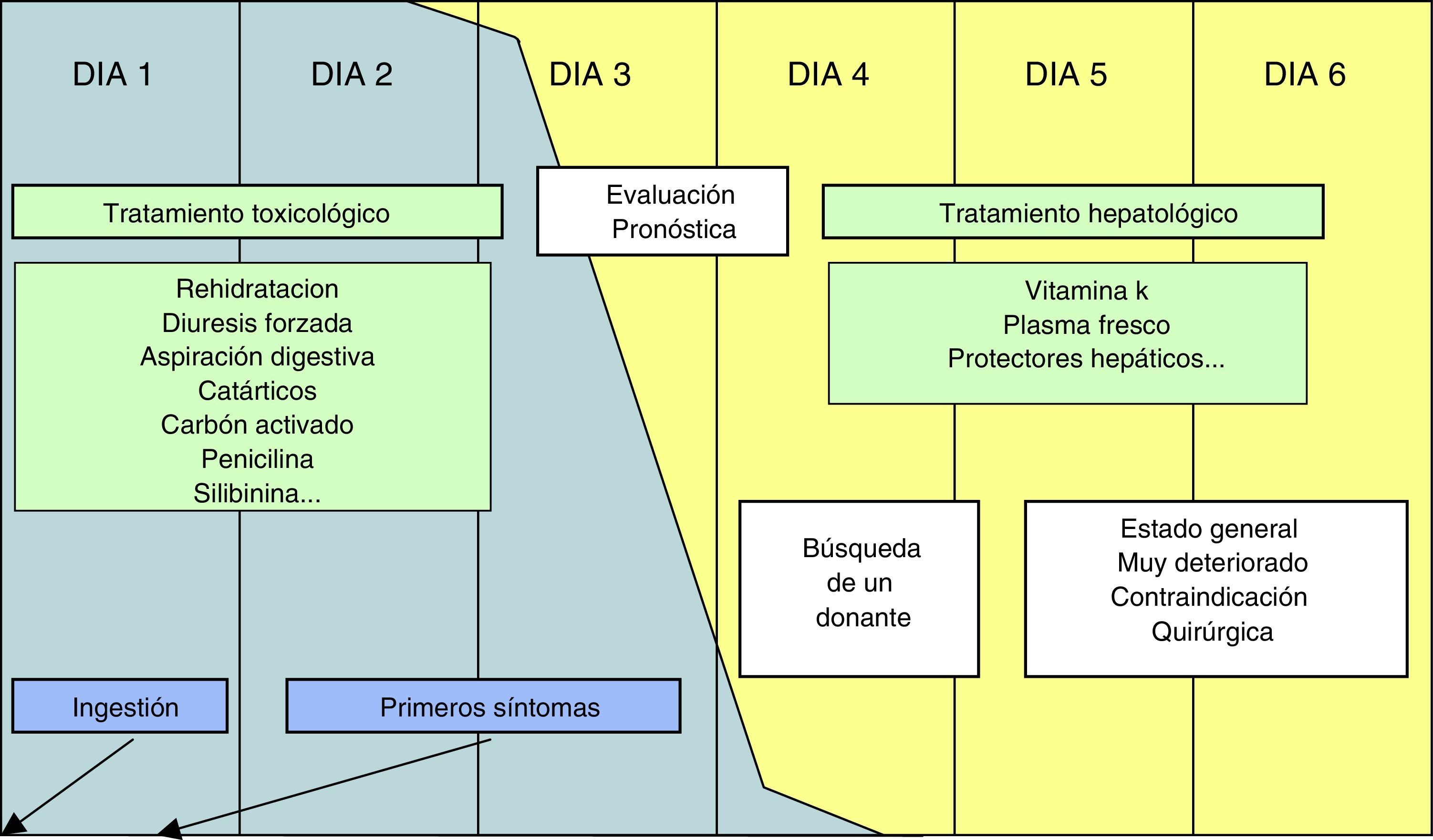
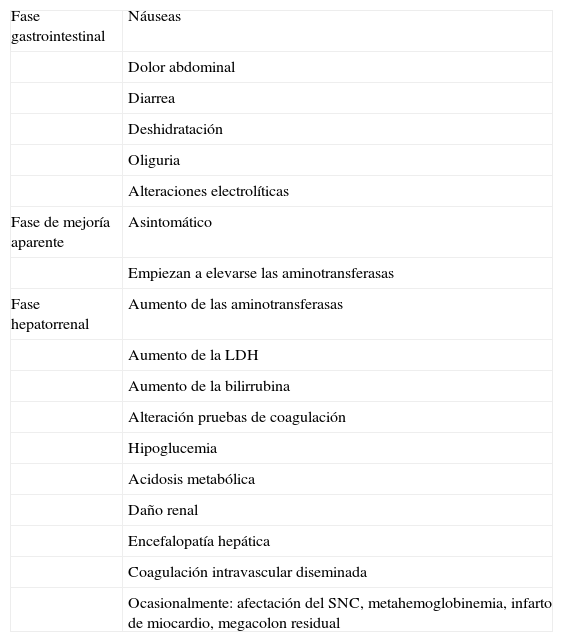
ClínicaTodos los pacientes que presenten indicios de intoxicación por hongos que contienen amatoxinas debieran ser ingresados en una unidad de cuidados intensivos. Tras la exposición se inicia un período asintomático o de latencia media de 11h (entre 6 y 24h) y que en algunos casos puede alcanzar las 36h, por lo que se califica de intoxicación de presentación sintomática tardía45. Este periodo de latencia es inversamente proporcional al consumo de toxina, es decir, largos periodos de latencia (más de 15h) corresponden a casos leves79.
La evolución clínica de la intoxicación se desarrolla en 3 etapas consecutivas:
- 1.
Fase gastrointestinal que se inicia a las 24 a 48h de la ingestión y que tiene una duración de 12 a 36h. Comienza súbitamente con un cuadro parecido al cólera: náuseas, dolor abdominal, vómitos y diarrea profusa, a veces muco-sanguinolenta, que si no es correctamente tratado puede conducir a deshidratación, alteraciones hidroelectrolíticas, shock hipovolémico, oliguria y terminar en daño renal45. En esta fase también puede manifestarse hipoglucemia, hipopotasemia y acidosis metabólica que pueden ser mortales26,33,80.
- 2.
Fase de mejoría aparente de 12 a 24h de duración, pero que según sea la magnitud de la exposición puede prolongarse hasta las 48h. El paciente se encuentra clínicamente asintomático, aunque se detecta aumento de actividad enzimática (ALT antes que AST) y bilirrubina, descenso de protrombina y factor V, así como aumentos de creatinina y urea en plasma indicando un deterioro funcional hepático y renal26–27.
- 3.
Fase hepatorrenal que comienza a las 48 a 96h después de la ingesta o antes si la ingesta fue abundante. Aparecen signos de lesión celular: aumento de bilirrubina, LDH y aminotransferasas que a concentraciones catalíticas altas son indicativas de mal pronóstico81,82. Hay alteración de las pruebas de coagulación, hipoglucemia83 y acidosis metabólica. El cuadro clínico evoluciona a insuficiencia hepática por necrosis (que se describe como necrosis centrolobulillar y degeneración grasa del hígado26) con hiperamoniemia, acidosis hipoglucémica y encefalopatía. Las altas concentraciones de creatinina señalan un daño renal adicional, directo o secundario al shock vascular hipovolémico, con deshidratación de las células tubulares renales que se manifiesta por oliguria grave o anuria. Raramente se produce pancreatitis. Sin el tratamiento oportuno sobreviene un fallo orgánico masivo acompañado de coagulación intravascular diseminada. La muerte por daño hepatorrenal puede producirse al cabo de 6 a 16 días de la ingesta. En algunos casos se observa una evolución a hepatitis crónica por inmunocomplejos.
Además de este proceso patológico hepatorrenal, puede presentarse afectación del sistema nervioso central, hemorragias gastrointestinales e incluso metahemoglobinemia, infarto de miocardio y megacolon residual33,84 (tabla 5).
Efectos de la intoxicación por amanitinas
| Fase gastrointestinal | Náuseas |
| Dolor abdominal | |
| Diarrea | |
| Deshidratación | |
| Oliguria | |
| Alteraciones electrolíticas | |
| Fase de mejoría aparente | Asintomático |
| Empiezan a elevarse las aminotransferasas | |
| Fase hepatorrenal | Aumento de las aminotransferasas |
| Aumento de la LDH | |
| Aumento de la bilirrubina | |
| Alteración pruebas de coagulación | |
| Hipoglucemia | |
| Acidosis metabólica | |
| Daño renal | |
| Encefalopatía hepática | |
| Coagulación intravascular diseminada | |
| Ocasionalmente: afectación del SNC, metahemoglobinemia, infarto de miocardio, megacolon residual |
Las amatoxinas pueden provocar la muerte de un adulto con tan solo una dosis de 0,1mg/kg de peso corporal85. Es decir, la ingestión de una A. phalloides madura de 20 a 25g implicaría la exposición a 5-8mg de amatoxina, letal para un adulto de 70kg. Los niños se consideran un grupo especialmente sensible a estas intoxicaciones, presentando la mortalidad más alta (tabla 6).
DiagnósticoEl diagnóstico de la intoxicación por amanitina se basa en la historia y la cuidadosa valoración de las manifestaciones clínicas, y se confirma con los exámenes de laboratorio. Debe efectuarse en fases iniciales con el objetivo de instaurar medidas terapéuticas orientadas a eliminar el tóxico y proteger el tejido hepático3,16,44,86–88.
Identificación del hongo causante de la intoxicaciónEl primer paso es la caracterización del espécimen ingerido.
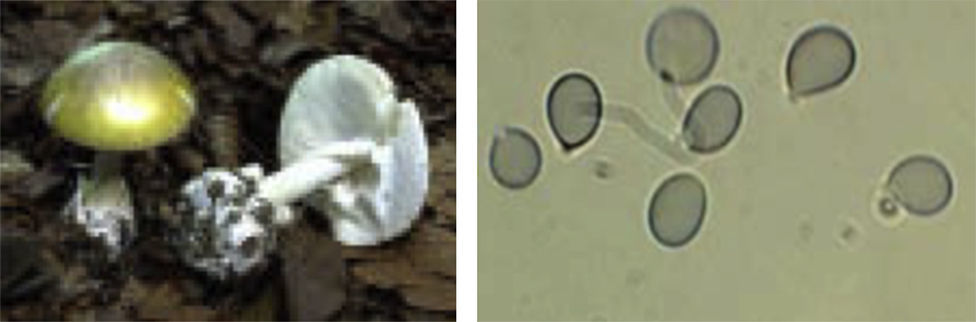
MorfologíaEs conveniente que el paciente proporcione la muestra o restos de los hongos consumidos para que sean identificados por un experto79,89. El estudio micológico puede verse dificultado por la mala conservación de los especímenes (la cocción o el almacenamiento prolongado pueden alterar el aspecto y dificultar la identificación de las esporas83,90,91), además de ser un procedimiento lento92 y que depende de la disponibilidad de personal experto (figs. 2 y 3).
Amanita phalloides y sus esporas89.
Lepiota bruneoincarnata y sus esporas89.
Esta prueba fue descrita originalmente por Wieland93 como una forma práctica de saber si unos restos orgánicos contienen amanitina. Consiste en depositar una pequeña cantidad del espécimen a estudiar (jugo de los hongos) sobre un papel rico en lignina (por ejemplo, papel de periódico pero no el papel de filtro habitual en el laboratorio) según la aportación de Meixner94, añadir HCl concentrado y, manteniéndolo al abrigo de la luz solar, calentar ligeramente sin sobrepasar los 30°C, por ejemplo con un secador de aire. El papel adquiere un color azul en 1 a 3min si la muestra contiene más de 2μg de amanitina79,89,95. No obstante, es un procedimiento inespecífico que presenta falsos positivos y negativos (19%) y no es capaz de resolver las diferentes amatoxinas96–98.
CromatografíaLa cromatografía en capa fina es un método rápido y asequible a muchos laboratorios, pero que presenta una baja resolución, poca sensibilidad y en el que la identificación descansa sobre la inespecificidad de reactivos y la comparación de la movilidad relativa con patrones.
La cromatografía líquida de alta resolución (HPLC), cuando se acopla a detectores de alta sensibilidad (espectrometría de masas en tándem, MS/MS) ofrece los mejores resultados, aunque con la dificultad añadida de la extracción de toxinas de diferente polaridad.
Por último, cabe mencionar la posibilidad de utilizar electroforesis capilar y en zona para separar las toxinas, y así poder identificar el hongo responsable de la intoxicación99.
Técnicas de biología molecularA finales de la década de 1980100 se abrió una posible alternativa a estos procedimientos a través de la metodología basada en el estudio de polimorfismos mediante la reacción en cadena de la polimerasa (PCR) para la amplificación aleatoria de ADN polimórfico, la restricción fragmentos de longitud (PCR/RFLP) y la longitud de fragmentos amplificados (PCR/AFLP)79,89. La identificación taxonómica de los hongos se confirma secuenciando regiones espaciadoras transcritas internas, regiones no codificantes de ADN ribosómico que separan componentes individuales. Se trata de regiones mucho más polimórficas que las propias regiones génicas, y por tanto constituyen marcadores genéticos útiles101. La primera detección específica utilizando PCR convencional para identificar A. phalloides a través de la amplificación de un fragmento del gen de la gliceraldehído 3 fosfato deshidrogenasa se describió en 2000102. Se trata de un procedimiento lento y poco sensible, quizás porque este gen no sea el más adecuado103,104. Originalmente era un procedimiento que no se validó para esporas ni se extendió a muestras biológicas. Unos años después se propuso la PCR en tiempo real para identificar 4 especies de hongos tóxicas habituales en Japón105 y para A. phalloides106. Existen también propuestas de macroarrays para ADN ribosómico de Amanita107 o PCR directa para restos de hongos crudos, cocinados o digeridos en parte o en su totalidad, con finalidades esencialmente forenses y que solo requieren 0,04pg de material genético103.
Exámenes de laboratorioEn la fase de afectación gastrointestinal las determinaciones de laboratorio se orientan al diagnóstico y seguimiento de la deshidratación y trastornos electrolíticos. En las siguientes fases se monitorizan los exámenes de laboratorio indicativos de daño y regeneración de los tejidos hepático y renal: enzimas de origen hepático y pancreático, bilirrubina, amonio, urinálisis, factores de coagulación, fibrinógeno y recuento de células periféricas25.
Determinación específica de amatoxinas en líquidos biológicosLa determinación de amatoxinas en líquidos biológicos viene realizándose desde hace décadas, aunque no se han publicado estudios exhaustivos de validación, por lo que solamente cabe asignarle una utilidad relativa de confirmación del diagnóstico establecido mediante la historia y la sintomatología clínicas. La exactitud diagnóstica mejora cuando se combina la alta sensibilidad y el valor predictivo del resultado negativo de las manifestaciones clínicas con la alta especificidad y valor predictivo del resultado positivo en la determinación de amatoxina en orina, siempre que esta se recogiera antes de que hayan transcurrido 36h de la exposición108. Es posible que una considerable cantidad de amatoxinas ya no esté presente en plasma si el paciente llega al hospital cuando ya han transcurrido más de 12h después de la ingestión y se han empezado a manifestar los primeros síntomas77,90,109. El periodo de detección de micotoxinas en plasma es de aproximadamente 36h77,108,110. En orina, el espécimen de elección99,110, la detectabilidad empieza a los 90min y puede prolongarse hasta 4 días después de la ingestión33,77,111.
De acuerdo con la excreción de amanitinas en orina se pueden establecer los siguientes estadios79,112:
- 1.
Concentraciones en orina inferiores a 3μg/l en las primeras 24-48h después de la ingesta indican intoxicación leve o nula.
- 2.
Concentraciones en orina entre 3 y 25μg/l en las primeras 24h o entre 3 y 15μg/l en las 24-48h después de la ingesta pueden evolucionar como intoxicaciones leves o graves.
- 3.
Concentraciones en orina superiores a 25μg/l en las primeras 24h o de 15μg/l de las 24-48h después de la ingesta son potencialmente mortales, especialmente si superan los 100μg/l.
Sin embargo, el resultado de la determinación de amatoxina en orina no se corresponde estrictamente con la gravedad de la lesión hepática, por lo que su valor pronóstico es discutible98. Posiblemente las variaciones en la dilución de la orina (en especial si previamente se ha administrado líquidos o forzado la diuresis) impiden una estrecha correspondencia con la clínica.
La resultados publicados de la determinación tanto en plasma como en orina muestran una considerable variabilidad atribuible a factores como cantidad, especie y partes de hongos ingeridos, área geográfica de crecimiento, además, lógicamente, del método analítico utilizado. Por ejemplo, en casos mortales se han descrito resultados desde 1μg/l59 a 8-150μg/l77.
Los procedimientos analíticos utilizados para la determinación de amanitinas en líquidos biológicos han sido:
RadioinmunoanálisisLos primeros intentos para conseguir anticuerpos frente las toxinas de A. phalloides utilizando extractos crudos se remonta a finales del siglo xix113, aunque sin éxito por la escasa antigenicidad de los péptidos. Posteriormente se intentó mejorar los resultados utilizando complejos de albúmina bovina que tampoco resultaron demasiado antigénicos, pero que se manifestaron mucho más tóxicos que las propias amatoxinas. Finalmente se logró un complejo albúmina-péptido-polilisina, menos tóxico y más antigénico que permitió desarrollar un primer radioinmunoanálisis (RIA) funcional con 3H como trazador114,115. Más tarde se utilizó como trazador el 125I desarrollando inmunoanálisis hasta 6 veces más sensibles y que requerían la mitad de tiempo de realización que los basados en 3H116. Durante muchos años el RIA fue considerado el método de referencia99; sin embargo, a los inconvenientes tradicionales de los inmunoanálisis isotópicos se sumó la poca estabilidad del trazador, que implicaba una caducidad prematura y una baja sensibilidad de los anticuerpos a la amanitina117.
Inmunoanálisis enzimáticoExiste un inmunoanálisis comercializado (Amanitin ELISA, Bühlmann Laboratories AG CH–4124 Schönenbuch/Basel, Suiza) que permite cuantificar amatoxina en orina79,89,112. No requiere los complejos procesos de extracción de la cromatografía ni las medidas de seguridad que lleva aparejado el RIA110. Actualmente es el método que muchos laboratorios clínicos han adoptado para confirmar o descartar intoxicaciones por hongos que contengan amatoxinas. El desarrollo analítico completo (incluyendo una calibración entre 0 y 100μg/l) es aproximadamente de una hora, por lo que puede utilizarse en el contexto de un laboratorio de urgencias. Se interpreta en función de un valor discriminante de 3μg/l propuesto por el fabricante. Valores superiores a 5μg/l se concluyen como claramente positivos118. Tiene una especificidad del 100% para α-amanitina, 90% para δ-amanitina, y 0% para δ-amanitina y falotoxinas. Puede utilizarse preferentemente con especímenes de orina, pero también de suero o plasma.
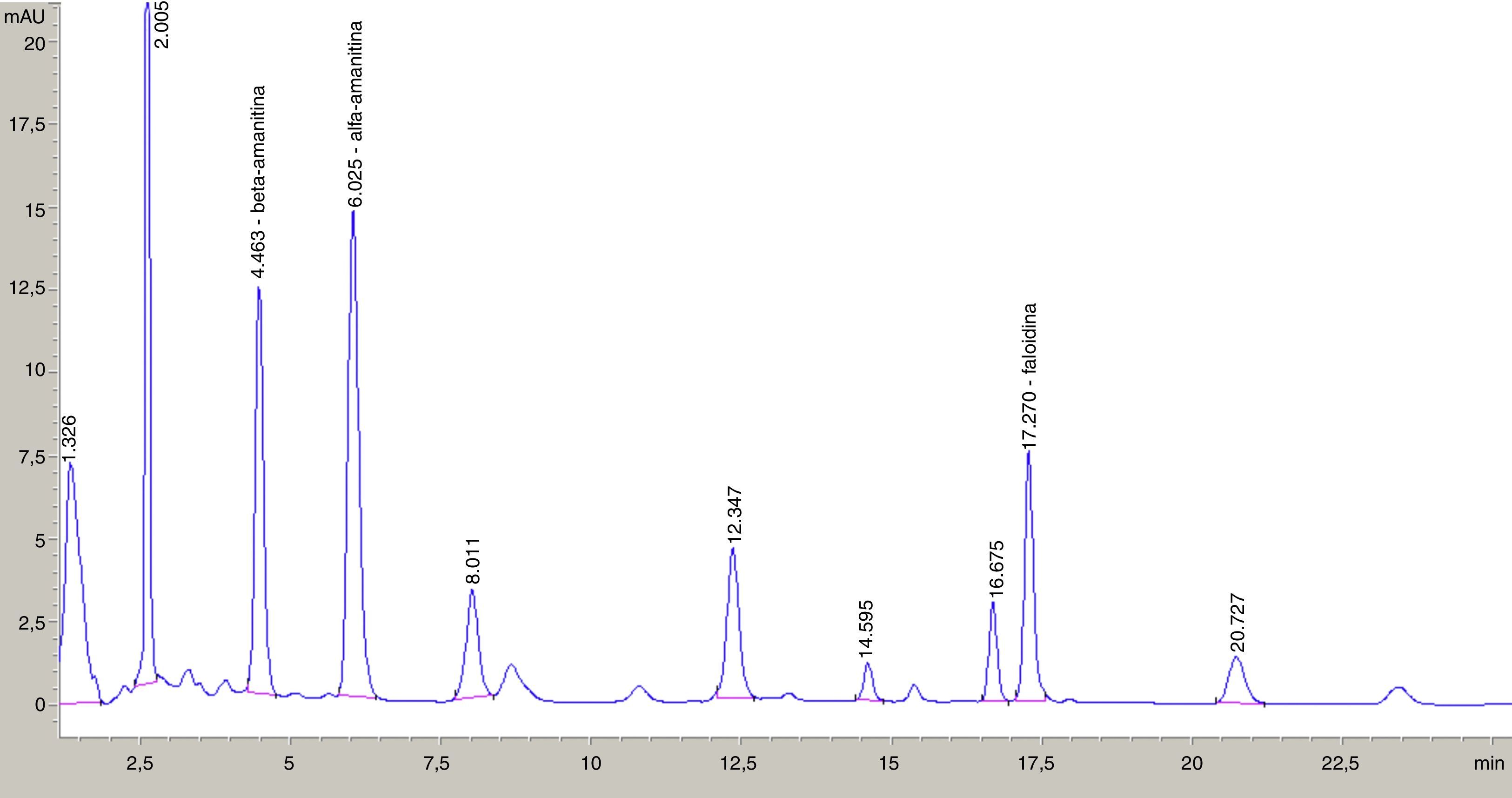
CromatografíaLa cromatografía de gases acoplada a un espectrómetro de masas ha sido considerada durante muchos años como la técnica de referencia en toxicología, pero no es posible aplicarla a la resolución de péptidos no volátiles como las amatoxinas119. No obstante, la HPLC es precisa, sensible y específica, pero también costosa y lenta89. Muchos de los procedimientos descritos para preparar la muestra utilizan sistemas de extracción en fase sólida, tanto de intercambio catiónico (por ejemplo benceno sulfonil propilsilano), con cadenas hidrofóbicas (C8, C18) como con combinaciones de ambas fases estacionarias, por lo que exhiben una notable capacidad de retener todo tipo de fármacos: ácidos, básicos, neutros o anfóteros120. Por lo que respecta a la identificación se han utilizado detectores electroquímicos, de radiación UV: fotomultiplicadores o de matrices de diodos, y espectrómetros de masas y en tándem. No obstante, los métodos de detección más simples y asequibles no permiten la identificación simultánea de amatoxina y falotoxinas por requerir diferente longitud de onda para su identificación. En la figura 4 se presenta un ejemplo de cromatograma realizado en un extracto de A. phalloides.
Cromatograma obtenido a partir de una muestra homogenizada de tejido de Amanita phalloides en una mezcla de metanol/agua/HCl 0,01M (5:4:1). Inyección de 0,200ml en un equipo HPLC con detección por diode array (Agilent 1200). Columna C18; fase móvil: acetato amónico 0,05M/acetonitrilo (90:10), pH: 5,5. Flujo 1ml/min. Destaca la elevada concentración de beta amanitina, alfa amanitina y faloidina (cedido por Jordi To-Figueras. Laboratorio de Toxicología, Hospital Clínic de Barcelona; noviembre de 2014).
Como ya se ha mencionado, las concentraciones observadas en líquidos biológicos en caso de intoxicaciones son muy variables. Típicamente están entre 2 y 10μg/l por HPLC9,121,122 o entre 0,26 y 2,5μg/l por MS MS75,109.
Electroforesis capilar en zonaSe trata de un procedimiento analítico rápido y sencillo con un límite de detección entre 1,5 y 1000μg/l, en algunos casos demasiado alto para las necesidades clínicas99,123,124. Ocasionalmente se ha señalado problemas de reproducibilidad120.
TratamientoSe hace difícil evaluar la eficacia clínica de todos los tratamientos sugeridos debido a que hasta hace relativamente poco tiempo se desconocían los mecanismos moleculares de la intoxicación125. Además, la literatura médica es escasa y muchas veces de carácter meramente anecdótico3. Aparentemente no existe antídoto disponible ni estrategia estándar. De cualquier modo, la supervivencia está condicionada por la precocidad del diagnóstico, de la hospitalización y de la implantación inmediata de medidas terapéuticas126. En un estudio de 1999 ya se concluía que los pacientes tardaban una media de 32h en recibir tratamiento, muchas veces cuando el daño hepático era ya irreversible y, por tanto, la supervivencia baja87.
Debe diferenciarse entre medidas de soporte y medidas terapéuticas.
- 1.
Cuidados médicos preliminares: descontaminación gastrointestinal. Teniendo en cuenta el período de latencia, la eficacia de los procedimientos habituales (inducción del vómito, lavado gástrico, etc.) es dudosa y solamente debe considerarse si la ingestión ha sido reciente.
- 2.
Medidas de soporte de implantación obligada al inicio del cuadro clínico:
- ∘
Mantenimiento de vías aéreas y estabilización hemodinámica.
- ∘
Establecimiento de un plan de hidratación parenteral para mantener el ritmo diurético de 3ml/kg/hora. La reposición de líquidos es importante en la fase gastrointestinal para evitar la deshidratación, debido a que la amatoxina se elimina por la orina en las primeras 24h.
- ∘
- 3.
Medidas específicas de detoxificación consistentes en disminuir la absorción, estimular la eliminación y administrar fármacos con el fin de proteger el hígado de la exposición tóxica:
- ∘
Para limitar la absorción se ha propuesto la administración cada 4h de 1g/kg de peso de carbón activado y sorbitol al 70% siempre que no presente diarrea, aunque existe poca evidencia de su eficacia. Puede combinarse con la aspiración gastroduodenal mediante una sonda de aspiración continua nasoduodenal con el fin de reducir la reabsorción del tóxico por recirculación enterohepática78,127,128.
- ∘
Respecto a la eliminación urinaria no se recomienda forzar la diuresis y se considera suficiente un flujo urinario de 0,1-0,2l/h para eliminar las toxinas.
- ∘
Los primeros procedimientos de depuración extrarrenal de amatoxinas fueron la hemoperfusión con carbón y la hemodiálisis, aunque con éxito desigual debido a que las amatoxinas poseen una alta afinidad por superficies de polímeros de carbono86,129–132. Estos procedimientos solamente serán efectivos si se inician durante las primeras 24-36h después de la ingesta debido al rápido aclaramiento plasmático de la amatoxina74,129,133,134. Además de precoz, se recomienda que la hemodiálisis sea prolongada porque el lactato se produce más rápidamente que se depura3,135. La plasmaféresis136 y la diálisis peritoneal137 también tienen una utilidad limitada138. Recientemente se ha propuesto el sistema de reciclado absorbente molecular (MARS)139,140 que incluye un circuito intermedio con 10-20% de albúmina en un sistema estándar de hemodiálisis o hemofiltración y una membrana de alta selectividad. Es un sistema útil para depurar sustancias hidrosolubles o unidas a proteína139,141. Se ha utilizado con éxito en pacientes con insuficiencia hepática aguda grave131,142–145, por lo que sería un procedimiento alternativo al trasplante hepático ortotópico145 o como un tratamiento puente hasta poder realizar dicho transplante146.
- ∘
Algunos fármacos han demostrado, de forma más o menos contrastada, su eficacia como antídotos en algún estudio experimental, pero pocos han llegado de forma protocolizada a la práctica clínica. En general su actuación se basa en el bloqueo farmacológico de la entrada de toxinas en el interior de la célula hepática más que en mecanismos intracelulares147:
- •
Ácido tióctico (ácido α-lipoico) (300-600mg/kg/d i.v. en 4 dosis) introducido en 1959, funciona como una de las coenzimas de la descarboxilación oxidativa del piruvato y otros ceto-ácidos del ciclo de Krebs25,61,148–150.
- •
Dexametasona (8-16mg/d i.v.), pero con resultados controvertidos61.
- •
Etanol, según un único estudio, parece ser que reduce la absorción de toxinas si se consume en el momento de la exposición151.
- •
Cimetidina, potente inhibidor del citocromo P450, se mostró eficaz en proteger de cambios mitocondriales en ratones de forma profiláctica y 6h después de la exposición a α-amanitina152. Sin embargo, no se mostró activa frente a la faloidina153.
- •
Glucósidos iridoides heterósidos utilizados en medicina tradicional china, como catalpol, swertimarina, gardenosido y especialmente aucubina han mostrado un efecto protector hepático en modelos de intoxicación por A. virosa en perros154, y combinadas con kutkina, un glucósido aislado de la raíz de Picrorhiza kurroa, frente a A. phalloides en ratón155.
- •
Penicilina (1.000.000UI i.v. el primer día y 500.000 los 2 días siguientes), fármaco bien conocido y seguro, pero susceptible de producir alergias27,33, actuaría a través de un mecanismo de acción no del todo bien conocido. A altas dosis parece ser que bloquea la ADN polimerasa alfa, la proliferación de células eucariotas, la disminución de producción de gamma-amino butírico156 además de bloquear la captación de amatoxina compitiendo por los sitios de unión de las proteínas61,157, aunque la eficacia es discutible3. Se ha administrado sola o en combinación con otros fármacos como el ácido tióctico o con silibinina158. La ceftazidina, miembro de la tercera generación de cefalosporinas, parece ser más potente que los beta-lactámicos y tener menos efectos secundarios159.
- •
N-acetil cisteína (NAC) (150mg/kg i.v. en la primera hora y 50mg/kg cada 4h160–162) es un fármaco que actúa sobre el ciclo del glutatión y que es utilizado en la intoxicación por acetaminofén. Se ha propuesto para el tratamiento de la intoxicación por amatoxinas cuando se detecta insuficiencia hepatocelular debido a su actividad antioxidante inespecífica162–165. La captación de radicales libres, la repleción de glutatión y la alteración de puentes intramoleculares de la amatoxina serían las claves de su efectividad166. Por tanto, tendría actividad toxicodinámica (antioxidante, antiinflamatoria y antifibrótica) y toxicocinética (inhibición de la captación por los hepatocitos y de la circulación enterohepática). Sin embargo, hay que tener en cuenta la posibilidad de que interfiera en las pruebas de coagulación167–170.
- •
Silibinina, el flavonoide polifenólico más abundante de la planta comestible mediterránea Sylibum marianum (cardo mariano) (5mg/kg i.v. en una hora; y 20 a 50mg/kg/día en perfusión i.v. continua, hasta normalizar los factores de coagulación171–172). Actúa: a) contrarrestando la peroxidación lipídica capturando radicales libres y aumentando la presencia de la forma reducida del glutatión173–174; b) estabilizando la membrana de los hepatocitos no afectados175 y modulando los transportadores de fármacos, por ejemplo a través de la inhibición de la glucoproteína P, responsable de la eliminación de diversos fármacos lipofílicos, potenciando su acción176; c) regulando la expresión de factores nucleares como el NF-κ B que participan en la regulación de la inflamación y la apoptosis, contribuyendo a la producción de IL-1, IL-6, α-TNF, linfotoxina, GM-CSF, interferón γ, etc.177–178; d) inhibiendo la transformación de hepatocitos estrellados en miofibrobastos, mecanismo de depósito de colágeno que conduce a la cirrosis179–180; e) modulación de los receptores nucleares de hormonas esteroides estrogénicas181,182; y f) actividad antiangiogénica asociada a restricción del receptor 3 del factor de crecimiento vascular endotelial183. Aunque la evidencia es aún limitada177 o controvertida184,185, parece ser que es eficaz sola o asociada a penicilina en la protección y tratamiento de la intoxicación por amanitinas, siempre que se administre precozmente, antes de que transcurran 24h de la ingestión180.
- •
Amifostina, un tiofosfato orgánico profármaco del WR-1065 (tiol libre), es un agente desarrollado en ámbitos militares para la protección celular frente a la radiación terapéutica y de una serie de agentes quimioterapéuticos (como cis- y carboxiplatino, fluorouracilo, etc.). Actuaría como depurador de radicales libres y protegería de la lipoperoxidación, el entrecruzamiento del ADN, aumentaría el glutatión intracelular y cooperaría en la reparación del ADN dañado186–188. A dosis de 0,25-0,50g/kgha mejorado moderadamente la supervivencia de ratones expuestos (20%) frente a la de controles (10%). A dosis más altas (1,6g/kg) probablemente su propia toxicidad se combinó con la de la amanitina189 porque el resultado fue una supervivencia menor que la del control190.
- •
- ∘
En la actualidad, para algunos hospitales de referencia los fármacos de elección son la silibinina y la penicilina. No obstante, a pesar de la incertidumbre que generan los diferentes modelos experimentales, parece ser que silibinina y NAC, solos o asociados, son los fármacos más prometedores ya que logran reducir la tasa de mortalidad de un 10,66% a un 5,6% y un 6,8% respectivamente3,180. Sin embargo, en un estudio con ratones en que se comparó la efectividad del tratamiento con NAC, silibinina, ácido tióctico, cimetidina y penicilina frente a controles, se concluyó que ninguno de ellos era capaz de reducir significativamente el incremento de la actividad aminotransferasa ni disminuir la necrosis hepática185. A pesar de ello, en otro estudio relativamente reciente se consiguió la supervivencia de todos los pacientes tratados antes de que transcurriera 36h de la exposición mediante la corrección de trastornos hidroelectrolíticos y de coagulación, manteniendo una diuresis moderadamente incrementada (0,2l/h, al menos 2 días) y administrando a las dosis expuestas anteriormente: carbón activado (3 días), dexametasona, glutatión (2,4g/12h) y penicilina126.
4. Trasplante hepático: en 1985 se realizó el primer trasplante hepático a una niña de 3 años por insuficiencia hepática consecuencia de intoxicación por amatoxinas191. De las 2 técnicas de trasplante hepático, ortotópico y parcial auxiliar, se ha propuesto este último como medida provisional hasta recuperar la funcionalidad de la parte original respetada192. La cuestión principal es establecer el momento más oportuno para poder realizarlo con éxito. Si el trasplante se efectúa demasiado pronto se expone al paciente al riesgo quirúrgico y se compromete su calidad de vida cuando hubiese podido sobrevivir con un tratamiento menos agresivo, pero si la decisión se pospone demasiado puede morir, por ejemplo, por no hallarse a tiempo un donante193,194. Por tanto, es importante que entre las 36-48h se tome una decisión sobre la realización de trasplante147. El intervalo más exigente para realizar el trasplante es de 24-48h después de observarse los criterios de selección195; el intervalo menos exigente es el del King's College para intoxicación diferente de paracetamol: 60h196. Criterios intermedios, 48h, son los de Ganzert197 o el del King's College para intoxicación por paracetamol198.
La etiología es el factor decisivo en el resultado del trasplante196,199,200, pero en muchas ocasiones el diagnóstico de la intoxicación por amatoxinas es incierto192,201 y es preciso adoptar criterios de indicación quirúrgica establecidos para otras etiologías, como la intoxicación por paracetamol196. No obstante, la literatura recoge diversos criterios para establecer la indicación del transplante en la intoxicación por amatoxinas:
- ∘
Criterios del Hospital del King's College (1989)196: a) INR por encima de 7; o b) por lo menos 3 de los siguientes signos: INR por encima de 3,5, bilirrubina en suero por encima de 300μmol/l, edad inferior a 10 años o por encima de 40 años, intervalo entre ictericia y encefalopatía de más de 7 días y toxicidad farmacológica. No serían indicativas la elevación de la concentración de bilirrubina y amonio, que sí lo son en la insuficiencia hepática fulminante de origen viral o por intoxicación por acetaminofén198,202–205.
- ∘
Criterios de Klein y Pinson (1990)127,128: tiempo de protrombina médicamente poco tratable y prolongado (>50%) junto a acidosis metabólica, hipoglucemia, hipofibrinogenemia, aumento del amonio sérico seguido de una marcada elevación de las concentraciones de aminotransferasas.
- ∘
Criterios de Hôpital Beaujon-Clichy (1993)206: a) Disminución del factor V por debajo del 30% del límite de referencia en pacientes de más de 30 años, o por debajo del 20% en pacientes de menos de 30 años; y b) encefalopatía de grado 3-4.
- ∘
Criterios de Beckurts, 1997207: a) tiempo de protrombina inferior al 20% de la referencia en curso de varios días; b) concentración sérica de creatinina superior a 124μmol/l incluso después de corregir anomalías hidroelectrolíticas; c) concentración sérica de bilirrubina>79μmol/l y encefalopatía progresiva que indicaría un curso letal.
- ∘
Criterios de Ganzert (2005)197: presentar en cualquier momento entre el tercer y el décimo día después de la ingestión: a) índice de protrombina igual o inferior al 25% de la referencia; y b) concentración sérica de creatinina igual o superior a 106μmol/l, prescindiendo de la presencia o no de encefalopatía y de otros factores como género (más frecuente en mujeres) y edad (menor supervivencia en niños). La posible sensibilidad a interferencias en la determinación de creatinina y la posible inconsistencia del índice de protrombina han sido objeto de discusión208.
Escudié209 juzga superior el criterio del Hospital del King's College, y sugiere valorar un INR superior a 6 a los 4 días o más de la ingestión. La encefalopatía tampoco sería un criterio de indicación de trasplante urgente.
El trasplante hepático por insuficiencia aguda plantea contraindicaciones absolutas y relativas:
- (a)
Contraindicaciones absolutas:
- ∘
Enfermedad cardiopulmonar incorregible que constituye un riesgo prohibitivo para la cirugía.
- ∘
Enfermedad maligna no hepática de menos de 5 años de evolución (exceptuando cáncer dermatológico superficial) o que no cumple criterios oncológicos de curación.
- ∘
Adicción al consumo de alcohol o drogas, requiriéndose ocasionalmente 6 meses de abstinencia o afiliación a programas de rehabilitación y abstinencia.
- ∘
- (b)
Contraindicaciones relativas (que deben ser consideradas individualmente):
- ∘
Edad avanzada (más de 65 años).
- ∘
Infección por el VIH.
- ∘
El embarazo no es una contraindicación para el trasplante210.
En la actualidad la expectativa de supervivencia del paciente tratado correctamente es del 90%, excluyendo el resto al que se le practica el trasplante hepático (fig. 5).
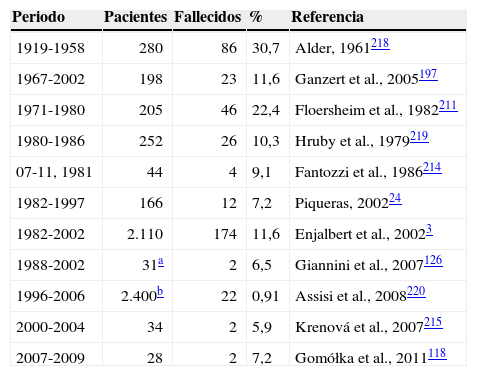
Mortalidad y epidemiologíaMortalidadAl inicio de la década de 1950 la mortalidad era del 20-30%. Con la introducción de medidas de tratamiento más eficaces ha descendido progresivamente a un 7%127,160. Sin embargo, debe tenerse en cuenta que la mortalidad en niños menores de 10 años es de alrededor del 50%26–27, probablemente porque ingieren mayor cantidad de toxina por kg de peso (tabla 7).
Mortalidad de las intoxicaciones por setas hepatotóxicas
| Periodo | Pacientes | Fallecidos | % | Referencia |
|---|---|---|---|---|
| 1919-1958 | 280 | 86 | 30,7 | Alder, 1961218 |
| 1967-2002 | 198 | 23 | 11,6 | Ganzert et al., 2005197 |
| 1971-1980 | 205 | 46 | 22,4 | Floersheim et al., 1982211 |
| 1980-1986 | 252 | 26 | 10,3 | Hruby et al., 1979219 |
| 07-11, 1981 | 44 | 4 | 9,1 | Fantozzi et al., 1986214 |
| 1982-1997 | 166 | 12 | 7,2 | Piqueras, 200224 |
| 1982-2002 | 2.110 | 174 | 11,6 | Enjalbert et al., 20023 |
| 1988-2002 | 31a | 2 | 6,5 | Giannini et al., 2007126 |
| 1996-2006 | 2.400b | 22 | 0,91 | Assisi et al., 2008220 |
| 2000-2004 | 34 | 2 | 5,9 | Krenová et al., 2007215 |
| 2007-2009 | 28 | 2 | 7,2 | Gomółka et al., 2011118 |
El pronóstico de la intoxicación viene indicado por la precocidad e intensidad del descenso de tiempo de protrombina209: si llega a ser inferior al 10% se considera letal; entre el 10 y 40% de gravedad moderada y si es superior al 40% de gravedad ligera211. Cuando la actividad de las aminotransferasas en plasma es mayor de 1.000U/l la tasa de mortalidad alcanza el 30-50%211. Sin embargo, es escaso el valor pronóstico de la bilirrubina y el de la creatinina plasmática, que aumenta al final del curso clínico fatal128,212, o expresado de manera similar la asociación de encefalopatía y daño renal209. Finalmente, el inicio de la diarrea antes de 8h después de la ingestión constituye un factor de mal pronóstico209.
Los supervivientes suelen evolucionar sin secuelas, aunque a tenor de los escasos informes publicados del seguimiento a medio y largo plazo, se puede admitir que un cierto número de pacientes progresará a enfermedad hepática crónica213–215.
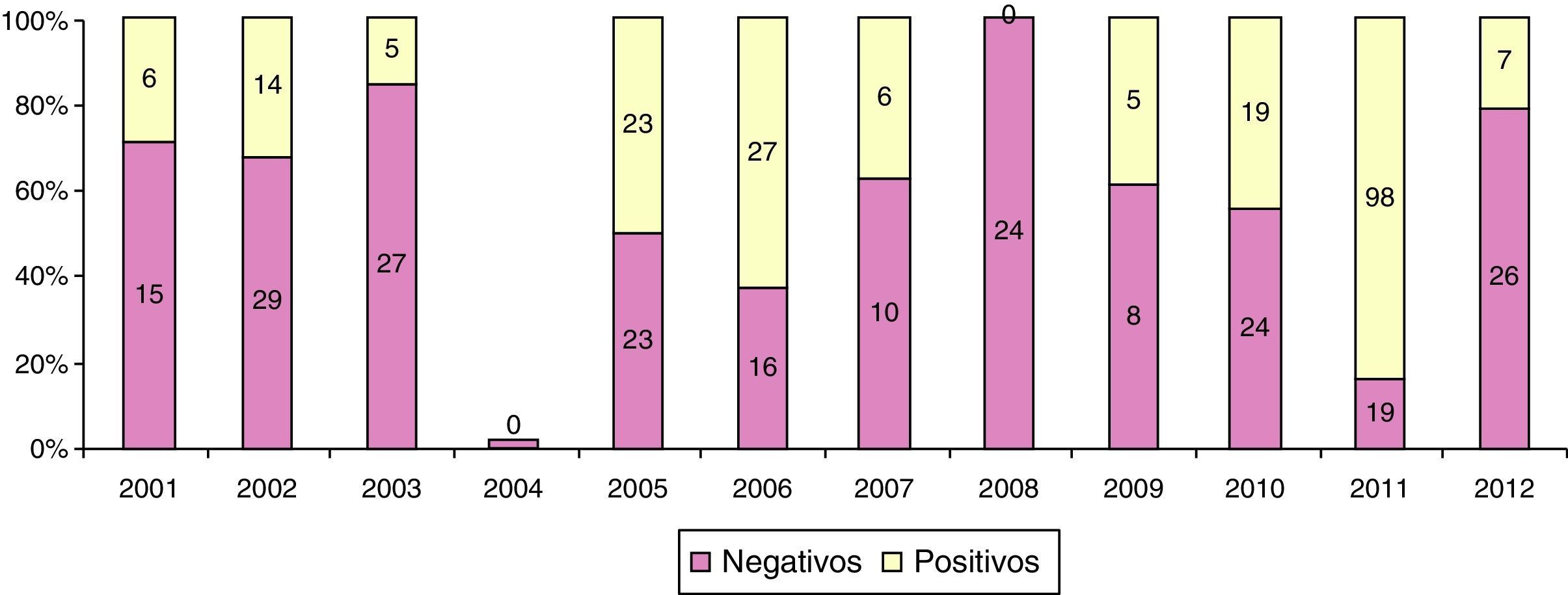
EpidemiologíaLos datos de los centros de información toxicológica muestran una incidencia de entre 2-6 posibles exposiciones por hongos por cada 1.000 consultas. En el año 2011 la American Association of Poison Control Centers, registró 6.818 exposiciones a hongos de un total de 2.334.004 consultas correspondientes a 57 centros (0,3%)216. En España, según datos del Servicio de Información Toxicológica del Instituto Nacional de Toxicología y Ciencias Forenses del Ministerio de Justicia, en un año se recogieron 187 consultas sobre hongos de un total de 77.000 exposiciones (0,23%)19. La incidencia de la intoxicación varía geográficamente y depende de factores como la dieta, el clima, el estilo de vida y los factores culturales26. En España la incidencia es de 5-10 casos por millón de habitantes. De estos el 30% son por amatoxinas112,160. En la figura 6 se presenta un ejemplo de incidencia de intoxicaciones por amatoxinas (positivas respecto al número de solicitudes) recogidas en el Hospital Clínico de Barcelona como centro de referencia entre 2001 y 2012.
Relación entre evolución, tratamiento y pronóstico en la intoxicación por amanitinas.
Las características de los intoxicados por micetismos presentan características muy especiales. Por lo general, son intoxicaciones típicamente estacionales, otoñales y de fin de semana, los denominados Sunday pickers217. Parece ser que una mayoría de intoxicaciones, que puede ser de hasta el 80%, se observa en grupos de 2 o más personas. Así mismo, se afirma que la incidencia es ligeramente superior en el sexo masculino —56%— y con un perfil urbano (75%) frente al rural (tabla 8).
Características epidemiológicas de los micetismos
| Intoxicación colectiva en el 80% de los casos |
| Estacional: en otoño (desde final de agosto a principio de diciembre) |
| Fin de semana: solicitud de asistencia en la madrugada o mañana del lunes |
| Afecta a todas las edades, sin diferencia de género, aunque la mayoría suelen ser adultos |
| Incidencia: 5-10 casos/millón habitantes/año (en España, 200-400 casos/año) |
| La mitad de las intoxicaciones no llega a los hospitales |
| De la mitad que consulta el 32,3% son formas graves del tipo A. phalloides |
Las intoxicaciones por hongos no comestibles pueden ser accidentales o intencionadas, ya sea de autolisis o de carácter criminal. En estos casos tendrán las repercusiones e implicaciones legales correspondientes.
Respecto a los accidentes, hay que tener en cuenta que en ocasiones los hongos no comestibles son difíciles de identificar127, y muchas veces es el consejo de personas inexpertas o la utilización de criterios erróneos de identificación («ennegrecimiento de un ajo al cocinarlas») causan la intoxicación. En estos casos las situaciones médico-legales que se derivan pueden estar relacionadas con la atención al paciente, en tiempo y forma, es el caso de las responsabilidades derivadas por posible demora en el diagnóstico o actuación diagnóstico-terapéutica no acorde con las exigencias propias de la lex artis. Incluso en el ámbito ético y deontológico los posibles conflictos derivados de los criterios de indicación del trasplante hepático19. En otros casos y en ámbitos profesionales como la restauración y hostelería se podría incurrir en responsabilidades penales derivadas de posibles delitos contra la salud pública.
También se pueden plantear problemas médico legales y forenses en los casos de diagnóstico cierto de la causa de muerte derivada de una intoxicación por amanitinas. Se podría exigir la intervención como testigos de los profesionales sanitarios que atendieron al paciente, realizar informes periciales postmortem, exigibles para conocer la causa de la muerte suicida, homicida o accidental. En todos los casos debe recordarse la importancia médico-legal que adquiere la documentación clínica detallada, que debe constar en la historia clínica y en la que deben estar recogidas las actuaciones profesionales de carácter diagnóstico terapéutico que se hubieren realizado, intervención de profesionales, interconsultas, exámenes complementarios, informes de laboratorio o los criterios diagnóstico terapéuticos que se reflejan en la hoja de evolución. No debe olvidarse que la documentación clínica puede ser requerida por la administración de justicia a fin de resolver las cuestiones y circunstancias médico-legales que de deriven de este tipo de intoxicaciones.
ConclusiónLa recolección y consumo de hongos silvestres es un hábito común en algunas zonas micófagas. Muchas veces la recolección se hace por personas inexpertas en el reconocimiento de especies tóxicas, por lo que supone un riesgo potencial. Aunque no sea un cuadro frecuente, la morbimortalidad asociada a esta exposición y la necesidad de instaurar precozmente un tratamiento hacen que sea conveniente un conocimiento actualizado tanto de la clínica como de las opciones terapéuticas. El laboratorio puede desempeñar un papel fundamental en el hecho de confirmar o descartar la sospecha de intoxicación. Actualmente se dispone de diferentes procedimientos para medir la concentración de amatoxinas en diferentes fluidos biológicos, siendo la orina el espécimen de elección, aunque no se han realizado estudios de validación completos de estos métodos, por lo que su utilidad es todavía relativa en la confirmación de una intoxicación que ha sido diagnosticada mediante la historia y la sintomatología clínica.
Conflicto de interesesNinguno.
Los autores desean agradecer los consejos y sugerencias del Dr. J. Piqueras en la redacción del manuscrito.