El estudio del papel de las citoquinas en los procesos neuroinmunológicos se ha intensificado en la última década, si bien los resultados han sido contradictorios debido al empleo de tecnologías poco sensibles. La implementación de la tecnología Multiplex en los inmunoensayos puede ser beneficiosa en la evaluación de pacientes con daño cognitivo leve (DCL) que evolucionan a enfermedad de Alzheimer (EA).
Materiales y métodosTreinta y siete pacientes con DCL y 24 sujetos control fueron estudiados mediante análisis Multiplex de citoquinas intratecales y en suero. Las variables del estudio fueron las citoquinas IL1β, IL2, IL5, IL6, IL7, IL8, IL10, IL12p70, IL13, factor necrosis tumoral alfa (TNFα), interferón gamma (IFNγ) y factor de crecimiento de granulocito-macrófago (GM-CSF) y los cocientes pro/antiinflamatorios IL6/IL10, IL6/IL5, IL8/IL10, IL8/IL5, TNFα/IL10 y TNFα/IL5. Se estudió la evolución a EA en los pacientes DCL y en los sujetos control en el período de un año.
ResultadosSe encontraron diferencias significativas (p<0,05) para el cociente IL6/IL10 entre el grupo DCL y el grupo control (mediana [rango intercuartílico]): (1,39 [1,18-1,80] vs. 1,91 [2,68-1,18] pg/ml). De 37 pacientes con DCL, 14 evolucionaron a EA (DCL-EA) en el período de un año. De nuevo se encontraron diferencias significativas (p<0,05) en el cociente IL6/IL10 entre el grupo DCL-EA y DCL- S (o estable): (1,29 [0,84-1,56] vs. 1,42 [1,27-2,07] pg/ml). Ninguno de los sujetos control evolucionó a EA.
ConclusionesEl descenso en el cociente IL6/IL10 en LCR puede ser un prometedor marcador diagnóstico de DCL y predictor/pronóstico de EA en DCL.
There has been an increase in the number of studies on the role of cytokines in neuro-immunological processes, over the last ten years, but some of these results have been contradictory due to a lack of sensitivity in the technology. The new Multiplex immunoassays can be beneficial for monitoring Mild Cognitive Impairment (MCI) patients who progress to Alzheimer Disease (AD).
MethodsA study was conducted on 37 MCI patients and 24 control subjects by means of multiplex analysis of CSF cytokines. The variables measured were the following cytokines: IL1β, IL2, IL5, IL6, IL7, IL8, IL10, IL12p70, IL13, tumour necrosis factor alpha (TNFα), interferon gamma (IFNγ) and granulocyte – macrophage growth colony stimulating factor (GM-CSF), as well as the following pro/anti-inflammatory ratios: IL6/IL10, IL6/IL5, IL8/IL10, IL8/IL5, TNFα/IL10 and TNFα/IL5. Progress to AD in MCI patients was studied over a period of one year.
ResultsSignificant differences were found (P<.05) for IL6/IL10 ratio between MCI patients and Control group (median [IR]): (1.39 [1.18-1.80] vs. 1.91 [2.68-1.18] pg/mL). Of the 37 MCI patients, 14 progressed to AD (DCL-EA group) within a year. Significant differences were also found (P<.05) for IL6/IL10 ratio between the DCL-EA group and the rest of MCI patients that did not progress (DCL-S or stable): (1.29 [0.84-1.56] vs. 1.42 [1.27-2.07] pg/mL). None of the control subjects progressed to AD.
ConclusionsA decrease in CSF IL6/IL10 ratio could be a promising diagnostic biomarker in MCI and a prognostic biomarker of AD in MCI.
La enfermedad de Alzheimer (EA) es un desorden neurodegenerativo caracterizado por la pérdida gradual de memoria, afectación de funciones cognitivas e invalidez progresiva. El hallazgo fisiopatológico principal de este complejo síndrome es la presencia de placas seniles compuestas de depósitos insolubles de β-amiloide, microglía activada, astrocitos y neuronas degeneradas.
Debido al papel central que las citoquinas ejercen en los procesos neuroinmunológicos, el estudio de la influencia de estas moléculas en los procesos cognitivos a través de diversos mecanismos se ha intensificado en la última década1. Los primeros trabajos acerca de la secreción de citoquinas en el líquido cefalorrraquídeo (LCR) de pacientes con EA realizados con técnicas inmunohistoquímicas propugnaron la teoría de que la formación de las placas seniles en la EA se asociaría a reacciones proinflamatorias a nivel del sistema nervioso central2–4. La información disponible sugería que en la EA, los procesos inflamatorios crónicos mediados por células de la glía activadas y centrados en la eliminación de las placas seniles, son letales para el resto de neuronas circundantes5, si bien el papel particular de las citoquinas en este contexto no estaba del todo claro dada su doble función perjudicial y/o beneficiosa.
La reciente introducción de técnicas de inmunoensayo (a priori más robustas y fiables que las técnicas histoquímicas tradicionales) en el estudio de las citoquinas en LCR y suero de pacientes con EA ha proporcionado por el contrario, resultados contradictorios e inconsistentes. Nuevos trabajos cuestionan la teoría proinflamatoria y apuntan a un declive en la capacidad de respuesta inmune como factor patogenético en EA, basado en una clara disminución en la producción citoquínica proinflamatoria y en la reserva funcional celular de los pacientes con EA. Todo ello produciría una respuesta inmune significativamente alterada y/o defectuosa propia de una inmunosenescencia prematura6. El interés por determinar en qué fase de la enfermedad comienza este declive ha llevado a la realización de varios trabajos7–9 en los que se apunta a una fase previa a la EA o fase de deterioro cognitivo leve (DCL) como el punto de inflexión donde pueden identificarse cambios en el perfil de secreción citoquínica respecto a EA.
Muchos autores consideran el DCL como el factor de riesgo más importante para desarrollar EA10. Así, el 40-60% de los pacientes con DCL desarrollan EA durante los siguientes 5 años11, aunque muchos otros tienen una forma estable de alteración de la memoria. Un buen número de estudios ha confirmado que las alteraciones bioquímicas intratecales que se describen en los pacientes con DCL se encuentran a medio camino entre la normalidad y la EA, con solapamiento en los resultados12–15.
El objetivo de nuestro estudio es doble. Por una parte buscamos implementar y optimizar la tecnología Multiplex en el análisis de citoquinas intratecales de pacientes con DCL. El segundo objetivo es evaluar el perfil de producción citoquínica en pacientes con DCL (en suero y en LCR) con respecto a la población control y estudiar la evolución a EA de éstos en el período de un año. Con ello buscamos identificar no solo si alguna citoquina o citoquinas pudieran servir como marcador diagnóstico de DCL, sino también si estos mediadores solubles pueden ser empleados como marcadores pronósticos/predictivos en pacientes con DCL que evolucionan a EA.
Materiales y métodosPoblación estudiadaSe realizó un estudio observacional prospectivo de cohortes. Se incluyeron 37 pacientes con DCL diagnosticados según los criterios de Petersen de 200413 pertenecientes a la consulta de deterioro cognitivo del Hospital General Universitario de Alicante. Su estudio incluyó exploración física y neurológica, estudio neuropsicológico, escala de depresión de Yesavage, analítica sanguínea, resonancia magnética cerebral (RMN) (aunque en 5 casos se realizó una tomografía computerizada [TAC] cerebral) y punción lumbar (PL). Según la evolución a los 12 meses tras la PL, diferenciamos a los pacientes en estables (DCL-S) o evolucionados a EA (DCL-EA). Para la valoración a evolución a EA se siguieron los criterios NINDS-ADRA16 y la escala GDS (Global Deterioration Scale)17.
Por otra parte, se incluyeron 24 sujetos control sin quejas subjetivas de memoria ni deterioro cognitivo conocido. Eran pacientes que iban a ser intervenidos mediante raquianestesia de procesos traumatológicos o urológicos no malignos. Se recogieron sus datos clínicos, analítica sanguínea y, unos días después de la intervención quirúrgica, se les realizó un estudio neuropsicológico (en todo ellos el índice mini-mental state examination [MMSE] estaba por encima de 27). Estos pacientes fueron invitados a una revisión anual en consulta de deterioro cognitivo. Ninguno de ellos evolucionó a EA en el período de un año.
Tanto los pacientes como los sujetos control fueron personas mayores de 55 años con concordancia entre el diagnóstico clínico y el neuropsicológico. Para la inclusión en el estudio y realización de la PL todos los participes firmaron el consentimiento informado. Se consideró la presencia de demencia o cualquier otra enfermedad que pudiera provocar deterioro cognitivo, la adscripción a tratamiento anticoagulante, la falta de consentimiento informado y una valoración en la escala de depresión de Yesavage superior a 5 puntos como criterio de exclusión.
Obtención de muestrasSe realizó entre febrero 2009 y febrero 2010. Las muestras se obtuvieron entre las 10 y las 14 horas. Todos los LCR se recogieron en tubos estándar y fueron congelados en menos de una hora a −80°C. Los LCR sanguinolentos fueron centrifugados antes de la congelación. Tras la PL se aconsejaba a todos los pacientes evitar maniobras de Valsalva durante al menos tres días. Paralelamente se extrajeron tanto para pacientes DCL como para controles, muestras sanguíneas para obtención de suero.
Este proyecto fue aprobado por el Comité Ético de Investigación Clínica del Hospital General Universitario de Alicante.
Métodos analíticosSe midieron los niveles de IL1β, IL2, IL5, IL6, IL7, IL8, IL10, IL12p70, IL13, factor de necrosis tumoral alfa (TNFα), interferón gamma (IFNγ) y factor estimulante de colonias granulocito-macrófago (GM-CSF) en el LCR y suero de pacientes y controles y se calcularon los cocientes pro/antiinflamatorios IL6/IL10, IL6/IL5, IL8/IL10, IL8/IL5, TNFα/IL10 y TNFα/IL5 en LCR de pacientes y controles. Para ello se empleó la tecnología xMAP Luminex® con los reactivos Milliplex de Millipore para citoquinas de alta sensibilidad según procedimiento. El rango analítico para las citoquinas analizadas se situó entre 0,13 y 2.000 pg/mL. Todas las muestras fueron analizadas de forma simultánea, al final del reclutamiento y de forma ciega para los datos clínicos.
Se analizaron la IgG y la albúmina en el LCR y suero del grupo de DCL y el grupo control para el cálculo del índice de IgG mediante la fórmula: ([IgG LCR/IgG suero]/[albúmina LCR/albúmina suero]), con el fin de detectar posibles daños a nivel de la barrera hematoencefálica (BHE). Se tomó como intervalo de referencia normal para el índice de IgG los valores entre 0,34 y 0,58.
Métodos estadísticosPara el análisis del tipo de distribución de cada variable se utilizó el test de Kolmogorov-Smirnov. Para la comparación entre dos grupos: t de Student para variables paramétricas y U Mann-Whitney para las variables no paramétricas. En todas las correlaciones paramétricas realizadas se empleó el método de Pearson (Spearman para no paramétricas). Además, se realizó el análisis de las curvas ROC para determinar el AUC (area under curve) y los mejores valores de corte para la medida de las variables estadísticamente significativas. Se estableció el punto de corte óptimo aquel que conjugaba la mejor sensibilidad con la mejor especificidad. A partir de estos datos se calculó el valor predictivo positivo (VPP) y negativo (VPN) y cocientes de probabilidad (CP) (o likelihood ratio, LR) positivo y negativo para dicho punto de corte. En todos los contrastes de hipótesis se utilizó el nivel de significación estadística de p<0,05. Se empleó el paquete estadístico SPSS v. 17.0.
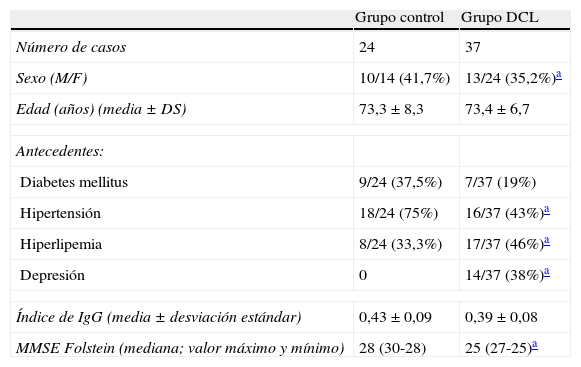
ResultadosLas características clínicas y antecedentes personales de los sujetos del estudio se presentan en la tabla 1. Aunque aparecen diferencias estadísticamente significativas en la proporción de sexos entre ambo grupos, no se demuestran diferencias significativas en los resultados de citoquinas y cocientes dependiendo del sexo de los pacientes/sujetos. No existen diferencias significativas para la edad entre los grupos DCL y control. Se observa una mayor proporción en el grupo control de factores como la diabetes mellitus e hipertensión arterial (p<0,05) y una menor proporción de hiperlipemia (p<0,05). Pero de nuevo no se demuestran diferencias significativas en los resultados de citoquinas y cocientes dependiendo del factor de riesgo considerado.
Características clínicas de los grupos control y DCL
| Grupo control | Grupo DCL | |
| Número de casos | 24 | 37 |
| Sexo (M/F) | 10/14 (41,7%) | 13/24 (35,2%)a |
| Edad (años) (media±DS) | 73,3±8,3 | 73,4±6,7 |
| Antecedentes: | ||
| Diabetes mellitus | 9/24 (37,5%) | 7/37 (19%) |
| Hipertensión | 18/24 (75%) | 16/37 (43%)a |
| Hiperlipemia | 8/24 (33,3%) | 17/37 (46%)a |
| Depresión | 0 | 14/37 (38%)a |
| Índice de IgG (media±desviación estándar) | 0,43±0,09 | 0,39±0,08 |
| MMSE Folstein (mediana; valor máximo y mínimo) | 28 (30-28) | 25 (27-25)a |
MMSE: mini mental state examination.
Se obtiene para el grupo DCL una media de índice de IgG de 0,43±0,09 siendo 0,30 y 0,68 el valor mínimo y máximo respectivamente. En el grupo control la media fue de 0,39±0,08, siendo 0,29 y 0,61 el valor mínimo y máximo respectivamente. No se observaron diferencias estadísticamente significativas entre ambos grupos para este índice.
La mediana del MMSE para el grupo control fue de 28 siendo 30 el valor máximo de la prueba. Para el grupo DCL este valor fue lógicamente inferior de 25. Los valores en esta prueba oscilan entre 0 y 30, considerándose normales los valores iguales o superiores a 25.
Los resultados para las citoquinas y los cocientes se muestran como mediana y rango intercuartílico. Se obtuvieron concentraciones indetectables (< 0,13 pg/mL) de IL1, IL2, IL7, IL12p70, IFN(, IL13 y GM-CSF en el LCR de ambos grupos para el 100, 100, 72, 90, 56, 93 y 100% de las muestras respectivamente; y de IL1, IL2 y GM-CSF en el suero de ambos grupos para el 93, 77 y 84% de las muestras analizadas.
En el grupo DCL los niveles de citoquinas y cocientes son siempre inferiores en LCR respecto a suero, excepto para la IL5, IL6, IL8, el cociente IL6/IL10, IL8/IL10 e IL8/IL5. Para todas las citoquinas y cocientes, salvo IL5 e IL6, se obtienen diferencias estadísticamente significativas (resultados no mostrados). No se obtienen correlaciones estadísticamente significativas entre los valores en suero y en LCR en ninguna citoquina ni cociente con la excepción de IL8 (Coef. Pearson 0,375; p=0,024).
Para el grupo control los niveles de citoquinas y cocientes son siempre inferiores en LCR respecto a suero, excepto para la IL5, IL6, IL8, el cociente IL6/IL10, IL8/IL10 e IL8/IL5. Para todas las citoquinas y cocientes, salvo IL5 e IL6, se obtienen diferencias estadísticamente significativas (resultados no mostrados). No se obtienen correlaciones estadísticamente significativas entre los valores en suero y en LCR en ninguna citoquina ni cociente con la excepción de IL8 (Coef. Pearson 0,425; p=0,020).
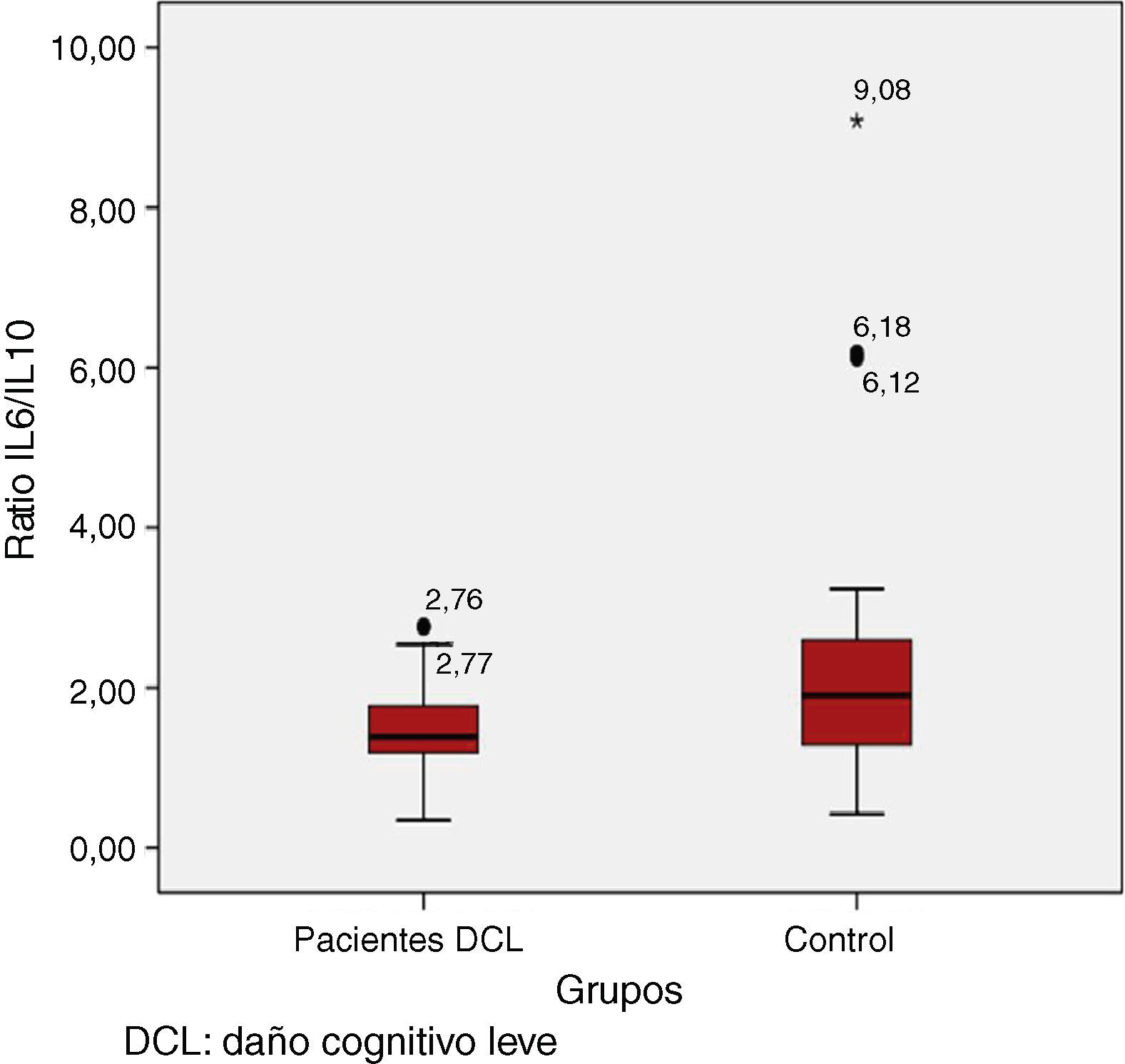
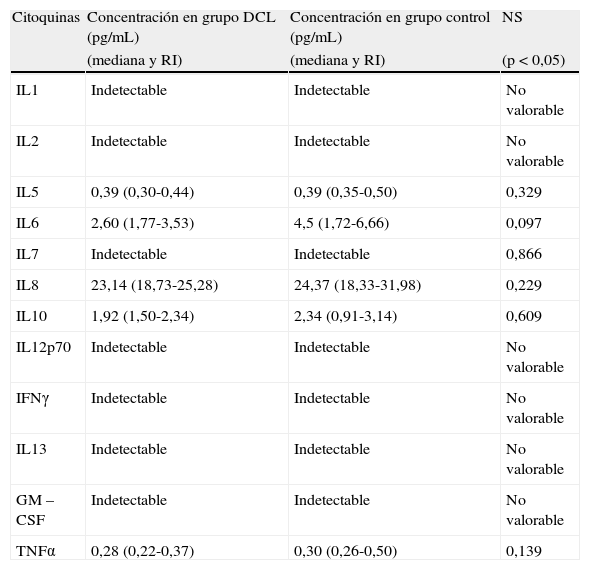
Al comparar los valores de citoquinas y cocientes medidos en LCR entre el grupo DCL y el grupo control, se observan concentraciones y/o cocientes muy similares entre ambos grupos salvo para IL6, el cociente IL6/IL10 y el cociente IL6/IL5, donde los valores son siempre superiores en grupo control, si bien únicamente se encuentran diferencias significativas para el cociente IL6/IL10 (p=0,022*) (resultados expresados como mediana y rango intercuartílico) (grupo control 1,91 (1,18-2,68) vs. grupo DCL 1,39 (1,18-1,80) mientras que IL6 roza la significación estadística (p=0,097) (tabla 2; fig. 1).
Comparación de los resultados de citoquinas en líquido cefalorraquídeo (LCR) en el grupo DCL y el grupo control (datos expresados como mediana y rango intercuartílico [RI])
| Citoquinas | Concentración en grupo DCL (pg/mL) | Concentración en grupo control (pg/mL) | NS |
| (mediana y RI) | (mediana y RI) | (p<0,05) | |
| IL1 | Indetectable | Indetectable | No valorable |
| IL2 | Indetectable | Indetectable | No valorable |
| IL5 | 0,39 (0,30-0,44) | 0,39 (0,35-0,50) | 0,329 |
| IL6 | 2,60 (1,77-3,53) | 4,5 (1,72-6,66) | 0,097 |
| IL7 | Indetectable | Indetectable | 0,866 |
| IL8 | 23,14 (18,73-25,28) | 24,37 (18,33-31,98) | 0,229 |
| IL10 | 1,92 (1,50-2,34) | 2,34 (0,91-3,14) | 0,609 |
| IL12p70 | Indetectable | Indetectable | No valorable |
| IFNγ | Indetectable | Indetectable | No valorable |
| IL13 | Indetectable | Indetectable | No valorable |
| GM – CSF | Indetectable | Indetectable | No valorable |
| TNFα | 0,28 (0,22-0,37) | 0,30 (0,26-0,50) | 0,139 |
| Cocientes | Grupo DCL (mediana y RI) | Grupo control (mediana y RI) | NS (p<0,05) |
| TNFα/IL10 | 0,15 (0,12-0,19) | 0,17 (0,12-0,26) | 0,323 |
| IL6/IL10 | 1,39 (1,18-1,80) | 1,91 (1,18-2,68) | 0,022* |
| IL8/IL10 | 11,35 (9,46-13,80) | 12,00 (8,19-19,78) | 0,595 |
| TNFα/IL5 | 0,79 (0,63-1,01) | 0,79 (0,60-1,19) | 0,723 |
| IL6/IL5 | 6,88 (4,94-10,56) | 8,84 (5,49-15,50) | 0,199 |
| IL8/IL5 | 57,09 (49,15-71,86) | 53,29 (47,34-74,39) | 0,585 |
DCL: daño cognitivo leve; NS: nivel de significación estadística.
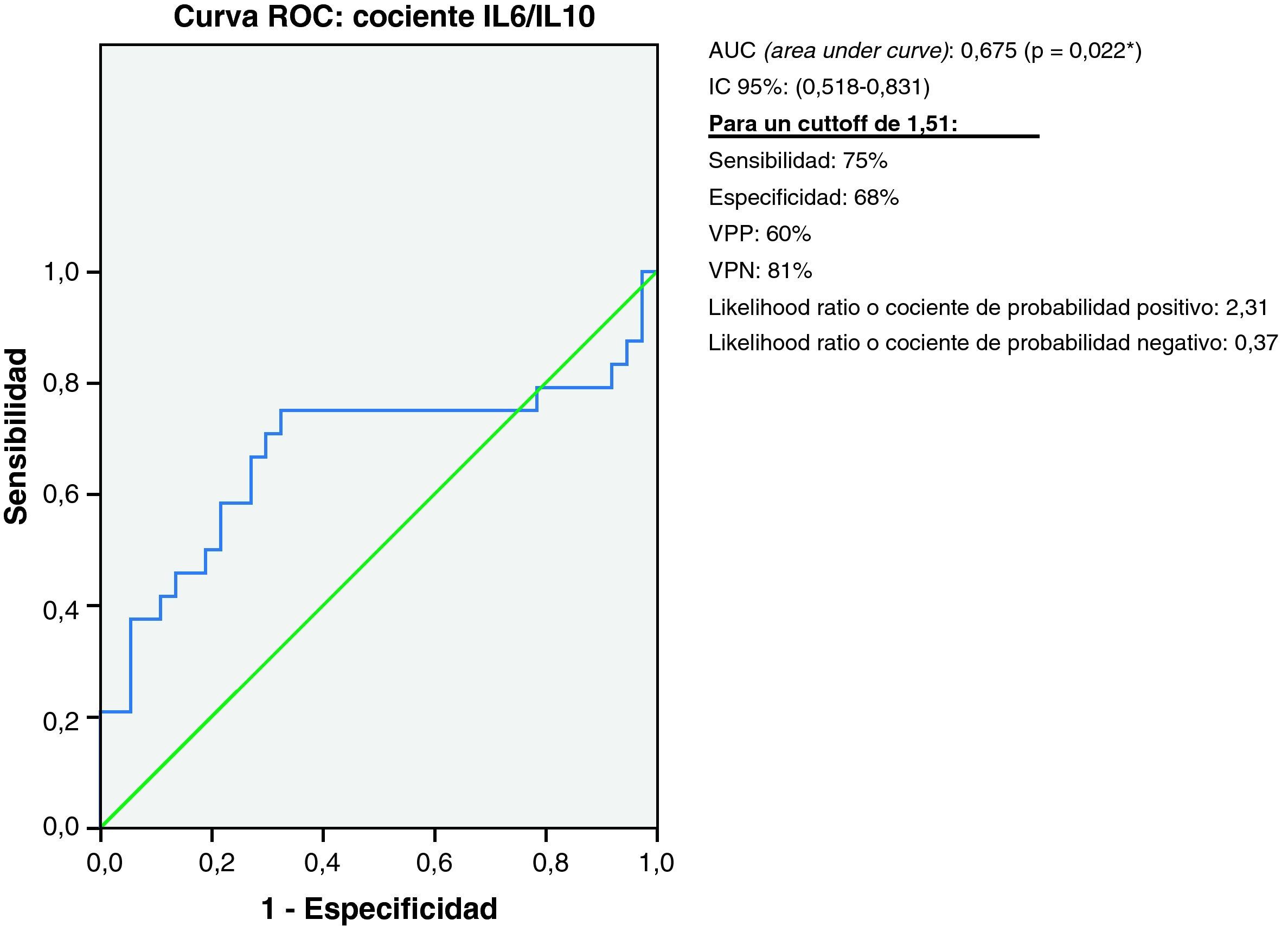
En el análisis de la curva ROC para el cociente IL6/IL10 entre el grupo DCL y el grupo control, se obtiene un área debajo de la curva (AUC) de 0,675 (IC 95%: 0,518-0,831) obteniendo una sensibilidad del 75% y una especificidad del 68% para un punto de corte de 1,5 (fig. 2) a la hora de descartar la presencia de DCL. VPP 60%; VPN 81%; CP(+) 2,31; CP(−) 0,37.
A los 12 meses tras la realización de la PL, 14 pacientes DCL (38%) progresan a EA (DCL-EA) y 22 (59%) permanecen estables (DCL-S). Uno de los pacientes fallece con anterioridad al control anual. No se observan diferencias significativas en la edad de ambos grupos.
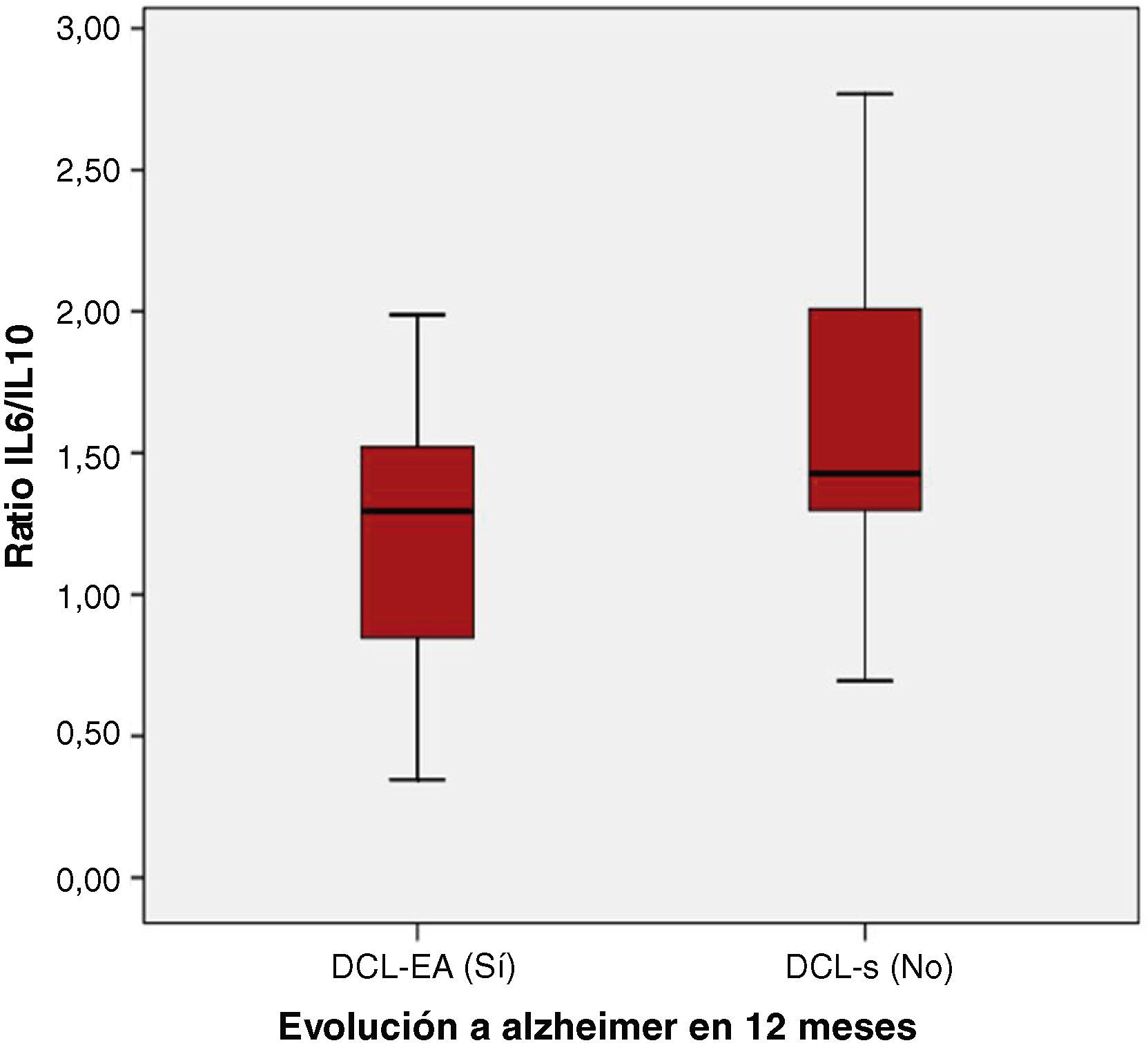
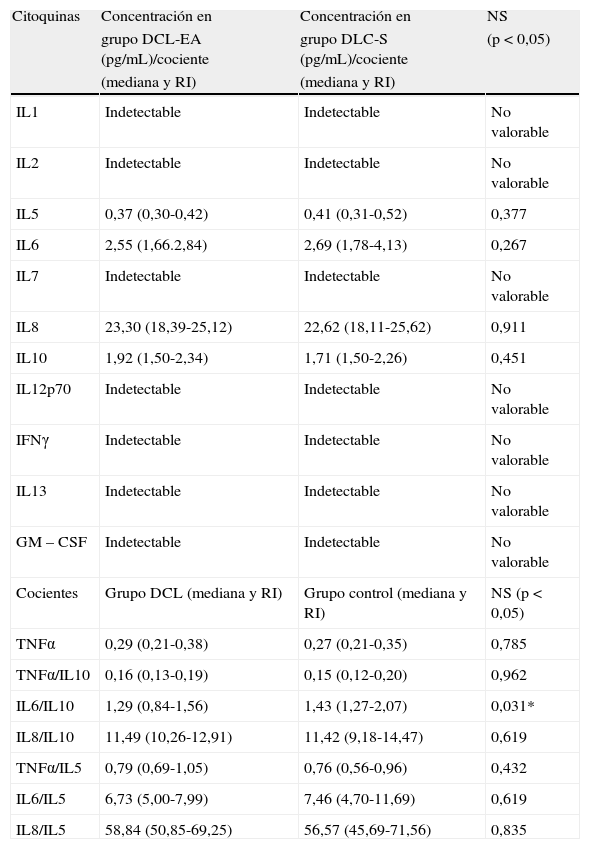
Los valores de citoquinas y cocientes obtenidos en ambos grupos (DCL-S y DCL-EA) son muy similares (tabla 3). El único parámetro en el que se encuentran diferencias significativas es el cociente IL6/IL10 con valores ligeramente más elevados en el grupo DCL-S (p=0,031*) (grupo DCL-EA 1,29 (0,84-1,56) vs. grupo DCL-S 1,43 (1,27-2,07) (fig. 3).
Comparación de los resultados de citoquinas en líquido cefalorraquídeo (LCR) en el grupo DCL-EA (n=14) y el grupo DCL-s (n=22) (datos expresados como mediana y rango intercuartílico [RI])
| Citoquinas | Concentración en | Concentración en | NS |
| grupo DCL-EA (pg/mL)/cociente | grupo DLC-S (pg/mL)/cociente | (p<0,05) | |
| (mediana y RI) | (mediana y RI) | ||
| IL1 | Indetectable | Indetectable | No valorable |
| IL2 | Indetectable | Indetectable | No valorable |
| IL5 | 0,37 (0,30-0,42) | 0,41 (0,31-0,52) | 0,377 |
| IL6 | 2,55 (1,66.2,84) | 2,69 (1,78-4,13) | 0,267 |
| IL7 | Indetectable | Indetectable | No valorable |
| IL8 | 23,30 (18,39-25,12) | 22,62 (18,11-25,62) | 0,911 |
| IL10 | 1,92 (1,50-2,34) | 1,71 (1,50-2,26) | 0,451 |
| IL12p70 | Indetectable | Indetectable | No valorable |
| IFNγ | Indetectable | Indetectable | No valorable |
| IL13 | Indetectable | Indetectable | No valorable |
| GM – CSF | Indetectable | Indetectable | No valorable |
| Cocientes | Grupo DCL (mediana y RI) | Grupo control (mediana y RI) | NS (p<0,05) |
| TNFα | 0,29 (0,21-0,38) | 0,27 (0,21-0,35) | 0,785 |
| TNFα/IL10 | 0,16 (0,13-0,19) | 0,15 (0,12-0,20) | 0,962 |
| IL6/IL10 | 1,29 (0,84-1,56) | 1,43 (1,27-2,07) | 0,031* |
| IL8/IL10 | 11,49 (10,26-12,91) | 11,42 (9,18-14,47) | 0,619 |
| TNFα/IL5 | 0,79 (0,69-1,05) | 0,76 (0,56-0,96) | 0,432 |
| IL6/IL5 | 6,73 (5,00-7,99) | 7,46 (4,70-11,69) | 0,619 |
| IL8/IL5 | 58,84 (50,85-69,25) | 56,57 (45,69-71,56) | 0,835 |
DCL: daño cognitivo leve; NS: nivel de significación estadística.
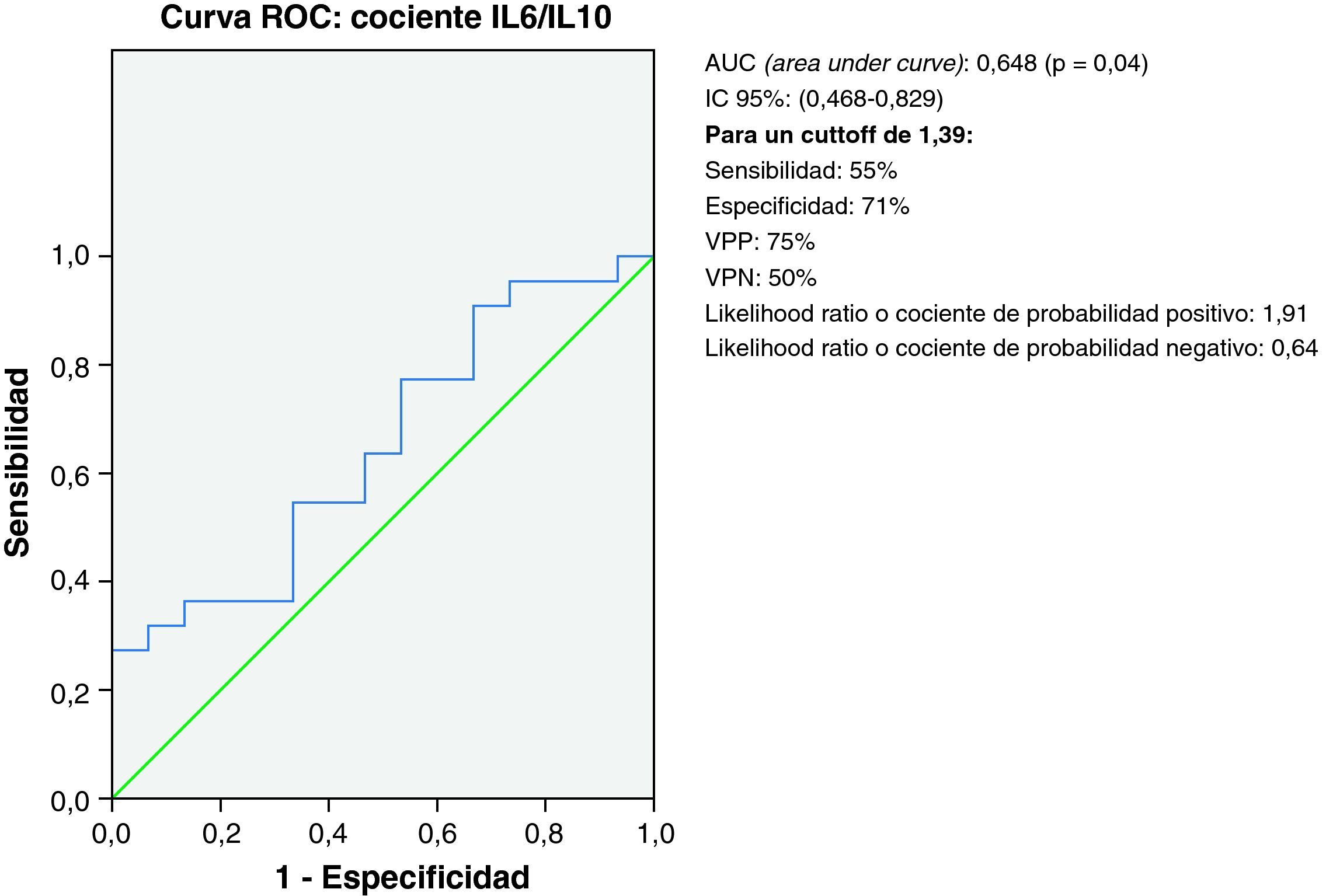
En el análisis de la curva ROC para el cociente IL6/IL10 entre el grupo DCL-S y el grupo DCL-EA, se obtiene un Área debajo de la curva (AUC) de 0,648 (p=0,04*) (IC 95%: 0,468-0,829) obteniendo una sensibilidad del 55% y una especificidad del 71% para un punto de corte de 1,39 a la hora de descartar la evolución a EA en pacientes con DCL (VPP 75%; VPN 50%; CP(+) 1,91; CP(−) 0,64) (fig. 4).
DiscusiónEl papel que desempeña el sistema inmune en la patogénesis de la EA ha sido ampliamente discutido y estudiado. En un primer momento, parecía lógico pensar que los procesos locales inflamatorios estarían asociados a signos inflamatorios sistémicos, si bien los resultados obtenidos durante la última década de citoquinas intratecales, eminentemente proinflamatorias de pacientes con EA han sido inconsistentes, publicándose trabajos que mostraban desde un aumento de niveles respecto sujetos control18,19, un descenso de niveles20,21 o hasta la presencia de niveles inalterados21–23.
Creemos que estas discrepancias tienen diferente explicación. Por un lado, tenemos una causa tecnológica. Así, los inmunoensayos empleados a la hora de cuantificar citoquinas intratecales adolecen de la sensibilidad analítica necesaria lo que restringe el análisis estadístico posterior. Por otra parte, puesto que la medida de una o un par de citoquinas por enzimoinmunoensayo clásico no permite dilucidar relaciones sólidas entre la patología y sus efectos, el hecho de disponer de un bajo volumen de muestra de LCR limita sobremanera el número de analitos a evaluar y las conclusiones que pudieran derivarse.
Desde una perspectiva metodológica, el empleo de la tecnología Multiplex, como es nuestro caso, presenta importantes ventajas con respecto a las técnicas tradicionales: una mayor sensibilidad analítica, ideal para detectar concentraciones subclínicas (< 0,5 pg/mL) y la capacidad de cuantificar simultáneamente múltiples analitos con poca cantidad de muestra disponible (50 microlitros), como es el caso de las muestras de LCR. En la bibliografía apenas encontramos trabajos precedentes en el que se hayan analizado una docena de citoquinas de manera simultánea en el LCR de pacientes con EA y en particular con DCL24. Revisiones recientes aconsejan emplear esta tecnología en este campo con el fin de dilucidar los mecanismos inflamatorios implicados25. La tecnología Multiplex (o array líquido) se basa en un inmunoensayo tipo sándwich donde la fase sólida es múltiple y se compone de medio centenar de familias de miles de microesferas cada una de ellas recubiertas de anticuerpos monoclonales contra los diferentes analitos. El hecho de emplear esferas proporciona una superficie de contacto antígeno-anticuerpo superior al ELISA convencional y por tanto una mayor sensibilidad.
La gran mayoría de los kits comerciales para el estudio de citoquinas mediante tecnología Multiplex están diseñados para muestras séricas y/o plasmáticas. Para estos casos, y con el fin de reducir el efecto matriz, el fabricante suele incluir un vial liofilizado con una concentración similar al intervalo de referencia de albúmina y/o principales proteínas plasmáticas. El contenido de este vial se emplea durante la técnica analítica a la hora de preparar la curva de calibración y los controles de calidad. En nuestro estudio y dado que el LCR presenta una concentración de proteínas sensiblemente inferior al plasma, a la hora de analizar estas muestras, hemos sustituido este liofilizado con una preparación tamponada de 20mg/dL de albúmina y 60mg/dL de glucosa con el fin de simular la concentración aproximada de estos componentes en un LCR normal, minimizando las diferencias entre los calibradores y las muestras analizadas en cuanto a matriz biológica se refiere.
Otras causas responsables de la discordancia de los resultados residen principalmente en las diferencias en el tamaño muestral de los trabajos, los estados de demencia considerados, la selección del grupo control (en muchos estudios con diferencias significativas en la edad respecto al grupo de pacientes), la variabilidad intrínseca en la producción citoquínica debido a polimorfismos19, la toma de medicación y lo que es más importante, la comorbilidad sistémica no diagnosticada en los grupos de pacientes que puede alterar el patrón de secreción citoquínica intratecal. De hecho se ha llegado a demostrar que los procesos neuroinflamatorios que se llevan a cabo en el cerebro y en el LCR de los pacientes con EA están limitados al Sistema Nervioso Central sin asociación directa con procesos de inflamación periférica18.
Para todos los pacientes y sujetos de nuestro estudio el índice IgG estaba dentro del intervalo de referencia establecido por la bibliografía26 y con ello se descartó que sufrieran cualquier tipo de alteración en la integridad de la barrera hematoencefálica que provoque un aumento de su permeabilidad y por lo tanto, una extravasación de citoquinas del suero al LCR. La ausencia de correlaciones LCR-suero para las distintas citoquinas en ambos grupos apoya este hecho. Si bien existía correlación para la IL8, sus concentraciones intratecales fueron en ambos grupos de media dos veces superior en LCR respecto a suero, por lo que se descarta una posible extravasación desde éste. Por lo tanto, las citoquinas analizadas en el LCR de los pacientes DCL fueron en su mayor parte de producción intratecal y constituían un fiel reflejo de los procesos neuroinmunes.
El hecho de que el grupo control presenta una mayor proporción de hipertensos puede explicar un perfil citoquínico más proinflamatorio, pero no creemos que los procesos de inflamación periféricos derivados de esta condición afecten al perfil citoquínico en el LCR dada la ausencia de correlaciones LCR-suero y al hecho de que no hemos encontrado diferencias significativas en concentraciones y cocientes en función de los factores de riesgo considerados.
Somos conscientes de que el pequeño tamaño muestral de nuestro estudio, principalmente en cuanto a sujetos control se refiere, ha podido afectar a los resultados obtenidos. Creemos que esta ha podido ser la causa de que los cocientes de probabilidad obtenidos para IL6/IL10 no hayan sido todo lo robustos que debieran, sobre todo a la hora de evaluar la eficiencia diagnóstica de EA en pacientes con DCL (fig. 4), si bien en este caso hemos preferido optar por un punto de corte que aunque menos sensible fuese de mayor especificidad y VPP.
Creemos que otra limitación de nuestro estudio podría ser el corto tiempo de observación (un año) realizado a pacientes con DCL y a controles, dado el mayor tiempo de evolución que tiene la EA. Lo tenemos presente, si bien el seguimiento continúa en la actualidad con una consulta para pacientes cada 6 meses y cada año como máximo para controles. Por otra parte, no descartamos en futuro realizar comparaciones con otro tipo de demencias menos frecuentes que la EA a la hora del diagnóstico diferencial empleando estos biomarcadores.
Con todo, en nuestro estudio hemos encontrado diferencias significativas en el cociente IL6/IL10 en el grupo DCL respecto al grupo control y entre el grupo DCL-EA y DCL-S. Este tipo de cocientes reflejan la relación entre los procesos pro y antiinflamatorios presentes en la enfermedad, relativizando las cifras absolutas obtenidas de las distintas citoquinas. Los resultados muestran un descenso paulatino de este cociente a medida que se agrava la patología. Puesto que la IL6 es una citoquina eminentemente proinflamatoria y la IL10 antiinflamatoria, todo indica que a medida que los pacientes progresan de DCL a EA observamos una desregulación de la respuesta inmune en la línea de las tesis defendidas por otros autores6, pudiendo ser debido a fenómenos como la presencia en pacientes con EA de daño oxidativo en el ADN linfocitario, de una respuesta alterada de linfocitos T y de un acortamiento acelerado en la regiones teloméricas linfocitarias27 entre otras causas.
Esta nueva hipótesis de declive inmunológico en la EA es actualmente motivo de discusión, ya que si bien algunos autores consideran que es un epifenómeno secundario a una activación central inmune, otros apuntan a que este declive guarda un importante papel en la patogénesis de la enfermedad6. Así, la disfunción en las células de la microglía, responsables de la supervivencia neuronal y los procesos de regeneración, se ha relacionado con una menor capacidad de producir factores neurotróficos, menor capacidad fagocítica y una mayor neurotoxicidad28. Por otra parte, la alteración en la función fagocítica implica un menor aclaramiento de la carga de amiloide cerebral. En último término está demostrado que el fenómeno de inmunosenectud constituye un importante factor de riesgo para la EA a nivel no solo de respuesta inmune adaptada sino también de innata29.
La IL6 guarda un papel preponderante en estos procesos, ya que proviene en su mayoría de células del sistema monocito/macrófago, responsables de eliminar las proteínas amiloides acumuladas, además de ser un importante factor neurotrófico y neuroprotector. Se ha demostrado que promueve la supervivencia de neuronas colinérgicas y potencia la secreción de neural growth factor (NGF) por los astrocitos. Algunos autores han apuntado la posibilidad de que una reducción en sus niveles puede estar relacionado con los procesos neurodegenerativos de la EA30. En nuestro trabajo su paulatino descenso relativo al aumento de IL10, constituye un prometedor marcador diagnóstico de DCL y pronóstico/predictivo de DCL que evoluciona a EA a la luz de las curvas ROC obtenidas y a pesar del pequeño tamaño muestral. De hecho hemos encontrado una correlación inversa estadísticamente significativa en este grupo entre IL6/IL10 y el péptido Tau-fosforilado en estos mismos pacientes (marcador bioquímico intratecal de EA) (−0,577 Coef. Pearson; p<0,031) (resultados no incluidos en este artículo)31 lo que pone de manifiesto una relación entre la etiopatogenia de la EA y el declive inmunológico.
Nuestro estudio respalda las ideas alternativas que descartan una patogénesis de la EA meramente inflamatoria, más si se tiene en cuenta la ausencia clara de beneficio demostrada en los ensayos clínicos por parte de la terapia antiinflamatoria a la hora de prevenir o retrasar la instauración de la EA. Por el contrario, nuestros resultados apoyan la hipótesis de una inmunosenescencia prematura como un factor relevante en EA en la línea de una visión más compleja, centrada en un declive inmunológico, más que en la simple deposición de amiloide32. El desarrollo de estrategias terapéuticas que estimulen la capacidad de respuesta del sistema inmune en el tratamiento de la EA surge como un excitante desafío en un futuro próximo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A los Servicios de Anestesia, Urología y Traumatología del Hospital General Universitario de Alicante. A María de los Ángeles Miguelsanz del Laboratorio de Inmunología del Hospital de Alicante, por la gestión de las muestras.
Este trabajo corresponde a una comunicación científica presentada y premiada con el segundo premio en el IV Congreso Nacional del Laboratorio Clínico celebrado en Zaragoza del 20 al 22 de octubre de 2010.