Cuatro sociedades científicas españolas, organizadoras de programas de garantía externa de la calidad en el ámbito del laboratorio clínico, crearon un grupo de trabajo para definir y divulgar especificaciones mínimas de la calidad analítica obtenidas por consenso (EMC) elaboradas con base en los resultados de sus programas de garantía externa de la calidad durante el período 2005-2010. Se definieron EMC para 60 magnitudes. En este trabajo se dan unas directrices sobre cómo utilizar estas especificaciones en la práctica diaria del laboratorio clínico. Se concluye que ante un resultado de un programa de evaluación externa con un error total superior a la EMC el laboratorio realizará un análisis de causas y establecerá las acciones correctivas oportunas para evitar que esta circunstancia vuelva a ocurrir. El cumplimiento de las EMC es un requisito necesario pero no suficiente en el sistema de la calidad del laboratorio. Debido a su condición de mínimas no deberían utilizarse como un objetivo de la calidad.
A working group was created to define and explain the minimum specifications for analytical quality obtained by consensus (MSC) by the four Spanish scientific societies that organise external quality assurance programs in laboratory medicine. The basis of these MSC were results obtained in the external programs of the 2005-2010 period, and were defined for 60 analytes. This paper gives guidelines on how the individual laboratory should use these specifications in its daily routine. It is concluded that laboratories should perform a cause analysis study and take the appropriate corrective action when a single result in an external program falls outside the MSC for an analyte. Fulfilling MSC is a necessary -but not sufficient- requirement in the laboratory quality system, but due to its condition of ‘minimum quality’ they should not be used as quality goals.
En el año 2005 4 sociedades científicas españolas, organizadoras de programas de garantía externa de la calidad en el ámbito del laboratorio clínico, crearon un grupo de trabajo para definir y divulgar especificaciones mínimas de la calidad analítica obtenidas por consenso (EMC). Su objetivo era definir el nivel de calidad mínimo que cada laboratorio debe obtener para alcanzar prestaciones analíticas armonizadas dentro de nuestro país.
Para ello, se tomaron los datos obtenidos en sus ejercicios de comparación entre laboratorios durante el período 2005-2010 (un total de 3.730.988 resultados procedentes de 4.104 laboratorios) y se aplicó un modelo que consistía en calcular la desviación porcentual de cada resultado respecto al valor diana, compararlo con los límites de obligado cumplimiento en otros países y asegurar que un 90% de los laboratorios españoles tenía un 75% de los resultados enviados a los programas de garantía externa de la calidad dentro de las especificaciones propuestas.
El método utilizado1 incluía los siguientes cálculos básicos:
- -
El % de la diferencia entre cada resultado y el valor diana (en valor absoluto).
- -
Representación gráfica de la distribución de las diferencias.
- -
Eliminación del 5% de las diferencias más altas.
- -
Definición del percentil 95 como la especificación mínima candidata (EMCc).
- -
Redondeo de esta especificación a valores enteros.
Las EMCc se compararon con las especificaciones obligatorias en otros países como Richtlinie en Alemania2 y Clinical Laboratory Improvement Amendments (CLIA) en Estados Unidos3.
- -
Si la EMCc era igual o superior (más permisible) que una de estas 2 especificaciones (Richtlinie y CLIA) se aceptó como definitiva (EMC). Esto sucedió para 8 de las 60 magnitudes estudiadas.
- -
Si la EMCc era inferior (más restrictiva) que las especificaciones de Alemania y Estados Unidos se empleó un cálculo adicional. Este consistió en un procedimiento iterativo que aumentaba la EMCc en un 0,01% (valor prueba error), cuantificando el número de laboratorios que obtenían el 75% de sus resultados dentro del valor prueba error. Cuando el 90% de los laboratorios tenían el 75% de sus resultados dentro del valor prueba error este se aceptó como la EMC. Esto afectó a 52 de las 60 magnitudes estudiadas.
Las EMC están definidas para 60 magnitudes biológicas, se han presentado en diversos congresos4–11, se han publicado en revistas nacionales e internacionales1,12,13 y están recomendadas por las 4 sociedades que integran el grupo de trabajo, según se detalla en las correspondientes páginas web14–17. Las EMC ocupan el cuarto nivel dentro del modelo jerárquico internacionalmente aceptado en Estocolmo18.
Estas especificaciones son muy conocidas a nivel teórico debido a la amplia difusión que se ha hecho de las mismas pero no se ha divulgado suficientemente su utilización desde un punto de vista práctico.
ObjetivoEl propósito de este trabajo es explicar, desde una perspectiva práctica, por qué y cómo el profesional del laboratorio debe aplicar las EMC, además de indicar para qué no deben utilizarse estas especificaciones.
Material y métodoComo material se utilizan las propias EMC (tabla 1) y los informes de resultados de los programas de garantía externa de la calidad de las 4 sociedades que conforman el grupo de expertos. Las EMC se basan en el error total (diferencia entre el resultado de una determinación y el valor diana). Este es el tipo de error que el laboratorio puede medir mediante la participación en un programa de garantía externa de la calidad donde cada muestra control se procesa una sola vez.
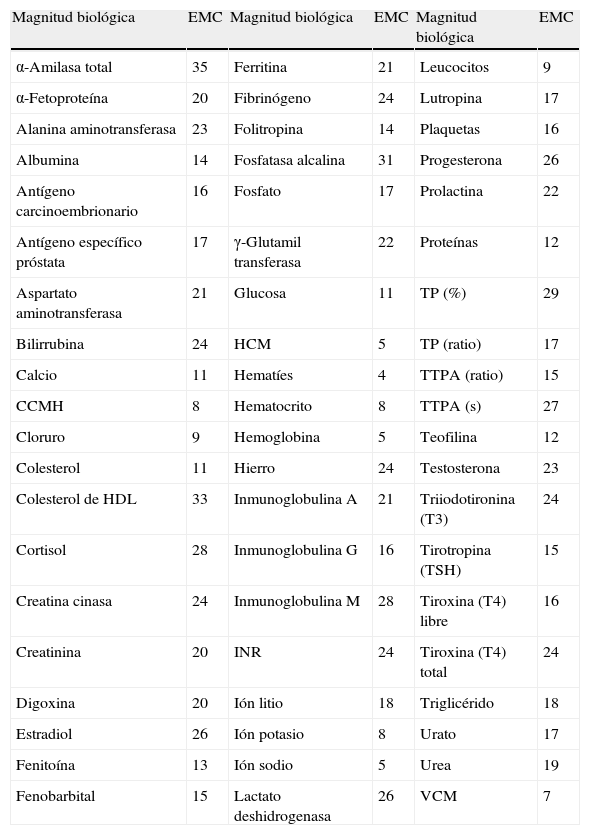
Magnitudes biológicas y especificaciones mínimas consensuadas (EMC)
| Magnitud biológica | EMC | Magnitud biológica | EMC | Magnitud biológica | EMC |
| α-Amilasa total | 35 | Ferritina | 21 | Leucocitos | 9 |
| α-Fetoproteína | 20 | Fibrinógeno | 24 | Lutropina | 17 |
| Alanina aminotransferasa | 23 | Folitropina | 14 | Plaquetas | 16 |
| Albumina | 14 | Fosfatasa alcalina | 31 | Progesterona | 26 |
| Antígeno carcinoembrionario | 16 | Fosfato | 17 | Prolactina | 22 |
| Antígeno específico próstata | 17 | γ-Glutamil transferasa | 22 | Proteínas | 12 |
| Aspartato aminotransferasa | 21 | Glucosa | 11 | TP (%) | 29 |
| Bilirrubina | 24 | HCM | 5 | TP (ratio) | 17 |
| Calcio | 11 | Hematíes | 4 | TTPA (ratio) | 15 |
| CCMH | 8 | Hematocrito | 8 | TTPA (s) | 27 |
| Cloruro | 9 | Hemoglobina | 5 | Teofilina | 12 |
| Colesterol | 11 | Hierro | 24 | Testosterona | 23 |
| Colesterol de HDL | 33 | Inmunoglobulina A | 21 | Triiodotironina (T3) | 24 |
| Cortisol | 28 | Inmunoglobulina G | 16 | Tirotropina (TSH) | 15 |
| Creatina cinasa | 24 | Inmunoglobulina M | 28 | Tiroxina (T4) libre | 16 |
| Creatinina | 20 | INR | 24 | Tiroxina (T4) total | 24 |
| Digoxina | 20 | Ión litio | 18 | Triglicérido | 18 |
| Estradiol | 26 | Ión potasio | 8 | Urato | 17 |
| Fenitoína | 13 | Ión sodio | 5 | Urea | 19 |
| Fenobarbital | 15 | Lactato deshidrogenasa | 26 | VCM | 7 |
CCMH: concentración corpuscular media de hemoglobina; Colesterol de HDL: colesterol de high density lipoprotein; HCM: hemoglobina corpuscular media; INR: international normalized ratio; TP: tiempo de protrombina; TTPA: tiempo de tromboplastina parcial activado; VCM: volumen corpuscular medio.
Especificación expresada en %. Desviación respecto al valor diana.
Se utilizan los informes de resultados de los programas que integran este estudio en los que se emplean 2 parámetros estadísticos para expresar la desviación: porcentaje de error total (ET) e índice de desviación estándar (ID) que se calculan mediante las siguientes fórmulas:
El valor diana es la media de los resultados emitidos por los laboratorios usuarios del mismo sistema analítico (grupo homogéneo) o la media global si hay pocos usuarios de cada grupo (< 10 laboratorios).
DE es la desviación estándar del grupo homogéneo o del global de participantes, según corresponda.
El método empleado para explicar cómo utilizar estas especificaciones son ejemplos reales extraídos de los programas de garantía externa de la calidad.
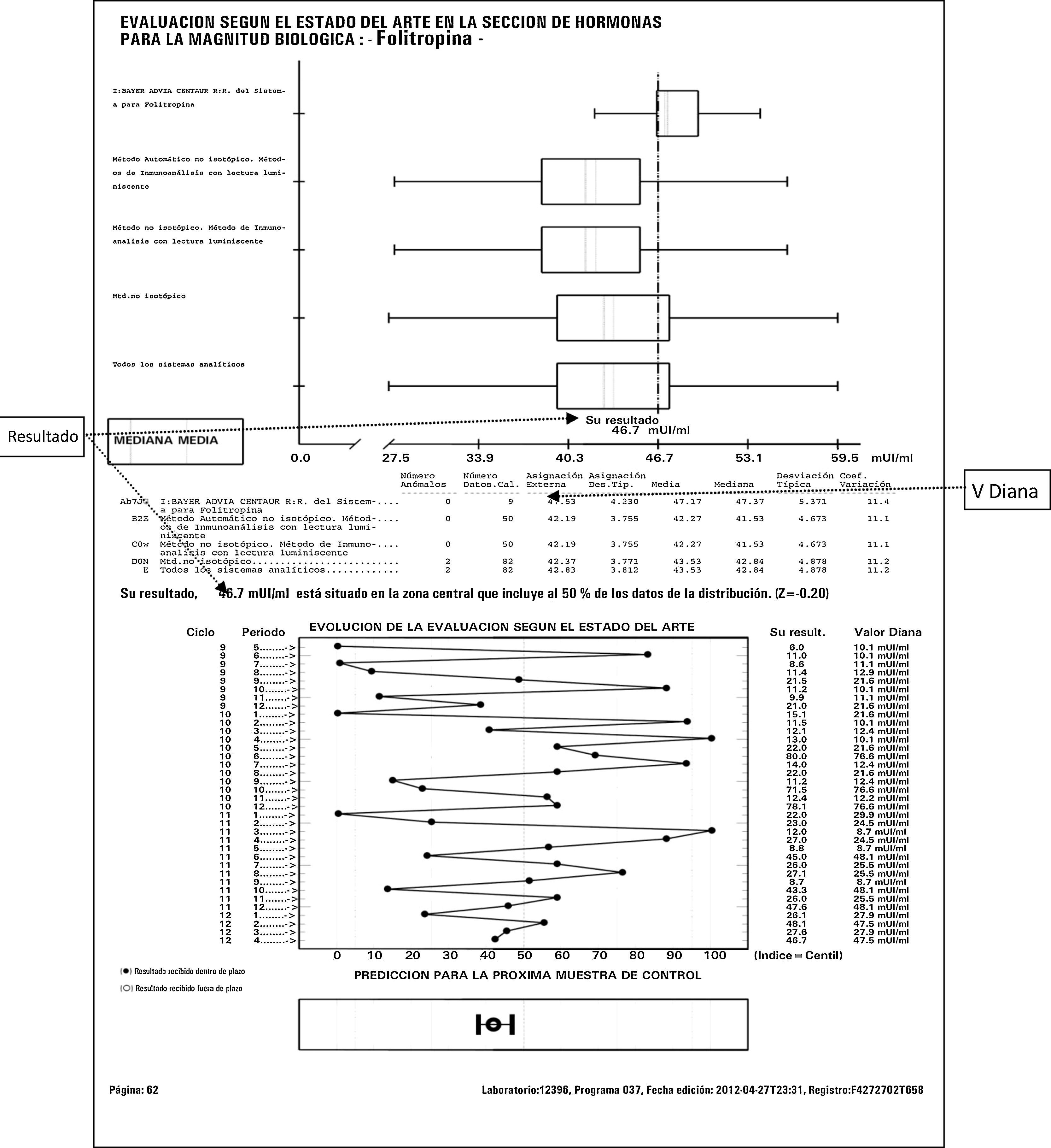
ResultadosEn la figura 1 se muestra un informe mensual de la AEFA/AEBM para la folitropina. Se resalta el resultado obtenido y el valor diana. En este informe el valor 46,7 mU/mL es 1,75% inferior al valor diana (47,53 mUI/mL). La EMC para la folitropina es de un 14% (tabla 1), por tanto el resultado es satisfactorio.
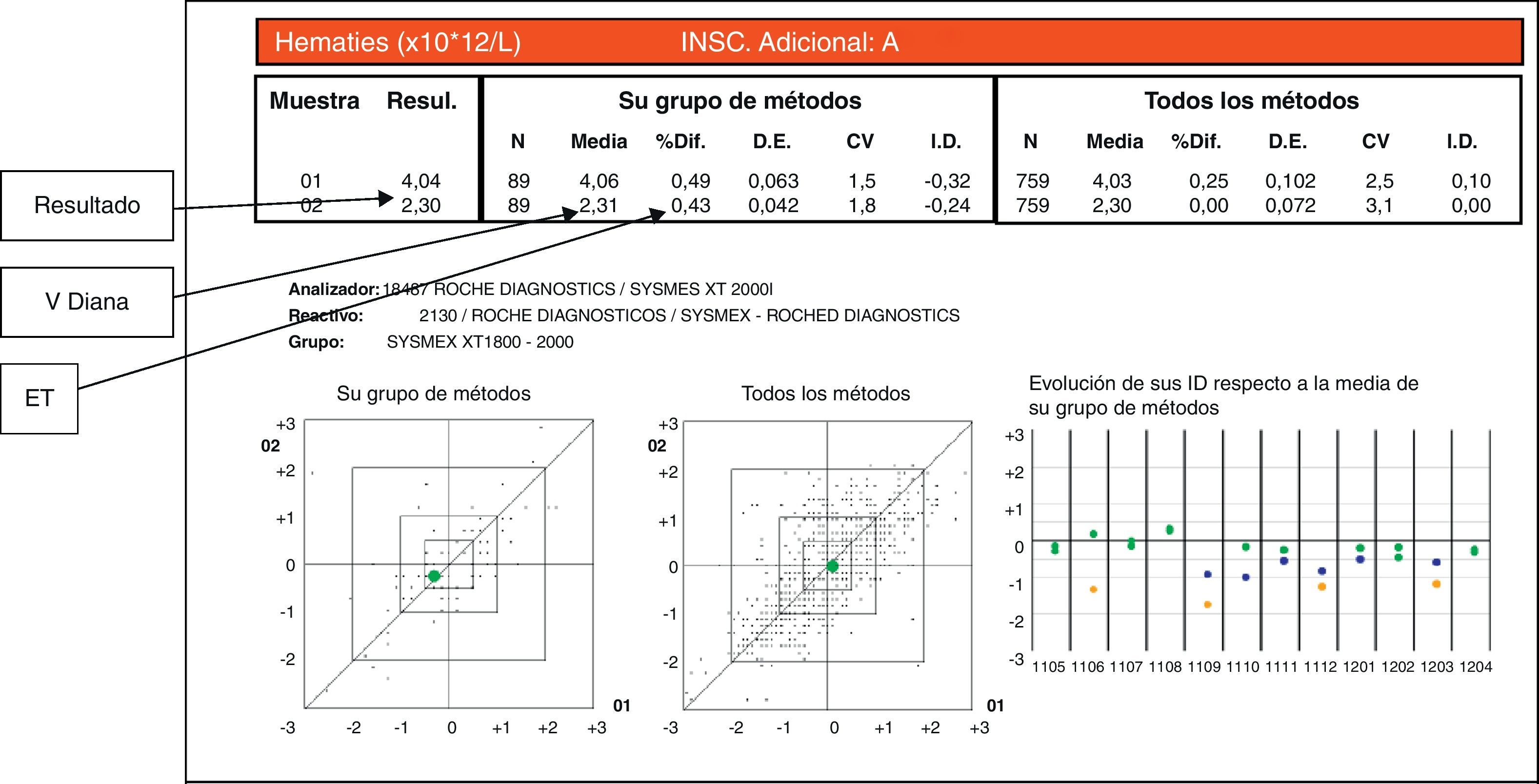
En la figura 2 se muestra un informe mensual de la SEHH para el recuento de los hematíes. En el gráfico de la derecha aparece el histórico de los ID de los últimos 12 meses, siendo los puntos de la derecha los resultados actuales para las 2 muestras remitidas el mes en cuestión. Para la muestra 02 de la figura el porcentaje de la diferencia entre el resultado y el valor diana (0,43) es inferior a la EMC para los hematíes que es de un 4% (tabla 1), por lo que el resultado es satisfactorio.
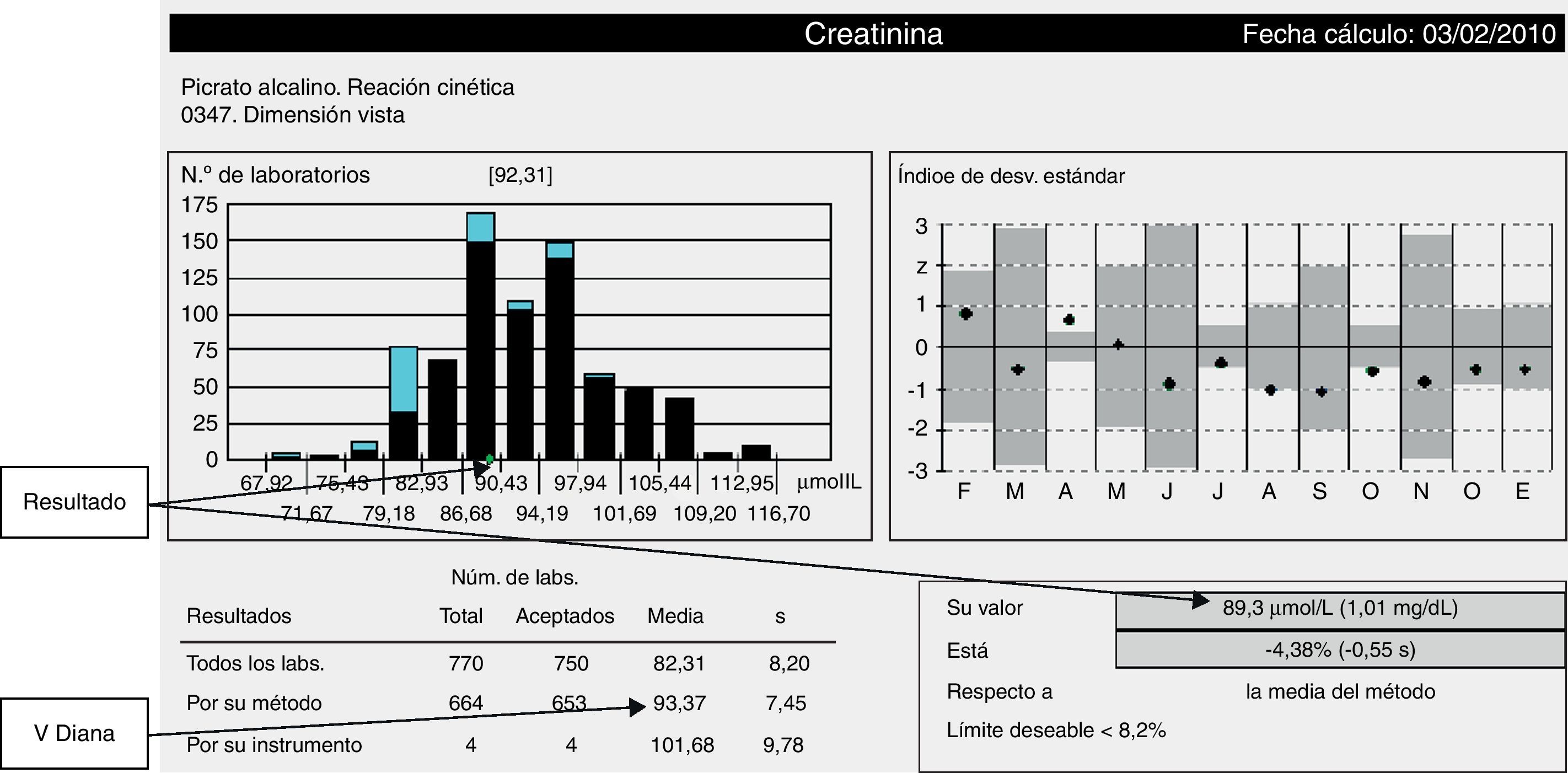
En la figura 3 se muestra un informe mensual de la SEQC para la creatinina. En el recuadro superior derecho se presentan el ID estándar y el porcentaje de desviación comparado con la especificación derivada de la variación biológica para el error total19. En el recuadro inferior derecho se muestra una tabla con los mismos datos: cálculo del error total, además del ID que en el ejemplo es de −4,36% y su interpretación respecto a la variación biológica (límite deseable). El laboratorio debe comparar este error total, en valor absoluto, con la EMC para la creatinina (20%), por lo que concluye que su resultado es satisfactorio.
Si en este ejemplo el resultado hubiera sido 73,9μmol/L el error total sería:
El valor absoluto (20,8) sería superior a la EMC para la creatinina y el laboratorio concluirá que su resultado no es satisfactorio.
DiscusiónEl profesional del laboratorio clínico se plantea diversas preguntas acerca de las EMC.
¿Para qué sirven las EMC?Las EMC se definieron con los siguientes propósitos:
- a.
Establecer el nivel mínimo de aceptación de los resultados obtenidos por un laboratorio al participar en un programa de garantía externa de la calidad.
- b.
Facilitar la armonización de los criterios utilizados en los procesos de certificación y acreditación.
- c.
Proporcionar una información a las administraciones sanitarias para definir criterios asistenciales del laboratorio clínico.
- a.
Establecer el nivel mínimo de aceptación de los resultados obtenidos por un laboratorio al participar en un programa de garantía externa de la calidad.
Cuando el laboratorio obtiene, para alguna magnitud, un resultado en el programa de garantía externa de la calidad que supera la EMC deberían formularse, entre otras, las siguientes preguntas relacionadas con la muestra control:
- -
¿El transporte de la muestra control se realizó de la forma adecuada?
- -
¿El almacenamiento y la conservación de la muestra control fueron correctos?
- -
¿Se tuvieron en consideración las instrucciones de manipulación y tratamiento de la muestra control?
- -
¿Se procesó la muestra control correcta?
- -
¿Se transcribió de forma correcta al formulario de resultados del programa?
- -
¿Se informó el resultado en las unidades correctas?
- -
¿Se comunicó al programa externo el analizador, el reactivo y el calibrador realmente utilizados?
- -
El resultado enviado al programa, ¿se comparó con el grupo correcto?
Si se han podido descartar los problemas debidos a la muestra control el laboratorio debería revisar su procedimiento analítico para identificar la causa de su desviación y corregirla20,21.
En todo caso, ante un solo resultado de un programa de evaluación externa con error total superior a la EMC el laboratorio realizará un análisis de causas y establecerá las acciones correctivas oportunas para evitar que esta circunstancia vuelva a ocurrir.
- -
- b.
Facilitar la armonización de los criterios utilizados en los procesos de certificación y acreditación.
Esta es una tarea que no corresponde al laboratorio clínico individual sino que es propia de la organización que reconoce y formaliza a los organismos certificadores y acreditadores que en España es la Entidad Nacional de Acreditación (ENAC). Esta organización y sus homónimas europeas e internacionales basan sus decisiones científicas en las recomendaciones de grupos de reconocida solvencia, respetando todas ellas la propuesta auspiciada por la IFCC, la IUPAC y la OMS en la Conferencia Internacional de Consenso de Estocolmo18. En dicha propuesta se aceptan las especificaciones establecidas explícitamente por organizadores de programas de garantía externa de la calidad.
El Comité de Expertos autor de este trabajo ha presentado sus especificaciones a la ENAC y las ha divulgado entre las entidades certificadoras que operan en nuestro país.
- c.
Proporcionar una información a las administraciones sanitarias para definir criterios asistenciales del laboratorio clínico.
Las EMC que están respaldadas por sociedades científicas garantizan la utilización de un criterio profesional basado en la evidencia científica. La preocupación principal de este grupo de expertos ha sido buscar unos límites de aceptabilidad para el error analítico similares a los reconocidos legalmente en otros países con regulación en este ámbito como Estados Unidos, Alemania, Australia22 y Suiza23 y alcanzable para la mayoría de los laboratorios clínicos de nuestro país.
El laboratorio clínico debe comprender que las EMC:
- -
No son un objetivo de la calidad.
- -
No deben reemplazar a las especificaciones de satisfacción médica general derivadas de la variación biológica.
- -
No deben reemplazar a las especificaciones de satisfacción médica de una enfermedad concreta.
No son objetivos ni se deben utilizar para definir objetivos porque implican diseñar un sistema de baja calidad. Por tanto, no se deben usar para describir el error total ni para establecer las reglas operativas en el control interno del proceso analítico.
Cumplir las EMC en un 100% de las magnitudes para las que están definidas es la base necesaria pero no suficiente para plantearse un objetivo de la calidad encaminado a satisfacer las necesidades médicas.
En general, las EMC son más permisibles que las derivadas de la variación biológica, excepto para magnitudes con regulación homeostática muy débil (algunas enzimas y metabolitos urinarios), en cuyo caso sí podrían usarse para definir objetivos de la calidad.
Para diseñar objetivos encaminados a satisfacer las necesidades médicas generales el laboratorio debe recurrir a las especificaciones derivadas de la variabilidad biológica que están definidas para 369 magnitudes biológicas19.
Para satisfacer las necesidades médicas de una enfermedad concreta se deben usar las especificaciones definidas para cada caso particular. Los pocos datos disponibles al respecto han sido compendiados recientemente24.
Conclusiones- •
Las EMC están obtenidas por consenso de las 4 sociedades científicas del laboratorio clínico en España.
- •
Suponen el 4.° nivel según el Consenso de Estocolmo.
- •
Su finalidad principal es la valoración de la prestación analítica en términos de error total, utilizando para ello los datos derivados de los programas de garantía externa de la calidad.
- •
Cuando el error total de alguna de las magnitudes supere la EMC debe realizarse un análisis de causas para subsanar el problema.
- •
Pretendemos que sirvan como referencia, tanto a las diferentes administraciones sanitarias como a las entidades certificadoras y acreditadoras para que en sus distintos ámbitos de actuación las utilicen en la evaluación de la labor asistencial del laboratorio clínico.
- •
El cumplimiento de las EMC es un requisito necesario pero no suficiente en el sistema de la calidad del laboratorio.
- •
Suponen un nivel mínimo que debe tener el proceso analítico. En consecuencia no pueden utilizarse como un objetivo de la calidad, porque implicaría crear un sistema de calidad muy limitada.
- •
No deben sustituir a las especificaciones de la calidad encaminadas a satisfacer las necesidades médicas específicas o las necesidades médicas generales (datos derivados de la variabilidad biológica o del análisis de las opiniones de los clínicos).
Los autores declaran no tener ningún conflicto de intereses.