Las proteínas de Bence Jones (PBJ) son cadenas ligeras libres monoclonales de inmunoglobulinas que aparecen en orina por producción excesiva de un clon de linfocitos B. Se han asociado a distintas enfermedades y tienen importante significado clínico. En este trabajo se ha evaluado la electroforesis capilar (EC) como método para su detección y medida.
Material y métodosSe analizaron 74 muestras de orina de 24h, para estudiar la PBJ mediante EC (previa desalinización de la muestra por ultrafiltración), inmunofijación y electroforesis de alta resolución en gel agarosa. Asimismo, se realizó un estudio de la imprecisión y del límite de detección de la EC.
ResultadosLa sensibilidad de la EC fue del 97,8% y la especificidad del 75,9%, sin diferencias entre muestras con baja o alta concentración de proteínas totales en orina. La agarosa presentó una sensibilidad y especificidad globales del 64,4% y 96,6%, respectivamente, siendo estos valores más altos en las muestras con concentraciones de proteínas totales en orina superiores a 150mg/L. La imprecisión de la EC para la medida de la PBJ osciló entre el 1,1% y el 4,5%. El límite de detección fue de 3mg/L para PBJ de clase kappa y de 1mg/L para PBJ de clase lambda.
ConclusionesEn la detección de la PBJ, la EC presentó valores altos de sensibilidad, especificidad y reproducibilidad, y un límite de detección muy bajo. La EC requiere un pretratamiento de las muestras, pero permite la detección y medida de las PBJ de manera automatizada y reproducible, con una sensibilidad cercana a la inmunofijación.
Bence-Jones proteins (BJP) are monoclonal immunoglobulin free light chains that are detected in urine due to an over-production by a B-lymphocyte clone. BJP have been linked to various diseases, with significant clinical signance. In this work, capillary electrophoresis (CE) has been evaluated as a technique for the detection and quantification of BJP.
Material and methodsTwenty four-hour urine samples from 74 patients were analyzed for BJP by CE (with a previous ultrafiltration step), immunofixation, and high resolution electrophoresis on agarose gel. Imprecision and the detection limit of CE were also studied.
ResultsSensitivity and specificity of CE was 97.8% and 75.9%, respectively. No differences were found between samples with a high or low urinary total protein concentration. Sensitivity and specificity of agarose were 64.4% and 96.6%, respectively, but these values were higher in samples with a urinary total protein concentration above 150mg/L. Imprecision of CE in the quantification of BJP was 1.1-4.5%. Detection limit for kappa and lambda BJP were 3mg/L and 1mg/L, respectively.
ConclusionsIn the detection of BJP by CE, sensitivity, specificity and reproducibility were very high, whereas the detection limit was very low. CE requires the prior treatment of samples, but it provides an automated and reproducible method for detecting and measuring BJP, with a sensitivity very close to that of immunofixation.
Las proteínas de Bence Jones (PBJ) son cadenas ligeras libres (kappa o lambda) monoclonales de inmunoglobulinas, que aparecen en la orina debido a una producción excesiva por parte de una célula plasmática con proliferación descontrolada1,2. Normalmente, las cadenas ligeras libres son reabsorbidas en las células tubulares del riñón, pero cuando se supera esta capacidad de reabsorción aparecen en la orina, en fragmentos o intactas, y con un grado de polimerización variable.
La presencia de PBJ se ha asociado a distintas enfermedades, principalmente a mieloma múltiple (MM), macroglobulinemia de Waldenström, amiloidosis AL y enfermedad por depósito de cadenas ligeras. También se han descrito en pacientes con linfomas, leucemia linfocítica crónica y gammapatía monoclonal de significado incierto3,4.
Las PBJ tienen un significado clínico importante, a nivel diagnóstico y de seguimiento, en la mayoría de las gammapatías monoclonales. Ante la sospecha de una gammapatía monoclonal, el estudio en orina puede ser eliminado inicialmente, ya que la realización en suero de la electroforesis de proteínas séricas, junto a la inmunofijación (IF) y la medida de las cadenas ligeras libres, provee de suficiente sensibilidad para su diagnóstico5. Sin embargo, una vez establecido este, es necesario realizar el estudio en orina6. En el caso de la amiloidosis AL, el estudio en orina incrementa la sensibilidad de detección y debe realizarse junto a los estudios en suero6. Asimismo, el estudio de la PBJ está indicado en el seguimiento y evaluación del grado de respuesta tras el tratamiento en el MM7.
Dado su significado clínico, resulta valioso disponer de un método fiable de detección y medida de estas proteínas. Actualmente, el método de elección para su estudio es la IF4,8–10, el cual presenta una elevada sensibilidad, pues es capaz de detectar e identificar PBJ en concentraciones superiores a 10mg/L11. No obstante, el método más extendido para la medida de la PBJ es la electroforesis de alta resolución en gel de agarosa (AG), con menor sensibilidad. Este método se basa en la medición de las proteínas totales en la muestra de orina y la lectura densitométrica de la banda monoclonal. Aunque es el método más recomendado, presenta limitaciones, como son que depende del método de medición de las proteínas totales en orina (PTO), las diferentes proteínas presentan distinta afinidad por los colorantes empleados, la subjetividad en la delimitación de los puntos de corte, y la dificultad en delimitar la banda monoclonal en trazados con fondo intenso, múltiples bandas o que migran con otras proteínas4,10.
La electroforesis capilar (EC) es un método ampliamente utilizado en la detección de componentes monoclonales en suero debido a su rapidez, automatización y alta sensibilidad. Sin embargo, su aplicación en el análisis de orina está menos extendida debido a la presencia en la muestra de sustancias interferentes que absorben en la región ultravioleta.
El objetivo de este trabajo es evaluar un método para la detección y medida de la PBJ, mediante ultrafiltración de la muestra de orina y análisis por EC.
Material y métodosMuestras clínicasSe recogieron 74 muestras de orina de 24h, procedentes todas ellas de pacientes distintos, diagnosticados de MM (n=37), gammapatía monoclonal de significado incierto (n=23), otras enfermedades hematológicas (n=9) o sin datos de diagnóstico previo (n=5). Los pacientes con gammapatía monoclonal fueron diagnosticados por un hematólogo siguiendo los criterios establecidos previamente12. A todos ellos se les había solicitado el estudio de la PBJ. Hasta su procesamiento, las muestras de orina se conservaron a 4°C durante un periodo máximo de 7 días, periodo durante el cual la muestra se mantiene estable10. Antes de su análisis, las muestras se centrifugaron a 1.800g durante 10min.
Medida de las proteínas totales en orinaLa medida de la concentración de proteínas totales en las muestras de orina se llevó a cabo por espectrofotometría de absorción molecular, mediante el método analítico rojo de pirogalol, en el equipo AU2700 (Beckman Coulter; Brea, EE. UU.).
Electroforesis de alta resolución en gel de agarosa (AG)La electroforesis se realizó utilizando un gel de agarosa de alta resolución (Hydragel 7HR, Sebia; Evry, Francia), adaptado para el uso de orina sin concentrar, empleando el sistema comercial Hydrasys (Sebia; Evry, Francia). No obstante, las muestras con una concentración de PTO inferior a 150mg/L se concentraron antes de su análisis (unas 10 veces, aproximadamente), utilizando las columnas Amicon Ultra-4 (Millipore; Billerica, EE. UU.), para lo cual se centrifugaron 4mL de orina a 2.300g durante 15min. Cuando la concentración de PTO era igual o superior a 150mg/L las muestras se procesaron sin concentrar. Siguiendo las instrucciones del fabricante, la electroforesis se realizó a voltaje constante con 10μL de orina y el gel se tiñó con el colorante violeta ácido. La evaluación de los trazados electroforéticos obtenidos por AG la realizó, mediante análisis ciego, un facultativo de laboratorio con varios años de experiencia en el procedimiento.
Inmunofijación (IF)Para detectar e identificar la clase de PBJ mediante IF se utilizó el producto comercial Hydragel 2/4 IF, en el sistema Hydrasys (ambos de Sebia; Evry, Francia). Siguiendo las instrucciones del fabricante, se utilizaron 10μL de orina sin concentrar, los antisueros comerciales suministrados y el colorante violeta ácido para teñir el gel. La evaluación de la IF se realizó por el mismo observador que en el caso de la AG. La inspección visual del gel permitió catalogar las muestras como negativas o positivas para PBJ y, en este último caso, identificar el tipo de cadena ligera libre. Aquellas muestras en las que no se detectó la PBJ por IF pero sí mediante EC (falsos positivos) se analizaron nuevamente por IF, concentrando las muestras unas 5-10 veces antes de este segundo análisis.
Análisis de la proteína de Bence Jones por electroforesis capilar (EC)Preparación de las muestrasUtilizando el sistema de columnas Amicon Ultra-4 (Millipore; Billerica, EE. UU.), se dispensaron 4mL de orina y se centrifugaron después a 2.300g durante 30min. Para eliminar el resto de sales y sustancias interferentes en el concentrado obtenido, a las orinas concentradas se les añadió 4mL de tampón TDT (Sebia; Evry, Francia) diluido 1:2 en agua destilada y se realizó una nueva centrifugación de 30min a 2.300g. Se añadieron 400 uL de tampón TDT diluido 1:2 en agua destilada y se homogeneizó la mezcla. Al final de este procedimiento, la concentración de PTO en las muestras fue aproximadamente unas 5-10 veces mayor que la inicial, y se eliminaron posibles sustancias interferentes que absorben en la región ultravioleta.
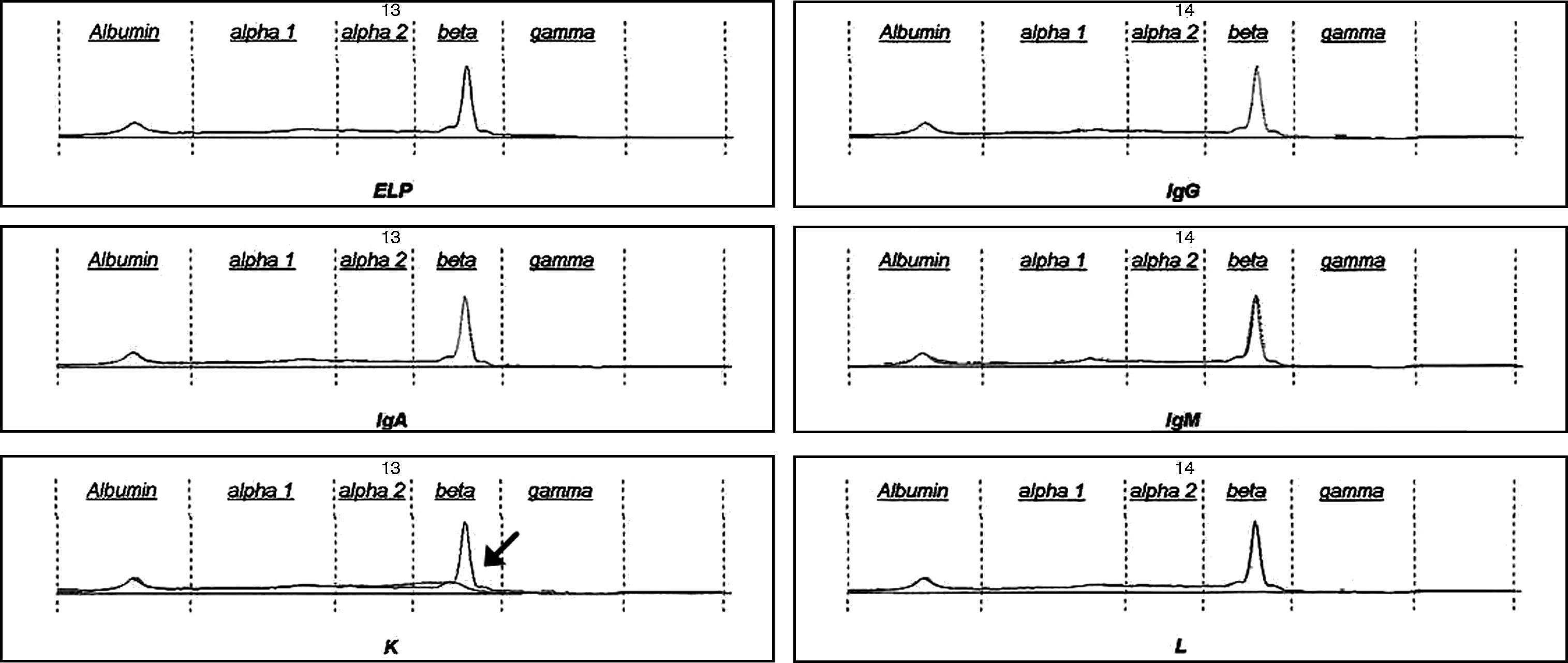
Detección, identificación y medida de la proteína de Bence Jones mediante electroforesis capilarLas muestras de orina, una vez preparadas, se procesaron por EC en el sistema Capillarys (Sebia; Evry, Francia). La interpretación de los electroferogramas se realizó también, mediante análisis ciego, por el mismo facultativo de laboratorio. Para una evaluación preliminar del inmunotipado, la identificación de la clase de PBJ se llevó a cabo mediante este método en el mismo equipo, además de realizarla por IF, en 8 muestras. Estas muestras se seleccionaron entre las muestras positivas y todas tenían picos monoclonales definidos y con un tamaño suficiente para que, tras enfrentar la muestra con los antisueros, la interpretación del pico no ofreciera dudas (fig. 1). En ambos casos, se siguieron las instrucciones del fabricante. La medida de la PBJ se realizó integrando el área bajo la curva del pico monoclonal y teniendo en cuenta la concentración de PTO de cada muestra, determinada previamente.
Inmunotipado de la proteína de Bence Jones mediante electroforesis capilar. En el ejemplo se muestra la identificación de un pico monoclonal de clase kappa. La incubación de la orina con el antisuero antikappa conlleva la desaparición del pico sospechoso (flecha), conservándose este en los casos en los que la muestra se incubó con antisueros de otras especificidades.
Se analizó la presencia o ausencia de PBJ en orina mediante 3 métodos: AG, EC e IF. Se calculó la sensibilidad y la especificidad diagnósticas de la EC a partir del número de muestras de orina en las que se detectó o no la PBJ por este método, y del número de muestras positivas y negativas mediante IF (método de referencia). Se realizó la misma comparación entre los resultados obtenidos por AG y los obtenidos por IF. Asimismo, se calculó en ambos casos el porcentaje de falsos positivos y falsos negativos.
La sensibilidad y especificidad fueron calculadas para las 74 muestras en su conjunto, así como divididas en 2 grupos en función de la concentración de PTO. En el primero, se incluyeron 43 muestras con una concentración de PTO menor de 150mg/L (rango 20-140mg/L); el segundo grupo lo integraron 31 muestras en las que la concentración de PTO era igual o mayor de 150mg/L (rango 150-4.260mg/L).
Estudio de la imprecisiónPara estimar la imprecisión se utilizaron 4 muestras de orina en las que previamente se había confirmado la presencia de PBJ. Dos muestras contenían PBJ de clase kappa, de baja y alta concentración, y otras 2 de clase lambda, de baja y alta concentración (rango: 22,2-367mg/L).
Las muestras se analizaron por duplicado durante 13 días consecutivos mediante EC y en este periodo no se observó disminución en la concentración de la PBJ. Se tuvo en cuenta también la imprecisión de la fase de preparación de las muestras. Para ello, antes de analizar las muestras por EC, se llevó a cabo el proceso completo de ultrafiltración en cada una de ellas. No se incluyó la imprecisión de la medida de las PTO, si bien cabe mencionar que la imprecisión interensayo para el método de medida de las PTO de nuestro laboratorio es inferior al 2,5%. Las muestras se conservaron a 4°C entre cada análisis.
La imprecisión total se estimó siguiendo el análisis estadístico descrito previamente en el documento EP5-A2 del CLSI13.
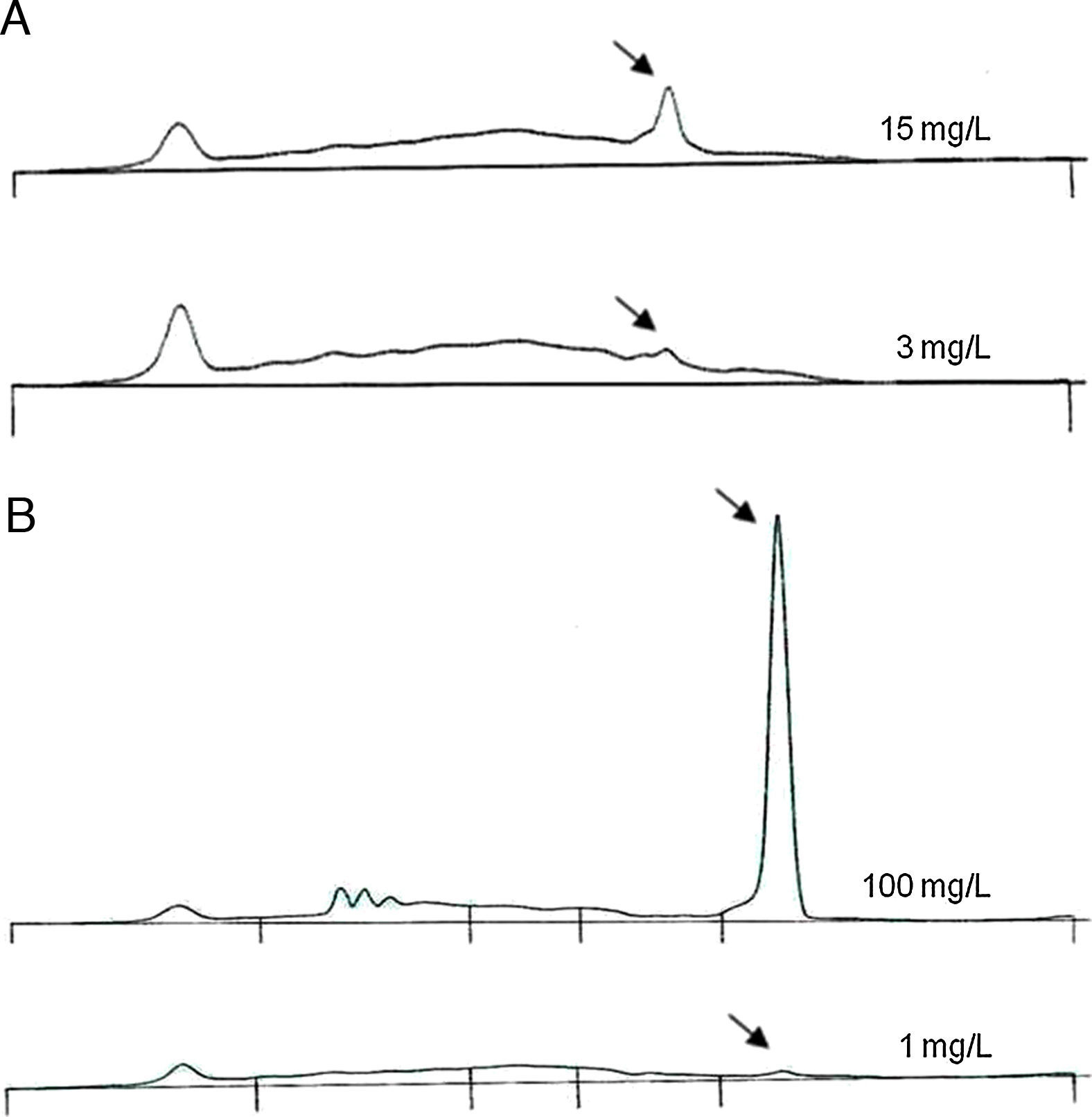
Cálculo del límite de detecciónSe seleccionaron 4 muestras de orina en las que previamente se había detectado PBJ (2 de clase kappa y 2 de clase lambda). En todas las muestras la PBJ migró en la región gamma. Estas muestras se diluyeron en una mezcla de orinas negativas para PBJ y se obtuvieron varias diluciones seriadas, en las que el rango de concentraciones de PBJ se situó entre 1 y 100mg/L. Todas las muestras diluidas se analizaron mediante EC y se calculó la concentración de PBJ como se ha señalado anteriormente. El límite de detección se obtuvo como la última dilución que producía un pico monoclonal perceptible.
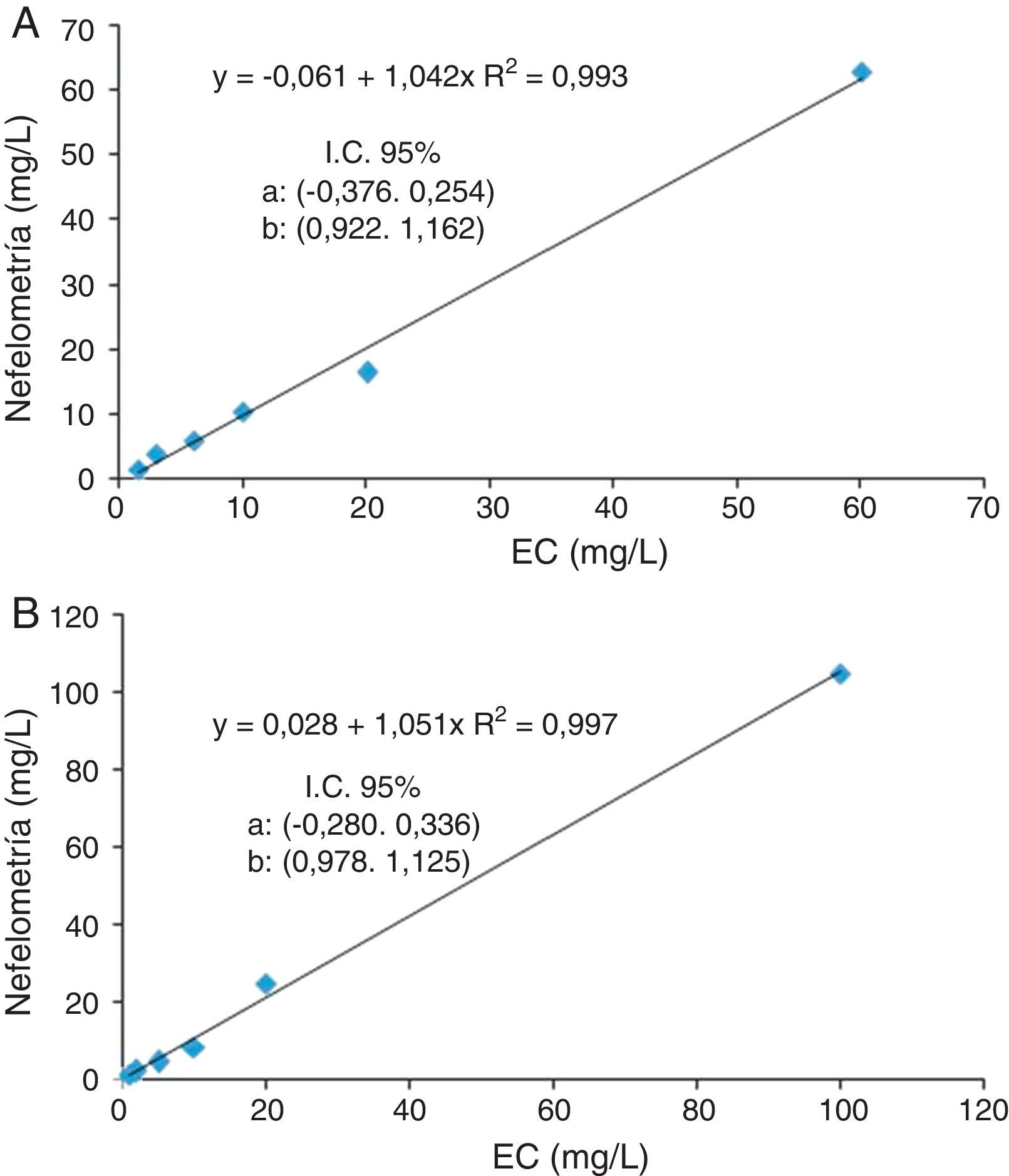
Para comprobar la concentración de PBJ obtenida por EC se realizó mediante nefelometría una medida de cadenas ligeras libres en orina en las mismas muestras diluidas. El analizador empleado fue el Immage 800 (Beckman Coulter, Brea, EE. UU.), mientras que el reactivo utilizado fue el New Scientific Company (Fenegrò-Como, Italia).
Análisis estadísticos y elaboración de gráficosLa recogida, interpretación y presentación de todos los datos obtenidos se llevó a cabo mediante el programa Microsoft Office Excel (Redmond, EE. UU.), versión 2007.
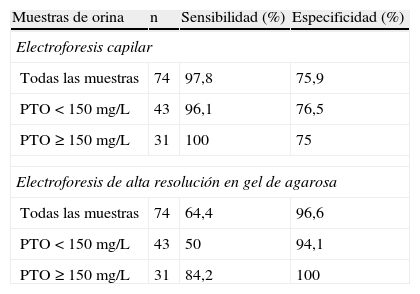
ResultadosLos valores obtenidos de sensibilidad y especificidad de la EC y de la AG en la detección de la PBJ en comparación con la IF se resumen en la tabla 1. La detección de la PBJ por EC presentó una sensibilidad superior al 96% y una especificidad por encima del 75%, tanto en el conjunto de las 74 muestras, como al desglosar estas en los grupos con concentración de PTO inferior a 150mg/L y superior o igual a 150mg/L. El único falso negativo obtenido correspondió a una muestra de orina con una concentración de PTO de 60mg/L y pertenecía a un paciente con MM. La detección de PBJ por AG arrojó una sensibilidad discreta y una especificidad muy alta (97%) en el conjunto de todas las muestras analizadas. Destaca el hecho de que la sensibilidad del método mejoró sustancialmente en las muestras con concentraciones de PTO superiores a 150mg/L. Un ejemplo de una muestra de orina positiva por los 3 métodos se ilustra en la figura 2. Los valores de especificidad obtenidos en el caso de la EC implican que los falsos positivos suponen en torno al 25%. Finalmente, hay que señalar que la identificación de la clase de PBJ realizada mediante inmunotipado coincidió con la realizada por IF, en las 8 muestras en las que se utilizaron ambos métodos.
Estudio de sensibilidad y especificidad de la electroforesis capilar y la electroforesis de alta resolución en gel de agarosa en la detección de la proteína de Bence Jones
| Muestras de orina | n | Sensibilidad (%) | Especificidad (%) |
| Electroforesis capilar | |||
| Todas las muestras | 74 | 97,8 | 75,9 |
| PTO<150mg/L | 43 | 96,1 | 76,5 |
| PTO≥150mg/L | 31 | 100 | 75 |
| Electroforesis de alta resolución en gel de agarosa | |||
| Todas las muestras | 74 | 64,4 | 96,6 |
| PTO<150mg/L | 43 | 50 | 94,1 |
| PTO≥150mg/L | 31 | 84,2 | 100 |
PTO: concentración de proteínas totales en orina.
El método de referencia es la inmunofijación.
Ejemplo representativo de una muestra de orina positiva para proteína de Bence Jones. Tanto la electroforesis de alta resolución en gel de agarosa (A), como la inmunofijación (B) y la electroforesis capilar (C) detectaron cadenas ligeras libres monoclonales de tipo lambda (flechas) en esta muestra.
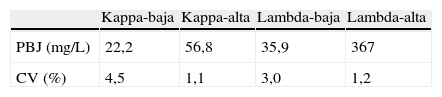
La imprecisión total obtenida para la PBJ de clase kappa fue del 4,5% en la muestra con concentración baja y del 1,1% para la muestra con concentración alta; en el caso de la PBJ de clase lambda, los valores de imprecisión en las muestras con baja y alta concentración fueron del 3 y del 1,2%, respectivamente (tabla 2).
Resultados del estudio de imprecisión de la electroforesis capilar como método de medida de la proteína de Bence Jones
| Kappa-baja | Kappa-alta | Lambda-baja | Lambda-alta | |
| PBJ (mg/L) | 22,2 | 56,8 | 35,9 | 367 |
| CV (%) | 4,5 | 1,1 | 3,0 | 1,2 |
CV: coeficientes de variación; PBJ: proteína de Bence Jones.
Para cada uno de los 4 especímenes utilizados (kappa de baja y alta concentración, lambda de baja y alta concentración) se muestran los valores medios de la concentración de PBJ y los CV obtenidos.
Por último, el límite de detección de la PBJ mediante EC fue de 3mg/L para la PBJ de clase kappa y de 1mg/L para la PBJ de clase lambda (fig. 3). Los datos obtenidos en la medida de cadenas ligeras libres en orina mediante nefelometría confirmaron que había una buena correlación entre los 2 métodos (fig. 4).
Cálculo del límite de detección de la proteína de Bence Jones (PBJ) por electroforesis capilar. Se muestran 2 ejemplos representativos, uno de los cuales corresponde a una orina con PBJ de clase kappa (A) y el otro a una orina con PBJ de clase lambda (B). En ambos casos, se representan los proteinogramas de la primera dilución de las muestras y de la última dilución en la que se pudo detectar la PBJ, junto con las concentraciones teóricas de PBJ en cada caso. Las flechas señalan el pico monoclonal correspondiente.
Correlación entre la concentración de proteína de Bence Jones obtenida mediante electroforesis capilar (EC) y la de cadenas ligeras libres por nefelometría, en el cálculo del límite de detección de la EC. Se representan los valores obtenidos por ambos métodos para las diluciones de una de las muestras con PBJ de clase kappa (A) y otra con PBJ de clase lambda (B).
El estudio de la PBJ requiere métodos con buena resolución y elevada sensibilidad, capaces de detectar concentraciones superiores a 10mg/L. Si bien la IF es el método más sensible y de referencia para su detección e identificación4,8–10, es la AG el más empleado para su medida. La AG permite además el estudio del tipo de proteinuria.
La EC es un método de separación de proteínas basada en el desequilibrio neto entre el flujo electroendosmótico y la movilidad electroforética de las proteínas, cuando se aplica un voltaje elevado a lo largo de un capilar. Las proteínas se detectan por medición de la absorbancia del enlace peptídico en la región ultravioleta (214nm). El empleo de la EC en suero ha revelado tener mayor sensibilidad en la detección de componentes monoclonales que la AG14–16, siendo el principal inconveniente de su aplicación en orina la presencia en esta de numerosas sustancias de bajo peso molecular y sales, que absorben en la región ultravioleta. Esto obliga a un pretratamiento de la muestra para eliminar los interferentes antes de su procesamiento.
En el presente trabajo se ha evaluado la EC como método de detección y medida de la PBJ, utilizando la ultrafiltración como tratamiento previo de las muestras. Tras esta preparación, las muestras de orina se concentraron entre 5 y 10 veces. La concentración de las muestras aumenta la sensibilidad; sin embargo, tiene como inconveniente que puede producir pérdida de algunas proteínas o fragmentos de cadenas ligeras. La mayoría de los trazados electroforéticos obtenidos estaban libres de picos inespecíficos, si bien en ciertos casos las sustancias interferentes no se lograron eliminar completamente y dieron lugar a la aparición de algunos picos, generalmente en la región alfa, aunque en ningún caso se correspondieron con componentes monoclonales. En todas las muestras analizadas, incluyendo aquellas con concentraciones de PTO muy bajas (inferiores a 10mg/L), se observó el pico correspondiente a la albúmina, que asegura una adecuada sensibilidad y una correcta aplicación de la muestra3,17. El proceso de ultrafiltración es reproducible, como muestran los resultados de imprecisión obtenidos, y además pueden procesarse a la vez un gran número de muestras de orina. Si bien el tiempo necesario para realizar la preparación de la muestra es largo, el requerido en el análisis por cada EC es reducido, por lo que el tiempo total invertido es similar al empleado para realizar la AG.
Los valores de sensibilidad obtenidos en el estudio de la detección de la PBJ por EC fueron muy elevados (96-100%), tanto en las muestras con alta concentración de PTO (superior a 150mg/L) como en las que tienen baja concentración (inferior a 150mg/L). Estos datos contrastan con un estudio previo18, realizado con un analizador Paragon CZE 2000 (Beckman Coulter; Brea, EE. UU.), en el que se obtuvieron diferencias en la sensibilidad de la EC entre muestras con concentraciones de PTO menores de 100mg/L (66,7%) o superiores a esa cantidad (91,9%). La diferencia en los resultados obtenidos puede deberse al método de preparación de las muestras, ya que en aquel estudio se utilizó un sistema de columnas de cromatografía manual, donde se produce una dilución de la muestra tras la desalinización.
La especificidad de la EC obtenida en este trabajo fue del 75%. En algunos casos, los falsos positivos se debieron a la presencia de proteínas tubulares, que dan lugar a picos en la región beta. Sin embargo, en la mayoría de las muestras el pico detectado apareció en la región gamma y sugería fuertemente la presencia de PBJ. Empleando alícuotas concentradas de estas muestras (todas ellas con PTO inferiores a 150mg/L), se repitió la IF y se obtuvieron resultados positivos en todos los casos, por lo que la especificidad de la EC aumentó de manera notable. Estos resultados sugieren que es recomendable una concentración previa de la muestra antes de realizar la IF, en las orinas que tengan unas proteínas totales inferiores a 150mg/L.
Respecto a los datos de la AG, se obtuvo una mayor especificidad que con la EC y una sensibilidad inferior. No obstante, los valores de sensibilidad fueron más elevados en las muestras con concentración mayor o igual de 150mg/L de PTO, respecto a las muestras con menos de 150mg/L. El método AG para orinas no concentradas de Sebia ha sido evaluado previamente19. En dicho estudio se concentraron 10 veces las orinas con concentración de PTO inferior a 150mg/L y se concluyó que poseía el mismo rendimiento para la detección de PBJ que otro método de AG que utilizaba orina concentrada 10-200 veces. En el presente trabajo se concentraron las muestras de orina con PTO inferiores a 150mg/L y, pese a ello, el método de AG para estas muestras no tuvo la sensibilidad adecuada, por lo que es muy alto el porcentaje de falsos negativos (50%). Los resultados de EC son sensiblemente mejores que los de la AG para las orinas con una concentración de PTO inferior a 150mg/L. Además, las muestras no necesitan un tratamiento diferente antes de su procesamiento mediante EC.
El inmunotipado es un método inmunoquímico muy utilizado en la identificación de componente monoclonal en suero y sirve también para su identificación en orina, con la consiguiente adaptación20. En aquellas muestras donde el inmunotipado se llevó a cabo, coincidió siempre con la identificación obtenida mediante IF. El inmunotipado es un procedimiento totalmente automatizado y permite una medida posterior más exacta de la PBJ, ya que esta queda identificada en el trazado electroforético y se pueden definir mejor los puntos de corte del área a integrar. Como inconveniente, destaca el hecho de que picos muy pequeños pueden generar dudas en su categorización, ya que, tras someter a la muestra a una segunda electroforesis tras su reacción inmunoquímica con los antisueros, los picos pueden quedar menos definidos y dificultar la interpretación. En estos casos siempre se debería optar por realizar una IF.
El límite de detección de la PBJ obtenido por medio de EC para las muestras con PBJ de clase kappa quedó establecido en 3mg/L, mientras que para las muestras con PBJ de clase lambda fue de 1mg/L. En ambos casos, los valores obtenidos quedan por debajo del límite de detección recomendado de 10mg/L3,4,9. Asimismo, los resultados aquí mostrados mejoran los obtenidos por la propia EC en un estudio previo18, en el que esos límites de detección fueron 11,7mg/L para la PBJ de clase kappa y 6,7mg/L para la de clase lambda.
La medida de la PBJ se utiliza en el seguimiento de los pacientes con gammapatías monoclonales, para valorar tanto la progresión de la enfermedad, como la respuesta al tratamiento7,21. Su medición, sin embargo, conlleva dificultades, ya que además de no disponer de un patrón internacional, los métodos electroforéticos se basan en la medida de las PTO y actualmente no existe un método para medir PTO que cumpla con los criterios clínicos y analíticos requeridos. Es importante disponer al menos de un método con poca variabilidad analítica para el seguimiento de los pacientes.
Los resultados de imprecisión obtenidos en la medida de la PBJ fueron buenos (1,1-4,5%) y lo suficientemente bajos para concluir que la EC es un método reproducible (la concentración de la PBJ apenas varió a lo largo de los 13 días del estudio) y, por tanto, adecuado para cuantificar la PBJ.
En conclusión, la evaluación de la EC como método de detección y medida de la PBJ ha mostrado que la reproducibilidad del método es alta, los valores de sensibilidad y especificidad obtenidos son elevados y el límite de detección es muy bajo, lo que permite detectar la PBJ en concentraciones muy pequeñas. Además, la identificación del componente monoclonal mediante inmunotipado es buena, si bien no es aplicable ante componentes monoclonales de muy baja concentración.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen a Olga Ares Vidal y a Ernestina Sánchez Rodríguez el apoyo técnico proporcionado durante la elaboración de este trabajo.