Frecuentemente el mieloma múltiple es precedido de una gammapatía monoclonal de significado incierto. Este estudio analiza la utilidad de una lipidemia falsamente positiva como un método rutinario y barato de detección de gammapatías monoclonales de IgM.
Material y métodosSe examinaron los sueros de 244 pacientes consecutivos con un índice lipidémico falso positivo (n=34) o negativo (n=210) y triglicéridos < 1,7mmol/L. Las concentraciones de inmunoglobulinas se estudiaron mediante un autoanalizador AU-5430. Los test de lipidemia fueron realizados con una concentración salina de 0,038M y los proteinogramas mediante una electroforesis capilar de la zona.
ResultadosCon el diagnóstico de banda monoclonal la lipidemia falsa positiva tuvo una sensibilidad del 97% (95% CI: 91-100) y especificidad del 94% (95% CI: 91-97). El valor predictivo positivo y negativo fue de 72% (95% CI: 59-85) y 99% (95% CI: 99-100), respectivamente. Para el diagnóstico de IgM elevada la sensibilidad fue del 71% (95% CI: 55-86), la especificidad del 99% (95% CI: 98-100) y el valor predictivo positivo y negativo del 92% (95% CI: 82-103) y 95% (95% CI: 93-98), respectivamente. El OR ajustado por edad y sexo de la lipidemia falso positivo fue de 768,0 (95% CI: 75,8-7.799,3) para la IgM elevada y de 219,4 (95% CI: 42,9-1.120,5) para la banda monoclonal.
ConclusionesLa lipidemia falsamente positiva se asoció a la IgM elevada y particularmente a la gammapatía monoclonal. Es una herramienta barata, sensible y específica para detectar una gammapatía monoclonal de IgM en los índices de interferencia rutinarios en analizadores.
Most patients with multiple myeloma have a previous monoclonal gammopathy of undetermined significance. This study analyzes the possible clinical usefulness of a false positive lipemia as a routine, inexpensive screening tool for IgM monoclonal gammopathies.
Material and methodsSerum samples from 244 consecutive patients with a false positive (n=34) or negative lipemia test (n=210), with triglycerides <1.7mmol/L were studied. Immunoglobulin levels were quantified in an AU-5430 autoanalyzer. Lipemia tests were performed in a final saline concentration of 0,038M, and proteins by capillary-zone electrophoresis.
ResultsSensitivity for monoclonal band detection was 97% (95% CI 91-100) for false lipemia, with 94% (95% CI: 91-97) specificity. The positive and negative predictive values were 72% (95% CI: 59-85) and 99% (95% CI: 99-100), respectively. Its sensitivity for elevated IgM detection was 71% (95% CI: 55-86) and 99% (95% CI: 98-100) specificity, positive and negative predictive values of 92% (95% CI: 82-100) and 95% (95% CI: 93-98), respectively. Age and sex-adjusted odds ratio of elevated IgM for false lipemic serum patients was 768.0 (95% CI: 75.8-7799.3), and 219.4 (95% CI: 42.9-1120.5) for the monoclonal band.
ConclusionsA false positive lipemic test was associated with elevated IgM, and particularly with monoclonal gammopathy. This finding offers an inexpensive, sensitive and specific screening tool to detect IgM monoclonal gammopathy processes in routine autoanalyzer interference tests.
Muchos analizadores de bioquímica tienen la capacidad de detectar hemólisis, ictericia y lipidemia en muestras biológicas, proporcionando índices séricos como indicadores de presencia de hemoglobina, bilirrubina o lípidos1. Dado que estos interferentes pueden alterar los resultados bioquímicos en determinados analizadores se comprueban de manera rutinaria y se miden debidamente con índices específicos semicuantitativos2,3. Algunos casos aislados de índice lipidémico anormal, en ausencia de lipidemia verdadera, han sido relacionados con la presencia de bandas monoclonales (BM) de IgM2,4. La gammapatía monoclonal de significado incierto (GMSI) se caracteriza por la presencia de la proteína M en suero en concentraciones < 30g/L, por la presencia de células plasmáticas clonales en la médula ósea inferior a un 10% y por la ausencia de daño en el órgano diana atribuible a un trastorno de proliferación de células plasmáticas5. La IgG ha sido descrita como la inmunoglobulina más predominante5. Su prevalencia aumenta con la edad, siendo del 5,3% en la población de edad superior o igual a 70 años6. La GMSI deriva en una enfermedad maligna en el 26% de los casos. Especialmente puede preceder al diagnóstico de mieloma múltiple, macroglobulinemia, amiloidosis y trastornos linfoproliferativos7. Además, la GMSI se observa previamente al diagnóstico de mieloma múltiple en prácticamente todos los pacientes5,8,9. Por ello, es muy importante identificar a los pacientes con este indicador clínico y realizarles un seguimiento adecuado5,10. El objetivo de este estudio fue analizar la utilidad bioquímica y clínica de la utilización de una prueba de lipidemia falsa positiva en un analizador bioquímico como método de cribado económico y rutinario en la detección de gammapatías monoclonales de IgM.
Material y métodosDiseño del estudio y participantesSe diseñó un estudio de validación de una prueba diagnóstica. Se obtuvieron muestras de suero de 244 pacientes anónimos de forma consecutiva. Eran personas mayores de 50 años con una lipidemia falsa positiva (n=34) o con un índice de lipidemia negativo (n=210). Nuestro laboratorio abarca la mayor parte de las peticiones analíticas de la ciudad de Barcelona con una población cercana a los 2 millones de personas y una población bastante heterogénea. El tamaño de la muestra permitía un 85% de sensibilidad del análisis con un intervalo de confianza (IC) del 95% de±10 unidades porcentuales y un 95% de especificidad con un 95% de IC de±2 unidades porcentuales. El estudio fue aprobado por el Comité Ético local (Fundación Jordi Gol # P10/01).
Mediciones bioquímicasLos índices séricos están basados en la lectura de absorbancia del suero diluido en suero fisiológico mediante la lectura de las gamas amarillo, rojo y turbio en sus respectivas longitudes de onda de absorbancia: 480, 570 y 660nm.
Las concentraciones de inmunoglobulinas se cuantificaron por inmunoturbidimetría y los triglicéridos por el método de glicerol oxidasa en un analizador AU-5430 (Beckman Coulter, Brea, Estados Unidos). Los proteinogramas para confirmar la BM se realizaron por electroforesis capilar de la zona (CZE) con Paragon-CZE-2000® (Beckman-Coulter, Brea, Estados Unidos). Las 2 condiciones consideradas en el estudio fueron la gammapatía monoclonal y la IgM elevada con un umbral de 30g/L11. Se ha descrito que los resultados de CZE concuerdan con los de electroforesis de inmunofijación (IFE): la detectabilidad fue del 95% y la especificidad del 99%12. Algunos autores ya han recomendado las técnicas de CZE para la detección de las gammapatías monoclonales13. El índice de lipidemia es un indicador semicuantitativo con un rango entre 1 y 5 de turbidez en la determinación de la solución de Intralípid (Fresenius Kabi, Barcelona, España) que no está relacionada estequiométricamente con la concentración de triglicéridos. Las lecturas se realizaron en densidades ópticas de 660 y 800nm. El índice lipidémico se realizó en una concentración salina final de 0,038M. También se estudiaron las curvas de disolución en las concentraciones salinas de 0M, 0,019M, 0,038M y 0,077M en 5 muestras lipidémicas falsas, así como en 5 sueros no lipidémicos usados como controles, de los cuales 2 presentaban una BM por IgA y 3 por IgG. Se comprobaron las absorbancias siguientes 0,0140, 0,0250, 0,0400, 0,0550 y 0,1000 en todas las muestras. Consideramos como falso lipidémico todo el suero transparente o sueros de sujetos con < 1,7mmol/L de triglicéridos con un resultado de lipidemia positivo en el analizador.
Análisis estadísticoTuvimos en cuenta la sensibilidad, la especificidad y los valores predictivos en el diagnóstico de lipidemia falsa positiva, así como el área bajo la curva ROC, la eficiencia diagnóstica y las razones de verosimilitud. Las diferencias entre pacientes con y sin concentración elevada de IgM y entre pacientes con y sin BM fueron evaluadas con una prueba chi-cuadrado para variables categóricas y un Student's T-test para variables continuas o las pruebas no paramétricas correspondientes si no se cumplían sus condiciones de aplicación. Se calculó la razón de odds (OR) ajustada para las determinaciones de los falsos positivos de suero lipidémico con valores de IgM elevados.
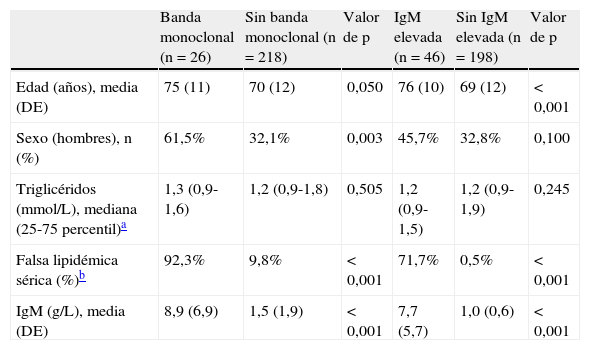
ResultadosLos pacientes con BM eran mujeres con más frecuencia y tanto los pacientes con BM como los que presentaban la IgM elevada eran de mayor edad que sus respectivos controles. Se observaron concentraciones similares de triglicéridos tanto en los pacientes con BM como en los pacientes con la IgM elevada y sus respectivos controles (tabla 1). No se detectó BM de IgG ni IgA pero se identificaron 8 bandas policlonales.
Características de los pacientes incluidos en el estudio por la presencia de una banda monoclonal de IgM elevada (> 30g/L)
| Banda monoclonal (n=26) | Sin banda monoclonal (n=218) | Valor de p | IgM elevada (n=46) | Sin IgM elevada (n=198) | Valor de p | |
| Edad (años), media (DE) | 75 (11) | 70 (12) | 0,050 | 76 (10) | 69 (12) | < 0,001 |
| Sexo (hombres), n (%) | 61,5% | 32,1% | 0,003 | 45,7% | 32,8% | 0,100 |
| Triglicéridos (mmol/L), mediana (25-75 percentil)a | 1,3 (0,9-1,6) | 1,2 (0,9-1,8) | 0,505 | 1,2 (0,9-1,5) | 1,2 (0,9-1,9) | 0,245 |
| Falsa lipidémica sérica (%)b | 92,3% | 9,8% | < 0,001 | 71,7% | 0,5% | < 0,001 |
| IgM (g/L), media (DE) | 8,9 (6,9) | 1,5 (1,9) | < 0,001 | 7,7 (5,7) | 1,0 (0,6) | < 0,001 |
DE: desviación estándar; IgM: inmunoglobulina M.
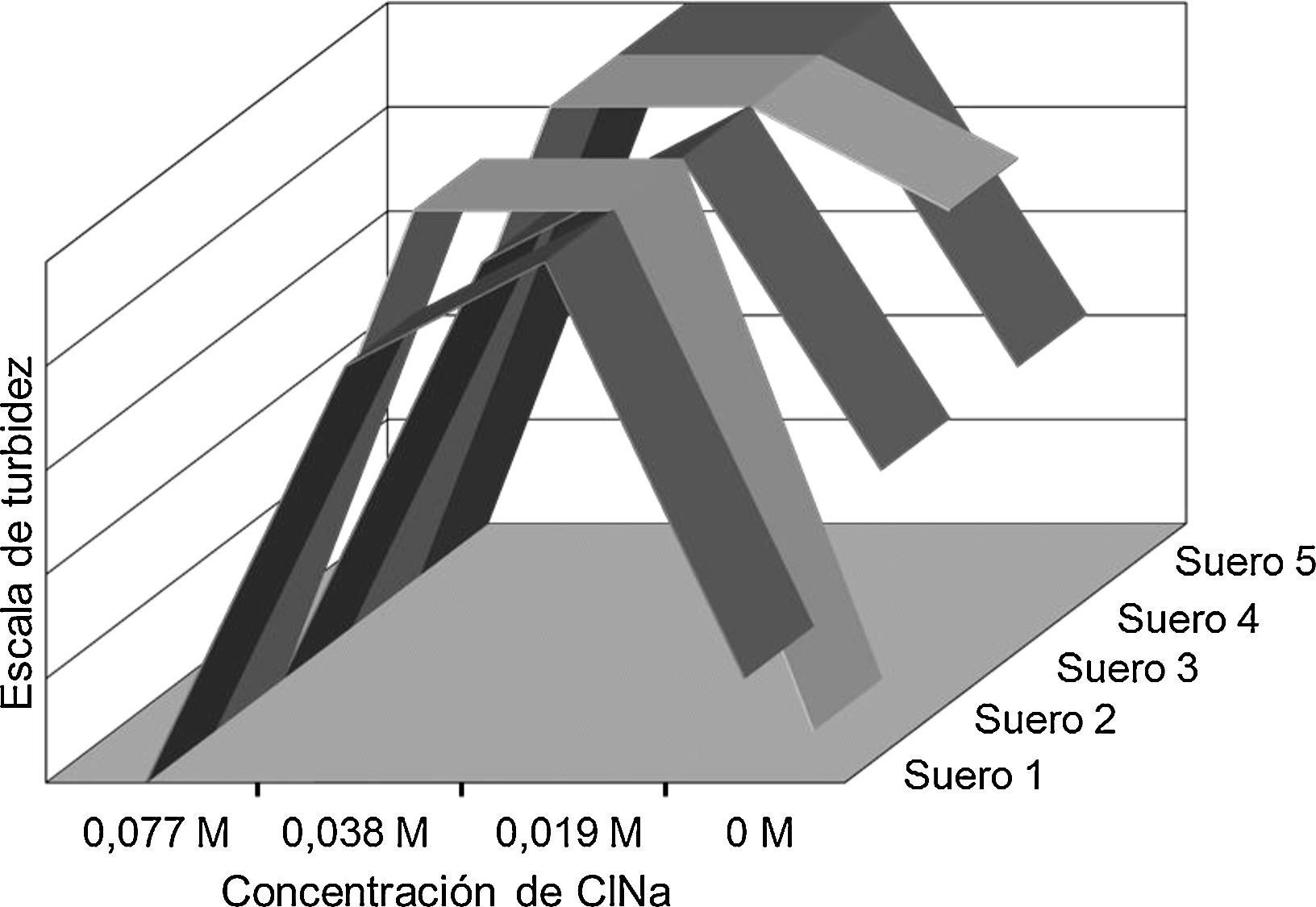
Las curvas de disolución de 4 soluciones salinas en 5 sueros falsos lipidémicos seleccionados mostraron que las concentraciones entre 0M y 0,077M producían un enturbiamiento mínimo o ninguno, respectivamente, con un enturbiamiento máximo a 0,038M y 0,019M (fig. 1). Las mediciones a iguales concentraciones salinas de los otros 5 sueros control con BM de otras clases no dieron ninguna turbidez.
El índice lipidémico tenía una sensibilidad del 97% (95% CI: 91-100) y una especificidad del 94% (95% CI: 91-97) para el diagnóstico de BM en comparación con la IFE. El área bajo la curva ROC fue de 0,95 (95% CI: 0,92-0,99). Los valores predictivos positivo y negativo fueron del 72% (95% CI: 59-85) y del 99% (95% CI: 99-100), respectivamente. Las razones de verosimilitud positiva y negativa fueron de 15,7 (95% CI: 9,2-26,6) y de 0,03 (95% CI: 0,004-0,2), respectivamente. El porcentaje de pacientes correctamente diagnosticados (eficiencia diagnóstica) fue del 94,26% (95% CI: 90,35-96,71).
La sensibilidad del índice lipidémico era del 71% (95% CI: 55-86) y la especificidad del 99% (95% CI: 98-100) para la detección de IgM elevada con valores predictivos positivo y negativo del 92% (95% CI: 82-100) y del 95% (95% CI: 93-98), respectivamente, siendo el área bajo la curva ROC de 0,85 (95% CI: 0,76-0,94). Las razones de verosimilitud positiva y negativa fueron de 70,6 (95% CI: 18,3-299,4) y de 0,3 (95% CI: 0,2-0,5), respectivamente. El porcentaje de individuos correctamente diagnosticados (eficiencia diagnóstica) fue de 95,08% (95% CI: 91,35-97,32).
La OR ajustada por edad y sexo de los sueros falsos lipidémicos fue de 768,0 (95% CI: 75,8-7.799,3) en pacientes con la IgM elevada y de 219,4 (95% CI: 42,9-1.120,5) en aquellos con BM comparadas con pacientes sin una IgM elevada y pacientes sin BM, respectivamente.
Los 34 casos de falsa lipidemia representaron un 0,098% de los 34.586 sueros consecutivos examinados en nuestro laboratorio durante el periodo de 31 d de duración del estudio.
DiscusiónLos resultados del presente estudio sugieren que la turbidez del suero observada en las concentraciones salinas entre 0,038M y 0,019M en el análisis de lipidemia en un analizador AU-5430, en ausencia de triglicéridos elevados, está estrechamente relacionada con la presencia de la IgM elevada en el suero y en especial con la gammapatía monoclonal de clase IgM. Hasta la fecha solo se han publicado casos aislados que describan la detección de la IgM muy elevada tras un índice de lipidemia falso positivo2,4. Uno de los estudios utilizó un analizador Roche-Modular Analytics® (Roche, Basel, Suiza)2 y una metodología similar a la de nuestra investigación. La gammapatía monoclonal de IgM Kappa ha sido relacionada con la crioglobulinemia utilizando en un analizador Beckman-Coulter un método completamente distinto al del AU-5430 ya que el suero fue tamponado con Tris-HC1 en lugar de con solución salina4. Otros autores sugieren una prueba de precipitación de Sia-euglobulina tras observar la interferencia de la lipidemia en un Dade Paramax-720-ZX (Dade International, Miami, Estados Unidos)14. Sin embargo, la falta de sensibilidad de la prueba de Sia, diseñada para realizarse en una concentración salina final de 0M, ha sido ya descrita con anterioridad15.
Las macroglobulinas son sumamente insolubles en aguas con concentraciones salinas bajas, siendo únicamente solubles en concentraciones salinas de 0,077M. Otros autores han descrito una solubilidad en solución salina superior a 0,02M. Además, la insolubilidad de la macroglobulina en agua desionizada o destilada se da en una amplia gama de pH con un máximo que se acerca a 6,5, que es el punto isoeléctrico de la IgM. La especificidad de nuestro hallazgo de IgM elevada en el suero de falsa lipidemia fue muy alta. De hecho, la IgM estaba dentro de los valores de referencia en solo una de las 34 muestras de suero. Tras diluir el suero en agua desionizada (0M ClNa) la prueba de Sia produce una sensibilidad inferior comparada con las concentraciones salinas de 0,038M y 0,019M (fig. 1).
La insolubilidad de las macroglobulinas a concentraciones salinas bajas solo puede explicarse mediante la disminución de la fuerza iónica del suero diluido y la neutralidad de la carga de la IgM cuando se diluye en el agua desionizada con pH de 6,5. La IgM sería insoluble en ese pH debido al hecho de que se vuelve neutra en ese entorno de baja ionización y puede resultar hidrofóbicamente atraída por otras moléculas de IgM. La interacción proteína-proteína se vuelve intensamente atractiva y da como resultado más agrupaciones energéticamente favorables.
La baja concentración salina presente en la solución explica la insolubilidad de la IgM. La alta solubilidad de la IgG y la IgA explicaría por qué no encontramos ninguna BM de IgG o IgA en el índice de suero falso lipidémico. Nuestra observación podría tener aplicación clínica integrando, en los analizadores bioquímicos, esta prueba rutinaria y de bajo coste para la detección de gammapatías monoclonales El sistema consiste en la utilización de un canal en el analizador para hacer un análisis con una solución salina de una concentración entre 0,019M y 0,038M en la que la IgM precipitaría. Un gran número de enfermedades pueden conducir a un aumento de la paraproteína IgM: macroglobulinemia de Waldenström, mieloma de IgM, mieloma extramedular, linfomas, leucemia linfática crónica, amiloidosis, malignidades dermatológicas, síndrome de Sjögren, miastenia grave, anemia hemolítica, artritis reumatoide con crioaglutininas, cirrosis, gammapatía de significado incierto y gammapatía transitoria.
Una limitación de nuestros resultados es que dependen de las características específicas del equipo utilizado. Se deben estudiar específicamente las condiciones de otros analizadores que utilicen otras pruebas u otras concentraciones salinas y el sistema no podría reproducirse en analizadores que trabajen con índices séricos a concentraciones en las que la IgM fuese soluble. Además, no revisamos nuestros resultados de CZE con el método de referencia IFE. Sin embargo, la detectabilidad y la especificidad del CZE son muy altas comparadas con los resultados de este método12,13. Por otro lado, no hemos podido disponer de curvas de disolución (fig. 1) en sueros sin BM.
Tampoco se han evaluado otros factores de confusión o variables clínicas diferentes a la edad y el sexo que podrían influir en tener una IgM elevada, por lo que los resultados presentados se deberían validar en futuros estudios.
Como conclusión, la turbidez observada en las concentraciones salinas entre 0,038M y 0,019M cuando se analiza el índice lipidémico, en ausencia de triglicéridos elevados, está asociada a una elevada IgM y, en particular, a la gammapatía monoclonal. Por ello, es factible detectar la gammapatía monoclonal de IgM durante el procesado rutinario de ciertos analizadores de bioquímica en los laboratorios clínicos con un método económico, sensible y específico.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este proyecto ha sido subvencionado mediante contratos de investigadores en el Sistema Nacional de Salud (SNS) Miguel Servet (CP06/00100) y financiado con subvenciones del Gobierno de España a través del FEDER y del Ministerio de Ciencia e Innovación, el Instituto de Salud Carlos III (Red HERACLES RD06/0009) y de la Agencia de Gestión de Ayudas Universitarias y de Investigación del Gobierno de Catalunya (Agència de Gestió d’Ajuts Universitaris i de Recerca) (2009SGR1195). CIBEROBN es una iniciativa del Instituto de Salud Carlos III, Madrid, España.