La enfermedad celíaca (EC) y la diabetes mellitus tipo 1 son alteraciones crónicas que comparten susceptibilidad genética, presencia de anticuerpos órgano específicos e influencia de factores ambientales. Según un estudio transversal realizado el año 2001 en nuestro centro, el 8,3% de los pacientes diabéticos tiene anticuerpos específicos de la EC y el 4,9% presenta una lesión intestinal Marsh III. Con estos antecedentes, se instaura el cribado serológico sistemático para la EC en los pacientes que debutan diabetes mellitus de tipo 1 (DM1).
El objetivo de este estudio es valorar el resultado de esta estrategia y caracterizar a los pacientes celíacos detectados.
Material y métodosSe estudian los 202 pacientes diabéticos que debutan durante el período 2002–2007 controlados en la Unidad de Diabetes de nuestro hospital. Se determina la concentración sérica de anticuerpos antitransglutaminasa en el debut diabético con controles anuales.
Resultados y discusiónEl 6,4% (13/202) de los pacientes diabéticos debutantes tiene EC, siendo más frecuente entre los que la debutan precozmente (p=0,016) y mostrando un orden de aparición aleatorizado de ambas enfermedades. En estos pacientes, la EC es mayoritariamente asintomática. La mitad de ellos muestra una respuesta serológica parcial a la dieta sin gluten, lo que sugiere una falta de motivación para el tratamiento dietético.
Según nuestra experiencia, el control metabólico de los pacientes diabéticos con EC puede ser complicado y una elevada proporción de casos (p=0,013) requiere el uso de bombas de infusión continua de insulina.
Celiac disease and type 1 diabetes mellitus are chronic diseases that share a genetic susceptibility, presence of organ specific autoantibodies and influence of environmental factors. According to a cross-sectional study performed in our hospital in 2001, 8.3% of diabetic patients have positive serological markers for celiac disease and 4.9% have a Marsh grade III intestinal lesion. With this background, we began systematic serological screening for CD on onset of type 1 diabetes. Our aim was to evaluate the results of this strategy, as well as characterizing the patients diagnosed with celiac disease.
Material and methodsWe studied 202 cases with type 1 diabetes onset detected from 2002 to 2007 and controlled in our Diabetes Unit. Serum Anti-transglutaminase antibodies were analyzed at onset and yearly.
Results and discussionWe found that 6.4% (13/202) of diabetic patients had celiac disease, which was more frequent among patients with early diabetes onset (P=0.016). In our series, the order of appearance of both disorders is fortuitous. These celiac patients are mainly asymptomatic, and half of them show a partial serological response to a gluten free diet, probably due a lack of motivation in following the dietary treatment.
In our experience, the metabolic control of diabetic patients with celiac disease can be difficult, and a high proportion of cases (P=0.013), require the use of insulin infusion pump.
La enfermedad celíaca (EC) y la diabetes mellitus de tipo 1 (DM1) son alteraciones crónicas de carácter autoinmune, que comparten características tan relevantes como los antígenos de susceptibilidad genética HLA-DQ2/DQ8, la presencia de autoanticuerpos órgano específicos y la influencia de factores ambientales1–4.
La asociación entre ambas enfermedades se describió en el año 19695, aunque previamente ya se había observado una mayor frecuencia de pacientes diabéticos entre familiares de pacientes celíacos. Durante los últimos 30 años, centenares de estudios han confirmado esta asociación.
La EC es la alteración crónica de carácter autoinmune más frecuente de nuestro medio y la que más a menudo pasa desapercibida debido a la falta de especificidad de sus formas de presentación clínica. La detección es clinicoserológica, mientras que el diagnóstico definitivo es histológico. La lesión intestinal es gradual y reversible con la retirada del gluten de la dieta. Los efectos indeseables más temidos de la enfermedad no tratada son la osteoporosis, la malignidad y las enfermedades autoinmunes asociadas.
La EC afecta al 3–8%6 de la población pediátrica con DM1, mientras que la prevalencia estimada de la EC en la población general escolar europea oscila alrededor del 1%7. Sin embargo, en estudios europeos recientes de series de pacientes diabéticos en edad pediátrica se encuentran prevalencias de EC del 1,6%8 y del 12,3%9, alejadas del rango previamente reconocido. Estas diferencias se justifican, en parte, por el diseño epidemiológico aplicado en cada uno de los estudios.
Las cuestiones más polémicas en cuanto a la caracterización de los pacientes diabéticos afectados por la EC se refieren al orden en que aparecen las 2 enfermedades, a la expresión clínica de la EC, a los beneficios de la dieta sin gluten (DSG) así como a la dificultad que esta dieta añade a la vida del paciente diabético.
Según un estudio transversal10 realizado en el Hospital Sant Joan de Déu de Barcelona durante el año 2001, el 8,3% (28/345) de los pacientes con DM1 tiene marcadores serológicos de la EC positivos y el 4,9% (17/28) presenta una lesión histológica intestinal de grado Marsh III. Con estos antecedentes, se instaura en la Unidad de Diabetes el despistaje serológico sistemático de la EC en el debut diabético (DD) y en los controles anuales.
El objetivo de este trabajo es valorar los resultados de esta estrategia en los pacientes diabéticos que debutan durante el período 2002–2007.
Material y métodosPacientesSe estudian los 202 casos que han inciado DM1 entre enero del 2002 y diciembre del 2007, correspondientes a 108 pacientes de sexo masculino y a 94 pacientes de sexo femenino, de edades comprendidas entre 1–18 años y controlados en la Unidad de Diabetes de nuestro Hospital. El 90% son pacientes cuyo DD se ha detectado en el Servicio de Urgencias de nuestro centro, mientras que el resto corresponde a pacientes diagnosticados en otros centros y que se han derivado a la Unidad de Diabetes de nuestro centro para su control y su seguimiento.
Protocolo diagnósticoSe determinan los marcadores serológicos de la EC en el DD y se realizan controles anuales de los casos con serología negativa.
Los casos con serología positiva se derivan a la Sección de Gastroenterología para llevar a cabo una exploración clínica y proponer la realización de una biopsia intestinal.
Los casos con serología dudosa se someten a un nuevo control serológico en un período superior a 3 meses. Ante un segundo resultado dudoso o positivo, se propone la realización de una biopsia intestinal.
El diagnóstico de certeza de la EC se obtiene a través del estudio histológico en una biopsia intestinal aplicando los criterios de Marsh. La biopsia está indicada en pacientes con marcadores serológicos positivos y/o en pacientes con clínica sugerente de EC.
Los padres o los tutores del paciente diabético están informados del proceso diagnóstico y proporcionan el correspondiente consentimiento informado.
Los marcadores de predisposición genética HLA-DQ2 y HLA-DQ8 se determinan en los casos ya diagnosticados de EC, principalmente si se desea estudiar la susceptibilidad genética para la EC en sus familiares de primer grado. Ante un caso índice con un DQ2 y/o un DQ8 positivo, el estudio del DQ2 y/o del DQ8 en sus familiares tiene un valor predictivo negativo para la EC cercano al 100%6.
En todos los casos se registra la edad del paciente en el DD y los marcadores serológicos de la EC sucesivos. En los casos con serología positiva o dudosa, se registra el informe histológico de la biopsia intestinal, los marcadores de predisposición genética, los síntomas digestivos si los hay así como los datos de la historia clínica que se consideren relevantes.
Marcadores serológicosSe determinan los autoanticuerpos antitransglutaminasa (AcTGt) de clase IgA mediante un fluoroenzimoinmunoensayo automatizado en el Analizador ImmunoCAP 250 (Celikey® IgA, Phadia, Suecia) así como la concentración de IgA total en suero por métodos estándar. En los casos con déficit selectivo de IgA (<0,05g/l), se determinan los mismos marcadores serológicos de clase IgG.
Los valores de referencia de AcTGt de clase IgA que se han aplicado son los siguientes: negativo 0–3U/ml, dudoso 3–10U/ml y positivo superior a 10U/ml.
El grado de adhesión a la DSG no siempre viene reflejado en la concentración sérica de anticuerpos, ya que la sensibilidad al gluten es una característica particular de cada paciente. Por esta razón, la evolución de la serología con la dieta es un fenómeno individual.
Estudio histológico intestinalLa biopsia intestinal se obtiene por endoscopia digestiva o mediante la cápsula de Watson-Crosby. La endoscopia digestiva bajo anestesia total permite la obtención de 4 a 6 pequeñas muestras de mucosa duodenal, mientras que mediante la cápsula de Watson-Crosby se obtiene, bajo sedación, una muestra única de mucosa yeyunal de mayor tamaño. La endoscopia digestiva permite hacer una observación macroscópica de la pared intestinal y es capaz de detectar lesiones parcheadas de la EC.
El patólogo emite el informe del estudio histológico de la mucosa intestinal aplicando los criterios de Marsh11. La lesión Marsh I está definida por un aumento del número de linfocitos intraepiteliales (LIE) superior a 25 por cada 100 enterocitos. La lesión Marsh II añade a la anterior una hiperplasia de las criptas y la lesión Marsh III añade una atrofia de las vellosidades. A su vez, el grado Marsh III se clasifica12 en grado Marsh IIIa, IIIb o IIIc, según se observe alguna vellosidad preservada de forma total, parcial o nula, respectivamente.
Marcadores de susceptibilidad genéticaLos marcadores de predisposición genética (HLA-DQ2 y HLA-DQ8) son proteínas diméricas codificadas por los alelos DQA1*0501/DQB1*0201 y DQA1*0301/DQB1*0302, respectivamente. Estos alelos se analizan mediante técnicas de PCR usando cebadores específicos13 en ADN genómico. El ADN se obtiene por métodos comerciales a partir de sangre total con EDTA. El producto de la amplificación mediante PCR se detecta por electroforesis en gel de agarosa, se visualiza con luz ultravioleta y se registra sobre papel mediante un programa de captación de imágenes.
Estudio estadísticoLos test estadísticos utilizados son: a) el test de la U de Mann-Whitney para datos no apareados con distribución no paramétrica para comparar la edad del DD entre diabéticos con EC y sin EC; b) la prueba de χ2 para comparar el tratamiento con bomba de infusión continua de insulina (ISCI) entre los pacientes con EC y sin EC, y c) el test de Wilcoxon para datos apareados con distribución no paramétrica para comparar la hemoglobina (HbA1c) previa y posterior a la DSG.
ResultadosEl 9,9% (20/202) de los diabéticos debutantes en el período 2002-2007 tiene marcadores serológicos positivos (15/20) o dudosos (5/20).
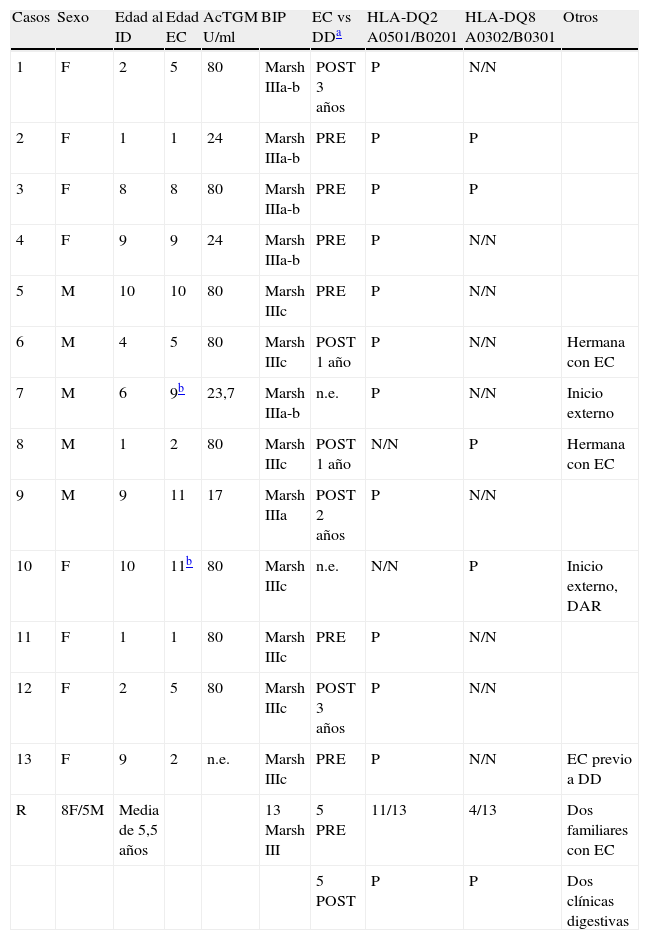
En el 5,9% de los casos (12/202) —todos ellos con serología positiva (12/15) y lesión intestinal de grado Marsh III— se establece el diagnóstico definitivo de la EC. Además, hay un caso en que el diagnóstico de la EC es previo al DD. Por tanto, la prevalencia total de la EC entre la población diabética estudiada es del 6,4% (13/202). La tabla 1 muestra los datos que caracterizan a los 13 pacientes con EC y DM1 de esta serie.
Caracterización de los pacientes con enfermedad celíaca identificados en la serie de pacientes diabéticos estudiada
| Casos | Sexo | Edad al ID | Edad EC | AcTGM U/ml | BIP | EC vs DDa | HLA-DQ2 A0501/B0201 | HLA-DQ8 A0302/B0301 | Otros |
| 1 | F | 2 | 5 | 80 | Marsh IIIa-b | POST 3 años | P | N/N | |
| 2 | F | 1 | 1 | 24 | Marsh IIIa-b | PRE | P | P | |
| 3 | F | 8 | 8 | 80 | Marsh IIIa-b | PRE | P | P | |
| 4 | F | 9 | 9 | 24 | Marsh IIIa-b | PRE | P | N/N | |
| 5 | M | 10 | 10 | 80 | Marsh IIIc | PRE | P | N/N | |
| 6 | M | 4 | 5 | 80 | Marsh IIIc | POST 1 año | P | N/N | Hermana con EC |
| 7 | M | 6 | 9b | 23,7 | Marsh IIIa-b | n.e. | P | N/N | Inicio externo |
| 8 | M | 1 | 2 | 80 | Marsh IIIc | POST 1 año | N/N | P | Hermana con EC |
| 9 | M | 9 | 11 | 17 | Marsh IIIa | POST 2 años | P | N/N | |
| 10 | F | 10 | 11b | 80 | Marsh IIIc | n.e. | N/N | P | Inicio externo, DAR |
| 11 | F | 1 | 1 | 80 | Marsh IIIc | PRE | P | N/N | |
| 12 | F | 2 | 5 | 80 | Marsh IIIc | POST 3 años | P | N/N | |
| 13 | F | 9 | 2 | n.e. | Marsh IIIc | PRE | P | N/N | EC previo a DD |
| R | 8F/5M | Media de 5,5 años | 13 Marsh III | 5 PRE | 11/13 | 4/13 | Dos familiares con EC | ||
| 5 POST | P | P | Dos clínicas digestivas |
AcTGt: autoanticuerpos antitransglutaminasa; BIP: biopsia intestinal peroral; DAR: dolor abdominal recurrente; DSG: dieta sin gluten; EC: enfermedad celíaca; F: femenino; ID: inicio diabético; M: masculino; N: negativo; n.e.: no efectuado; P: positivo; R: resumen.
Los 3 casos (3/15) con serología positiva (AcTGt superior a 10U/ml) y biopsia intestinal no concluyente de EC corresponden a lo siguiente: a) un paciente con AcTGt de 12,7U/ml en el DD y la lesión intestinal Marsh I (LIE [59%]), el DQ2 positivo y el DQ8 negativo y AcTGt de 85U/ml a los 5 años de seguimiento serológico posterior al DD. En la actualidad está pendiente de nuevo estudio intestinal; b) un caso con AcTGt de 17U/ml a 2 años del DD y biopsia normal. Las concentraciones de AcTGt en el seguimiento serológico son de 22U/ml y de 14U/ml, y c) un caso con AcTGt de 18U/ml a 3 años del DD y biopsia no concluyente, DQ2 y DQ8 positivo, episodios de diarrea y un difícil control metabólico que requiere infusión subcutánea continua de insulina (ISCI). El grado de sospecha para la EC en este paciente es máximo y está pendiente de nuevo estudio histológico intestinal.
Los 5 casos con serología dudosa (AcTGt entre 3 y 10U/ml) corresponden a: a) un paciente detectado al DD (3,9U/ml) cuyos AcTG se normalizan espontaneamente; b) 2 casos detectados al DD (4,9 y 6,4U/ml), cuyos AcTGt se mantienen dudosos en el seguimiento y que están pendientes de estudio intestinal; c) un caso detectado al año del DD (3,6U/ml) pendiente de control serológico, y d) un caso detectado a los 2 años del DD (8,1U/ml) con lesiones mínimas en la biopsia intestinal que está bajo vigilancia serológica.
El carácter DQ2/DQ8 se determina en los pacientes con DM1 y EC. Los resultados, todos ellos DQ2 y/o DQ8 positivos, se muestran en la tabla 1.
El orden en que aparecen la DM1 y la EC en esta serie es aleatorizado. En 6 casos (6/13), la celiaquía precede al DD (un caso con diagnóstico previo al DD y 5 casos identificados en el DD). En 5 casos (5/13) hay seroconversión de los AcTGt durante los 3 años siguientes al DD (tabla 1). En los 2 casos restantes (2/13) no se dispone de la concentración de AcTGt en el DD al tratarse de pacientes externos derivados a nuestro centro. Estos dos casos presentan AcTGt de 80U/ml y de 23,7U/ml al año y a los 3 años del DD, respectivamente.
El estudio en familiares de primer grado de los nuevos celíacos se lleva a cabo mediante el análisis de los marcadores serológicos y de los marcadores de predisposición genética, detectándose 2 nuevos casos de EC en hermanos genéticamente susceptibles.
Once de los 13 pacientes celíacos de la serie estudiada son clínicamente asintomáticos. Un caso se ha diagnosticado previamente al DD por la presencia de síntomas digestivos y el último caso se ha detectado por serología, pero manifiesta dolor abdominal recurrente.
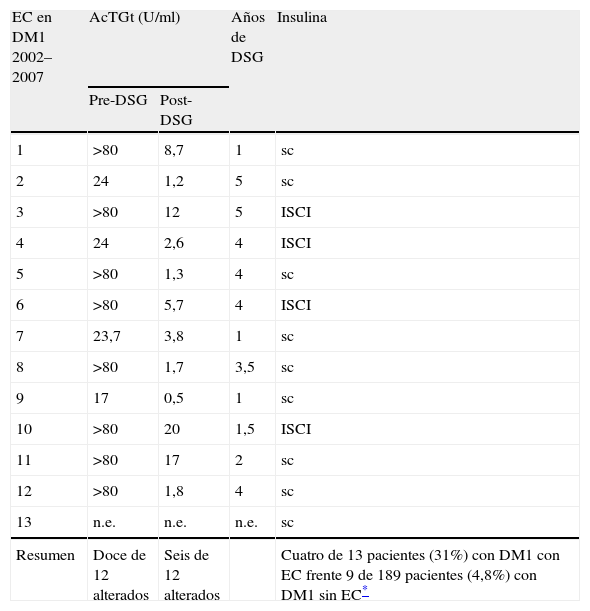
La tabla 2 muestra la concentración de AcTGt en la detección serológica antes de instaurar la DSG y la del último control serológico. La respuesta serológica a la DSG es deficiente o incompleta en la mitad de los casos (6/12), con una concentración de anticuerpos específicos positiva débil o dudosa que sugiere una falta de adhesión al tratamiento dietético.
Respuesta serológica a la dieta sin gluten. Tratamiento con insulina
| EC en DM1 2002–2007 | AcTGt (U/ml) | Años de DSG | Insulina | |
| Pre-DSG | Post-DSG | |||
| 1 | >80 | 8,7 | 1 | sc |
| 2 | 24 | 1,2 | 5 | sc |
| 3 | >80 | 12 | 5 | ISCI |
| 4 | 24 | 2,6 | 4 | ISCI |
| 5 | >80 | 1,3 | 4 | sc |
| 6 | >80 | 5,7 | 4 | ISCI |
| 7 | 23,7 | 3,8 | 1 | sc |
| 8 | >80 | 1,7 | 3,5 | sc |
| 9 | 17 | 0,5 | 1 | sc |
| 10 | >80 | 20 | 1,5 | ISCI |
| 11 | >80 | 17 | 2 | sc |
| 12 | >80 | 1,8 | 4 | sc |
| 13 | n.e. | n.e. | n.e. | sc |
| Resumen | Doce de 12 alterados | Seis de 12 alterados | Cuatro de 13 pacientes (31%) con DM1 con EC frente 9 de 189 pacientes (4,8%) con DM1 sin EC* | |
AcTGt: autoanticuerpos antitransglutaminasa; DM1: diabetes mellitus de tipo 1; DSG: dieta sin gluten; EC: enfermedad celíaca; ID: inicio diabético; ISCI: infusión subcutánea continua de insulina; n.e.: no efectuado; sc: subcutánea.
La DSG revierte la lesión intestinal aumentando la capacidad de absorción de los hidratos de carbono de la dieta y, en consecuencia, de los requerimientos de insulina. En la serie estudiada, llama la atención el alto porcentaje de celíacos que deben tratarse con bombas de insulina (ISCI) para conseguir un control glucémico satisfactorio. En la tabla 2 se muestran frecuencias de uso de ISCI entre los diabéticos con EC y sin EC, con diferencias significativas (prueba de χ2; p=0,0130).
El efecto de la DSG sobre el control metabólico de la DM1 no es evaluable mediante la HbA1C cuando el tratamiento de la DM1 y de la EC inicia a la vez. Esta valoración sólo es posible en los pocos celíacos detectados en los controles anuales posteriores al DD. En estos casos, se calcula el valor medio de la HbA1C antes y después de la DSG. El valor medio de los resultados obtenidos antes (7,86%) y después (8,02%) de la DSG no muestra diferencias significativas (prueba de Wilcoxon).
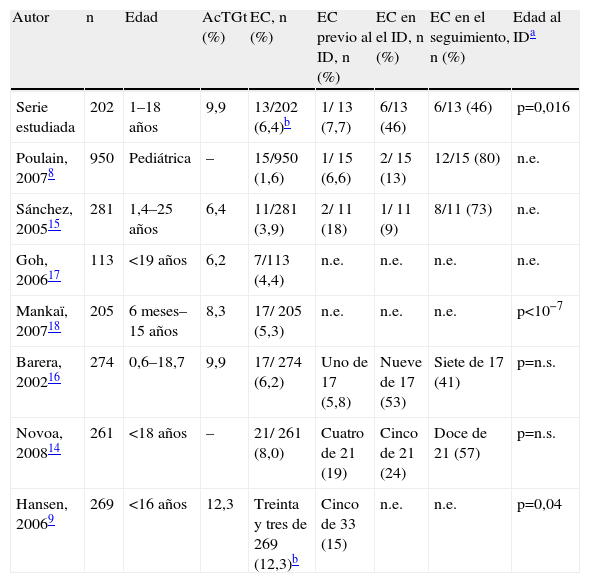
La tabla 3 muestra los resultados de la prevalencia de EC obtenida en la serie estudiada y los contrasta con los obtenidos recientemente en series similares de diferentes países, detallando el número y el porcentaje de pacientes celíacos detectados antes, durante y después del DD.
Prevalencia de la enfermedad celíaca. Detección de la enfermedad celíaca respecto al inicio diabético y relación entre la asociación de ambas enfermedades y la precocidad del inicio diabético
| Autor | n | Edad | AcTGt (%) | EC, n (%) | EC previo al ID, n (%) | EC en el ID, n (%) | EC en el seguimiento, n (%) | Edad al IDa |
| Serie estudiada | 202 | 1–18 años | 9,9 | 13/202 (6,4)b | 1/ 13 (7,7) | 6/13 (46) | 6/13 (46) | p=0,016 |
| Poulain, 20078 | 950 | Pediátrica | – | 15/950 (1,6) | 1/ 15 (6,6) | 2/ 15 (13) | 12/15 (80) | n.e. |
| Sánchez, 200515 | 281 | 1,4–25 años | 6,4 | 11/281 (3,9) | 2/ 11 (18) | 1/ 11 (9) | 8/11 (73) | n.e. |
| Goh, 200617 | 113 | <19 años | 6,2 | 7/113 (4,4) | n.e. | n.e. | n.e. | n.e. |
| Mankaï, 200718 | 205 | 6 meses–15 años | 8,3 | 17/ 205 (5,3) | n.e. | n.e. | n.e. | p<10−7 |
| Barera, 200216 | 274 | 0,6–18,7 | 9,9 | 17/ 274 (6,2) | Uno de 17 (5,8) | Nueve de 17 (53) | Siete de 17 (41) | p=n.s. |
| Novoa, 200814 | 261 | <18 años | – | 21/ 261 (8,0) | Cuatro de 21 (19) | Cinco de 21 (24) | Doce de 21 (57) | p=n.s. |
| Hansen, 20069 | 269 | <16 años | 12,3 | Treinta y tres de 269 (12,3)b | Cinco de 33 (15) | n.e. | n.e. | p=0,04 |
AcTGt: autoanticuerpos antitransglutaminasa; EC: enfermedad celíaca; ID: inicio diabético; n.e.: no efectuado; n.s.: no significativo.
Según nuestra experiencia, la EC es sensiblemente más frecuente entre los pacientes que han tenido un DD precoz (test de la U de Mann-Whitney; p=0,016). La mediana de edad en el DD de los pacientes diabéticos con EC de la serie estudiada es de 6,0 años frente a 9 años en los diabéticos no diagnosticados de EC. En la tabla 3 se contrasta este resultado con resultados discordantes obtenidos recientemente en otras series.
DiscusiónLa prevalencia mínima de EC entre la población diabética en edad pediátrica de nuestra área geográfica es del 6,4%, una cifra comparable a la obtenida en estudios recientes con criterios diagnósticos y diseños epidemiológicos parecidos14–18. En estos estudios se muestra un porcentaje de casos con serología positiva superior al porcentaje de casos finalmente diagnosticados de EC. Esta diferencia corresponde a los diabéticos que rechazan la biopsia intestinal y a aquéllos cuyo informe histológico intestinal no es concluyente de EC. En estos casos, el análisis de los genes de susceptibilidad DQ2 y DQ8 puede ser útil para establecer el riesgo de progresión a la EC.
La concentración sérica de AcTGt se relaciona, en general, con el grado de lesión histológica. En nuestra serie, los pacientes con serología positiva y biopsia intestinal no concluyente tienen concentraciones de AcTGt ligeramente superiores a los valores normales establecidos (<10U/ml). Merece especial atención el paciente asintomático con una concentración de AcTG de 12,7U/ml (lesión intestinal Marsh I, DQ2/DQ8 positivo) que evoluciona a 80U/ml a los 5 años de seguimiento serológico. La gradación histológica de la lesión intestinal está bien representada entre los celíacos detectados en la población diabética. La tabla 1 muestra como los diferentes estadios del grado Marsh III están representados entre los pacientes celíacos de la serie estudiada.
Los marcadores de susceptibilidad genética para la EC, DQ2 y/o DQ8, están presentes en todos los celíacos de la serie estudiada. La asociación entre la DM1 y la EC se relaciona con la presencia del perfil DQ2/DQ8, estando el DQ2 asociado al DR3 y el DQ8 asociado al DR44.
La tabla 2 muestra una clara respuesta serológica a la DSG en todos los pacientes celíacos de nuestra serie, aunque esta respuesta es insuficiente en la mitad de ellos (6/12), mostrando concentraciones de AcTGt en la zona dudosa (8,7; 5,7, y 3,8U/ml) o positiva (12; 20, y 17U/ml). Según nuestra experiencia, este fallo terapéutico no es tan frecuente entre los celíacos identificados por serología de otras poblaciones de riesgo19, como en familiares de primer grado o pacientes con anemia sin causa aparente. Algunos autores han citado la dificultad para la adhesión a la DSG en pacientes celíacos asintomáticos identificados en series de pacientes diabéticos8,15,17. La falta de motivación para el cumplimiento de una rigurosa y permanente DSG se puede explicar basándose en la frágil percepción de los beneficios que la dieta aporta a su salud y a la complejidad que esta dieta añade a la inherente de su condición diabética.
Los efectos beneficiosos de la DSG sobre el crecimiento o el estado nutricional del paciente con EC y DM1 (peso, talla, índice de masa corporal y anemia) se han evaluado en estudios recientes8,9,15,16. Asimismo, estos estudios demuestran que la DSG no repercute sobre el control metabólico de la diabetes8,9,20 o lo hace con una ligera mejora15 de éste.
El efecto de la DSG sobre el control metabólico de la diabetes no es un objetivo de este estudio. La mitad de los pacientes con EC de la serie estudiada se ha detectado en el DD. En estos casos, la DSG y el tratamiento con insulina se debutan simultáneamente, no pudiéndose evaluar el efecto de la DSG sobre el control glucémico de la DM1. En los celíacos detectados después del DD (5 casos), el valor medio de la HbA1C (%) no se altera significativamente con la instauración de la DSG.
La DSG se instaura para frenar la respuesta anómala del sistema inmune intestinal y para revertir la lesión inflamatoria. Con la restauración de las vellosidades intestinales aumenta la capacidad de absorción de los hidratos de carbono de la dieta y, por consiguiente, también aumentan los requerimientos de insulina necesarios para el control metabólico de la diabetes. En este contexto y para el correcto mantenimiento del control glucémico, los pacientes diabéticos con EC de la serie estudiada requieren tratamiento con ISCI con más frecuencia (4/13 [31%]) que los diabéticos sin EC (9/189 [4,8%]). En la tabla 2 se pueden ver las diferencias significativas obtenidas al comparar estas proporciones. La disponibilidad de ISCI representa un gran beneficio para los pacientes con mayores dificultades para la regulación del control glucémico, en este caso, más relacionado con la función intestinal que con la función pancreática endocrina.
La tabla 3 muestra la prevalencia de EC en distintas series de pacientes diabéticos, detallando el orden en que se manifiestan ambas enfermedades así como la relación entre la presencia de la EC y la edad del DD según diversos autores8,9,14–18. En la serie estudiada, no se observa ninguna prioridad en el orden de aparición de la diabetes y de la celiaquía. La mitad de los pacientes con celiaquía asintomática se detecta en el DD, mientras que la otra mitad lo hace en el seguimiento serológico anual. Sólo un caso de la serie se ha identificado clínicamente por los síntomas clínicos antes del DD.
En la tabla 3 se muestra la proporción de pacientes con EC que se manifiestan antes, durante o después del DD en la serie estudiada, así como en estudios similares recientes realizados en diferentes países. Los pacientes celíacos identificados entre la población diabética se distribuyen entre los siguientes grupos: a) pacientes con EC identificados por clínica antes del DD (6,6–18%); b) pacientes celíacos silenciosos identificados por serología en el DD (9–53%), y c) pacientes celíacos presumiblemente latentes, dado que no hay un estudio intestinal previo, identificados por serología durante los controles anuales siguientes al DD (41–80%).
Según nuestra experiencia, la DM1 y la EC están asociadas con mayor frecuencia de la que les correspondería por azar, sin que haya evidencia de que una de las 2 alteraciones preceda, con mayor frecuencia, a la otra. Mientras que la diabetes difícilmente puede pasar desapercibida, la mayoría de los pacientes celíacos no pueden identificarse por sus síntomas clínicos y se deben detectar por serología.
Las recomendaciones acerca del despistaje serológico sistemático de la EC entre la población diabética son polémicas y no está actualmente recomendado por la AGA6 (American Gastroenterological Association). Según la AGA, la investigación y el tratamiento de la EC debe estar limitado a los pacientes diabéticos con síntomas clínicos de EC. Las razones alegadas para no recomendar el estudio serológico sistemático a toda la población diabética se basan en la falta de datos acerca del beneficio de la DSG a corto plazo en el paciente asintomático, así como la falta de estudios sobre los efectos indeseables a largo plazo de la celiaquía asintomática no tratada o, lo que es lo mismo, el desconocimiento del curso natural de la enfermedad.
Por otro lado, la ADA (American Diabetes Association)21 y los autores de los estudios realizados en las distintas series de diabéticos recomiendan este despistaje serológico sistemático. Hill22, en una reciente editorial, expone de forma brillante una valoración de las ventajas y de los inconvenientes de la investigación y del tratamiento de la celiaquía en pacientes diabéticos asintomáticos.
En conclusión y según nuestra experiencia, se valora positivamente la estrategia para la detección serológica de la EC en el DD con controles anuales. Según los resultados obtenidos en la serie estudiada, la EC es más frecuente en los pacientes diabéticos de debut más precoz. La celiaquía pasa clínicamente inadvertida entre la población diabética y puede estar presente antes o después del DD, indistintamente. La sumisión a la DSG es irregular y el control glucémico viene facilitado en una elevada proporción de casos por el uso de ISCI.
Comunicación premiada en el II Congreso Nacional de Laboratorio Clínico celebrado en La Coruña del 4 al 7 de junio de 2008.