La Medicina del Laboratorio constituye un área de conocimiento multidisciplinar en continuo cambio, siendo responsabilidad de las sociedades científicas el compendiar y difundir los últimos avances científicos, así como proporcionar herramientas para su interpretación. El establecimiento de protocolos, guías y recomendaciones constituye una actividad esencial, pero estas acciones deben ir acompañadas de la definición de indicadores claves de procesos. Los indicadores claves de procesos permiten evaluar y hacer un seguimiento del correcto cumplimiento de los objetivos propuestos, así como actuar a modo de herramienta de mejora a través de la intercomparación entre laboratorios (benchmarking).
La reciente publicación realizada por la Asociación Española de Biopatología Médica-Medicina del Laboratorio Decisiones inteligentes desde el laboratorio: de elegir sabiamente a no hacer constituye, en este sentido, un buen ejemplo. Elaborada en el seno del proyecto «Compromiso por la Calidad de las Sociedades Científicas en España» promovido por el Ministerio de Sanidad, Servicios Sociales e Igualdad, propone un total de 19 recomendaciones avaladas por un panel constituido por 26 expertos. Cada una de estas recomendaciones se acompaña de un conjunto de indicadores de proceso para evaluar el cumplimento y eficiencia de su implementación.
Considerando como punto de partida la metodología y sistema de notación empleados en la citada monografía para el diseño de indicadores claves de procesos, constituye una guía de diseño útil para la evaluación de cualquier proceso de adecuación y uso efectivo del laboratorio.
Laboratory Medicine is an area of multidisciplinary knowledge in continuous change. The scientific societies have the responsibility for summarising and disseminating the latest scientific advances, as well as providing tools for their interpretation. The establishment of protocols, guidelines and recommendations is an essential activity of these societies, but these actions must be accompanied by the definition of key performance indicators. The key performance indicators enable the objectives to be correctly fulfilled. Moreover, these indicators are an improvement tool based on the intercomparison between laboratories (benchmarking).
Thus, the recent publication by the Spanish Medical Biopathology Society-Laboratory Medicine (Asociación Española de Biopatología Médica-Medicina del Laboratorio) entitled “Intelligent decisions since laboratory: from choose wisely till “not to do” (Decisiones inteligentes desde el laboratorio: de elegir sabiamente a no hacer) is a good example. This publication, prepared within the framework of the “Commitment to Quality by the Spanish Scientific Societies” project, proposed by the Ministry of Health, makes 19 recommendations proposed by an expert panel of 26 laboratory professionals. Each recommendation includes several indicators to evaluate the compliance and effectiveness of their implementation.
Taking the methodology and function used in the Spanish Medical Biopathology Association-Laboratory Medicine document for the design of key performance indicators as a basis, it becomes a useful guide for designing the evaluation of any adjustment process and its effective use in the laboratory.
La Medicina del Laboratorio constituye un área de conocimiento multidisciplinar que se halla en continuo avance tecnológico y científico. El adecuado desempeño profesional requiere por tanto de un esfuerzo permanente en formación y actualización. Desde esta perspectiva, la implicación de sociedades científicas para analizar, compendiar y difundir el conocimiento es esencial, debiéndose al mismo tiempo proporcionar las herramientas necesarias para la correcta interpretación de la información.
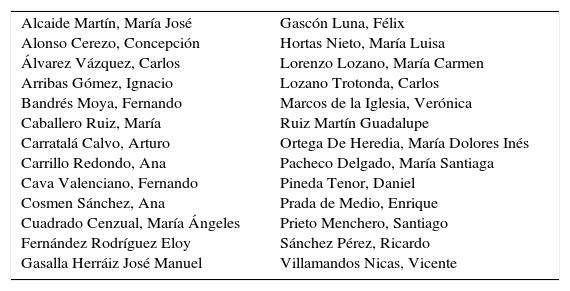
A finales del 2015, la Asociación Española de Biopatología Médica-Medicina del Laboratorio (AEBM-ML) publicó una monografía titulada Decisiones inteligentes desde el laboratorio: de elegir sabiamente a no hacer (fig. 1)1. Este trabajo tuvo su origen en el proyecto «Compromiso por la Calidad de las Sociedades Científicas en España»2 promovido por el Ministerio de Sanidad, Servicios Sociales e Igualdad siguiendo las líneas maestras de propuestas internacionales como las de «Choosing Wisely» en los EE. UU.3-5, o las del National Institute for Health and Care Excellence (NICE) de Reino Unido6,7. Enmarcadas en este proyecto, cada sociedad propuso un máximo de 5 recomendaciones, seleccionadas y consensuadas mediante el método Delphi por un panel de expertos. Internamente, el panel de expertos de la AEBM, constituido por 26 profesionales del laboratorio (tabla 1), elaboró un total de 19 recomendaciones (tabla 2). Considerando que todas ellas presentan un potencial impacto en la mejora de la calidad asistencial y seguridad del paciente, las recomendaciones fueron desarrolladas, documentadas y publicadas en el texto anteriormente mencionado1.
Panel de expertos que elaboraron y que avalan las recomendaciones de la monografía Decisiones inteligentes desde el laboratorio: de elegir sabiamente a no hacer, de la AEBM-ML
| Alcaide Martín, María José Alonso Cerezo, Concepción Álvarez Vázquez, Carlos Arribas Gómez, Ignacio Bandrés Moya, Fernando Caballero Ruiz, María Carratalá Calvo, Arturo Carrillo Redondo, Ana Cava Valenciano, Fernando Cosmen Sánchez, Ana Cuadrado Cenzual, María Ángeles Fernández Rodríguez Eloy Gasalla Herráiz José Manuel | Gascón Luna, Félix Hortas Nieto, María Luisa Lorenzo Lozano, María Carmen Lozano Trotonda, Carlos Marcos de la Iglesia, Verónica Ruiz Martín Guadalupe Ortega De Heredia, María Dolores Inés Pacheco Delgado, María Santiaga Pineda Tenor, Daniel Prada de Medio, Enrique Prieto Menchero, Santiago Sánchez Pérez, Ricardo Villamandos Nicas, Vicente |
Recomendaciones propuestas en la monografía Decisiones inteligentes desde el laboratorio: de elegir sabiamente a no hacer, de la AEBM-ML
| Recomendaciones enmarcadas en el proyecto inicial «Compromiso por la Calidad de las Sociedades Científicas en España» | |
| Recomendación 01: No hacer: | Marcadores tumorales serológicos como cribado poblacional (salvo que se pertenezca a los grupos de riesgo definidos para cada tipo de tumor) |
| Recomendación 02: No hacer: | HbA1c más de 2 veces al año en pacientes diabéticos con buen control clínico y metabólico. Si es preciso realizar la determinación con mayor frecuencia, no hacerlo con periodicidad inferior a 3 meses |
| Recomendación 03: No hacer: | Estudios de cribado tiroideo en pacientes ingresados. Cuando se realicen en pacientes ambulatorios, determinar solo TSH, pudiendo ampliar el laboratorio la T4 libre y otras determinaciones, en aquellos casos en que proceda |
| Recomendación 04: No hacer: | Reevaluación de anticuerpos antinucleares en tiempos inferiores a 3 meses |
| Recomendación 05: No hacer: | CK ni CK-MB en el diagnóstico de infarto agudo de miocardio |
| Recomendaciones adicionales | |
| Recomendación 06: No hacer: | Repetición de la determinación de colesterol (y fracciones) en intervalos inferiores a 3 años, en personas aparentemente sanas, sin tratamiento farmacológico o dietético |
| Recomendación 07: No hacer: | Repetición del perfil lipídico en menos de 2 años en pacientes diabéticos con bajo riesgo de dislipidemia y enfermedad cardiovascular |
| Recomendación 08: No hacer: | HbA1c como prueba de cribado de diabetes mellitus tipo 2 |
| Recomendación 09: No hacer: | Ferritina como prueba de cribado de anemia ferropénica durante el periodo gestacional |
| Recomendación 10: No hacer: | La determinación del proteinograma a menores de 50 años sin sospecha clínica de gammapatía monoclonal, ni utilizar el proteinograma para el estudio de proteínas séricas aisladas |
| Recomendación 11: No hacer: | BNP o NTproBNP para otra indicación que no sea el diagnóstico diferencial de la disnea aguda en la atención hospitalaria urgente y para evaluar el pronóstico de la insuficiencia cardiaca aguda y crónica |
| Recomendación 12: No hacer: | Más de una determinación de autoanticuerpos en los estudios de cribado de enfermedad celiaca |
| Recomendación 13: No hacer: | Dímero D en pacientes con alta probabilidad de sufrir tromboembolismo pulmonar o trombosis venosa profunda |
| Recomendación 14: No hacer: | Estudio genético de hipercolesterolemia familiar si el caso índice no tiene una puntuación igual o mayor a 6 según los criterios de la DLCN |
| Recomendación 15: No hacer: | Cariotipo en sangre periférica como primera opción a pacientes con retraso mental/discapacidad intelectual, trastornos del espectro autista o anomalías congénitas |
| Recomendación 16: No hacer: | Pruebas preoperatorias de laboratorio si no existe una indicación clínica en el paciente |
| Recomendación 17: No hacer: | Análisis genéticos con fines sanitarios, sin garantizar al interesado un asesoramiento genético apropiado pre-test y post-test |
| Recomendación 18: No hacer: | Urianálisis o sistemático de orina (tira reactiva y sedimento urinario) si no se aseguran la correcta obtención y manipulación del espécimen |
| Recomendación 19: No hacer: | Procesamiento, estudio o emisión de informes si existen dudas de que el proceso de identificación u obtención no ha sido el adecuado |
Sin embargo, desde el punto de vista de la gestión de calidad, y en el entorno del uso adecuado del laboratorio, no basta con diseñar e implementar herramientas de mejora, tales como guías, procedimientos o recomendaciones, sino que es además esencial evaluar y controlar el correcto desempeño de las mismas. De esta forma, añadiendo un nuevo enfoque al proyecto inicial, la monografía cuenta con el desarrollo de un conjunto de mecanismos o indicadores de medida (indicadores claves de proceso [key performance indicators, KPI]) que permiten cuantificar el correcto cumplimiento de los objetivos propuestos. Un ejemplo práctico a este respecto se muestra en el anexo i.
Un valor añadido a la utilización sistemática de KPI es la posibilidad de establecer procesos de benchmarking en el laboratorio, lo que permite tomar decisiones en cualquier ámbito en base a la comparación de datos y experiencias contrastadas, y que en nuestro caso aplica a laboratorios de diferentes características8. La importancia del benchmarking no se encuentra en la comparación en sí misma, sino en el impacto que pueden tener estas comparaciones sobre los comportamientos que se analizan a través de un indicador, permitiendo huir de esta forma de la intuición y logrando la innovación y la implementación de acciones de mejora.
Objeto y campo de aplicaciónEl presente documento pretende definir una estructura de indicadores con la aportación de una notación específica y enfoque de KPI. Constituye por lo tanto un texto metodológico aplicable no solo a las recomendaciones propuestas para las «recomendaciones de no hacer» planteadas por la monografía de la AEBM-ML1, sino que pretende constituir una guía de diseño de KPI útil para la evaluación de cualquier proceso de evaluación de adecuación de la demanda o de efectividad desarrollado en el ámbito del laboratorio clínico.
Por tanto, si bien el campo de aplicación de la monografía Decisiones inteligentes desde el laboratorio: de elegir sabiamente a no hacer1 incluye al conjunto de los clínicos que pueden beneficiarse del conocimiento y propuesta de manejo aportado por cada recomendación, el alcance del presente documento pone el foco en el profesional del laboratorio clínico, dotándole de las herramientas necesarias para la evaluación de las citadas recomendaciones y para el diseño, desde su propia experiencia y perspectiva, de nuevos indicadores de proceso.
Diseño de indicadores de calidad y gestiónA continuación se exponen la definición con sus notaciones y un primer nivel de clasificación de los indicadores:
- •
Condiciones preliminares.
- •
Indicadores a nivel de estructura.
- •
Indicadores de proceso.
- •
Indicadores de resultados en salud.
Condiciones que deben cumplir los sistemas informáticos del laboratorio (SIL) y los sistemas de información de atención especializada y/o primaria para poder usar el indicador, ya sea a nivel de diseño como sistemas de estadística, ya como recuento o exportación de datos que permita un análisis de los mismos.
Indicadores de estructura- •
Existencia o no de pruebas en perfiles.
- •
Existencia de sistemas de control de petición (acceso restringido o previa justificación).
- 1.
Sistemáticos. Se realiza la evaluación de manera periódica para todos los eventos ya sea:
- a)
Manual. Por ejemplo, realizando una exportación con la estadística mensual y después un análisis con un programa externo.
- b)
Automático. Por el SIL o el sistema de control de gestión que se haya definido.
- a)
- 2.
Por muestreo. Si la evaluación del dato no puede realizarse con facilidad o para todos los casos, puede hacerse un análisis parcial del indicador de manera periódica utilizando solo datos del SIL o cruzándolos con otros datos del centro o del área (por ejemplo, número de partos o número de intervenciones quirúrgicas programadas o número de pacientes en programa de diabetes en atención primaria).
En caso de muestreo se recomienda definir un mínimo de los casos posibles seleccionados de manera aleatoria en el periodo o bien elegir una fecha (aleatoria) y seleccionar N casos consecutivos.
Indicadores de resultados en saludEs el mejor sistema para demostrar la evidencia de la acción, si bien resulta muy difícil especialmente en el caso de actividad del laboratorio. Sin embargo, siempre debe ser buscado como estándar de referencia y usar otros solo si estos indicadores no pueden ser obtenidos.
En el caso de las recomendaciones de no hacer deberían buscarse:
- •
Mejoras en indicadores de salud (benchmarking) o ausencia de cambios al «dejar de hacer».
- •
Disminución de visitas o frecuentación por determinada enfermedad (eliminación de encuentros innecesarios).
- •
Disminución de pruebas diagnósticas adicionales de laboratorio y extralaboratorio.
- •
Disminución de tratamientos innecesarios.
- •
Aumento del número o la calidad de los diagnósticos.
Se expone una definición de términos y una notación para expresar los criterios de medida.
- •
Prueba. Hace referencia a una determinación, grupo, perfil o parámetro concreto. Se define para cada indicador. Ejemplo, HbA1c.
Las pruebas se agrupan mediante recuento numérico.
- ∘
Determinación. Se expresa como «D». Se refiere a un resultado informado de una prueba. Así, una muestra no recibida o un «no procede» no se considera determinación.
- ∘
Solicitud. Se expresa como «S». Se refiere a cada una de las peticiones que agrupa un conjunto de pruebas de un paciente; puede ser considerado como sinónimo de volante de petición.
La prueba puede ser solicitada aislada, como grupo, perfil o incluida en un algoritmo que gestiona el laboratorio.
- ∘
Ejemplo: de 80.000 solicitudes de HbA1c/año, una petición directa de 7.000 determinaciones, 69.000 de petición en grupo, 3.000 ampliadas por el laboratorio y 1.000 «no procede» o «no recibida por el laboratorio».
Este tipo de recuento no hace referencia a pacientes, sino a solicitudes de pacientes.
- •
Pacientes. Habitualmente se refiere al total o a un grupo de pacientes atendidos en el hospital del área en un año y se expresa genéricamente como «P». Un paciente puede tener una o «n» solicitudes.
- •
Habitantes. Número de individuos protegidos del área por año ([media]) o población cubierta. Es la población potencialmente atendible. Se expresa como «Hbt».
- •
Población atendida. Es la población realmente atendida. Se cuenta como pacientes que hayan sido atendidos una o «n» veces. Se subdivide en diversas categorías, las cuales pueden superponerse en algunos casos:
- ∘
P(L), pacientes atendidos en el laboratorio.
- ∘
P(H), pacientes atendidos en el hospital.
- ∘
P(A), pacientes atendidos en atención primaria (extrahospitalarios).
- ∘
P(AH), pacientes atendidos por centros sanitarios del área.
- ∘
Ejemplo: de un total de 250.000 Hbt con 80.000 solicitudes de HbA1c/año, se han estudiado un total de 23.000 pacientes en el laboratorio, es decir, P([L])=23.000.
Determinación y solicitud coinciden siempre que: (a) cada solicitud genere una única determinación; (b) todas las solicitudes generen determinación. La discrepancia puede venir si hay solicitudes que no generan determinación (por ejemplo, muestra insuficiente) o solicitudes no realizadas (el paciente no acude a la cita); (c) no se haya rechazado ninguna determinación; (d) no se haya ampliado desde el laboratorio ninguna determinación.
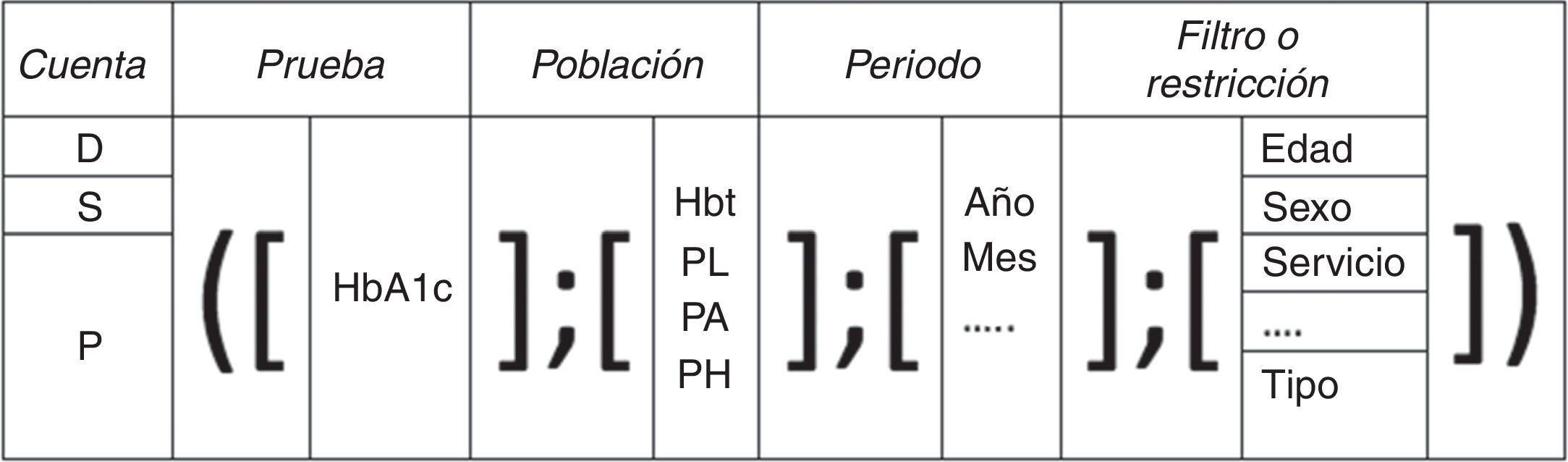
Notación o sintaxisCon estos elementos, somos capaces de construir un sistema de notación que expresa en detalle lo que se mide en cada momento.
El primer elemento es el recuento (D,S,P), el segundo la prueba, el tercero la población, el cuarto el periodo, y finalmente, cuando proceda, un filtro o restricción (edad, sexo, servicio etc.) (fig. 2).
Sistema de notación de indicadores en el laboratorio clínico.
Notación abreviada (si se refiere a año y sin filtros ni restricciones) solo se expresan las 2 primeras variables.
Ejemplo 1: Número de determinaciones de colesterol total realizadas en un año entre la población que se ha hecho algún análisis de laboratorio.
D ([colesterol total]; [PL]; [año])
Si queremos referirlo a la población del área protegida, podemos calcular la «tasa de determinaciones al año por 1.000 habitantes». La notación sería:
D ([colesterol total]; [PL]; [año])x1.000/[Hbt]
Ejemplo 2: Número de pacientes a los que se les ha realizado una o «n» determinaciones de colesterol total en un año, buscados entre los que se han hecho algún análisis de laboratorio en ese periodo,
P ([colesterol total]; [PL]; [año]).
- •
Densidad de solicitud. Se refiere al número de veces que se realiza una solicitud de una prueba, en una población y en un periodo concreto. Requiere que el SIL sea capaz de contar o de exportar los datos. Las estadísticas o sistemas de cuadro de mandos de los SIL deben ser desarrolladas en esa línea.
D ([prueba]; [PL]; [año];[-])/[Hbt]
Número de determinaciones realizadas por año. Cada determinación se cuenta como una solicitud. El dato se extrae de la estadística anual del SIL y se divide por el número de pacientes protegidos.
Ejemplo: D ([HbA1c]; [PL];[año];[-])/[Hbt]. 80.000/250.000=0,32
- •
Frecuentación en el laboratorio para la prueba. Número de pacientes que han acudido al laboratorio al año y a los que se les ha realizado la prueba concreta, ya sea una o «n» veces.
P ([prueba]; [PL]; [año]; [-])
Podemos referir la frecuentación a los pacientes atendidos en el hospital o en el área.
P ([prueba]; [PH]; [año]; [-])
P ([prueba]; [PAH]; [año]; [-])
Ejemplo: P ([HbA1c]; [PL]; [año]; [-]). 23.000
Esto requiere que no existan historias duplicadas, los sistemas actuales de historia clínica electrónica o el recuento de pacientes por número de CIPA garantiza actualmente y sobre todo a futuro que este riesgo será mínimo.
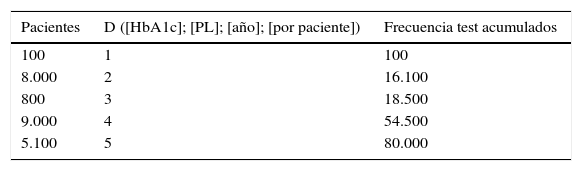
- •
Determinaciones por paciente y por año. Número de test realizados por año a cada paciente. Se trata de una distribución que puede expresarse como moda o como cuartiles ([Q1-mediana-Q3]).
D ([prueba]; [PL]; [año]; [por paciente])
Ejemplo: D ([HbA1c]; [PL]; [año]; [por paciente]). Las 80.000 HbA1c se han solicitado a 23.000 pacientes.
([NHC diferentes]) con la siguiente distribución:
- •
Solicitudes. Número de solicitudes (volantes) que contengan una o «n» peticiones de las incluidas en el grupo de pruebas.
S ([marcadores tumorales]; [PL]; [año]; [pacientes con HbA1c])
Ejemplo: en este caso se contarían el número de «volantes de petición» de pacientes que conteniendo la prueba HbA1c incluyan también algún marcador tumoral en un año.
- •
Ratio pacientes estudiados versus prevalencia de enfermedad. División entre los P([PL]) y la prevalencia estimada de la enfermedad en la población protegida.
P ([prueba]; [PL]; [año] [-])/prevalencia de la enfermedad
Ejemplo: en este caso se ha estimado un 6% de prevalencia de diabetes en el área, es decir 15.000 pacientes. 23.000/15.000=1,53.
Los autores declaran no tener ningún conflicto de intereses.
Este documento ha sido elaborado en colaboración con el panel de expertos AEBM-ML del proyecto «Compromiso por la Calidad de las Sociedades Científicas en España» promovido por el Ministerio de Sanidad, Servicios Sociales e Igualdad.







![Sistema de notación de indicadores en el laboratorio clínico. Notación abreviada (si se refiere a año y sin filtros ni restricciones) solo se expresan las 2 primeras variables. Ejemplo 1: Número de determinaciones de colesterol total realizadas en un año entre la población que se ha hecho algún análisis de laboratorio. D ([colesterol total]; [PL]; [año]) Si queremos referirlo a la población del área protegida, podemos calcular la «tasa de determinaciones al año por 1.000 habitantes». La notación sería: D ([colesterol total]; [PL]; [año])x1.000/[Hbt] Ejemplo 2: Número de pacientes a los que se les ha realizado una o «n» determinaciones de colesterol total en un año, buscados entre los que se han hecho algún análisis de laboratorio en ese periodo, P ([colesterol total]; [PL]; [año]). Sistema de notación de indicadores en el laboratorio clínico. Notación abreviada (si se refiere a año y sin filtros ni restricciones) solo se expresan las 2 primeras variables. Ejemplo 1: Número de determinaciones de colesterol total realizadas en un año entre la población que se ha hecho algún análisis de laboratorio. D ([colesterol total]; [PL]; [año]) Si queremos referirlo a la población del área protegida, podemos calcular la «tasa de determinaciones al año por 1.000 habitantes». La notación sería: D ([colesterol total]; [PL]; [año])x1.000/[Hbt] Ejemplo 2: Número de pacientes a los que se les ha realizado una o «n» determinaciones de colesterol total en un año, buscados entre los que se han hecho algún análisis de laboratorio en ese periodo, P ([colesterol total]; [PL]; [año]).](https://static.elsevier.es/multimedia/18884008/0000000900000003/v1_201608060017/S1888400816300319/v1_201608060017/es/main.assets/thumbnail/gr2.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)
