La proteína epididimaria humana (HE4) es un nuevo marcador para el diagnóstico del cáncer de ovario. Junto con el CA125 mejora el rendimiento diagnóstico a través del algoritmo de riesgo de malignidad (ROMA) especialmente en mujeres posmenopáusicas. Nuestro objetivo es verificar las prestaciones analíticas del ensayo de electroquimioluminscencia del HE4 en el analizador Cobas e411.
Material y métodosPara el estudio de la imprecisión y la veracidad se analizaron dos niveles de controles comerciales durante 20 días. El límite de blanco y límite de detección se evaluaron haciendo 20 repeticiones de un espécimen sin analito. La linealidad se evalúo mediante un análisis de regresión lineal mezclando un espécimen con elevada concentración de HE4 y otro desprovisto de analito. Además se evaluaron el arrastre y la influencia de interferencias endógenas.
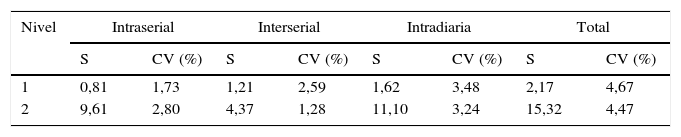
ResultadosLas imprecisiones obtenidas para cada nivel fueron 1,7 y 2,8% para la intraserial, 2,59 y 1,28% para la interserial y 4,67 y 4,47% para la total. Los errores relativos fueron 6,11 y 1,54% para cada nivel. El límite de blanco fue de 1,25 pmol/L y límite de detección 2,21 pmol/L. El estudio de linealidad produjo la siguiente ecuación de regresión y=-18,22+0,98 x demostrando un comportamiento lineal. No hubo arrastre significativo. El método no resultó afectado por la hemólisis, ictericia ni lipidemia.
ConclusionesEl método de electroquimioluminiscencia para HE4 mostró una imprecisión y veracidad excelentes. El límite de detección resultó ser más bajo que el declarado por el fabricante. El comportamiento del método fue lineal dentro del intervalo estudiado. Además el ensayo no mostró arrastre ni interferencias endógenas significativas.
Human epididymis protein 4 (HE4) is an emerging tumor marker in diagnosis of ovarian cancer. Together with the cancer antigen CA 125 it can improve sensitivity and specificity by calculating the risk of ovarian malignancy algorithm (ROMA) score. Our purpose is to validate performance characteristics of the electrochemiluminiscent Cobas e411 assay for HE4, including the endogenous interference study.
Material and methodsTwo different levels of commercial control were analyzed for imprecision and trueness study during 20 days. Limit of blank and limit of detection was assessed with 20 replicates of a sample lacking HE4. Linearity was assessed by regression analysis mixing specimens, with high HE4 concentration and a devoid analyte one. In addition carry-over assay and endogenous interference study were conducted.
ResultsThe imprecision obtained for each level were 1.7 and 2.8% for within run, 2.59 and 1.28%, for between run and 4.67 and 4.47% for total imprecision. The relative biases were 6.11 and 1.54% for each level. The limit of blank was 1.25 pmol/L and the limit of detection 2.21 pmol/L. The linearity study yielded the following regression equation y=-18.22+0.98x, demonstrating a linear behavior. There was not significant carry-over. The method was not affected by hemolysis, bilirrubin, neither lipemia.
ConclusionsElectrochemiluminiscence method for HE4 showed an excellent imprecision and trueness. The limit of detection resulted lower than the declared by the manufacturer. Linearity was verified within the limits studied. In addition the assay is devoid of carry-over and free of significant endogenous interferences.
El cáncer de ovario representa el 4% de todos los cánceres en el sexo femenino, pero supone la quinta causa de muerte por cáncer en las mujeres1, presentando una mortalidad global del 60%2. En España hubo 3.300 casos nuevos durante el año 2012, lo que supone el 3,7% de todos los cánceres en las féminas3 y 1.878 muertes (58%). La mortalidad debida a este cáncer está fuertemente relacionada con el estadio diagnóstico, siendo la supervivencia en 5 años del 70%, pero desciende al 40 y 20% en los estadios III y IV respectivamente1,4. Por desgracia debido a que en la mayoría de los casos es clínicamente silente, en más del 75% de ellos el diagnóstico se hace en estadios avanzados, lo que disminuye la supervivencia2. El diagnóstico viene dado por la combinación del examen pélvico, las técnicas de imagen y el análisis de biomarcadores séricos2,4,5.
El marcador bioquímico más utilizado en el diagnóstico y monitorización del cáncer de ovario ha sido clásicamente el CA1252,6, que se encuentra elevado en un 80% de casos de cáncer epitelial de ovario, la variante histológica predominante2,6, pero se trata de un marcador poco específico, ya que se puede encontrar elevado en diversas enfermedades benignas, como la inflamación pélvica y la endometriosis6,7. Además este biomarcador presenta una sensibilidad baja, en torno al 50% en los estadios iniciales de la enfermedad7–9. En los últimos años se ha revelado el papel emergente de la proteína humana epididimaria (HE4) en el diagnóstico y manejo del cáncer de ovario10,11. El HE4 es una proteína de 20kD descubierta por Kirschhoff en 1991 en el conducto epididimario, de donde recibe el nombre, presentando funciones inhibidoras de proteasas12. Recibe también el nombre de WFDC2, ya que pertenece a una familia de proteínas conocidas como WFDC (whey acidic protein four disulphide core), que se caracterizan por la presencia de cuatro núcleos unidos por puentes disulfuro13. Esta proteína se expresa fisiológicamente en el tracto genitourinario y respiratorio, siendo sobreexpresada en algunos tejidos neoplásicos, como ocurre en el cáncer de pulmón y sobre todo de ovario11. En el cáncer de ovario se hallan incrementadas las concentraciones séricas de esta proteína, siendo su sensibilidad diagnóstica similar a la del CA12514, excepto en los estadios precoces, donde la sensibilidad es mayor, y además es más específico, ya que se haya incrementado con menos frecuencia en enfermedades ginecológicas benignas10,14,15. Moore et al.16 idearon un algoritmo matemático que combina las concentraciones de CA125 y de HE4, con el estado pre- o posmenopáusico de la mujer, para predecir el riesgo de cáncer de ovario. Este algoritmo conocido como Risk of Ovarian Malignancy Algorithm que proporciona una valiosa herramienta para diferenciar las masas pélvicas malignas de las benignas17.
Desde el punto de vista metodológico el análisis de rutina del HE4 se puede llevar a cabo mediante dos métodos automatizados, a saber el inmunoanálisis quimioluminiscente mediado por partículas magnéticas (Chemiluminiscent Magnetic Immunoassay), comercializado por Abbott®, que se lleva a cabo en la plataforma Architect® y el inmunoanálisis de electroquimioluminiscencia (ECLIA) patentado por Roche Diagnostics®18. Como quiera que el método de Abbott® fue uno de los primeros ensayos en ser introducido en los laboratorios clínicos de rutina, la mayoría de los trabajos publicados se refieren a él. En el presente trabajo nos proponemos verificar las prestaciones analíticas del método de inmunoanálisis electroquimioluminiscente para el HE4 en el analizador cobas e411 (Roche Diagnostics®).
Material y métodosEl método evaluado fue el inmunoanálisis electroquimioluminiscente (ECLIA) para la medida de HE4 en el analizador Cobas e411 (Roche Diagnostics®). Se trata de un inmunoanálisis tipo sándwich (inmunométrico) que usa un anticuerpo monoclonal de captura biotinilado que se une a micropartículas magnéticas recubiertas de estreptavidina y un segundo anticuerpo monoclonal trazador marcado con un quelato de rutenio. El complejo formado por el HE4 y los dos anticuerpos se fija a un electrodo gracias al magnetismo de las partículas, y se aplica una diferencia de potencial, que provoca la emisión de una radiación luminiscente que es detectada por un fotomultiplicador.
El estudio evaluó las principales prestaciones analíticas del método, como imprecisión, veracidad, sensibilidad analítica (límite de blanco, límite de detección), linealidad, estudio de arrastre y evaluación de interferencias endógenas.
Imprecisión analíticaEl estudio de imprecisión fue llevado a cabo con dos niveles de control de calidad provistos por el fabricante, con diferentes concentraciones del analito en evaluación. Las imprecisiones intra- e interensayo fueron evaluadas durante 20 días consecutivos por duplicado y en dos series analíticas diferentes siguiendo el protocolo EP05-A2 del Clinical Laboratory Standard Institute (CLSI)19.
VeracidadLa veracidad fue evaluada con los datos obtenidos en el estudio de imprecisión después de descartar la presencia de valores aberrantes mediante el test de Dixon20. Se usó como valor verdadero el asignado por el fabricante a cada uno de los niveles del control de calidad, expresándose como error relativo (porcentaje de desviación) respecto al valor verdadero asignado según las recomendaciones de la Sociedad Española de Bioquímica Clínica y Patología Molecular20.
Límite de blanco. Límite de detecciónLa determinación del límite de blanco (LoB) y el límite de detección (LoD) se llevó a cabo según el protocolo EP17-A del CLSI21. De acuerdo con esta guía se calculó el LoB como el percentil 95 de una serie de 20 mediciones del analito llevadas a cabo en cuatro series analíticas diferentes. Según este mismo protocolo el LoD se calculó mediante la ecuación: LoD=LoB+1,645*Sd, donde Sd es la desviación típica de la serie de mediciones. Las concentraciones por debajo del límite de detección declarado por el fabricante (15pmol/l) se calcularon a partir de la señal de fotón obtenida, usando la función de Rodbar provista por el fabricante para ese lote de reactivo, cuya expresión matemática es:
donde S es la señal del fotón obtenida en la fotocélula y P1, P2, P3 y P4 constantes para el lote de reactivo utilizado.LinealidadEl estudio de linealidad se realizó según lo descrito en la guía EP6-A CLSI22. Se usó una mezcla de sueros con concentraciones de HE4 cercanas a 1.500pmol/l y una matriz proteica desprovista del analito (Disolvente Universal, Roche Diagnostics®) en diferentes proporciones para obtener 7 diluciones intermedias. Se hizo un análisis por triplicado de cada dilución representando la concentración esperada según la dilución realizada frente a la concentración real medida por el equipo.
Arrastre (carry-over)La posible existencia de arrastre fue evaluada con arreglo a lo establecido en la guía del CLSI correspondiente23, usando una mezcla de sueros con elevadas concentraciones de HE4 (A) y otro con concentraciones bajas del analito, realizando primero el análisis del pool alto (n=2) y posteriormente el de baja concentración (n=3). Se obtiene así una secuencia de determinaciones A1, A2, B1, B2, B3, que se repite 10 veces en el mismo día. Para definir si hay arrastre significativo se compararon las medias de las distribuciones obtenidas con el pool de baja concentración entre la primera y la última medición, mediante el test estadístico adecuado y se calculó la constante de Broughton, K24, mediante la siguiente ecuación:
En donde Aim, Bim es la media de resultados obtenidos en las determinaciones realizadas en el orden i (i=1, 2, 3).Interferencias endógenasSe llevó a cabo un estudio de la posible influencia de los tres interferentes endógenos clásicos (hemólisis, bilirrubina y lipidemia) sobre la exactitud de la medida del HE4. Para ello se usaron dos mezclas de sueros con diferentes concentraciones de HE4 (concentraciones medias de HE4 de 48,52 y 1272,5pmol/l para el pool bajo y alto respectivamente) con el fin de evidenciar si la interferencia depende de la concentración de constituyente. A estos pools de suero se les añadió el interferente a partir de una solución primaria de hemolizado, bilirrubina o Intralipid®, según lo descrito por Glick25, usando pequeñas modificaciones contenidas en la guía26EP7-A2 del CLSI.
Las soluciones primarias de los interferentes fueron preparadas como sigue. El hemolizado se preparó mediante el método descrito por Jay et al.27, lavando una mezcla de eritrocitos 3 veces con solución isotónica (NaCl 154mM) y posterior rotura hipotónica con agua destilada seguida de un ciclo de congelación y descongelación. En el caso de la solución lipídica se partió de la emulsión comercial de Intralipid® al 20% y para la bilirrubina se obtuvo una solución de 60mg de bilurrubina no esterificada en 10mL de NaOH 0,1N, pesada en oscuridad26. Se ajustaron los volúmenes de solución primaria de interferente de tal modo que se obtuvieron en la mezcla con interferente concentraciones finales de 1.000mg/dl de hemoglobina, 30mg/dl de bilirrubina y 1.625mg/dl de triglicéridos. Se preparó otra mezcla control añadiendo el mismo volumen de una matriz proteica desprovista de analito (Disolvente Universal Roche Diagnostics® a la mezcla de sueros) para constituir la mezcla de referencia. La medición de HE4 se efectúo 15 veces en cada una de las mezclas para comparar las medias mediante el test estadístico adecuado con el fin de discriminar si la interferencia es significativa. Se midieron los índices séricos en las mezclas resultantes en el analizador Cobas c8000. Asimismo se calculó la desviación obtenida con respecto a la mezcla de referencia mediante la ecuación 100*(C-C0)/C0, siendo C0 el valor medio de HE4 obtenido en la mezcla de referencia y C el resultado tras la adición de interferente, considerándose significativas las desviaciones de ±10%26.
Estudio estadísticoLa imprecisión intraserial, interserial, interdiaria, y la propia del laboratorio se calcularon con arreglo a las recomendaciones contenidas en el documento de la SEQC referido al estudio de la precisión de los procedimientos de medida28, usando el programa informático Excel 2007. Se obtuvieron las medias, desviaciones estándar y coeficientes de variación para cada caso. Para el estudio de linealidad se realizó un análisis de regresión lineal entre las concentraciones obtenidas y las teóricas para deducir la ecuación de la recta a la que se ajustaron los datos.
En el estudio de arrastre se realizó el test de normalidad de Kolmogorov-Smirnov antes de aplicar el test adecuado para la comparación de las medias de las mediciones obtenidas en el pool con nivel bajo de analito antes y después del análisis del pool con nivel elevado de dicho analito. Se consideró la existencia de arrastre significativo cuando el resultado de comparación de medias fue p<0,05 o si la constante de Broughton K es mayor del 1%24.
En el estudio de interferencias se realizó una comparación de medias entre la mezcla sin interferente aplicando el test estadístico adecuado después de usar el test de D¿Agostino-Pearson para aceptar o rechazar la gaussianidad de las distribuciones. Se consideró que existía interferencia cuando hay diferencia significativa entre las medias de las distribuciones con y sin interferente o cuando la desviación del resultado de la mezcla con interferente respecto a la mezcla de referencia es mayor del 10%26.
ResultadosLas imprecisiones (intraserial, interserial, interdiaria y total) obtenidas en el estudio se resumen en la tabla 1, expresadas como desviación típica (pmol/l) y coeficiente de variación (%). En el estudio de veracidad después de descartar la presencia de datos atípicos mediante el test de Dixon, los errores sistemáticos con respecto a los valores convencionalmente verdaderos para cada nivel (49,6 y 348pmol/l) resultaron ser 6,11% para el nivel bajo y 1,54% para el nivel alto.
Estudio de imprecisión
| Nivel | Intraserial | Interserial | Intradiaria | Total | ||||
|---|---|---|---|---|---|---|---|---|
| S | CV (%) | S | CV (%) | S | CV (%) | S | CV (%) | |
| 1 | 0,81 | 1,73 | 1,21 | 2,59 | 1,62 | 3,48 | 2,17 | 4,67 |
| 2 | 9,61 | 2,80 | 4,37 | 1,28 | 11,10 | 3,24 | 15,32 | 4,47 |
En la tabla se muestran las imprecisiones obtenidas en el estudio para los dos niveles de control utilizados, donde s indica la desviación estándar pmol/l y CV el coeficiente de variación (%).
En el estudio de sensibilidad analítica se obtuvo una media de 1,14 para la serie de determinaciones en la muestra desprovista de analito. El límite de blanco (LoB) obtenido fue 1,25pmol/l, mientras que el límite de detección (LoD) fue 2,21pmol/l.
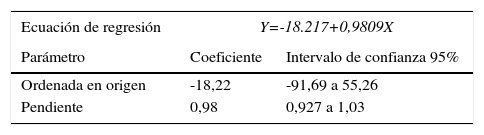
En el estudio de linealidad se obtuvo la siguiente ecuación de regresión lineal Y=-18,22+0,98X, en donde Y es la concentración medida experimentalmente y X es la concentración teórica, siendo el coeficiente de determinación R2=0,99. En la tabla 2 se resumen los resultados del estudio de linealidad.
Estudio de linealidad
| Ecuación de regresión | Y=-18.217+0,9809X | |
|---|---|---|
| Parámetro | Coeficiente | Intervalo de confianza 95% |
| Ordenada en origen | -18,22 | -91,69 a 55,26 |
| Pendiente | 0,98 | 0,927 a 1,03 |
En esta tabla se muestran la ecuación de regresión lineal y los parámetros obtenidos comparando las concentraciones teóricas predichas con las obtenidas experimentalmente.
En el estudio de arrastre las distribuciones estadísticas de los resultados de la muestra de nivel bajo analizada en primer lugar (B1) después de analizar el suero de alto contenido de analito y de la misma muestra analizada en último lugar fueron gaussianas (test de Kolmogorov-Smirnov p=0,97 para B1 y p=0,97 para B3). No hubo diferencias significativas entre las dos series (diferencia de medias -0,25, t=0,63, p=0,55). La constante de Broughton resultó ser K= 0,02%.
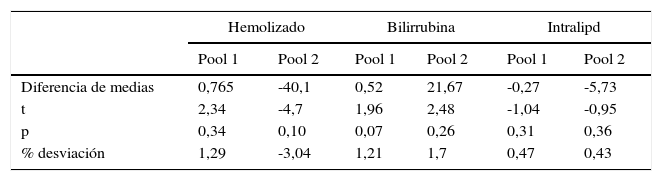
En lo que se refiere al estudio de interferencias las distribuciones resultaron normales en las series con interferente y sin interferente según el test de D¿Agostino-Pearson, en las tres interferencias estudiadas, por lo que se pudo aplicar la t de Student para muestras pareadas en la comparación de medias. Como se resume en la tabla 3, en ninguno de los dos pools de sueros hubo diferencias significativas entre las medias obtenidas con interferente y sin interferente, tanto para la hemólisis (t=2,34, p=0,34 para pool bajo, t=-4,77, p=0,10 para pool alto), como para ictericia (t=1,96, p=0,070 para pool bajo y t=2,48, p=0,26 en el pool alto) y lipidemia (t=-1,04, p=0,31 para el pool bajo y t=-0,95, p=0,36 para el pool alto). Además en la desviación obtenida en las mezclas con interferente respecto a las mezclas de referencia fue en valor absoluto inferior al 10% tanto en el pool bajo (1,29 para la hemólisis, 1,21 para la bilirrubina y 0,47 para la lipidemia), como en el alto (-3,04 para el suero hemolizado, 1,70 para el ictérico y 0,43 para el lipidémico). Los índices hemolíticos medios obtenidos en cobas c8000 para las mezclas con y sin interferente respectivamente fueron 960 y 4 en el pool alto y 927 y 3 para el bajo. Respecto al índice ictérico se obtuvo un valor de uno en ambos pools sin interferente y 38 en las mezclas con bilirrubina. Con el índice lipidémico se obtuvieron valores de 8 y 14 en las mezclas de referencia baja y alta y 1.894 y 1.874 en las mismas mezclas con la adición de la emulsión lipídica. En la tabla 3 se resumen los resultados obtenidos en el estudio de interferencias.
Estudio de interferencias
| Hemolizado | Bilirrubina | Intralipd | ||||
|---|---|---|---|---|---|---|
| Pool 1 | Pool 2 | Pool 1 | Pool 2 | Pool 1 | Pool 2 | |
| Diferencia de medias | 0,765 | -40,1 | 0,52 | 21,67 | -0,27 | -5,73 |
| t | 2,34 | -4,7 | 1,96 | 2,48 | -1,04 | -0,95 |
| p | 0,34 | 0,10 | 0,07 | 0,26 | 0,31 | 0,36 |
| % desviación | 1,29 | -3,04 | 1,21 | 1,7 | 0,47 | 0,43 |
Estudio de interferencias realizado en dos muestras con diferente contenido de HE4 usando máximas concentraciones de interferente equivalente a 1.000mg/dl de hemoglobina, 30mg/dl de bilirrubina y 1.000mg/dl de triglicérido. Se muestras los parámetros obtenidos en la comparación de medias mediante t de Student de datos pareados entre las mezclas con interferente y las mezclas control, así como el porcentaje de desviación obtenido en la muestra con interferente con respecto a la muestra control.
En los últimos años el HE4 se ha revelado como un biomarcador prometedor en el diagnóstico diferencial de las masas anexiales, así como en el seguimiento y monitorización del tratamiento del cáncer de ovario7,11, combinando su medida con la del CA125 mediante la aplicación del algoritmo ROMA. Existen fundamentalmente dos métodos automatizados a gran escala para la medida de HE4, el ensayo quimioluminiscente mediado por micropartículas (Chemiluminiscent Magnetic Immunoassay) y el ensayo de electroquimioluminiscente (ECLIA), estando la mayoría de los estudios publicados referidos al primero. En nuestro estudio hemos pretendido validar metodológicamente el método de electroquimioluminiscencia para este biomarcador, ya que no hay ningún estudio publicado al respecto.
Las imprecisiones analíticas obtenidas en nuestro estudio siguiendo el protocolo del CLSI EP15-A219 resultaron ser muy satisfactorias para los dos niveles estudiados. El índice de capacidad (nivel σ) que se puede inferir de este estudio considerando un error máximo permitido del 21% es de 4,5 y 4,7 respectivamente para cada nivel, lo que indica un nivel σ óptimo. La elección del error máximo permitido no se ha realizado con arreglo a ningún documento normativo, al ser HE4 un parámetro novedoso, sino a partir del valor consensuado para un parámetro similar, en nuestro caso el antígeno carcinoembrionario29,30. También cabe decir que las veracidades obtenidas en los dos niveles estudiados son muy satisfactorias, teniendo en cuenta este error máximo permitido.
En lo que se refiere al estudio de sensibilidad analítica se debe destacar que el valor de límite de detección obtenido aplicando el protocolo del CLSI es muy inferior al declarado por el fabricante (2,2 frente a 15pmol/l). Este hecho no tiene una gran relevancia clínica ya que los valores discriminantes usados para clasificar o estratificar pacientes están muy por encima de estos valores, incluso en mujeres premenopaúsicas18. El ensayo demostró ser lineal en el intervalo estudiado, ya que en la recta de regresión obtenida el intervalo de confianza del 95% para la ordenada en el origen comprende el cero y para la pendiente incluye la unidad tal y como se recoge en la tabla 2.
También hemos podido demostrar que el método está desprovisto de arrastre ya que no hay diferencias significativas entre las medias obtenidas para la muestra de contenido bajo de HE4 analizada en primer lugar (B1) tras el duplicado de la mezcla de alto contenido y la muestra analizada en último lugar (B3). Además la constante de Broughton (K) obtenida apoya este hecho, ya que es muy inferior al 1%, valor a partir del cual se puede considerar la existencia de carry-over24. Esta circunstancia es lógica si se tiene en cuenta que el equipo utiliza una punta de pipeta en cada determinación.
Finalmente el estudio de interferencias demostró que el método no resulta afectado por los tres interferentes endógenos clásicos (hemolizado, bilirrubina, triglicérido) a las concentraciones estudiadas (1.000mg/dl de hemoglobina, 30mg/dl de bilirrubina y 1.625mg/dl de triglicérido) en ninguno de los dos niveles de analito estudiados. De hecho la comparación de medias (una vez demostrada la normalidad de las distribuciones) resultó no ser significativa y la desviación obtenida tras la adición de interferente resultó ser muy inferior al 10% que se considera unánimemente aceptado en la bibliografía como criterio de interferencia significativa25–27.
En resumen el método de electroquimioluminiscencia evaluado produjo unos resultados satisfactorios en términos de imprecisión y veracidad. El límite de detección resultó ser inferior al declarado por el fabricante y tuvo un comportamiento lineal en todo el intervalo estudiado. Además no presentó arrastre de muestra ni interferencias endógenas a concentraciones elevadas de interferente en los dos niveles de concentración estudiados.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen a la compañía Roche Diagnostics la cesión de los reactivos, calibradores y controles necesarios para el estudio.