Los síndromes neurológicos paraneoplásicos constituyen un conjunto de manifestaciones neurológicas asociadas a la existencia de una tumor oculto no diagnosticado en un paciente. Los síndromes neurológicos paraneoplásicos están producidos por mecanismos inmunológicos donde tiene lugar una respuesta inmunológica frente a antígenos compartidos por el tumor y el tejido neuronal del paciente. La detección serológica de los anticuerpos onconeuronales (Hu, Yo, Ri, Ma-2, anfifisina, etc.) es de utilidad en el diagnóstico de los síndromes neurológicos paraneoplásicos asociados. Presentamos el caso de una paciente que acude a Urgencias por presentar alteraciones neurológicas y donde los resultados obtenidos por el laboratorio clínico permiten orientar el estudio diagnóstico de la paciente hacía la búsqueda de un tumor oculto de estirpe microcítica mixta.
Paraneoplastic neurological syndromes are a set of neurological manifestations associated with the existence of a hidden tumour in a patient. Paraneoplastic neurological syndromes are produced by immunological mechanisms where an immune response occurs against antigens shared between tumour and neuronal tissue of the patient. Serological detection of onconeural antibodies (Hu, Yo, Ri, Ma-2, amphiphysin, etc.) is useful in the diagnosis of associated paraneoplastic neurological syndromes. The case is presented of a patient who was admitted to emergency room due to neurological disorders. With the results of the clinical laboratory, the study was oriented towards the search for a hidden tumour of microcytic mixed lineage.
Mujer de 50 años de edad y fumadora de 32 paquetes/años que acudió a las Urgencias del hospital porque presentaba mareos inespecíficos de dos meses de evolución. En la consulta la paciente refirió mareos con inestabilidad a la marcha presentando caída hacia el lado derecho del cuerpo y con presencia de hormigueo en ambas manos y miembros inferiores. Describió la sensación de mareo como aturdimiento, intranquilidad, sin giro de objetos, sin sonofotofobia, ni acúfenos, con náuseas y ausencia de vómitos. No presentaba rigidez de nuca, signos meníngeos, nistagmo, ni afectación de la marcha previamente descrita por la paciente. Se solicitó una tomografía axial computarizada (TAC) craneal donde se apreciaron dos pequeñas áreas hipodensas (una frontal paramediana izquierda y otra en la base temporal izquierda) que tras la administración de contraste se identificó un área de realce de 7mm en la región temporal. Los hallazgos encontrados eran sugerentes de un posible proceso tumoral por lo que se recomendó completar el estudio con una resonancia magnética craneal.
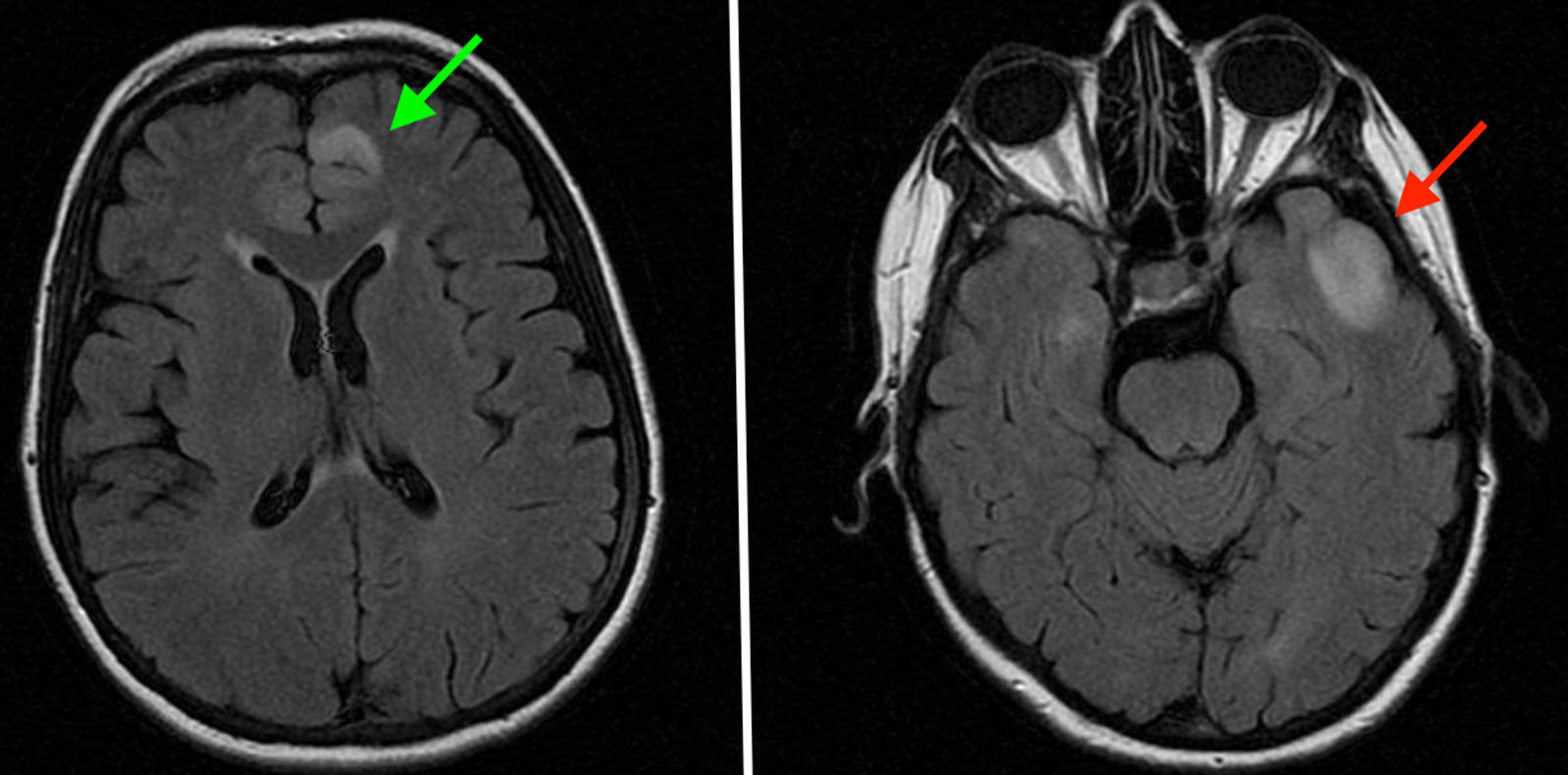
En la resonancia magnética craneal (fig. 1) se apreciaron sendas lesiones temporal izquierda y frontal anterior paramedial izquierda, que afectaban a la corteza y la región subcortical siendo hiperintensas en secuencias Flair, T2 y secuencia potenciada en difusión. Dichos hallazgos sugirieron lesiones isquémicas agudas como primera posibilidad aunque sin poder descartar un posible origen inflamatorio, desmielinizante o una tumoración glial escasamente agresiva en el contexto de gliomatosis. La paciente fue ingresada para continuar el estudio diagnóstico.
Se solicitó un análisis completo al laboratorio clínico para determinar el origen de la patología subyacente y responsable de los hallazgos clínicos de la paciente. Los resultados del hemograma, bioquímica y estudio del líquido cefalorraquídeo se encontraron dentro de los rangos de normalidad sin alteraciones significativas. El estudio microbiológico fue negativo para todos los agentes infecciosos estudiados: anticuerpos antivirus de la inmunodeficiencia humana, anti-Treponema pallidum, anti-Citomegalovirus y anti-Borrelia. Todas las determinaciones serológicas se realizaron mediante quimioluminiscencia en un analizador Liaison XL (DiaSorin, Italia). Los marcadores tumorales estudiados (antígeno carcinoembrionario, alfa-fetoproteína, CA-125, CA-15.3, CYFRA 21.1, CA 19.9, enolasa neuronal específica (NSE), subunidad beta de la gonadotropina coriónica humana (BHCG) y CA 72.4 se encontraron dentro de valores de referencia excepto la NSE que estaba ligeramente elevada (20,6ng/mL; valores de normalidad: 0,0-16,3ng/mL). Los marcadores tumorales se analizaron por electroquimioluminiscencia en un analizador Cobas e602 (Roche, Switzerland).
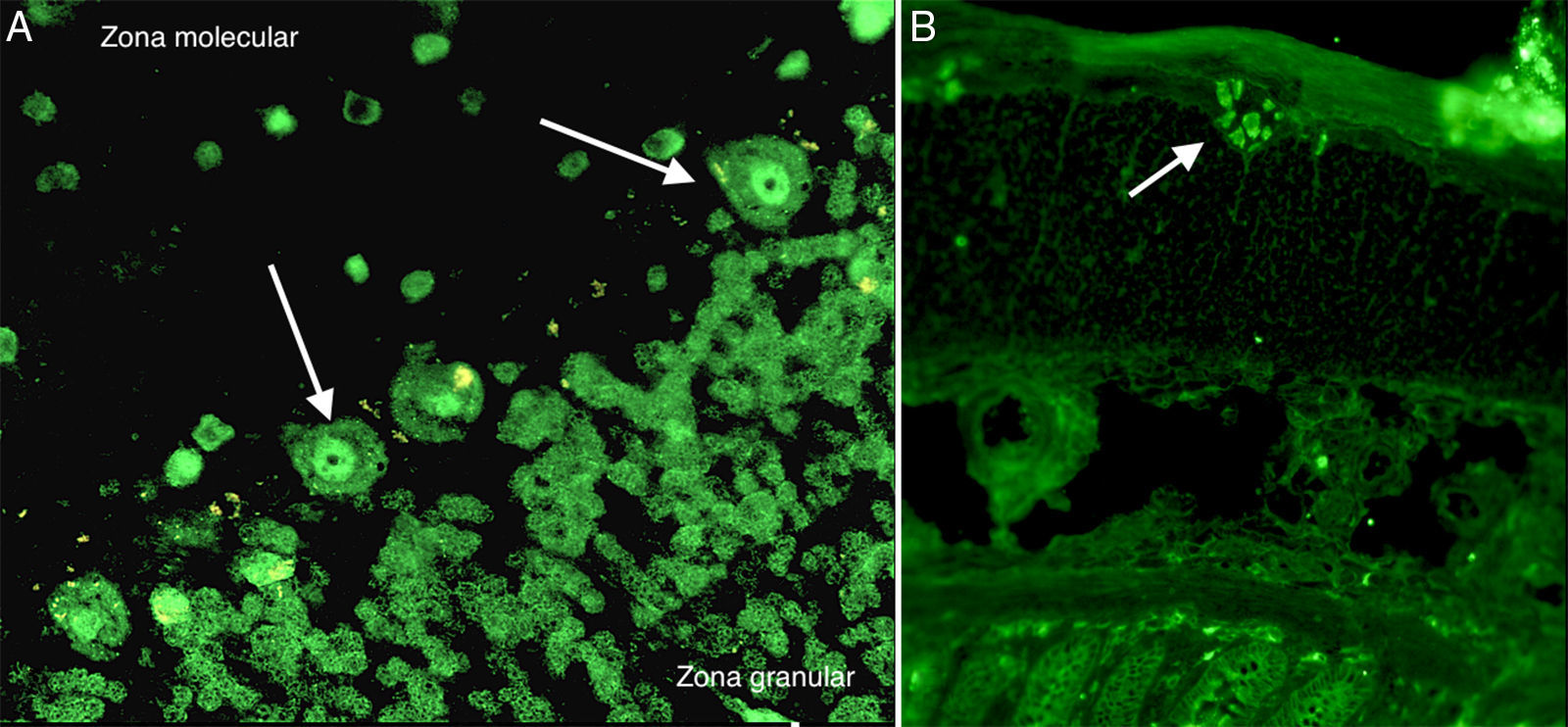
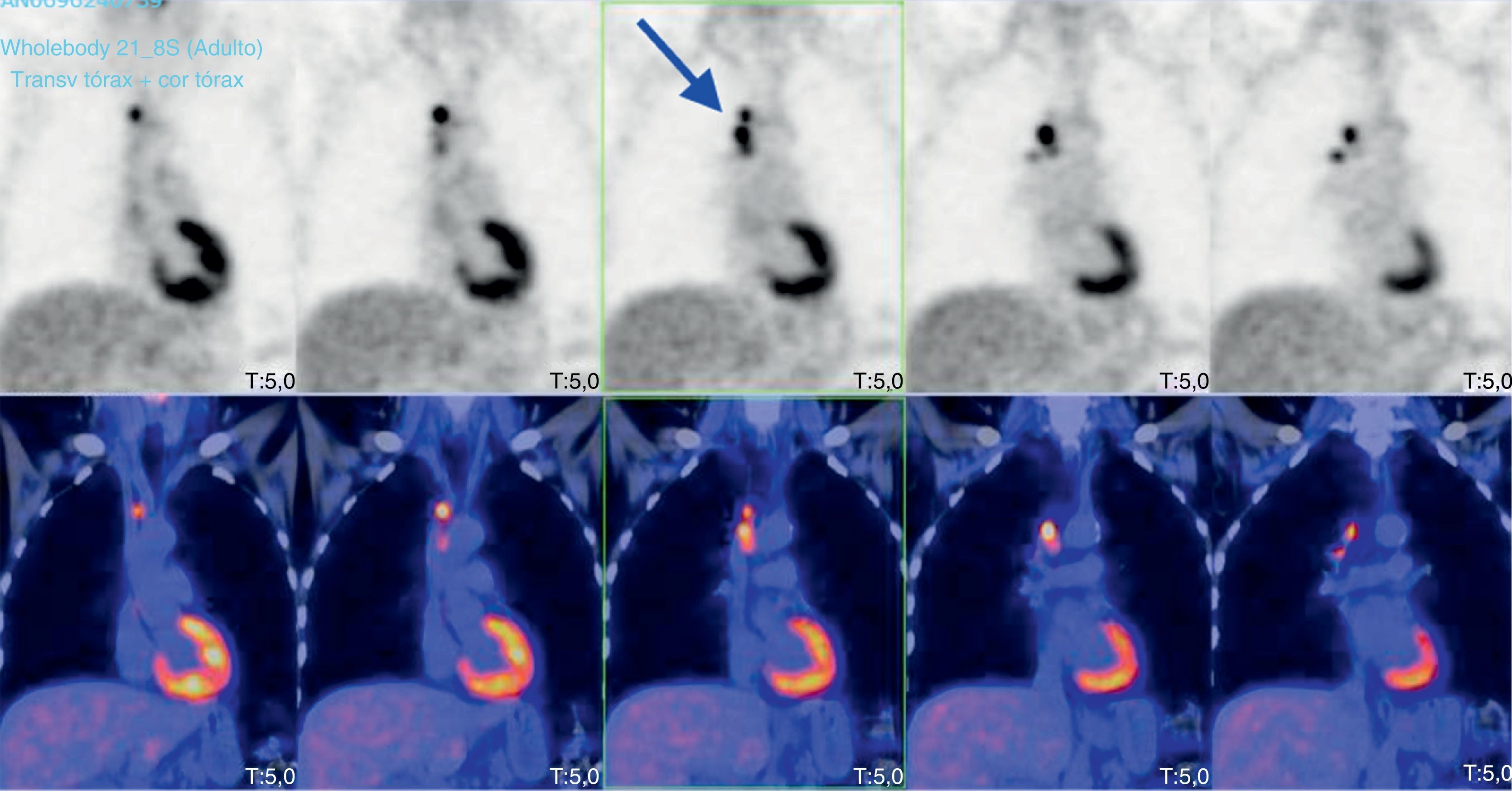
En el estudio de autoinmunidad se detectaron por inmunofluorescencia indirecta la presencia de anticuerpos anti-Hu positivos a título>1/100 en tejido de cerebelo e intestino de primate («IIFT Neurologic Mosaic 1» de Euroimmun AG, Luebeck, Alemania) (fig. 2). Por inmunoblot recombinante («Neuronal Antigens Profile 2 EUROLINE» de Euroimmun AG, Luebeck, Alemania) que detecta los anticuerpos anti-Hu, Yo, Ri, CV2, Ma y anfifisina se confirmó la especificidad para los anticuerpos anti-Hu. El resto de determinaciones autoinmunes: anticuerpos antinucleares («IIFT Mosaico HEp-20-10/hígado de mono» de Euroimmun AG, Luebeck, Alemania), anticuerpos antimitocondriales («IIFT Mosaico Perfil Básico 2» de Euroimmun AG, Luebeck, Alemania) y anticuerpo anticitoplasma de neutrófilos («IIFT Mosaico de granulocitos 13 EUROPLUS» de Euroimmun AG, Luebeck, Alemania) fueron negativas. La presencia de los anticuerpos anti-Hu se asoció a encefalitis paraneoplásica autoinmune lo que orientó el estudio diagnóstico del paciente hacia la búsqueda de un tumor oculto. Para ello, se realizaron las siguientes pruebas para localizar el posible tumor oculto:a) TAC toracoabdominopélvica con y sin contraste: sin evidencia de patología neoplásica abdominopélvica lo que descartaría un posible tumor de ovario y/o vejiga. A nivel del tórax, se apreció una pequeña masa de partes blandas a nivel de la parte derecha de la bifurcación traqueal, junto a dos adenopatías mediastínicas, una carinal y la otra pretraqueal derecha, que hacen que no se pueda descartar una incipiente neoplasia de pulmón.b) Tomografía por emisión de positrones/tomografía computarizada (PET/TAC) con rastreo corporal desde cabeza hasta región inguinal (fig. 3): se observaron aumentos de metabolismo nodulares a nivel de mediastino en las estaciones ganglionares 2R (SUVmax: 12,30), 4R (SUVmáx: 12,23) y en la zona hiliar derecha (SUVmax: 6,28).c) Broncoscopia, cepillado y punción de adenopatías: se realizó un cepillado citológico en región anterior de carina donde se apreció un festoneado de la mucosa. Así mismo se realizaron varias punciones de adenopatía 4R con el citólogo in situ. Tras el estudio citológico del lavado broncoalveolar se descartó la presencia de células neoplásicas en el interior de vías respiratorias.d) Mediastinoscopia: ante la ausencia de células neoplásicas mediante broncoscopia se decidió realizar videomediastinoscopia diagnóstico-terapéutica para el estudio de las adenopatías mediastínicas y/o neoplasia primaria y valoración de tratamiento. En dicho proceso se tomaron biopsias de adenopatías que fueron informadas intraoperatoriamente como tumor maligno.
Inmunofluorescencia indirecta en cerebelo e intestino de primate. A) Tinción fluorescente intensa del núcleo de las células de Purkinje (marcadas con flecha blanca) en el tejido de cerebelo de primate. B) Tinción fluorescente de los núcleos de las neuronas del plexo mientérico de Auerbach en el tejido de intestino de primate (marcado con flecha blanca). Título del patrón>1/100. Los colores de la figura solo pueden apreciarse en la versión electrónica.
Finalmente, tras el estudio por la unidad de Anatomía Patológica de las adenopatías mediastínicas paratraqueales, el resultado de la biopsia fue compatible con carcinoma anaplásico de células pequeñas mixto (células pequeñas y grandes) con expresión de CD56+ cromogranina -, sinaptofisina -/+, enolasa -, CKAE1/AE3 -, CK7 -, CK20 -, CD45 -, S100 -, melan A -, CEA -, HMB45 -, TTF1 -, EMA–con un índice de proliferación Ki 67+ alto superior al 60%.
El diagnóstico definitivo de la paciente fue carcinoma atípico de pulmón de células pequeñas mixto (células pequeñas y células grandes) con presencia de cuadro neurológico compatible con encefalitis paraneoplásica autoinmune.
DiscusiónLos anticuerpos anti-Hu (ANNA-1), dirigidos contra el núcleo de las neuronas, se asocian a un grupo de proteínas de unión al ARN (Hu-D, Hu-C y Hel N1) presentes en las neuronas tanto del sistema nervioso central como periférico y con un tamaño molecular comprendido entre 35-40kD. Su presencia se asocia a cáncer de pulmón microcítico, carcinoma de próstata, cáncer de mama, cáncer de vejiga, neuroblastoma, etc. Los síndromes neurológicos paraneoplásicos asociados a dicho anticuerpos comprenden la encefalitis límbica, neuropatía sensitiva, encefalomielitis aguda y degeneración cerebelosa neoplásica. Debido al impacto que supone su presencia en el diagnóstico del paciente, la identificación en el laboratorio de un anticuerpo onconeuronal ha de ser confirmada por dos técnicas: inmunofluorescencia indirecta e inmunoblot1–3.
Cuando este anticuerpo se identifica en pacientes adultos que son fumadores habituales presenta una alta sensibilidad para síndromes neurológicos paraneoplásicos superior al 80% y un cáncer de pulmón microcítico subyacente. El tratamiento del tumor no siempre implica una mejora de la función neurológica pero la estabiliza4. La identificación de este anticuerpo en el paciente dirigió el estudio hacia la localización e identificación del tumor oculto mediante una serie de pruebas complementarias sucesivas encadenadas (TAC, PET/TAC, broncoscopia y mediastinoscopia) para finalizar con el estudio de las biopsias obtenidas.
El cáncer de pulmón se clasifica en dos grandes grupos: cáncer de pulmón microcítico (CPCP) y cáncer de pulmón no microcítico o de células no pequeñas (CPCNP). Cada uno de estos dos tipos de cáncer van a presentar diferente pronóstico y van a requerir tratamientos distintos. El CPCP mixto o combinado (c-CPCP) es un tumor multifásico poco frecuente que se caracteriza por presentar células con características de CPCP y al menos un 10% de células con características morfológicas de CPCNP. Representa aproximadamente el 20% de todos los casos de CPCP siendo fundamental el tipo de histología del tumor al tener impacto en la supervivencia del paciente5,6.
El valor clínico de los marcadores tumorales en el estudio de pacientes con sospecha de cáncer de pulmón ha sido ampliamente estudiado. Molina et al. señalan que el uso combinado de un panel de seis marcadores tumorales (péptido liberador de progastrina [ProGRP], CEA, antígeno del carcinoma de células escamosas [SCC], CA 125, CYFRA 21.1 y NSE) es más preciso en el estudio de neoplasias de pulmón que cuando se emplean dichos marcadores individualmente. Dicho panel de marcadores tumorales orienta en unas pocas horas hacia el diagnóstico histológico en la mayoría de los pacientes con cáncer de pulmón lo que supone una inestimable ayuda para el clínico7,8. La NSE es un importante marcador en inmunohistoquímica para el tipado histológico de los tumores y su determinación en suero puede ayudar a sostener el diagnóstico de un CPCP al momento del estudio inicial del paciente. En el caso atípico que nos concierne, paciente con un c-CPCP, el único marcador tumoral positivo en suero fue el NSE pero a título bajo. Sin embargo, el estudio histológico fue negativo para dicho marcador.
La evaluación por inmunohistoquímica de los tumores primarios de origen desconocido y/o indiferenciados como en el caso expuesto nos permite tipificar su linaje mediante el uso de marcadores: citoqueratinas AE1/E3 para los tumores epiteliales malignos o carcinomas, proteína S100 para el melanoma maligno, CD45 para los tumores malignos hematológicos tipo linfoma y ausencia de estos tres marcadores para los sarcomas. A continuación, en los tumores clasificados como carcinomas hay que especificar el subtipo con otros marcadores inmunohistoquímicos: escamosos (citoqueratinas 5/6, p63, citoqueratinas 7/20), neuroendocrinos (cromogranina, sinaptofisina, CD56, TTF1, enolasa), tiroideos (TTF1, tiroglobulina), adrenocorticales (melan A, inhibina) y adenocarcinomas (citoqueratinas 7/20)9. El caso expuesto corresponde a un tumor muy indiferenciado que presenta algunos marcadores inmunohistoquímicos poco comunes en los tipos histológicos más frecuentes en cáncer de pulmón.
ConclusiónEl caso clínico pone de manifiesto la importancia de los resultados del laboratorio en las decisiones clínicas. La clasificación de los síntomas neurológicos del paciente como encefalitis paraneoplásica autoinmune asociada a anticuerpos anti-Hu permitió a los clínicos orientar el estudio del paciente hacía la búsqueda de un tumor oculto de estirpe microcítica. La presencia en el paciente de un carcinoma atípico de pulmón mixto de células pequeñas y grandes se refleja en una negatividad para los marcadores tumorales serológicos junto a marcadores inmunohistoquímicos poco comunes típicos de neoplasias pobremente diferenciadas.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.