La macroglobulinemia de Waldenström es un linfoma linfoplasmocítico caracterizado por una proliferación monoclonal de linfocitos B productores de inmunoglobulina M que infiltran la médula ósea. Las manifestaciones neurológicas asociadas a la macroglobulinemia de Waldenström suelen ser debidas al fenómeno de hiperviscosidad o a neuropatías desmielinizantes mediadas por inmunoglobulina M. Cuando la afectación neurológica es debida a la infiltración del sistema nervioso central por las células linfoplasmocitoides, se produce un síndrome denominado de Bing-Neel, con baja prevalencia y variedad de manifestaciones clínicas.
Se presenta el caso clínico de una mujer de 76 años con antecedentes de macroglobulinemia de Waldenström, con un cuadro neurológico repentino de alteración del lenguaje y torpeza en la mano derecha.
Cabe destacar la relevancia del laboratorio clínico en el diagnóstico del síndrome de Bing-Neel y en el seguimiento del tratamiento.
Waldenström macroglobulinemia is a lymphoplasmacytic lymphoma defined by a monoclonal proliferation of bone marrow infiltrating immunoglobulin M producing B lymphocytes. Neurological simptoms of Waldenström macroglobulinemia are mainly dominated by signs of hyperviscosity and autoimmune neuropathies mediated by immunoglobulin M. Neurological involvement secondary to the infiltration of IgM producing B lymphocytes, is defined as a Bing-Neel syndrome. This syndrome has a low prevalence and the clinical manifestations are variable.
The case described is about a 76 year-old female with a history of Waldenström macroglobulinemia, who presents sudden neurological signs such as alteration of spoken language and clumsiness of the right hand.
The clinical laboratory has a primary role in the diagnosis of Bing-Neel syndrome and monitoring of the treatment.
La macroglobulinemia de Waldenström es un linfoma linfoplasmocítico caracterizado por una proliferación monoclonal de linfocitos B productores de inmunoglobulina M (IgM) que infiltran la médula ósea. Esta enfermedad suele tener un curso crónico con evolución lenta y puede permanecer asintomático durante años.
Las manifestaciones neurológicas asociadas a la macroglobulinemia de Waldenström son debidas principalmente al fenómeno de hiperviscosidad o a neuropatías desmielinizantes mediadas por IgM1. El síndrome de Bing-Neel es un síndrome neurológico raro2 causado por la infiltración de las células linfoplasmocitoides de la macroglobulinemia de Waldenström en el parénquima cerebral, la leptomeninge, dura o líquido cefalorraquídeo (LCR)3 y se caracteriza por una amplia variedad de manifestaciones clínicas.
Las manifestaciones neurológicas más comunes asociadas a la macroglobulinemia de Waldenström son las neuropatías periféricas bilaterales y simétricas con reducción de la función sensorial en manos y pies, y las dificultades para escribir o para manipular objetos pequeños. Cuando se desarrolla un síndrome de Bing Neel pueden producirse manifestaciones neurológicas como déficits motores y alteración del estado mental, déficits en el nervio craneal, convulsiones, dolores de cabeza y neuropatías periféricas atípicas4.
Presentamos un caso de síndrome de Bing-Neel en el que el laboratorio clínico interviene activamente en el diagnóstico y seguimiento.
Caso clínicoMujer de 76 años, con síntomas neurológicos (alteración del lenguaje y torpeza en la mano derecha) y tomografía computarizada con lesión dudosa en la neuroimagen, que es derivada a nuestro centro. Como antecedentes de interés destacan diabetes mellitus, hipertensión arterial y macroglobulinemia de Waldenström diagnosticada en 2004. La paciente logró una remisión completa de la macroglobulinemia de Waldenström, con posterior aparición de la proteína monoclonal, sin sintomatología asociada. La exploración, física y neurológica, revela una alteración de la fluencia verbal con ligera apraxia.
Se le realizan las siguientes pruebas complementarias:
- -
Resonancia magnética cerebral, que descarta isquemia subaguda. Destaca un engrosamiento paquimeníngeo y leptomeníngeo en la región parietal izquierda y en el polo anterior frontal.
- -
Analítica con hemograma, exploración de la hemostasia, bioquímica en suero, marcadores tumorales, bioquímica en orina de 24 h y estudio de LCR. Se incluye la medida de la enzima convertidora de angiotensina en suero y de la adenosina desaminasa en LCR. En los resultados solo destaca una concentración de proteína C reactiva en suero de 6,5mg/dl (intervalo de referencia: 0,1-0,5mg/dl), una concentración de β-2-microglobulina sérica de 4,9mg/l (1-2,5mg/dl) y una concentración de proteínas en LCR de 48mg/dl (15-45mg/dl).
- -
Examen microbiológico del LCR: tinciones de Gram y Zhiel-Nielssen, cultivo bacteriano, incluidas micobacterias, detección mediante técnicas de biología molecular de virus neurotropos y serología para virus y bacterias neurotropos. Todos los resultados son negativos.
- -
Tomografía computarizada de tórax con contraste yodado y resultado normal.
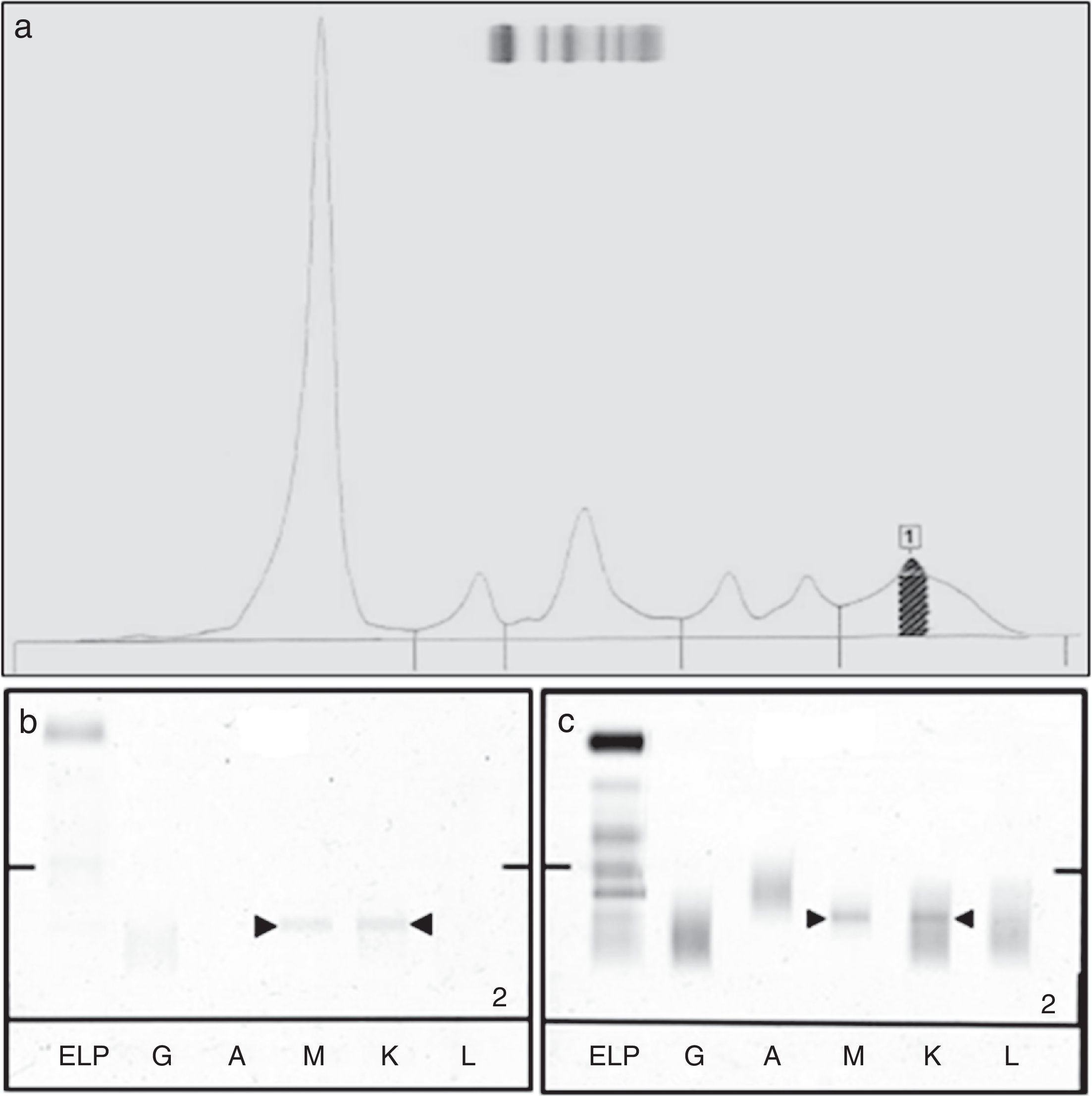
A la vista de los resultados, se sospecha infiltración meníngea por el linfoma linfoplasmocítico. Se le practica a la paciente una nueva punción lumbar y se realiza un proteinograma en suero y en orina de 24 h, e inmunofijación en LCR. En la inmunofijación del LCR se detecta un componente monoclonal IgM-Kappa, del mismo isotipo y con la misma movilidad electroforética que el detectado anteriormente en suero. En el proteinograma en suero se detecta un componente monoclonal IgM-Kappa, con una concentración de 2,9g/l (fig. 1). En el proteinograma en orina no se detecta proteína monoclonal.
Electroforesis de proteínas para la evaluación de la infiltración meníngea por el linfoma linfoplasmocítico. a) Proteinograma en suero (aparece sombreada el área correspondiente al componente monoclonal). b) Inmunofijación en LCR. c) Inmunofijación en suero. En b) y c) se señala entre flechas el componente monoclonal.
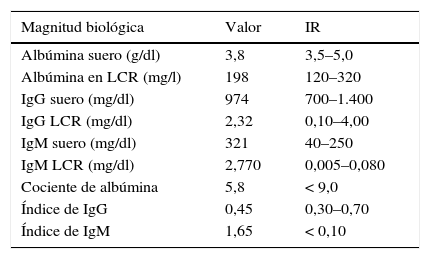
Se realiza una evaluación del estado de la barrera hematoencefálica y de la síntesis intratecal de inmunoglobulinas. Se miden las concentraciones de albúmina, IgG e IgM en suero y LCR. Se calcula el cociente de albúmina, el índice de IgG o de Tibbling-Link y el índice de IgM (tabla 1) y se realizan gráficos de Reiber para la IgG y la IgM (fig. 2a).
Valores de las magnitudes biológicas empleadas para la valoración del estado de la barrera hematoencefálica y la síntesis intratecal de inmunoglobulinas
| Magnitud biológica | Valor | IR |
|---|---|---|
| Albúmina suero (g/dl) | 3,8 | 3,5–5,0 |
| Albúmina en LCR (mg/l) | 198 | 120–320 |
| IgG suero (mg/dl) | 974 | 700–1.400 |
| IgG LCR (mg/dl) | 2,32 | 0,10–4,00 |
| IgM suero (mg/dl) | 321 | 40–250 |
| IgM LCR (mg/dl) | 2,770 | 0,005–0,080 |
| Cociente de albúmina | 5,8 | < 9,0 |
| Índice de IgG | 0,45 | 0,30–0,70 |
| Índice de IgM | 1,65 | < 0,10 |
IgG: inmunoglobulina G; IgM: inmunoglobulina M; IR: intervalo de referencia; LCR: líquido cefalorraquídeo.
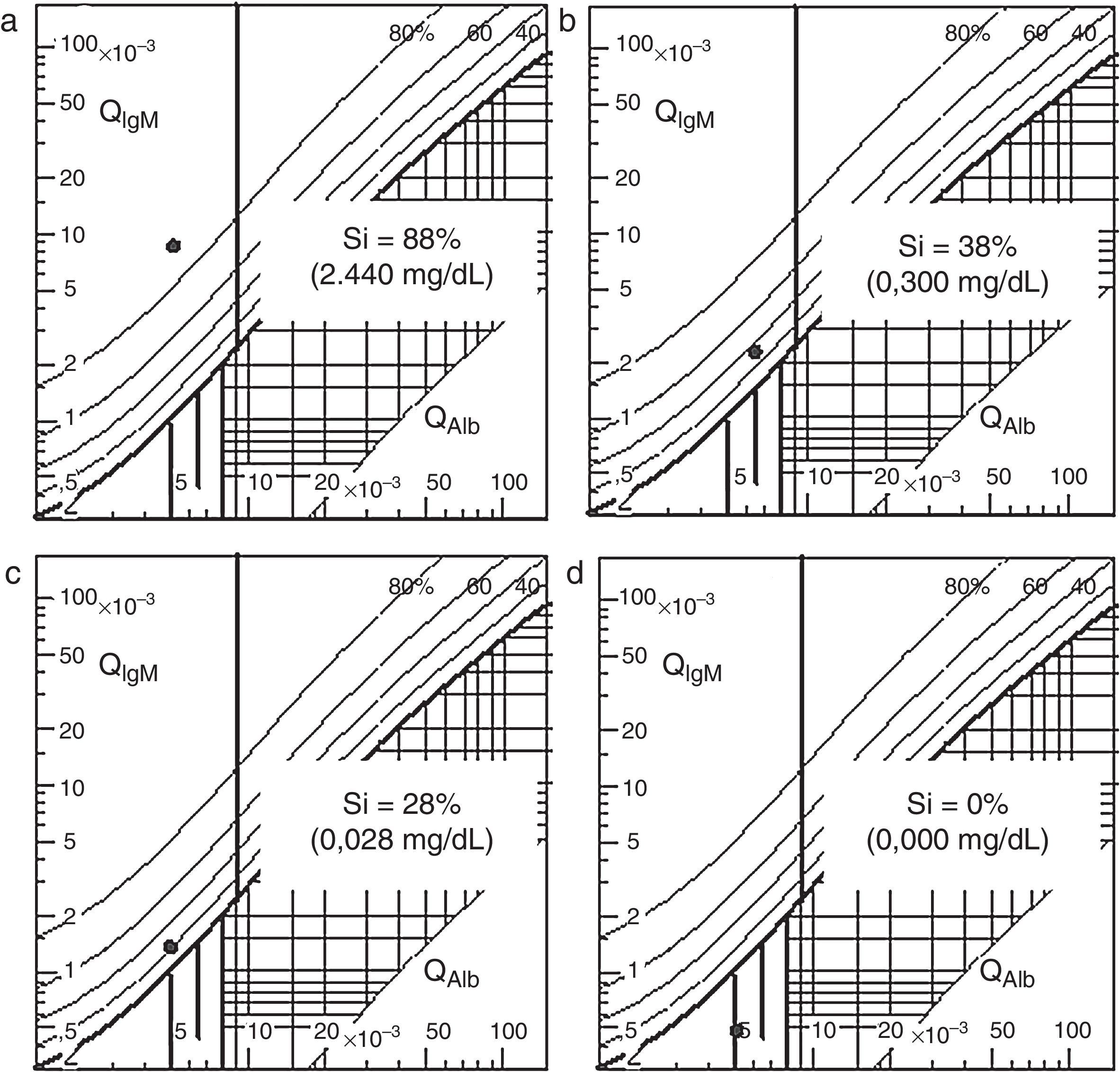
Reibergramas para IgM. a) Antes de comenzar el tratamiento. b) En el día 32 tras el inicio del tratamiento. c) En el día 231 tras el inicio del tratamiento. d) En el día 372 tras el inicio del tratamiento.
QAlb: cociente de albúmina; QIgM: cociente de IgM; SI: concentración y porcentaje de la IgM procedente de la síntesis intratecal.
El cociente de albúmina y los gráficos de Reiber descartan un aumento de permeabilidad de la barrera hematoencefálica. El índice de IgM y el reibergrama para IgM indican síntesis intratecal de IgM, mientras que el índice de IgG y el reibergrama para IgG descartan la síntesis intratecal de IgG.
Paralelamente a las pruebas bioquímicas, se realiza un análisis por citometría de flujo en el LCR que revela la existencia de una población monoclonal de linfocitos IgM-Kappa. Se realiza también una tomografía por emisión de positrones con 18-fluorodesoxiglucosa asociada a tomografía computarizada, con resultado normal.
A la vista de los resultados, se establece el diagnóstico de sospecha de infiltración subaracnoidea por el linfoma linfoplasmocítico. Tres semanas después del ingreso, ante la desaparición de los síntomas, la paciente recibe el alta sin tratamiento para seguir su evolución mediante controles periódicos por Hematología Clínica.
Sin embargo, pocos días después, ante la reaparición de los síntomas neurológicos, se realiza un nuevo estudio bioquímico y citométrico de LCR y una tomografía computarizada, en los que no se evidencian cambios. Se inicia tratamiento con quimioterapia triple intratecal (metotrexato, citarabina y dexametasona) y la paciente es dada de alta con buen estado general.
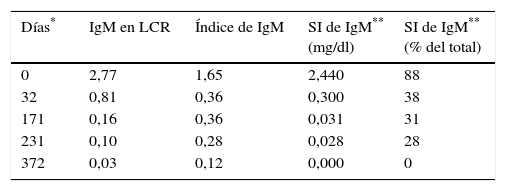
Un mes después del primer episodio, la paciente reingresa por un cuadro de disminución del nivel de conciencia y convulsiones. Una nueva resonancia magnética no muestra mejoría de la lesión subaracnoidea, sin embargo, el estudio bioquímico del LCR muestra una reducción en la síntesis intratecal de IgM (tabla 2 [día 32] y fig. 2b).
Evolución de la concentración de IgM en LCR, el índice de IgM y de la síntesis intratecal de IgM desde el primer ingreso de la paciente
| Días* | IgM en LCR | Índice de IgM | SI de IgM** (mg/dl) | SI de IgM** (% del total) |
|---|---|---|---|---|
| 0 | 2,77 | 1,65 | 2,440 | 88 |
| 32 | 0,81 | 0,36 | 0,300 | 38 |
| 171 | 0,16 | 0,36 | 0,031 | 31 |
| 231 | 0,10 | 0,28 | 0,028 | 28 |
| 372 | 0,03 | 0,12 | 0,000 | 0 |
IgG: inmunoglobulina G; IgM: inmunoglobulina M; LCR: líquido cefalorraquídeo; SI: síntesis intratecal.
Se decide la realización de una biopsia meníngea que confirma la infiltración por una neoplasia de estirpe linfoide compuesta por linfocitos pequeños y algunas células plasmáticas positivas para CD20, Bcl2 y CD18. Las células proliferantes expresan mayoritariamente cadenas ligeras kappa.
Se diagnostica a la paciente de neurolinfomatosis por macroglobulinemia de Waldenström (síndrome de Bing-Neel), sin evidencia de macroglobulinemia de Waldenström a otros niveles.
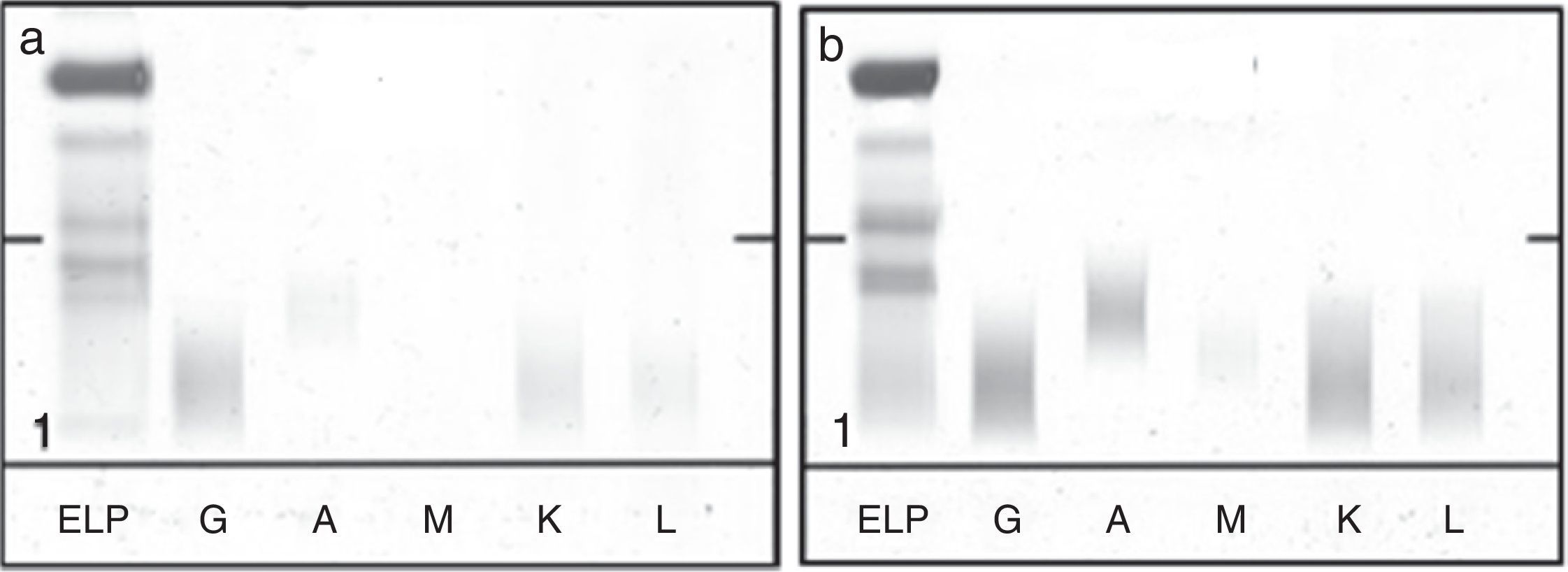
Se trata a la paciente con quimioterapia intratecal a la que se añade quimioterapia (fludarabina, ciclofosfamida y rituximab) sistémica, tras descartarse mediante serología una infección por los virus de la hepatitis B y C, que podría reactivarse por el uso de rituximab. En total se le administran cuatro ciclos del tratamiento completo en un periodo de cinco meses y, posteriormente, cuatro ciclos más, exclusivamente de quimioterapia intratecal. La respuesta al tratamiento se monitoriza mediante la detección y la medición de la proteína monoclonal en el suero y en el LCR, el índice de IgM (tabla 2) y reibergramas (fig. 2). Al cabo de un año desde el episodio inicial, se obtiene una respuesta completa para la macroglobulinemia de Waldenström, normalización de la concentración de IgM en LCR y desaparición de la inmunoglobulina monoclonal en suero y LCR por inmunofijación (fig. 3).
A pesar de la buena respuesta, la paciente continúa con sintomatología neurológica heterogénea.
DiscusiónPara el diagnóstico de la macroglobulinemia de Waldenström es necesario que se cumplan los siguientes dos criterios fundamentales: infiltración de la médula ósea por el linfoma linfoplasmocítico y la presencia de un componente monoclonal IgM en la sangre, acompañados de síntomas o signos derivados de los dos criterios anteriores5. La detección, identificación y medida de la proteína monoclonal se realiza mediante el proteinograma e inmunofijación.
Los criterios actuales de respuesta al tratamiento se basan principalmente en el grado de reducción de la proteína monoclonal6.
El diagnóstico diferencial de un paciente con macroglobulinemia de Waldenström y síntomas neurológicos debe incluir enfermedades inflamatorias/infecciosas del sistema nervioso central, linfoma primario del sistema nervioso central, linfoma de células B de bajo grado de malignidad, meningitis carcinomatosa y síndrome de hiperviscosidad4.
En el caso expuesto se descarta primero un accidente isquémico mediante una resonancia magnética.
Debido a la concentración de IgM en suero cercana al intervalo de referencia y a que la paciente no presenta alteraciones visuales ni sangrado, y el resultado del análisis del hemograma es completamente normal, se descarta un síndrome de hiperviscosidad.
Los resultados de las diferentes pruebas descartan la posibilidad de etiología infecciosa, especialmente tuberculosis cerebral, etiología inflamatoria no infecciosa como sarcoidosis (no hay hipercalciuria y la concentración de enzima convertidora de angiotensina en suero es normal) u otra patología autoinmune. Por último, se valora la posibilidad de infiltración meníngea por una neoplasia. La paciente no presenta síndrome constitucional, los marcadores tumorales son negativos y la tomografía por emisión de positrones asociada a tomografía computarizada no evidencia enfermedad maligna macroscópica, por lo que se descarta una metástasis de un tumor no localizado. Parece más probable una infiltración por su enfermedad de base (linfoma linfoplasmocítico) debido a la elevación de la concentración de β-2-microglobulina y el reciente aumento de la concentración de la proteína monoclonal sérica en el último control, lo que sugiere una reactivación del tumor.
La presencia de IgM kappa monoclonal en el LCR debido a una síntesis intratecal de IgM, junto al resultado del análisis por citometría de flujo que revela la existencia de una población monoclonal de linfocitos IgM kappa apoyan firmemente la infiltración meníngea por el linfoma.
Finalmente, la biopsia meníngea confirma el diagnóstico de infiltración meníngea por el linfoma linfoplasmocítico o síndrome de Bing-Neel.
El síndrome de Bing-Neel es tratable, aunque está asociado a un peor pronóstico que la macroglobulinemia de Waldenström5.
Se ha propuesto una clasificación en la que se divide a los pacientes afectos de síndrome de Bing-Neel en dos grupos: grupo A, en el que existe infiltración de células linfoplasmáticas en el parénquima cerebral, duramadre, meninges o LCR, y grupo B, en el que existe depósito de IgM en el sistema nervioso central pero no infiltración celular6. En el grupo B lo más probable es que la IgM se difunda hacia el LCR7.
Nuestra paciente pertenecería al grupo A, ya que se encontró infiltración linfoide en la biopsia meníngea.
La afectación neurológica debida al síndrome de Bing-Neel suele desarrollarse tras el diagnóstico de macroglobulinemia de Waldenström, aunque se han descrito casos en los que ambas entidades han sido diagnosticadas a la vez8, y otros en los que el diagnóstico del síndrome de Bing-Neel ha sido previo al diagnóstico de la macroglobulinemia de Waldenström9.
Se ha propuesto un método de diagnóstico de síndrome de Bing-Neel basado en pruebas en sangre y suero, biopsia de médula ósea y marcadores de superficie, pruebas en LCR y resonancia magnética de cerebro y médula espinal3. Se recomienda, además, biopsiar la lesión siempre que existan menos de 5 células linfoplasmáticas por cada microlitro en LCR y lesiones en el sistema nervioso central. El análisis de LCR debe incluir, además de las pruebas de rutina, estudios inmunohistoquímicos, citometría de flujo y estudio para la detección de proteína monoclonal9.
En nuestro caso han sido los resultados de la resonancia magnética y el análisis del LCR, lo que ha sustentado el diagnóstico hasta su confirmación por la biopsia meníngea.
Recientemente se ha propuesto la presencia de la mutación L265P en el gen MYD88 en LCR como criterio diagnóstico adicional10,11.
A pesar de que la paciente responde bien al tratamiento, continúan los síntomas neurológicos. Se especula con posibles secuelas del síndrome de Bing-Neel pero no existen evidencias que lo demuestren. Además, la concentración de proteína monoclonal presente en LCR no se correlaciona con la disfunción neurológica, ya que existen casos de síndrome de Bing-Neel descritos sin la correspondiente sintomatología12–14. Se especula también con el tratamiento intratecal, diabetes, o leve atrofia cerebral entre otras posibles causas de esta sintomatología.
ConclusiónEl laboratorio clínico contribuye significativamente en el estudio del caso expuesto. En el diagnóstico de síndrome de Bing-Neel, la presencia de IgM monoclonal en el LCR debido a una síntesis intratecal de IgM sustenta la sospecha de infiltración meníngea por linfoma linfoplasmocítico. Asimismo, la evaluación de la respuesta al tratamiento se basa en la monitorización de la proteína monoclonal en el LCR.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.