En los últimos años, la procalcitonina (PCT) ha demostrado ser la prueba más sensible para el manejo del proceso infeccioso, el diagnóstico y la estratificación de la sepsis. Ésta aporta valor pronóstico de complicaciones en pacientes postoperados y críticos, e incluso es útil como guía para la retirada del tratamiento antibiótico.
Recientemente se está comercializando un nuevo inmunoensayo de electroquimioluminiscencia para la determinación de PCT (Elecsys BRAHMS PCT) con características similares a la prueba más eficaz descrita hasta ahora (PCT KRYPTOR). En el presente trabajo se procesaron 140 especímenes de pacientes con concentraciones de PCT de entre 0,02 y 47,13ng/ml, en un Cobas e411 y en un KRYPTOR; se observó que los resultados no son transferibles entre ambos métodos. Si bien la clasificación diagnóstica con los puntos de corte actuales no varía sensiblemente, es necesario un estudio más amplio para redefinir estos puntos de corte con el nuevo método. Por otra parte, se ha verificado que, aunque no hay efecto de arrastre significativo para una concentración de PCT cercana al límite superior del intervalo dinámico de la prueba, sí se observa arrastre para concentraciones más altas. Sin embargo, la modificación producida para una concentración cercana al límite de decisión clínica de 0,5ng/ml es clínicamente irrelevante, por lo que no parece necesario incorporar ninguna acción correctiva para evitar este arrastre.
Over the last few years, Procalcitonin (PCT) has been shown to be the most sensitive test for the management of the infectious process, diagnosis and stratification of sepsis, prognosis of postoperative complications, and even useful for monitoring antibiotic therapy.
A new electrochemical luminescence immunoassay (ECLIA) has recently been developed for measuring Procalcitonin (Elecsys BRAHMS PCT), with similar characteristics to the most efficient method described up to now (PCT KRYPTOR). In the present work, 140 patient specimens were analysed with PCT concentrations ranging 0.02–47.13ng/mL, in a Cobas e411 and a KRYPTOR analysers, and the results were found not to be transferable between methods. Although diagnostic classification using the current cut-off points did not vary significantly, a larger study will be required to redefine these cut-off points for the new method. On the other hand, there was no significant carryover effect at PCT concentrations close to the upper limit of the dynamic range, but it was observed at higher concentrations of PCT. However, at a concentration of PCT close to the clinical decision limit of 0.5ng/mL this effect seems to be clinically insignificant, thus no corrective action would be necessary to prevent carryover.
La sepsis es aún una de las principales causas de mortalidad en pacientes críticos. El tratamiento antibiótico precoz y eficaz tiene un papel crucial en el pronóstico de estos pacientes. Para prevenir diversas complicaciones, es preciso optimizar el diagnóstico y monitorización de la sepsis. Por otra parte, en la mayoría de los procesos infecciosos, el análisis microbiológico actual no ofrece un diagnóstico suficientemente sensible ni precoz, basado en el cultivo de fluidos biológicos tomados de los posibles focos de la infección.
El desarrollo de nuevos marcadores bioquímicos de inflamación ha conducido a una redefinición del síndrome de respuesta inflamatoria sistémica y de la sepsis en la Conferencia Internacional de Definición de Sepsis, celebrada en el año 20011. En esta conferencia se estableció un nuevo sistema de estadificación de la enfermedad, denominado sistema PIRO (Predisposition, Infection, Response, Organ dysfunction) para estratificar a los pacientes no sólo en función de la clínica, sino también atendiendo a los marcadores bioquímicos de inflamación, incluso la proteína C reactiva y con la sugerencia de la utilización de procalcitonina (PCT) e interleucina 6, independientemente del resultado microbiológico.
En los últimos años, la PCT ha demostrado ser la prueba más sensible para el manejo del proceso infeccioso2,3, es útil para el diagnóstico y seguimiento de pacientes con mayor riesgo de desarrollo de sepsis (por ejemplo: pacientes de una unidad de vigilancia intensiva e inmunodeprimidos)4,5, con valor pronóstico en determinadas situaciones (por ejemplo: período postoperatorio o pacientes críticos)6–8 e incluso es útil como guía para la retirada del tratamiento antibiótico9,10.
En un inicio, se valoraba un único punto de corte de 0,5ng/ml de PCT para el diagnóstico de infección, pero posteriormente se introdujeron nuevos puntos de corte para el seguimiento y clasificación de las diferentes entidades clínicas. Por ejemplo, para la retirada del tratamiento antibiótico, Peters et al11 proponen un valor de corte de PCT de 0,25ng/ml. Por tanto, actualmente se requieren sensibilidades funcionales inferiores a 0,1ng/ml para la determinación de PCT.
En este sentido, de todos los ensayos disponibles hasta ahora, la tecnología TRACE (Time-Resolved Amplified Cryptate Emission) del ensayo PCT KRYPTOR ha sido descrita como la más adecuada12, con una sensibilidad funcional de 0,06ng/ml, superior a la de otras alternativas, como los métodos inmunocromatográficos, inmunoluminométricos o el ELFA (VIDAS PCT), con sensibilidades funcionales que varían entre 0,09 y 0,3ng/ml.
Recientemente, se está comercializando un nuevo método para la determinación de PCT. Se trata de un inmunoensayo de electroquimioluminiscencia, desarrollado por Roche Diagnostics en colaboración con BRAHMS (Elecsys BRAHMS PCT). La sensibilidad funcional de este método es la misma que la de PCT KRYPTOR, aunque con intervalo dinámico más amplio (de 0,02 a 100ng/ml).
El laboratorio de respuesta rápida del Hospital Universitario Central de Asturias ha sido pionero en la cuantificación de PCT por TRACE en España. Al disponer también del ensayo Elecsys BRAHMS PCT, hubo 2 aspectos fundamentales que llamaron la atención en la información aportada para la nueva técnica. En primer lugar, la comparación descrita entre este nuevo método y PCT KRYPTOR, donde únicamente se informa de las rectas de regresión y de los coeficientes de correlación (lineal y de Passing Bablok). No se presentan los intervalos de confianza (IC) obtenidos ni gráficas de comparación de ambos métodos, con lo que no es posible valorar la transferibilidad de los resultados entre éstos. En segundo lugar, sorprende que la amplitud del intervalo dinámico es mayor que la de KRYPTOR, aunque sin posibilidad de dilución automática, y sobre todo que ante resultados de PCT superiores a 100ng/ml, a pesar de que el analizador advierte mediante una alarma del posible arrastre, en la descripción de la técnica no se aporta información acerca de la magnitud ni relevancia de este posible efecto de arrastre en el método Elecsys BRAHMS PCT.
Por este motivo, se plantea describir las observaciones acerca de estos 2 aspectos. Las determinaciones de PCT se realizaron en especímenes de plasma heparina de litio conservados a −4°C o a −80°C hasta su procesamiento, en un KRYPTOR (Brahms, Hennigsdorf, Alemania) y en un Cobas e411 (Roche Diagnostics, Mannheim, Alemania).
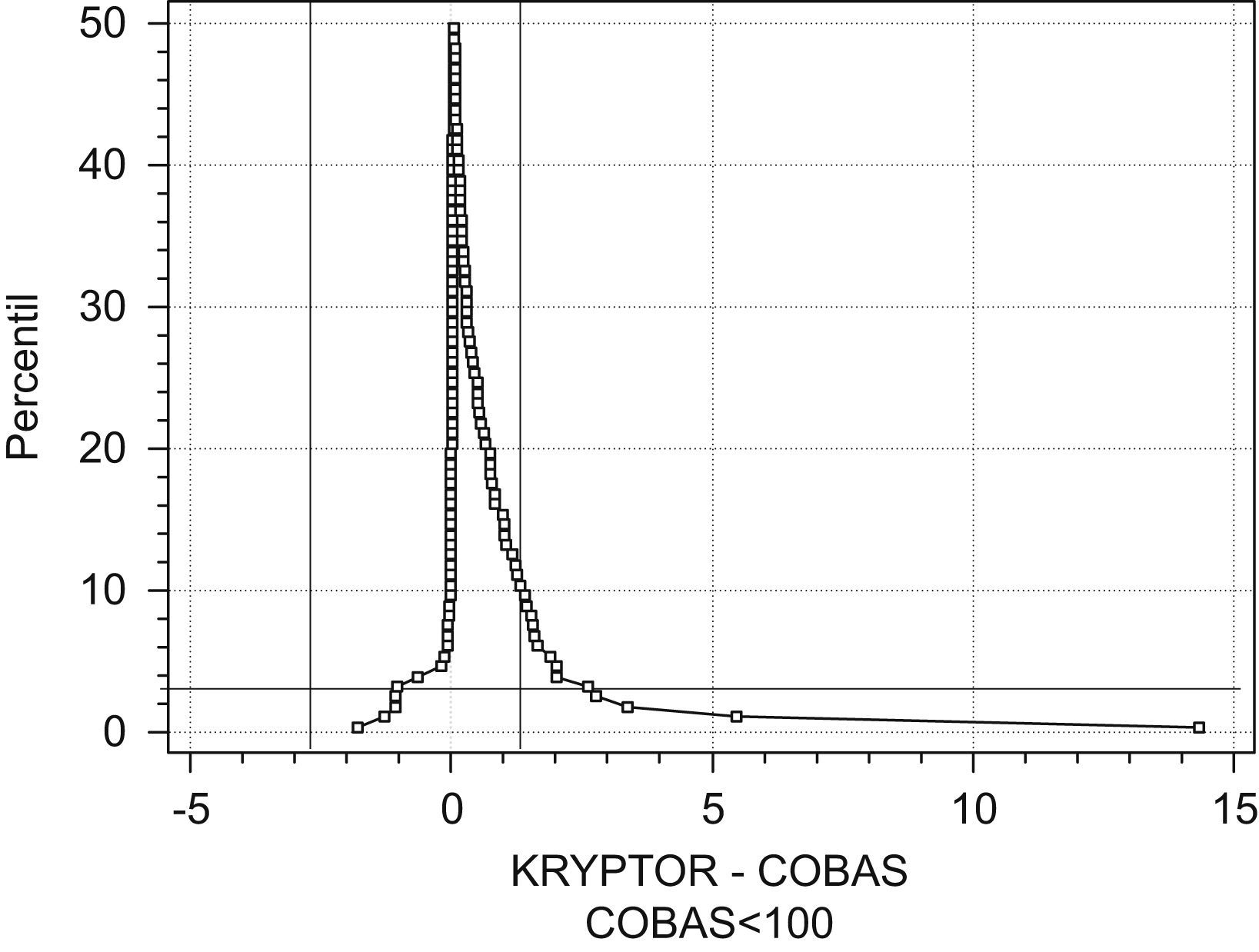
Para estudiar la transferibilidad entre los resultados se analizaron 140 especímenes de plasma por ambos métodos, con valores de PCT obtenidos por KRYPTOR, entre 0,02 y 47,13ng/ml. Se observaron diferencias estadísticamente significativas entre ambos métodos (prueba de Wilcoxon para datos emparejados; p<0,0001). El análisis de regresión permitió observar la heterocedasticidad de los resultados, así como la ausencia de normalidad de los residuales, sobre todo para valores de PCT por encima de 20ng/ml. Se adoptó como alternativa la regresión no paramétrica de Passing Bablok, se observó tendencia proporcional del método Elecsys BRAHMS PCT hacia valores más bajos de PCT que KRYPTOR (IC del 95%: de 0,843 a 0,875). Para poder establecer con mayor claridad el alcance de esta observación, se representó un gráfico de montaña (fig. 1) que permite comparar métodos cuando las diferencias entre éstos no sigue una distribución normal, como en este caso, a través de una distribución de probabilidad acumulada empírica doblada. Este método gráfico, descrito por Krouwer en 199513, es el recomendado en estos casos por el CLSI (Clinical and Laboratory Standards Institute)14. Al fijar el error analítico total en un 95%, se agregó una línea de especificación horizontal correspondiente al percentil 2,5 de la distribución acumulada, así como líneas de especificaciones verticales correspondientes a los límites del error analítico total, calculados de modo no paramétrico con los percentiles 2,5 y 97,5 de las diferencias (entre −2,79 y 1,06). Se observa que la curva de la representación de montaña no está contenida dentro de la intersección entre la línea horizontal y las líneas verticales de las especificaciones, el diagrama está sesgado a la derecha del 0 y se observa un valor aberrante. A la vista de estos resultados, no hay transferibilidad de resultados entre las determinaciones de PCT entre KRYPTOR y Cobas, puesto que menos del 95% de las diferencias observadas se encuentra entre los límites de tolerancia.
Diagrama de montaña que compara los resultados obtenidos para procalcitonina en el KRYPTOR y en el Cobas e411. Las líneas que establecen las especificaciones deseadas son el percentil 2,5 de la distribución acumulada empírica doblada (línea horizontal) y los percentiles 2,5 y 97,5 de la distribución de las diferencias observadas entre ambos métodos (líneas verticales).
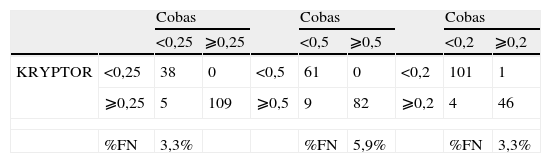
Dado que se están comparando 2 métodos entre sí, ambos están sujetos a error y ninguno de éstos se considera como método de referencia, se estudió la imprecisión como posible fuente de discrepancias, de acuerdo con el protocolo recomendado por el CLSI.15 La imprecisión intraensayo e interensayo observada en 3 conjuntos de muestras, con concentraciones de PCT de 0,1ng/ml, 0,4ng/ml y 0,6ng/ml, respectivamente, variaron entre el 0,5 y el 3,4%. Los controles internos mostraron una imprecisión durante los días del estudio entre el 1,1 y el 2,4%, para valores de PCT de 0,46ng/ml y de 9ng/ml, respectivamente. Se comparó, a continuación, la clasificación diagnóstica que se realizaría con cada método para 152 resultados de pacientes. Para 3 puntos de corte, considerados como valores discriminatorios para bajo y alto riesgo de sepsis o shock séptico (de 0,25ng/ml, 0,5ng/ml y 2ng/ml, respectivamente), se observó que aproximadamente un 5% de los pacientes habría recibido diferente clasificación por ambos métodos (tabla 1). Por tanto, aunque las diferencias observadas de estas concentraciones de PCT pueden llegar a ser de hasta el 30%, a efectos del diagnóstico, estas diferencias parecen irrelevantes. No obstante, dado que el mayor porcentaje de discordancia se observa en el punto de corte de 0,5ng/ml, sería más adecuado establecer nuevos puntos de corte más ajustados para el nuevo método, en una serie más amplia de pacientes con diferentes situaciones clínicas.
Clasificación de pacientes por ambos métodos para diferentes valores de corte de procalcitonina*
| Cobas | Cobas | Cobas | |||||||
| <0,25 | ⩾0,25 | <0,5 | ⩾0,5 | <0,2 | ⩾0,2 | ||||
| KRYPTOR | <0,25 | 38 | 0 | <0,5 | 61 | 0 | <0,2 | 101 | 1 |
| ⩾0,25 | 5 | 109 | ⩾0,5 | 9 | 82 | ⩾0,2 | 4 | 46 | |
| %FN | 3,3% | %FN | 5,9% | %FN | 3,3% | ||||
FN: falso negativo.
El posible efecto de arrastre en el Cobas se evaluó de acuerdo con el protocolo descrito por la International Union of Pure and Applied Chemistry16. Se procesaron 10 series consecutivas de una concentración de PCT cercana al límite superior del intervalo dinámico de Cobas (A=93ng/ml) seguida de una concentración de PCT próxima al valor de decisión clínica (B=0,37ng/ml), según la secuencia A1A2B1B2B3. No se observó arrastre estadísticamente significativo (prueba de Wilcoxon para datos emparejados) entre B1 y B3. Sin embargo, cuando se procesaron muestras con concentraciones superiores a 100ng/ml (A=240ng/ml), de las que el analizador no emite resultado sin dilución, sí se observó arrastre estadísticamente significativo (p<0,05). No obstante, la repercusión clínica es irrelevante, dado que la diferencia en concentraciones para una muestra en torno a 0,4ng/ml conlleva un incremento del 20% aproximadamente, que no supone modificación de la actitud diagnóstica. Por otra parte, este efecto de arrastre probablemente se produzca por un lavado incompleto en la célula de medida, ya que el sistema utiliza puntas desechables para el muestreo. De hecho, diversos analitos que ocasionalmente generan lecturas muy bajas en la célula (por ejemplo: antígeno prostático específico, tirotropina y troponina T) también producen esta alarma en el sistema, si bien hasta ahora no se habían encontrado diferencias significativas. Para completar este estudio, se ha comprobado que en otros 2 parámetros que se determinaban en el mismo analizador del laboratorio de urgencias (troponina T y N-terminal propéptido natriurético de tipo B) no se produce arrastre estadísticamente significativo tras la determinación de concentraciones elevadas de PCT, por lo que este parámetro parece ser el más afectado por el efecto descrito.
Como conclusión, el nuevo ensayo Elecsys BRAHMS PCT proporciona resultados más bajos de PCT que su homólogo PCT KRYPTOR, por lo que será necesario valorar con series amplias de pacientes nuevos puntos de corte más adecuados para este método. La imprecisión observada parece adecuada para los fines clínicos del método y el arrastre no es clínicamente relevante, por lo que no se requiere una actuación especial ante un resultado de PCT obtenido a continuación de una muestra que haya generado alarma de posible arrastre.
Brahms y Roche Diagnostics cedieron los reactivos requeridos para el presente estudio. Los autores manifiestan no tener conflicto de intereses.