En los últimos años la aplicación de la hibridación in situ fluorescente (FISH) permite el diagnóstico precoz de aneuploidias. El objetivo de este estudio es el análisis descriptivo mediante FISH de los líquidos amnióticos procesados en el laboratorio y la concordancia con el cariotipo.
Material y métodosAnálisis de 821 muestras de líquidos amnióticos (enero 2009 a diciembre 2010) remitidas por Medicina Fetal desde la semana 13 a 36 de gestación para estudio prenatal de aneuploidias, (kit Aneuvysion) con sondas centroméricas para los cromosomas X, Y y 18, y locus específicas para los cromosomas 13 y 21. El estudio se completa con el cariotipo mediante método de bandeo G.
ResultadosDe las 821 muestras, 776 (94,52%) fueron normales y 45 (5,48%) presentaron aneuploidias: en 22 casos (48,88%) el sexo cromosómico del feto fue masculino, en las 23 restantes (51,12%) femenino. La cromosopatía más frecuente fue la trisomía 21 (19 casos en fetos masculinos y 11 femeninos), la de menor presentación fue la trisomía 13 (2 casos) que representa el 0,24% del total de los líquidos amnióticos procesados. En todos los casos, la concordancia con el cariotipo fue del 100%.
ConclusionesEl estudio de aneuploidias mediante FISH en núcleos en interfase en líquido amniótico permite un diagnóstico prenatal rápido de las principales cromosomopatías, siendo la trisomía 21 la más frecuentemente detectada. Los resultados del FISH coincidieron en el 100% con el cariotipo, gold estándar en el diagnóstico prenatal de cromosomopatías.
The application of fluorescence in situ hybridization (FISH) techniques in the last few years has led to the prenatal diagnosis of aneuploidies. The objective of this investigation was a descriptive analysis of amniotic fluids processed in the laboratory using FISH and the agreement with the karyotype.
Material and methodsA total of 821 amniotic fluid samples (January 2009 to December 2010) at gestational ages 13 to 36 weeks, from Fetal Medicine Unit for prenatal testing for aneuploidies (Aneuvysion kit) with centromeric probes for chromosomes X,Y and 18, and locus specific for chromosomes 13 and 21. The study was complemented by the karyotype by G-banding method.
ResultsOf the 821 samples, 776 (94.52%) were normal and 45 (5.48%) had aneuploidy: in 22 cases (48.88%) the chromosomal sex of the foetus was male, in the remaining 23 (51.12%) female. The most common chromosomal abnormality detected was trisomy 21 (19 cases in males and 11 cases in female foetuses), the lowest performance was the trisomy 13 (2 cases) representing 0.24% of total processed amniotic fluids. In all cases, the concordance with the karyotype was 100%.
ConclusionsThe study of aneuploidy by FISH of interphase nuclei present in the amniotic fluid enables rapid prenatal diagnosis of major chromosomal abnormalities, trisomy 21 was more frequently detected. FISH results in 100% agreed with the karyotype, the gold standard in prenatal diagnosis of chromosomal abnormalities
El diagnóstico prenatal de aneuploidias mediante el estudio de amniocitos no cultivados, obtenidos por amniocentesis durante el segundo trimestre del embarazo en aquellas mujeres con aumento de riesgo de cromosomopatías por hibridación in situ fluorescente (FISH), es una técnica que proporciona información sobre alteraciones cromosómicas de tipo numérico en núcleos en interfase1. Aunque son numerosos los trabajos publicados acerca de la técnica FISH sobre amniocitos no cultivados2–4, no encontramos muchas referencias bibliográficas que relacionen los resultados del FISH y la concordancia con el cariotipo5–8.
Nuestro estudio se basa en un análisis descriptivo de tipo retrospectivo de los resultados obtenidos por FISH realizado a los líquidos amnióticos procesados en el laboratorio y su concordancia con los obtenidos del cariotipo, técnica considerada como gold estándar en el diagnóstico prenatal de cromosomopatías9.
Material y métodosPara el estudio se recogen 821 muestras de líquido amniótico, obtenidas por amniocentesis, durante el periodo comprendido de enero de 2009 a diciembre de 2010. Las muestras proceden de la consulta de Medicina Fetal del hospital Universitario Reina Sofía. Se recogen en tubos estériles de tapón de rosca y fondo cónico con volumen suficiente, entre 8-10mL y acompañado de la tarjeta de petición donde nos remiten los datos clínicos de la paciente. La edad gestacional osciló de 13 a 36 semanas y la técnica se indicó cuando existía al menos una de las siguientes circunstancias: antecedentes familiares/personales de cromosomopatía, screening bioquímico positivo o bien criterios ecográficos. Tras la obtención del consentimiento informado, firmado por la paciente y el ginecólogo que realiza la amniocentesis, la muestra obtenida se separa en 2 partes: una para el estudio FISH y otra para la realización del cariotipo. Todos los FISH y parte de los cariotipos fueron realizados en la sección de Citogenética Molecular del Laboratorio del hospital Reina Sofía. El resto de los cariotipos no realizados en el hospital se enviaron a un laboratorio externo de referencia (Reference Laboratorios, Barcelona) siendo analizados, en ambos casos, mediante el método de bandeo G. Para el FISH se utilizó el kit Aneuvysion con sondas centroméricas para los cromosomas X, Y y 18, y locus específicas para los cromosomas 13 y 21, preparando las muestras según las indicaciones del fabricante. Las preparaciones se visualizaron en un microscopio fluorescente de epiiluminación Nikon Eclipse 50 equipado con una lámpara de mercurio de 100 vatios.
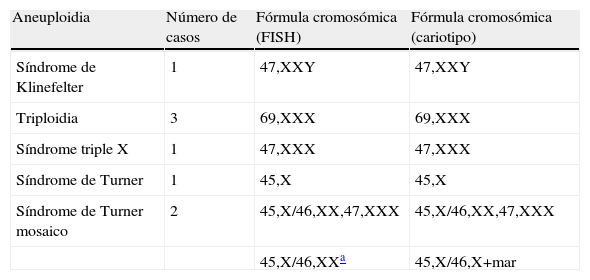
ResultadosDe las 821 muestras analizadas, 776 (94,52%) fueron normales y 45 (5,48%) presentaron aneuploidias; de ellas en 22 casos (48,88%) el sexo cromosómico del feto fue masculino y en las 23 restantes (51,12%) femenino. La cromosopatía más frecuentemente detectada entre los autosomas fue la trisomía 21 (19 casos en fetos masculinos y 11 casos en fetos femeninos), lo que supone el 66,66% de las alteraciones numéricas detectadas. El 11,11% (2 casos en fetos varones y 3 fetos de sexo femenino) fueron trisomías 18, mientras que la de menor frecuencia de presentación fue la trisomía 13, solo 2 casos, lo que representa el 4,44% de los líquidos amnióticos procesados con aneuploidias. Los 8 casos restantes, es decir, el 17,77% correspondieron a otras aneuploidias detalladas en la tabla 1.
Otras aneuploidias fetales diagnosticadas por FISH y cariotipo
| Aneuploidia | Número de casos | Fórmula cromosómica (FISH) | Fórmula cromosómica (cariotipo) |
| Síndrome de Klinefelter | 1 | 47,XXY | 47,XXY |
| Triploidia | 3 | 69,XXX | 69,XXX |
| Síndrome triple X | 1 | 47,XXX | 47,XXX |
| Síndrome de Turner | 1 | 45,X | 45,X |
| Síndrome de Turner mosaico | 2 | 45,X/46,XX,47,XXX | 45,X/46,XX,47,XXX |
| 45,X/46,XXa | 45,X/46,X+mar |
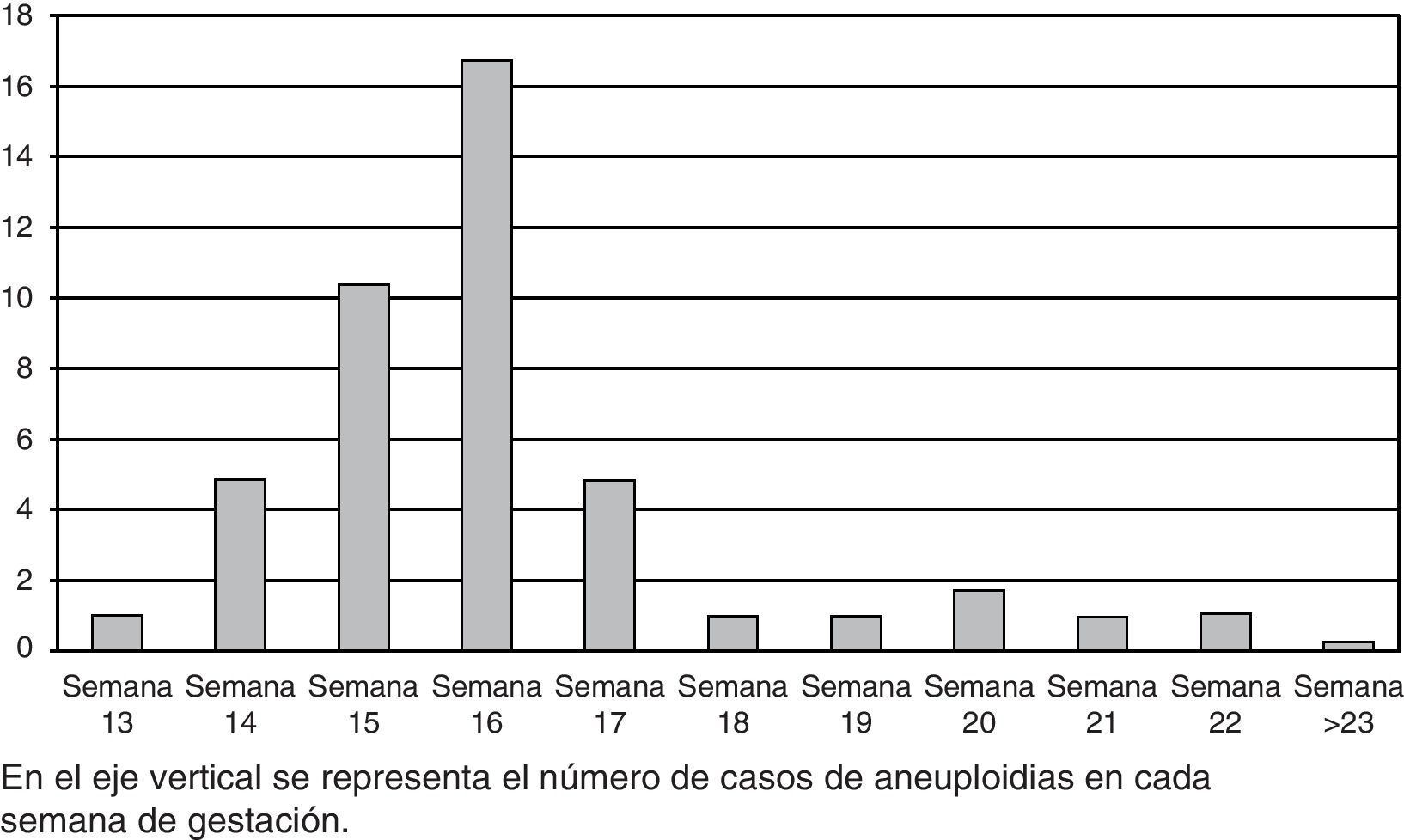
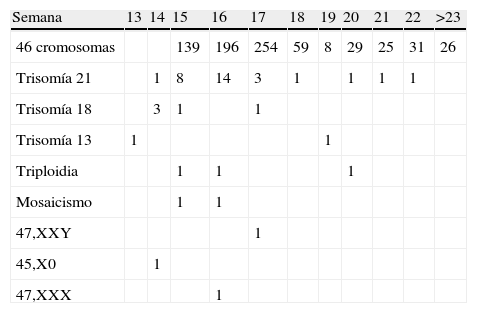
Las causas por las que se les practicó la amniocentesis a las gestantes participantes en el estudio fueron las siguientes: en el 71,37% de los casos por screening bioquímico positivo; en un 19,73% se realizó por criterios ecográficos; en el 6,69% por antecedentes personales (hijo anterior con cromosomopatía) o familiares (familiar afecto de alguna cromosomopatía); y en el 1,21% de los casos fueron criterios mixtos, ecográficos, bioquímicos y/o por antecedentes personales/familiares. No consta el motivo en el 1% de los casos. La amniocentesis fue realizada entre la semana 13 y 36 de gestación, siendo la semana 17 en la que con más frecuencia se ha practicado, en un 31,42%, seguida de la semana 16 en un 26,06%, la semana 15 en el 18,51% y la semana 18 en el 7,42%, disminuyendo la frecuencia en el resto de las semanas (tabla 2). La frecuencia de aneuploidias en relación con la semana de gestación se representa en la figura 1.
Se realizaron un total de 799 cariotipos. No se pudo llevar a cabo en 22 casos porque los cultivos no crecieron, lo que representa el 2,67% del total de las amniocentesis que se practicaron. En estos casos, solo se realizó el FISH. De ellos, en 20 muestras no se detectaron aneuploidias para los cromosomas estudiados mientras que en 2 casos fue el FISH el que puso de manifiesto una trisomía 13 en la semana 13 y una trisomía 21 en la semana 16. En todos los casos en los que se realizó FISH y cariotipado la concordancia fue del 100%.
DiscusiónLa capacidad para la detección de anomalías cromosómicas mediante FISH ha mejorado en los últimos años debido al perfeccionamiento de las sondas cromosómicas específicas10, lo que permite el diagnóstico de aneuploidias de forma más precoz que con las técnicas citogenéticas convencionales como es el cariotipo, permitiendo no solo el diagnóstico de anomalías cromosómicas, sino la posibilidad de anticipar el consejo genético11.
En nuestro trabajo los criterios que con más frecuencia han llevado al estudio citogenético han sido el screening bioquímico positivo seguido del cribado ecográfico. En ambos casos está indicado realizar el método más rápido de que se disponga, así como cuando las anomalías detectadas por ecografía requieran tomar decisiones obstétricas lo más precozmente posible. Hay una urgencia similar cuando la edad de la gestación está llegando al límite legal del aborto terapéutico. Esta situación es muy común tras el screening del suero materno en el segundo trimestre12, si bien el screening combinado de aneuploidias en el primer trimestre aplicado a todas las gestantes independientemente de la edad ha contribuido al descenso del número de pruebas invasivas que hay que realizar en gestantes mayores de 35 años con el consiguiente descenso del número de pérdidas reproductivas como consecuencia de la amniocentesis13.
En nuestra experiencia, la trisomía 21 fue la alteración cromosómica más frecuente. Este dato es concordante con los disponibles en la bibliografía14 demostrando tanto el FISH como el cariotipo ser técnicas con una alta sensibilidad y especificidad para el diagnóstico de trisomía 21 así como de las otras aneuploidias estudiadas, no encontrándose ni falsos positivos ni falsos negativos.
En los casos de mosaicismo en nuestro estudio, el FISH realizado sobre los núcleos en interfase no cultivados ha permitido descartar que se traten de seudomosaicismos, siendo esta técnica más fiable que el diagnóstico realizado por los métodos citogenéticos convencionales; por lo tanto, el FISH es capaz de poner de manifiesto la coexistencia de 2 poblaciones celulares con diferente dotación cromosómica12. Además, el FISH se ha mostrado muy útil en los casos en los que el cariotipo no se ha podido realizar debido a que en el cultivo de los amniocitos no se han obtenido metafases o el número de ellas no han sido suficientes para poder efectuarlo, diagnosticándose solo por FISH una trisomía 13 y otra 21. En todos los demás casos los resultados obtenidos mediante FISH y cariotipo coincidieron al 100%. Por tanto, ambos métodos poseen gran fiabilidad.
Actualmente se están utilizando otras técnicas moleculares como la QF-PCR (reacción en cadena de la polimerasa cuantitativa y fluorescente) que posee una sensibilidad y especificidad similar al FISH y cariotipo para la detección de aneuploidias fetales15,16. Esta técnica utiliza varios marcadores polimórficos por cromosoma, permitiendo una alta fiabilidad, rapidez puesto que los resultados se obtienen en menos de 24h, automatización, lo que permite analizar un gran número de muestras17 y bajo costo. La QF-PCR presenta limitaciones para la detección de mosaicismos de bajo grado18,19, limitación presente en otras técnicas de diagnóstico molecular, aunque sí los reconoce cuando una de las líneas celulares anómalas está presente en al menos un 20% de las células16,17. Otra limitación de esta técnica radica en la dificultad para distinguir sujetos homocigotos o monosómicos cuando se quieren descubrir anormalidades en los cromosomas sexuales. En aquellas muestras de líquido amniótico correspondientes a fetos femeninos XX normales se pueden obtener perfiles homocigotos de QF-PCR, indiferenciables de aquellos producidos con un único cromosoma X, como es el síndrome de Turner, con lo cual existe la posibilidad de confusión en una homocigosis. En ocasiones, se obtienen perfiles alélicos normales y anormales para un mismo cromosoma; en estos casos habría que continuar haciendo otro tipo de estudios, FISH o cariotipo, para identificar las causas por las que esto ocurre20,21. Por tanto, ambos tests, FISH y QF-PCR, muestran una sensibilidad y especificidad elevada. La aplicación de una u otra técnica va a depender de las preferencias de los laboratorios así como del volumen de muestras y de los costes16.
En conclusión, en nuestra experiencia las principales ventajas del FISH son, por un lado, la gran concordancia con el cariotipo, puesto que se han detectado el 100% de las aneuploidias estudiadas. Es un método rápido, los resultados se obtienen en 3 días. Permite detectar la contaminación de la muestra con sangre materna mediante morfología celular con coloración DAPI. Alta fiabilidad en la detección de mosaicismos, debido a la posibilidad de contar un alto número de núcleos celulares. Asimismo, detecta las principales causas de malformaciones fetales debidas a aneuploidias de los cromosomas estudiados.
Por otro lado, esta técnica presenta también limitaciones, puesto que necesita de personal técnico entrenado y facultativos con experiencia en microscopia de fluorescencia y morfología celular. En nuestro laboratorio esto no supone una limitación ya que disponemos de técnicos y facultativos entrenados y también empleamos la tecnología FISH para el estudio de microdelecciones y pintado cromosómico.
Finalmente, aunque el cariotipo sigue siendo el gold estándar en el diagnóstico prenatal de cromosomopatías, consideramos que el FISH es un procedimiento útil en el laboratorio para el despistaje precoz de aneuploidias entre la población gestante de riesgo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.