La dimetilarginina asimétrica (ADMA) se forma como subproducto metabólico del almacenamiento continuo de proteínas en las células del cuerpo. Hace más de una década se propuso que ADMA ejerce efectos biológicos sin inhibir la síntesis de NO. El papel fisiopatológico de ADMA ha sido elucidado según los esfuerzos de colaboración de diferentes grupos de investigación en el mundo. Hoy por hoy, se admite que ADMA puede desempeñar un papel prominente en la patogenia y en la progresión de enfermedades cardiovasculares, específicamente en la aterosclerosis.
La ADMA es un inhibidor competitivo endógeno de la eNOS, descubierto en pacientes con insuficiencia renal. La denominación se debe a que los 2 metilos están unidos a un solo nitrógeno del grupo guanido. ADMA está aumentada en la insuficiencia renal y en otras situaciones patológicas como la hipercolesterolemia, la aterosclerosis y la hipertensión arterial. El aumento en las concentraciones de ADMA supone un importante efecto inhibidor en la enzima. Algunos estudios de intervención indican que la suplementación con arginina mejora la función endotelial en pacientes con enfermedad coronaria.
Asymmetric dimethylarginine (ADMA) is formed as a metabolic byproduct of continuous protein turnover in the cytoplasm of all human cells. For more than a decade it was proposed that ADMA exerted its biological effects by inhibiting the synthesis of NO. The pathophysiological role of ADMA has been clarified in more detail by collaborative efforts of different research groups around the world. Today, it is recognized that the ADMA can play a prominent role in the pathogenesis and progression of cardiovascular diseases, specifically atherosclerosis.
Asymmetrical dimethyl-arginine (ADMA) is a competitive inhibitor of endogenous eNOS, discovered in patients with renal insufficiency. Its name comes from the methyl groups bound to the guanidine nitrogen. ADMA is increased in kidney failure and other pathological situations such as hypercholesterolemia, atherosclerosis and hypertension. The increase in the concentrations of ADMA shows a significant inhibitory effect on the eNOS enzyme. Inhibition can be reduced by increasing the concentration of substrate available. Indeed, some intervention studies indicate that arginine supplements improve endothelial function in patients with coronary heart disease.
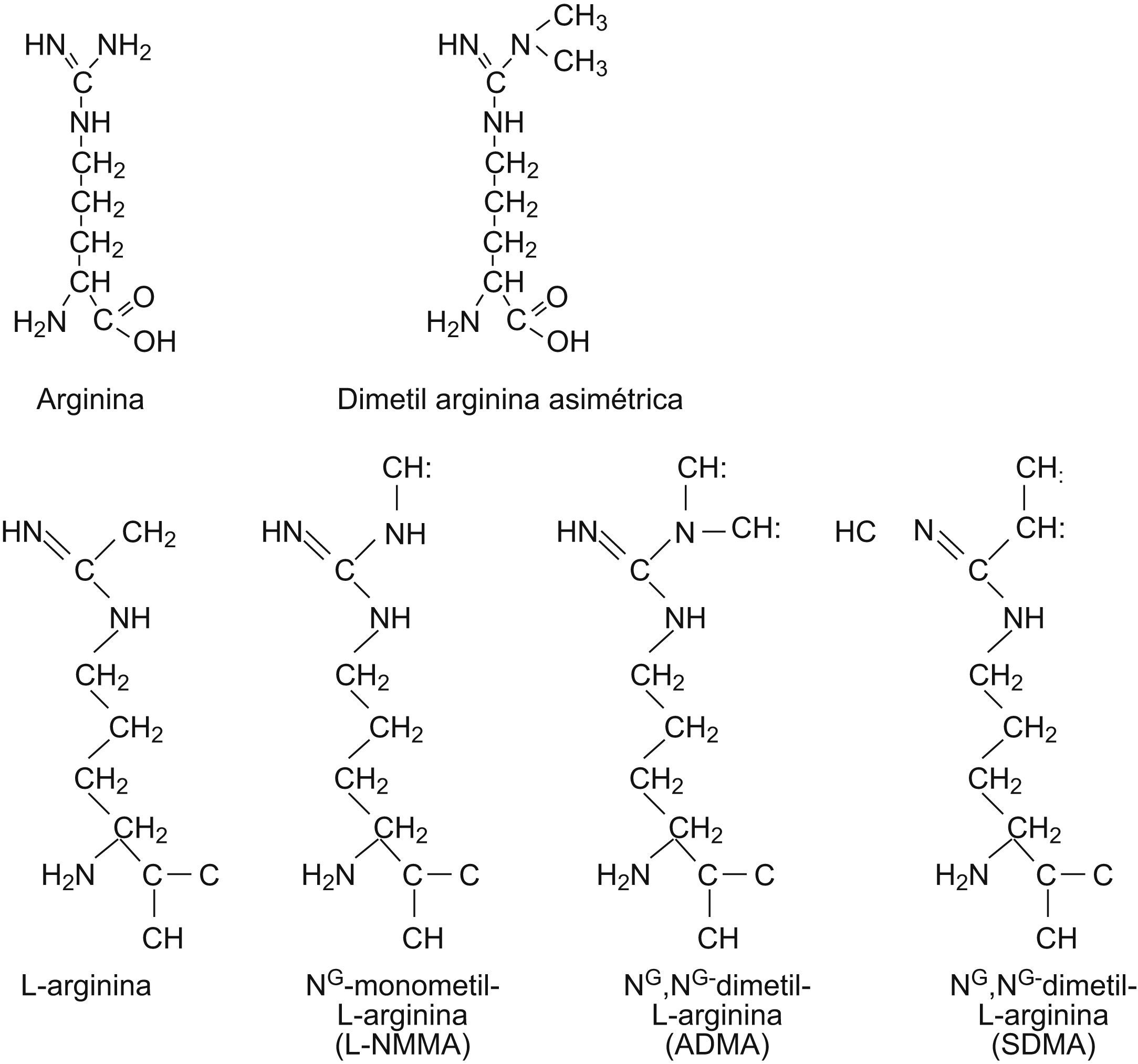
La dimetilarginina asimétrica (ADMA) es una molécula endógena que se puede detectar en sangre y orina. Exhibe homología estructural con el aminoácido L-arginina, y actúa como inhibidor de la síntesis del óxido nítrico (NO). Esta reacción es catalizada por la enzima oxido nítrico sintetasa (NOS). El NO es uno de los mediadores más importantes en la fisiología del organismo y desempeña un papel importante en muchas funciones. En 1992, Vallance et al fueron los primeros en referir las sustancias que muestran homología estructural con la L-arginina pero que se diferencian de ella en que contienen 1 o 2 grupos metílicos y en que pueden actuar como inhibidores de la síntesis de NO1. Estas sustancias, que por consiguiente se han denominado monometil argininas o NMMA (por contener un grupo metílico) o dimetilargininas (que contienen 2 grupos metílicos), están presentes endógenamente en plasma y orina humanas. Los autores citados también mostraron que la ADMA se comportaba como un inhibidor competitivo endógeno de la NOS endotelial en células humanas aisladas in vitro2, y pueden provocar una interrupción de la producción de NO, mientras que la dimetilarginina simétrica del isómero estructural (SDMA) no tenía efecto alguno en la producción de NO (fig. 1).
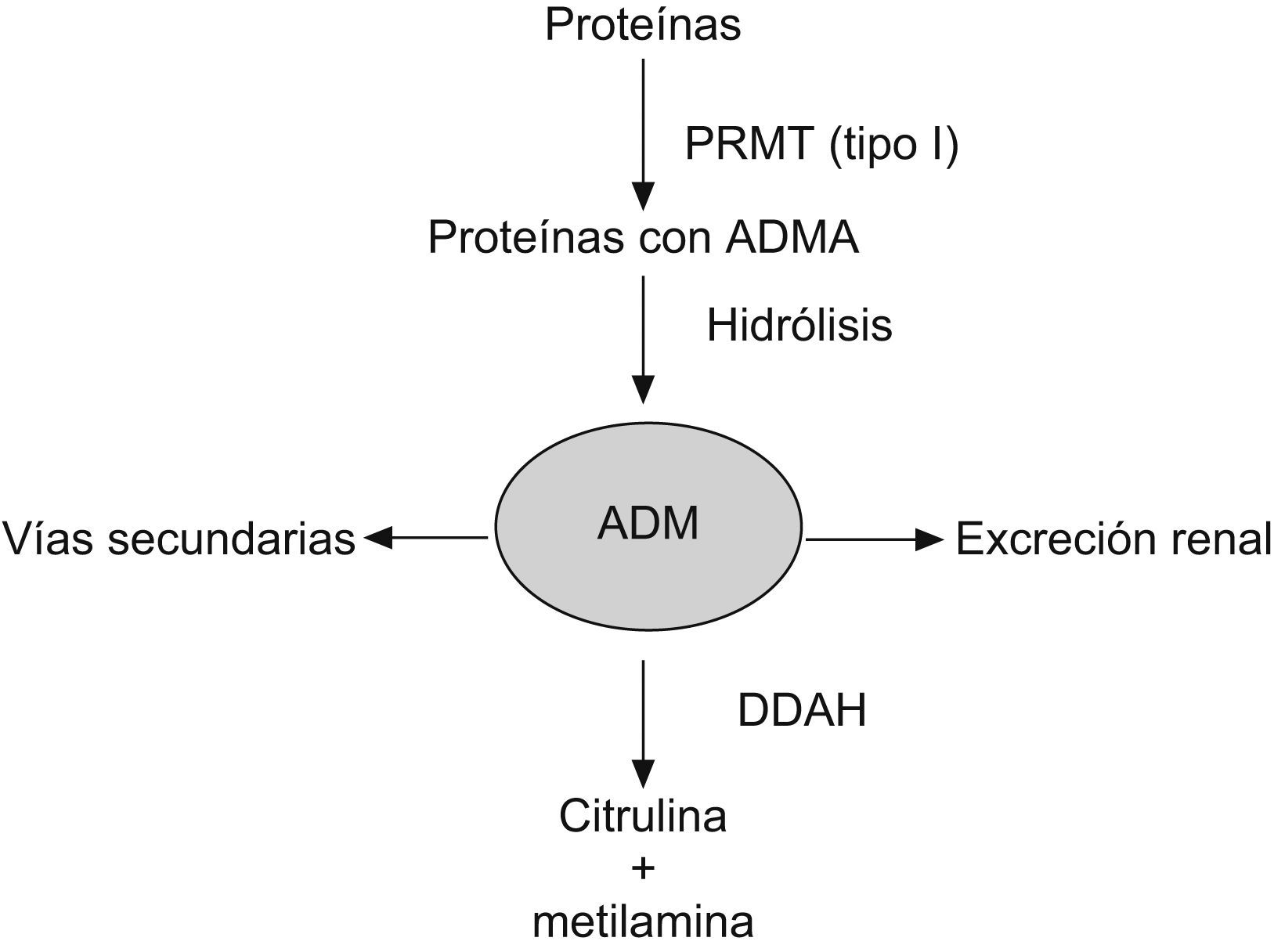
La ADMA procede de la hidrólisis de proteínas nucleares previamente metiladas, implicadas en el procesado y transcripción del ARN. Las enzimas causantes de estas metilaciones se denominan proteinarginina metiltransferasas (PRMT). La PRMT tipo I causa la formación de restos de ADMA mientras que la PRMT tipo II produce una metilación simétrica de los restos de arginina que originarán posteriormente una SDMA (por metilación en distintos restos nitrogenados, en vez de la dimetilación en un solo grupo nitrogenado que caracteriza a la ADMA) que no interfiere con la NOS. Una vez hidrolizadas las proteínas que contienen los restos ADMA, este metabolito puede tener varios destinos (fig. 2)12:
- 1.
Excreción renal.
- 2.
Hidrólisis hasta citrulina y metilaminas. La reacción de hidrólisis está catalizada por la enzima DDAH (dimetilarginina dimetilaminohidrolasa).
- 3.
Otras vías metabólicas secundarias (reacciones de transaminación en el riñón o reacciones de acetilación en el hígado).
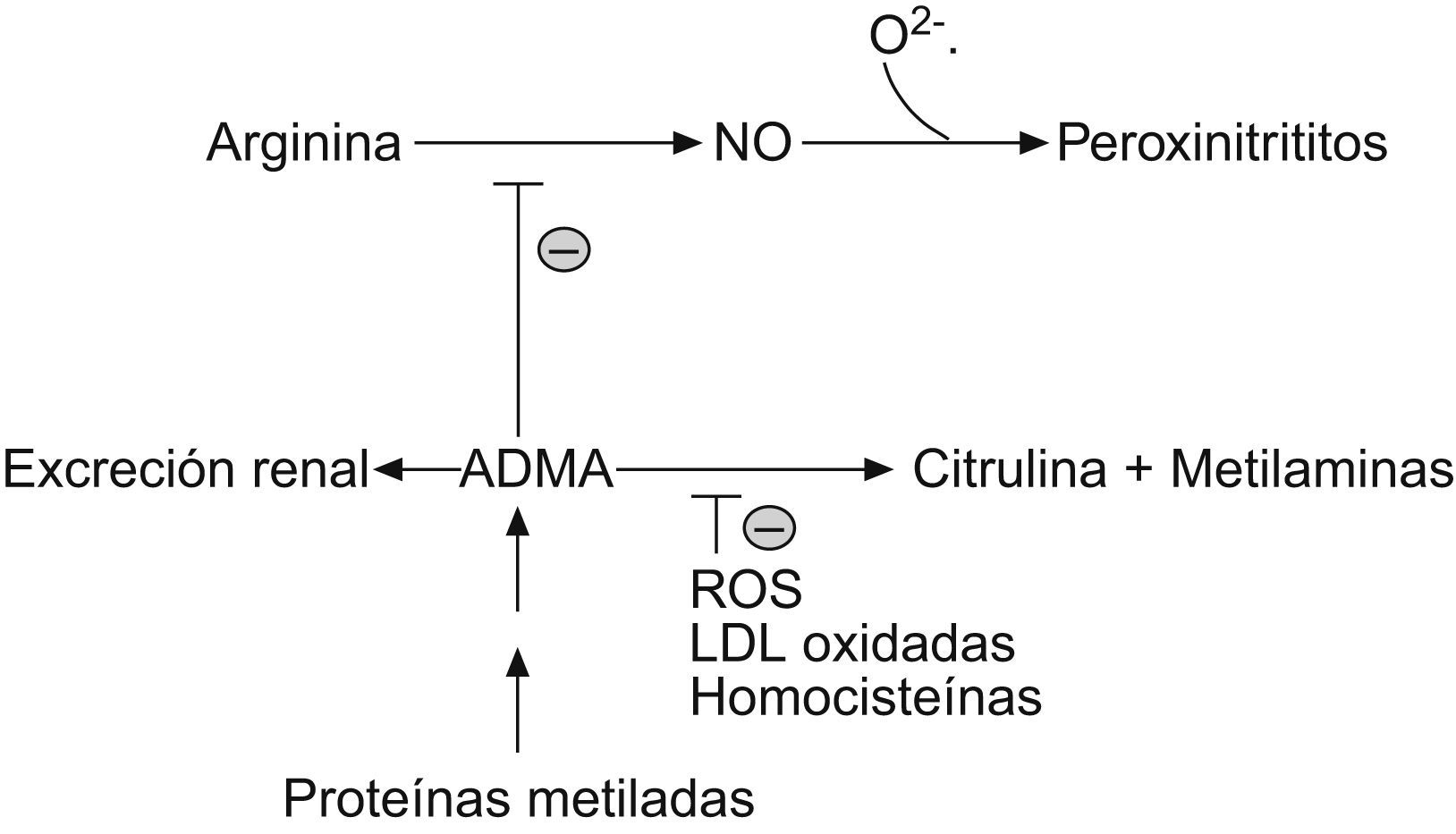
La causa mejor establecida del aumento de las concentraciones plasmáticas del ADMA es la insuficiencia renal. Además, este metabolito puede aumentar por la inhibición de la enzima causante de su catabolismo: la DDAH. Esta inhibición puede ser originada, en general, por las especies reactivas de oxígeno, especialmente por las lipopoteínas de baja densidad (LDL) oxidadas3.
También se ha demostrado el efecto inhibidor de la homocisteína4. Conviene señalar que las concentraciones endoteliales de óxido nítrico no disminuyen solamente a causa de la disminución de su síntesis: como ocurre en el proceso aterosclerótico, la producción excesiva del radical superóxido hace que esta molécula reaccione con el NO, disminuyendo su concentración y originando una especie oxidativa muy reactiva denominada peroxinitrito (fig. 3)5.
Estudios experimentales en varios laboratorios de todo el mundo han demostrado que la ADMA no inhibe la producción de NO in vitro para un intervalo de concentraciones mensurable en el plasma de pacientes con enfermedades cardiovasculares o metabólicas3–5. En los macrófagos humanos cultivados (que expresan la isoforma inducible de NOS), la ADMA no inhibe la producción de NO en modo dependiente de la concentración2. Por otra parte, los experimentos con las isoformas aisladas, purificadas, de NOS in vitro6 así como los estudios clínicos en pacientes con concentraciones plasmáticas variables de esta sustancia también demostraron que ADMA dependiente de la concentración no siempre inhibe la producción de NO7–9.
Síntesis de ADMALas dimetilargininas se forman durante la proteólisis de las proteínas metiladas. La metilación de proteínas es un mecanismo de modificación postraslacional de proteínas que produce cambios en la estructura terciaria y en la función de las proteínas. Este proceso es catalizado por un grupo de enzimas denominadas S-adenosilmetionina N-metiltransferasas (proteinmetilasas I y II)10. El nombre complejo de estas enzimas sugiere su función molecular: transfieren uno o más grupos metilo desde la S-adenosilmetionina, donadora de grupos metilo, a residuos de L-arginina dentro de proteínas o péptidos.
Dependiendo del número de grupos metilo transferidos se obtienen unos u otros derivados arginínicos: NG-monometil-L-arginina y NG,NG-dimetil-L-arginina (ADMA) se forman por la actividad de la proteína metilasa I, mientras que la NG,NG-L-arginina (SDMA) se forma por la actividad de la proteína metilasa II. La ADMA circulante libre y la SDMA son liberadas después de la degradación de tales residuos de proteína metilada.
Los grupos metilo contenidos en las dimetil argininas se derivan, pues, del grupo metilo disponible de la S-adenosilmetionina donadora, que es un intermediario en el metabolismo de la homocisteína. Está experimentalmente probado que, cuando las células endoteliales humanas se incuban con S-[14C]-adenosilmetionina marcada radiactivamente, parte de la radiactividad puede ser detectada dentro del ADMA sintetizado de nuevo11. Este descubrimiento puede explicar el mecanismo por el que la homocisteína deteriora la función endotelial en animales y humanos.
Papel fisiopatológico de la ADMALas enfermedades cardiovasculares son la principal causa de muerte en EE.UU. y en los países de Europa occidental. Los factores de riesgo cardiovascular tradicionales como la hipercolesterolemia, la hipertensión, el tabaquismo y la diabetes mellitus pueden explicar el 80% de los accidentes coronarios que ocurren en la población de estos países. Sin embargo, estos factores no pueden explicar las tasas de accidentes coronarios extraordinariamente altas que se registran, por ejemplo, en los pacientes en hemodiálisis12.
La intensa investigación en los mecanismos celulares y moleculares relacionados con la aterogénesis condujo a la comprensión de que el endotelio vascular desempeña un papel crucial para los cambios funcionales tempranos en la pared celular, que inician y promueven el proceso aterosclerótico.
Hay numerosos datos experimentales que muestran que el endotelio vascular desempeña un papel central en el mantenimiento del tono vascular fisiológico y en la estructura vascular13. Uno de los principales mediadores liberados por las células del endotelio sano es el NO14. El NO se forma por acción de la NOS a partir del aminoácido precursor L-arginina. El NO esta relacionado con un gran número de procesos reguladores del sistema cardiovascular. Su potente efecto vasodilatador ha sido ampliamente demostrado, y tal conocimiento condujo en las década de 1980 al descubrimiento de un factor relajante derivado del endotelio (EDRF)15.
Además de sus potentes efectos vasodilatadores, el NO actúa como un inhibidor endógeno de la agregación plaquetaria. Inhibe la adhesión de monocitos y leucocitos al endotelio vascular sano, y subsiguientemente la formación de placas. (De hecho, la inhibición de la proliferación de las células musculares blandas vasculares podría ser de mayor importancia durante el desarrollo de reestenosis después de la angioplastia.) El NO reduce la liberación vascular de radicales superóxido (O2−), que están relacionados con procesos inflamatorios y citotóxicos, e inhibe la oxidación de las LDL. Estas acciones saludables del NO en el sistema vascular han conducido a su denominación como una molécula antiaterogénica endógena16.
Importancia clínica de la ADMALas NOS catalizan la oxidación de uno de los 2 nitrógenos guanidínicos equivalentes de la L-arginina para producir NO y L-citrulina (otros sustratos requeridos son el oxígeno molecular y el NADPH).
En condiciones experimentales que conducen a concentraciones de L-arginina subóptimas o a una deficiencia relativa de cofactores esenciales para la NOS, la actividad de esta enzima es incompleta (es decir, la oxidación de la L-arginina a NO es incompleta)17–19.
En condiciones normales, la formación de NO se produce en 2 pasos; empieza con la oxidación de 5 electrones de la L-arginina, 2 de los cuales son provistos por el NADPH para producir NG-hidroxi-L-arginina, seguida de una oxidación de 3 electrones del nitrógeno hidroxilado para formar NO. Los 5 electrones cedidos por el nitrógeno guanidinio de la L-arginina se transfieren, en una reacción redox, a los 2 dominios de NOS de origen molecular.
Bajo condiciones subóptimas como las indicadas anteriormente el flujo de electrones dentro de los 2 dominios de la NOS está distorsionado, y el oxígeno molecular actúa como un aceptor de electrones para producir radical superoxido (O2−)20.
Las células humanas cultivadas producen O2− en presencia de ADMA. Esto conduce a la hipótesis de que el ADMA puede interrumpir la actividad productora de NO a través de NOS: la enzima incompleta da lugar a una aceleración de la actividad enzimática de NO a O2−. Esto conducirá a la activación de factores de transcripción redox-sensibles, a la sobrerregulación subsiguiente de moléculas de adhesión endotelial, y además a la adhesión aumentada de monocitos a la línea vascular, que es un paso temprano en la iniciación y progresión de la aterosclerosis21.
En condiciones experimentales, la expresión de moléculas de adhesión es sobrerregulada y la adhesión de leucocitos está aumentada en células humanas cultivadas en presencia de altas concentraciones de ADMA. Un fenómeno similar puede ser observado cuando los monocitos son aislados de sangre periférica de pacientes con factores de riesgo cardiovascular y coincubados con células endoteliales humanas cultivadas. De hecho, los monocitos de pacientes hipercolesterolémicos se adhieren más fuertemente al endotelio que los monocitos de controles normocolesterolémicos. En este contexto, es interesante señalar que la hiperadhesividad de los monocitos en sujetos hipercolesterolémicos puede ser normalizada por la L-arginina suplementada22. Esto también apunta a favor de un desplazamiento competitivo de L-arginina endógena (por el ADMA) como causa de estos cambios fisiopatológicos.
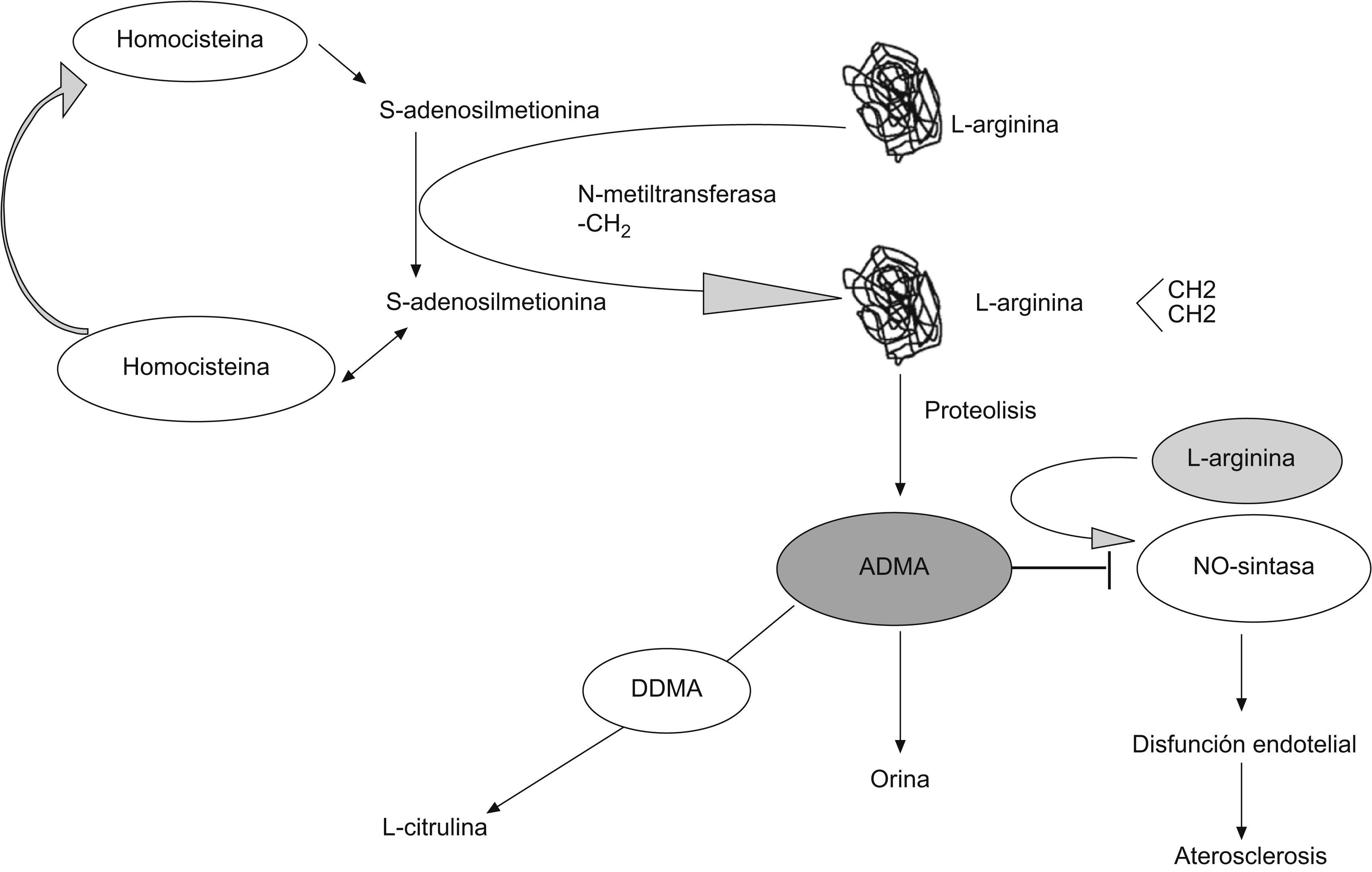
Regulación de las concentraciones de ADMA en sangreLa ADMA se forma en el citoplasma y puede ser liberado al espacio extracelular y al plasma sanguíneo. Existen evidencias de que ADMA actúa como un regulador autocrino de la actividad NOS (dentro de la misma célula en la que se forma, a diferencia de las hormonas, que actúan sobre células diferentes de las que las han formado) y de que, en presencia de colesterol LDL nativo u oxidado, su liberación está aumentada significativamente11. Los valores de ADMA elevados pueden ser la causa de parte de la acción deletérea del colesterol unido a LDL (cLDL) en la función celular endotelial. Tanto la ADMA como la SDMA, son excretados por la orina. En su primer informe sobre el ADMA como inhibidor endógeno de la síntesis de NO2, Vallance et al ya mostraron que los valores de ADMA están significativamente aumentados en pacientes con enfermedad renal en el último estadio. Varios grupos de investigadores, de forma independiente, confirmaron que los valores de ADMA y SDMA están aumentados en el fallo renal crónico. Aunque en la mayoría de los estudios se sugiere que el ADMA puede ser excretado por diferentes vías metabólicas, la excreción renal es el único camino metabólico de eliminación del ADMA (fig. 4)23,24.
Biosíntesis y metabolismo de la dimetilarginina asimétrica (ADMA) en el organismo23.
La ADMA, pero no la SDMA, se metaboliza por un enzima denominado DDAH para producir L-citrulina y dimetilamina25. La inhibición farmacológica de DDAH produce una constricción, dependiente de la concentración, de segmentos arteriales aislados in vitro, que puede ser revertida por exceso de L-arginina26. Este descubrimiento ha conducido a pensar que la regulación de los valores de ADMA alcanzados por los cambios en la actividad de la DDAH pueden conducir a cambios en la producción de NO.
La actividad del DDAH, que media la degradación metabólica de ADMA, parece conducir a mecanismos reguladores complejos que no han sido completamente elucidados. El estrés oxidativo conduce a actividad DDAH reducida. Esto se mostró no sólo en células endoteliales cultivadas, sino también en tejidos homogéneos de aorta, riñones e hígado de conejos hipercolesterolemicos27. La homocisteína, un factor de riesgo cardiovascular conocido, aumenta la concentración de ADMA, lo que da lugar a una infrarregulación redox-inducida de la actividad de DDAH por la homocisteína28, o alternativamente a la metilación aumentada de los residuos de L-arginina, y subsiguientemente a la liberación aumentada de ADMA11. Estos datos permiten concluir que la ADMA se forma durante la metilación de proteínas y se libera continuamente al espacio extracelular después de la liberación de las proteínas, durante el turnover fisiológico de proteínas. Su acumulación en el organismo se previene en humanos sanos por la excreción renal, por un lado, y por la degradación metabólica por ADMA, por otro. Cambios en la función excretora renal o cambios en la actividad DDAH, como los que pueden ser inducidos por los factores de riesgo cardiovascular, conducen a valores de ADMA elevados en diversas enfermedades metabólicas y cardiovasculares.
Métodos de determinación de ADMALos primeros métodos que se establecieron para medir ADMA se basaron en la cromatografía líquida de alta resolución (HPLC), que permite la separación cromatográfica de los dos isómeros ADMA y SDMA (estructuralmente muy similares, pero funcionalmente muy diferentes)29.
Estos métodos presentaban la desventaja de una preparación de muestras laboriosa, que limitaba el número de determinaciones/día y hacía necesario la aplicación de recursos personales y económicos no siempre disponibles.
Más prometedora parecía la más reciente introducción en los laboratorios hospitalarios de métodos cromatográficos asociados a la espectrometría de masas (por ejemplo LC-MS, LCMS/MS o GC-MS), pero la experiencia no ha sido significativamente mejor.
Sin embargo, y afortunadamente, en los últimos años se ha desarrollado un inmunoensayo de fácil realización que ha sido validado para la determinación de ADMA en plasma o suero humano30: un ADMA-ELISA. Este ensayo permite procesar grandes series de muestras en períodos relativamente cortos, en la rutina clínica, y presenta las ventajas de costes de personal drásticamente reducidos. Es realizable en cualquier laboratorio clínico en que se disponga de un lector de placas microtitter ELISA estándar y posee la garantía de una buena correlación de resultados con los obtenidos por las metodologías GS-MS y LCMS (el ensayo ha sido validado para su uso experimental en plasma de rata y ratón, así como en sobrenadantes de cultivos celulares). Las reactividades cruzadas con los análogos de la L-arginina presentes en el plasma o suero son insignificantes (L-NMA 1%, SDMA 1,2%, L-arginina<0,02%). Además, este ELISA tiene un rango de linealidad entre 0,1 y 3μmol/l en plasma y suero humano y cubre el rango total de concentraciones fisiológicas y fisiopatológicas. Actualmente, el ADMA-ELISA se usa en cohortes de pacientes de grandes estudios clínicos controlados.
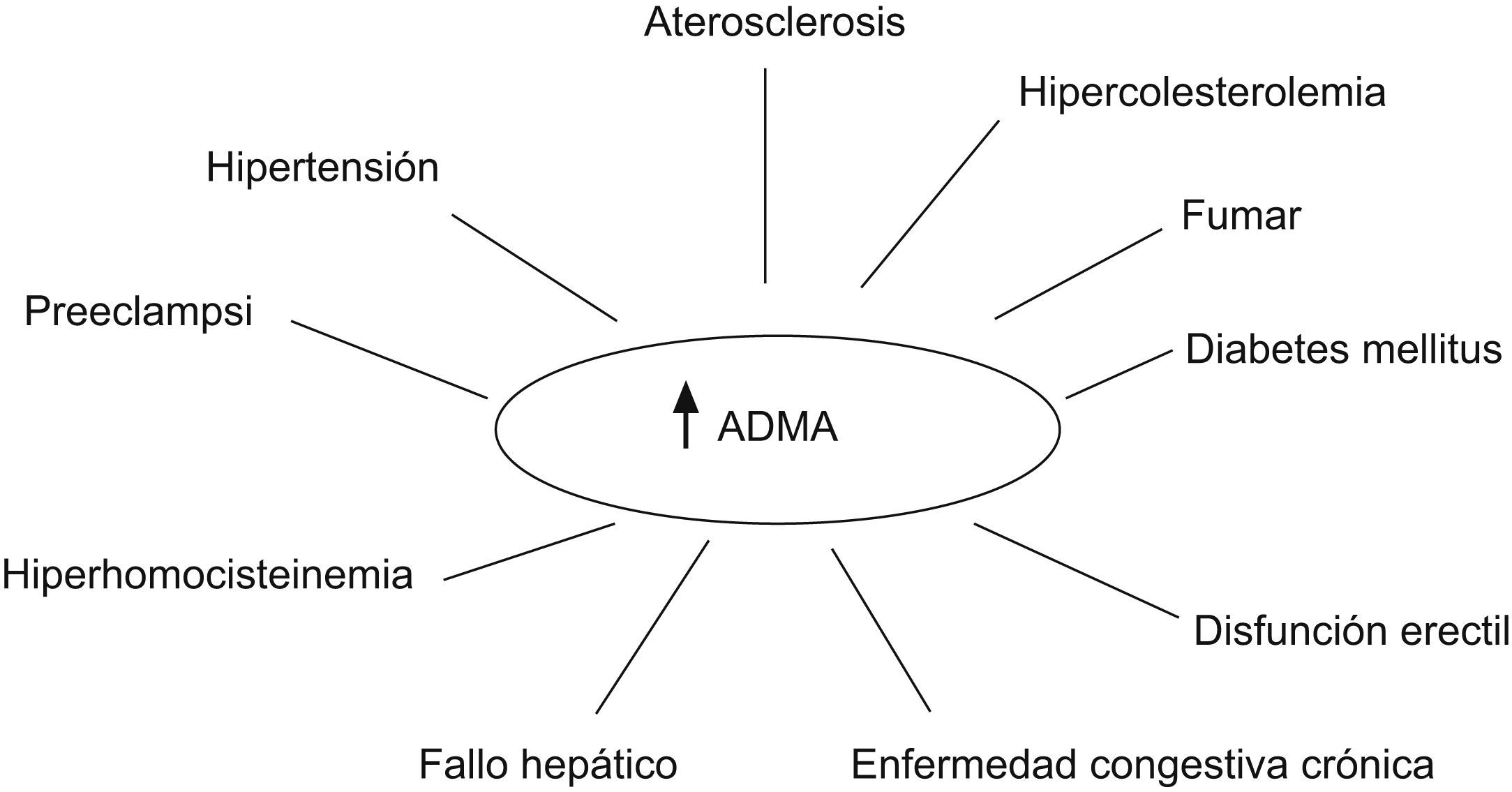
Relevancia clínica de la determinación de valores de ADMAEl papel clínico de ADMA como marcador del riesgo cardiovascular es deducible del gran aumento de los estudios que han demostrado la presencia de una relación estadísticamente significativa e independiente entre ADMA y la incidencia de presentar acontecimientos cardiovasculares adversos o la muerte31. En el cuadro se han destacado diferentes enfermedades en las cuales la elevación de ADMA puede desempeñar un papel fisiopatológico importante (fig. 5).
Con la disponibilidad del ADMA®-ELISA competitivo (un método que, como se ha dicho, está validado y es sencillo, rápido, específico y fácilmente disponible), se tiene la posibilidad de obtener, con la cuantificación de los valores de ADMA en suero o plasma de un paciente dado, más evidencias de riesgo que la información conseguida por los marcadores tradicionales y, por tanto, conseguir un acercamiento terapéutico más específico.
La ADMA como marcador de disfunción endotelialEn los animales experimentales, los valores de ADMA comienzan a aumentar muy rápidamente después de la inducción de la hipercolesterolemia en la dieta. A su vez, las lesiones ateroscleróticas pueden ser detectadas macroscópicamente. De modo similar, en sujetos humanos clínicamente sanos, con hipercolesterolemia aislada y otros factores de riesgo cardiovascular, se han encontrado valores en plasma de ADMA elevados8,32.
Estos datos sugieren que el ADMA es un marcador temprano de las etapas iniciales de aterogénesis, lo cual puede ser útil para conocer el riesgo cardiovascular total de un paciente tras la información generada por los factores de riesgo tradicionales. Volviendo a resultados de experimentación animal, se ha observado, en conejos alimentados con alto contenido en colesterol, que los niveles elevados de ADMA se correlacionan con el espesor de la íntima en la arteria carótida, lo que es visto como un útil marcador para la progresión de la aterosclerosis en este modelo animal33.
De hecho, también en humanos, el espesor de la intima media en la arteria carótida medido por ultrosonografía puede ser adoptado como una medida de la progresión de la aterosclerosis. En un estudio clínico en pacientes con fallo renal en la última etapa, se ha observado una relación estadísticamente significativa entre los valores de ADMA y el espesor de la intima media. En este estudio, el ADMA fue el factor pronóstico con mayor poder predictivo para el espesor de la intima, entre todos los factores evaluados34.
La explicación puede buscarse en que los valores de ADMA elevados se asocian con la producción de NO sistémico reducido, una excreción urinaria reducida de los metabolitos de NO estables, nitrito y nitrato en orina, y una vasodilatación dependiente del endotelio insuficiente7,8.
Estos estudios sugieren seriamente que el ADMA es un marcador de la disfunción endotelial en humanos. La observación de la disfunción endotelial en un paciente dado es vista por muchos cardiólogos como un indicador de un elevado riesgo cardiovascular de accidentes cardiovasculares graves o de muerte. Esta conclusión ha sido referida desde varios estudios clínicos prospectivos, que señalan que los pacientes con disfunción endotelial (valorada como vasoconstricción en respuesta a la infusión intraarterial de acetilcolina o como vasodilatación inducida de flujo insuficiente en la arterial braquial) tienen un riesgo de experimentar accidentes cardiovasculares o muerte, significativamente mayor que el de pacientes con endotelio funcionalmente intacto (determinada como vasodilatación en respuesta a acetilcolina intraarterial o como vasodilatación inducida de flujo), dentro del rango de grupo control sano35,36.
Como el ADMA deteriora directamente la fisiología (funciones dependientes de NO de línea endotelial), su mecanismo fisiológico primario de acción resulta diferente de todos los otros factores de riesgo conocidos: hipertensión (presión de sobrecarga de la pared arterial, elasticidad arterial reducida), hipercolesterolemia (descarga de LDL oxidado en la capa de la íntima, generación de células de grasa e inflamación local), tabaquismo (inducción y potenciación del daño oxidativo de las estructuras celulares dentro de la pared arterial), etc.
En consecuencia, puede esperarse que los efectos de ADMA sean independientes de otros factores de riesgo y añadidos a sus efectos. Sin embargo, se han comunicado dependencias entre ADMA e hipertensión o tabaquismo37.
ADMA como factor de riesgo cardiovascularLa relación establecida entre la concentración de ADMA elevada y la disfunción endotelial, así como la posible relación entre los valores de ADMA elevados y la incidencia de accidentes cardiovasculares principales, han llevado a que varios grupos de investigación hayan estudiado la asociación entre ADMA elevado y muerte de cualquier causa.
En uno de los estudios38, en que se determinaron valores plasmáticos de ADMA en 116 humanos sanos que no tenían signos de enfermedad coronaria o periférica, se encontró: a) una relación significativa entre la concentración de ADMA y parámetros como edad, presión sanguínea arterial media y tolerancia a la glucosa, y b) a través de análisis de regresión multivariante, una relación significativa entre el ADMA y el espesor de la intima-media de la arteria carótida. De este estudio, los autores concluyeron que el ADMA es un marcador de enfermedad cardiovascular.
En otro estudio simultáneo39, un estudio clínico prospectivo, los valores de ADMA en plasma y otros marcadores de riesgo cardiovascular fueron determinados en 225 pacientes con fallo renal final o terminal. Después de una media de seguimiento de 33,4 meses, durante la que tanto los accidentes cardiovasculares graves como los fallecimientos fueron evaluados por un comité independiente, se detectaron 120 accidentes cardiovasculares (fatales y no fatales) y 83 muertes (53, de causa cardiovascular). En un análisis de regresión de Cox multivariante, solamente ADMA y edad resultaron significativamente predictivas, independientemente de la incidencia de episodios cardiovasculares (como angina de pecho e infarto) y muerte de cualquier causa. Los pacientes cuya concentración de ADMA en plasma estuvo por encima del percentil 75 tenían un riesgo tres veces más elevado de experimentar un episodio cardiovascular adverso comparado con los pacientes cuyos valores iniciales de ADMA estaban por debajo de la mediana.
Otro grupo de investigadores de los Países Bajos estudió la supervivencia de pacientes que estaban sometidos a tratamiento en una Unidad de Cuidados Intensivos e identificaron nuevos factores predictivos de supervivencia durante el tratamiento en la UCI40. Entre todos los marcadores bioquímicos de función de órganos y enfermedad que fueron medidos en este estudio, el ADMA fue el factor con mayor poder predictivo. Los pacientes con valores de ADMA elevados tenían un riesgo 17 veces mayor de fatalidad durante el tratamiento en UCI.
En la actualidad, se están realizando numerosos estudios de casos y controles, y ensayos clínicos prospectivos con una gran variedad de poblaciones de pacientes, al objeto de contribuir a una mayor comprensión del papel de ADMA como un factor de riesgo independiente para la enfermedad cardiovascular y la mortalidad. Los datos generados en estos estudios ayudarán a determinar el papel del ADMA como un factor de riesgo y a explorar su papel diagnóstico en diferentes enfermedades.
Consecuencias terapéuticas de las concentraciones de ADMA elevadasSegún el conocimiento adquirido durante los últimos años del papel fisiopatológico del ADMA en el desarrollo de enfermedades cardiovasculares, puede afirmarse que esta molécula puede ser utilizada como una nueva herramienta para la intervención terapéutica. Se ha demostrado que el ADMA induce la disfunción endotelial no sólo en pacientes con enfermedades cardiovasculares o metabólicas sino en los de edad alta en general41.
La opción más obvia para antagonizar los efectos de ADMA en el endotelio es el suplemento de L-arginina en la dieta. El ADMA compite con la L-arginina por la unión a la NO sintetasa, y la acción inhibitoria de ADMA sobre la actividad de esta enzima puede ser revertida por la L-arginina7,22,42. La relación de las concentraciones de L-arginina frente a ADMA determina la actividad de la NO sintetasa. Esto significa que niveles elevados de ADMA producen una relativa deficiencia de L-arginina funcional, incluso en presencia de valores plasmáticos de arginina dentro del intervalo normal. La suplementación dietética dirigida conduce a una elevación en los niveles en plasma de arginina que normalizan la proporción de L-arginina a ADMA en presencia de valores de ADMA elevados.
La capacidad de la L-arginina exógena para mejorar la función vascular, estructura vascular y curso clínico de las enfermedades cardiovasculares, ha sido probada por una gran cantidad de estudios experimentales y clínicos40–44. Estos estudios mostraron que la L-arginina no sólo mejora la función endotelial en poblaciones de pacientes caracterizados por niveles de ADMA elevados, sino que también reduce los síntomas clínicos de la enfermedad cardiovascular establecida43–47. La eficacia clínica de esta estrategia preventiva está siendo investigada en ensayos clínicos. Sin embargo, esta estrategia no está basada en la intervención farmacoterapéutica en el sentido clásico, sino que es una estrategia nutricional que ayuda a mantener las funciones fisiológicas de NO endógeno en etapas muy tempranas (p. ej., en prevención primaria). Cuando los niveles de ADMA elevados se encuentran en pacientes que ya presentan una enfermedad cardiovascular, la suplementación dietética de L-arginina puede tener también un papel en la prevención secundaria. Algunos estudios clínicos han demostrado que las estatinas, medicamentos usados en principio para la disminución del cLDL, ejercen muchos de sus efectos beneficiosos al mejorar también la función endotelial. Estos efectos varían de acuerdo a la concentración de ADMA de los pacientes.
Los datos experimentales han demostrado que las estatinas sobrerregulan la expresión del gen de la NOS endotelial. En pacientes con valores de ADMA elevados, la NOS no ejerce su función esperada, ya que su actividad está bloqueada48,49. Un estudio clínico aleatorizado ha demostrado por primera vez que en pacientes con concentraciones de ADMA elevadas, las estatinas sólo mejoran la vasodilatación dependiente del endotelio cuando se administran concomitantemente con la L-arginina en la dieta50.
Se ha demostrado que el tratamiento con inhibidores de la enzima angiotensina convertasa o con bloqueadores del receptor de la angiotensina conducen a una pequeña pero significativa reducción de los niveles de ADMA circulantes51. Sin embargo, la relevancia clínica del hallazgo de los efectos terapéuticos de estos medicamentos no está todavía clara. Puede especularse que la combinación de estos medicamentos con suplementos de L-arginina podría también aumentar sus efectos beneficiosos en el endotelio vascular. Otros grupos de medicamentos que reducen los valores de ADMA circulantes son los usados para el tratamiento de pacientes diabéticos tipo II, metiformina y rosiglitazona, y los estrógenos52,53. Aún no se han descubierto las posibles sustancias que ejercen su acción principal interfiriendo con el metabolismo de ADMA.