El cáncer escamoso de cabeza y cuello se caracteriza por su tendencia a la invasión local y a distancia, además de una alta predisposición a la aparición de segundas neoplasias. El proceso de invasión y metástasis es complejo y tiene múltiples etapas. Las metaloproteinasas de matriz 2 y 9, se sobreexpresan en el cáncer escamoso de cabeza y cuello donde actúan degradando la membrana extracelular favoreciendo así la invasión tumoral y la metástasis. El bacilo de Calmette-Guérin (BCG) ha sido usado como inmunomodulador en el tratamiento de algunos tipos de cáncer con buenos resultados. El propósito de este estudio es determinar el efecto de la activación inmune mediada por el BCG sobre la migración e invasión usando un modelo in vitro 3D de cultivos de células tumorales de faringe cocultivadas con células mononucleares de sangre periférica en contacto o no con el BCG. Para determinar la expresión de las metaloproteinasas y p53 se realizó Western blot y para la migración e invasión, kits comerciales. Los resultados muestran disminución en la expresión de metaloproteinasas, p53 y en la migración en el grupo BCG.
Head and neck squamous cell carcinoma is characterized by local invasion and a propensity for dissemination to cervical lymph nodes and recurrence. Cancer cell invasion and metastasis represent complex, multistep process. The remodelling of ECM by MMPs is one of the most crucial steps for cancer progression. MMP-2 and MMP-9, are over expressed in head and neck squamous cell carcinoma where they act to degrade the basement membrane thus promoting tumor invasion and metastasis. Bacillus Calmette-Guérin (BCG) has been used as an immunomodulator in treating some cancers with good results. The purpose of this study is to determine the effect of BCG immune activation in migration and metastasis using in vitro 3D cultures pharyngeal tumor cells were co-cultured with previously isolated peripheral blood mononuclear cells, in experimental groups or cultured alone. MMPs and p53 was determinate by Western blot and the invasion-migration using commercial assays. Our results showed decreasing expression of MMPs, p53 and significantly reduced migration in BGC group.
El cáncer escamoso de cabeza y cuello (CECC) es la sexta neoplasia más frecuente a nivel mundial, en España son diagnosticados entre 12000 y 14000 casos nuevos cada año1. Más del 50 por ciento de estos pacientes presenta una enfermedad localmente avanzada con elevada tendencia a las metástasis, las recidivas y la aparición de segundas neoplasias2.
El proceso invasivo tumoral se acompaña de una pérdida progresiva de la homeostasis local y una alteración de la arquitectura tisular. Las células tumorales inducen profundas alteraciones, tanto en las células estromales como en la matriz extracelular a través de varios mecanismos, entre los que se encuentra la secreción de diferentes moléculas, destacando las metaloproteinasas de matriz (MMP). Estudios realizados in vitro e in vivo resaltan que el remodelado de la matriz extracelular por MMP es uno de los pasos cruciales para la progresión del cáncer y que las MMP 2 y 9 son enzimas clave en este proceso, debido a que degradan el colágeno tipo IV, que es el componente estructural más importante de las membranas basales3. La sobreexpresión de estas MMP ha sido observada en el CECC4, lo que ha llevado a considerarlas un blanco terapéutico.
Las MMP están estrechamente reguladas en su transcripción, secreción, activación e inhibición por diversos estímulos, como citoquinas, factores de crecimiento, agentes químicos, estrés oxidativo, el gen p53 e interacciones con la matriz extracelular5.
La inmunoterapia es un tratamiento que mediante la manipulación, activación o estimulación del sistema inmune, se emplea en el tratamiento de distintas enfermedades, entre ellas el cáncer. El bacilo de Calmette-Guérin (BCG) es un modulador de la respuesta biológica ampliamente aceptado en el tratamiento del cáncer superficial de vejiga y el melanoma, donde actúa promoviendo la activación inmunológica y la liberación de mediadores antitumorales6, los cuales actúan como reguladores de la transcripción, secreción, activación e inhibición de las MMP, por tanto, el propósito de este estudio es estudiar el efecto del tratamiento con BCG sobre la proliferación, invasión y migración tumoral en un modelo in vitro 3D de CECC.
MétodosCultivo de células de carcinoma escamoso de faringeLas células tumorales de faringe FaDu, se obtuvieron comercialmente en ATCC (Manassas, EE. UU.), criopreservadas a una concentración de 4,5×106 células/ampolla. Las células se cultivaron siguiendo las instrucciones de la casa comercial en Eagle's Minimun Essential Medium ATCC-formulated específico para estas células, al cual se le adicionó: suero bovino fetal 10% y penicilina-estreptomicina 1% (Lonza). Los cultivos de FaDu se usaron entre el segundo y sexto pase. Para obtener cultivos 3D se realizó la siembra de las células tumorales sobre una placa tratada previamente durante 30 minutos con 200μl de Matrigel™ (BD Biosciences), consistente en una membrana basal solubilizada compuesta de: laminina (componente principal), colágeno IV, proteoglicanos, heparán sulfato, y entactin/nidogen; creándose una capa gelatinosa en la que el tumor crece de forma similar a la que lo hace in vivo.
Obtención y cultivo de células mononucleares de sangre periféricaLas células mononucleares se obtuvieron a partir de la sangre de donantes sanos, previo consentimiento informado del paciente. Las células mononucleares (PBMC, Peripheral Blood Mononuclear Cells) se aislaron mediante un gradiente de Ficoll-paque® siguiendo las indicaciones del fabricante.). El pellet resultante fue resuspendido en medio RPMI (Lonza) suplementado con 10% de suero bovino fetal, 100 IU/ml penicilina y 0,1mg/ml de estreptomicina. Las PBMC se cultivaron a una densidad de 2,5×105 cel/ml.
Bacilo de Calmette-GuérinLa vacuna del BCG Oncotice® (MERCK SHARP & DOHME) se obtuvo comercialmente. La presentación es en polvo liofilizado para instilación intravesical que contiene 2-8×108UFC de BCG de la cepa Tice. La concentración utilizada en los experimentos fue de 20mg/ml.
Western blotLa extracción de proteínas y el Western blot se llevaron a cabo en los lisados celulares como se describió previamente7. Los anticuerpos primarios utilizados fueron: anti-MMP2, anti-MMP-9 y anti-p53 (anticonejo policlonal; dilución 1/1000 Abcam, Cambridge, UK). Las bandas inmunorreactivas se detectaron mediante el kit de quimioluminiscencia SuperSignal® West Pico Chemiluminescent Substrate (PIERCE, Rockford, IL, EE. UU.) y se cuantificaron usando el software Chemi-Imager 5.5 de AlphaInnotec (San Leandro, CA, EE. UU.). El análisis densintométrico es representativo de la media de varios experimentos.
Ensayo de migración celular (Wound Healing Assay)Para estimar la capacidad de la célula de proliferar y migrar en diferentes condiciones de cultivo, se utilizó el kit 24-Well Wound Healing Assay de Cell Biolabs, Inc., en el cual se colocan inserts de plástico, dentro de cada pocillo de una placa de 24, creando un campo con una separación definida de 0,9mm para la medición de las tasas migratorias. Las células migratorias son capaces de extenderse y, finalmente, invadir y cerrar la zona abierta. La proliferación celular y las tasas de migración se determinaron tras 48 horas de incubación, valorando mediante microscopia óptica.
Ensayo de invasiónLas propiedades invasivas de las células FaDu se examinaron mediante el kit 24 Well Cell Invasion Assay (Basement Membrane, Colorimetric Format) de Cell Biolabs, Inc, basado en el principio de la cámara de Boyden, siguiendo las recomendaciones del fabricante. El tiempo de incubación para el experimento fue de 24 horas. La densidad óptica fue cuantificada a 560nm.
Grupos de estudioLos grupos experimentales del estudio fueron: control: células tumorales FaDu en 3D; PBMC: células tumorales FaDu en Matrigel (3D) cocultivadas (separadas a través de una membrana semipermeable) con PBMC; BCG: células tumorales FaDu en Matrigel (3D) cocultivadas (separadas a través de una membrana semipermeable) con PBMC y BCG.
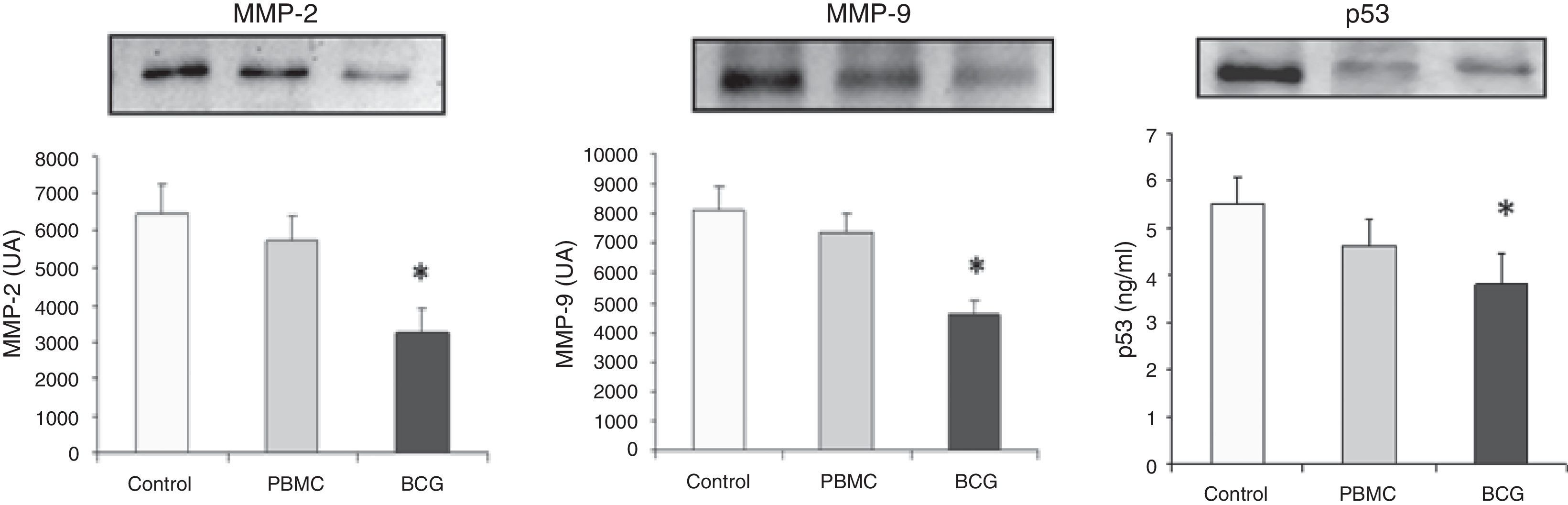
ResultadosEl BCG disminuye los niveles de las MMP 2 y 9 en las células tumoralesDado que diversos estudios muestran que MMP-2 y MMP-9 desempeñan un rol esencial en la degradación de la matriz extracelular, realizamos la medición de sus niveles en los extractos proteicos de las células FaDu para observar los cambios que se producían tras la activación inmune mediada por BCG. En la figura 1, se observa una disminución estadísticamente significativa (p<0,05) de la enzimas MMP-2 y MMP-9 para el grupo BCG respecto a los grupos control y PBMC.
El BCG disminuye la expresión de p53 y de las metaloproteinasas de matriz 2 (MMP-2) y 9 (MMP-9) en las células tumorales FaDu. Los cultivos de FaDu en 3D se cocultivaron con PBMC (1×105 cel./ml) y con PBMC activadas con el BCG (20mg/ml) durante 48h. Los datos se presentan la media±sem de al menos cuatro experimentos independientes expresados como unidades arbitrarias (UA), (MMP-2 y MMP-9) y ng/ml (p53). *p<0,05 vs. control y PBMC para MMPs. *p<0,001 vs. control y PBMC para p53.
En función de los resultados anteriores y en base al hecho de que p53 se encuentra asociada al aumento de la secreción y activación de MMP-2, se midió su expresión en las células FaDu. Como se observa en la figura 1, la expresión de proteína p53 (55kDa) obtenidos por Western blot en las células tumorales FaDu son significativamente menores en el grupo BCG respecto al control y al grupo PBMC (p<0,001).
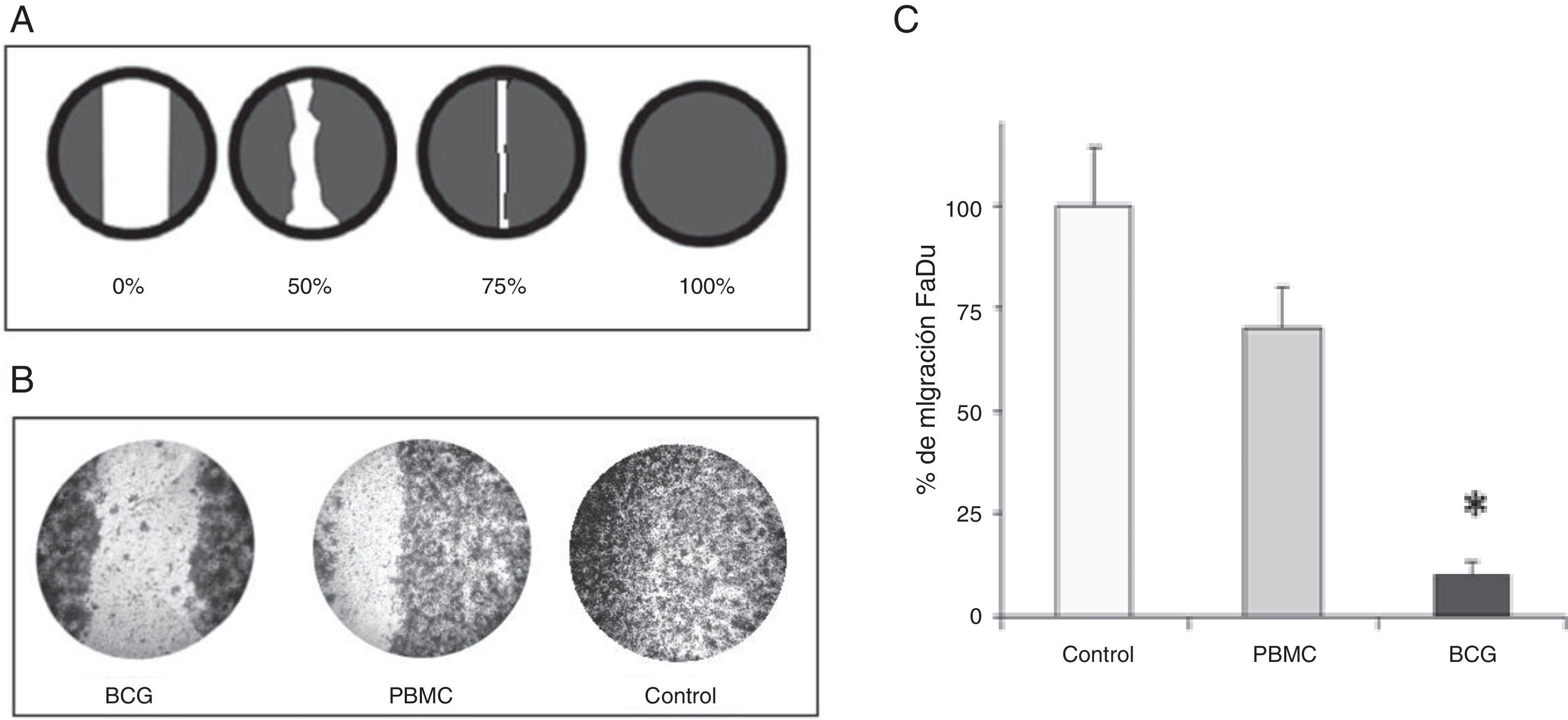
El BCG disminuye la capacidad migratoria tumoralPara determinar si los niveles de MMP-2, MMP-9 encontrados se correlacionaban con la capacidad migratoria tumoral se realizó el ensayo de migración (Wound Healing), cuya representación esquemática se muestra en la figura 2A; a medida que las células tumorales comienzan a migrar van cerrando la brecha o cicatriz preformada, esta migración puede expresarse porcentualmente según los hallazgos observados al microscopio. En la figura 2B se observan las imágenes captadas durante los experimentos para cada uno de los grupos que luego son representadas en forma gráfica en la figura 2C. Como puede observarse en estas imágenes, el grupo control tras 48 horas de incubación tiene un porcentaje de cierre cercano al 100%, el grupo PBMC se acerca al 70% y en el grupo BCG no se produjo migración de las células (p<0,01). Además se observó un descenso cualitativo de la población celular respeto a los otros dos grupos.
Ensayo de migración celular (Wound Healing). Las células se cultivaron 24 horas hasta formar una monocapa en cuyo momento se retiraron los inserts para comenzar el ensayo. Las células fueron monitoreadas bajo contraste de fase, y teñidas tras 48h para determinar el porcentaje de cierre (0, 50, 75, y 100%, figura A). B) Se observa el comportamiento de las células tumorales según los grupos de estudio. C) Porcentaje de migración por grupos obtenido durante el ensayo. En el grupo BCG se observa escasa migración (*p<0,01 vs. control y PBMC) y un descenso cualitativo de la población celular.
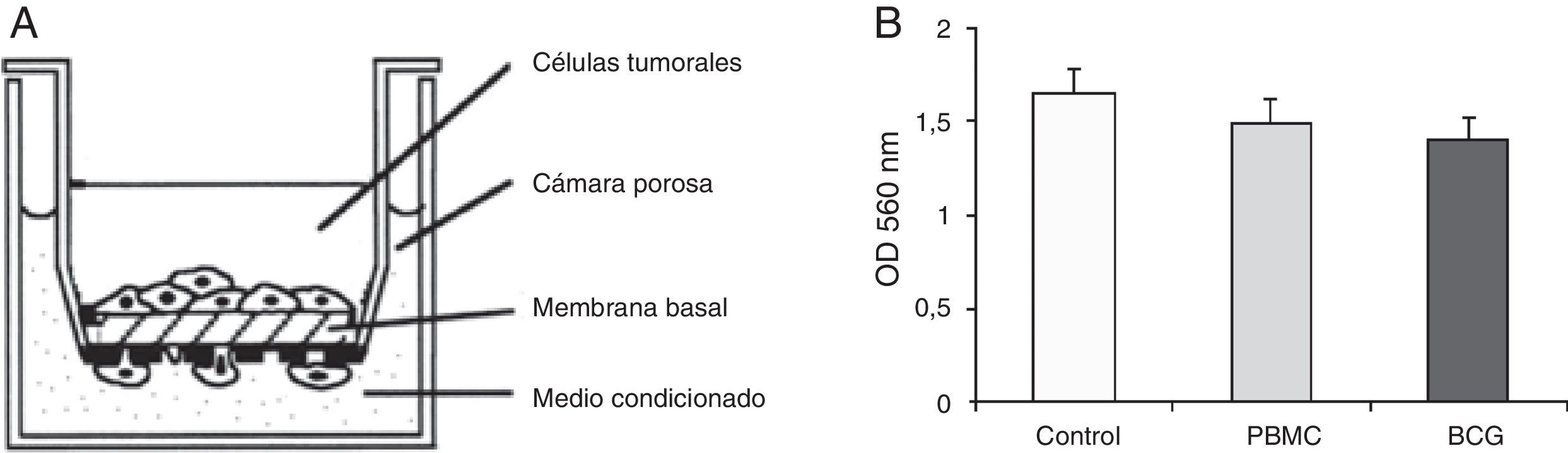
La invasión implica no solo procesos de migración sino además, requiere que la célula posea la capacidad para unirse y degradar componentes de la matriz extracelular. Como se muestra en la figura 3, existe una tendencia invasiva similar entre los grupo.
Ensayo de invasión celular. A) Se muestra un esquema representativo de la cámara porosa cubierta de membrana basal, a través de la cual pueden pasar las células con capacidad invasiva. B) Se observa el comportamiento de las células tumorales según los grupos de estudio. Las células migratorias en la parte inferior de la membrana de policarbonato se tiñeron y cuantificaron a 560nm OD después de la extracción. No se observaron diferencias estadísticamente significativas.
Los tratamientos del CECC comprenden cirugía, radioterapia, quimioterapia o una combinación de ellas, sin embargo, al momento del diagnóstico el 80% de los pacientes presentan estadios avanzados de la enfermedad y las opciones son limitadas y altamente incapacitantes. Muchos pacientes con CECC requieren después del tratamiento, rehabilitación, fisioterapia, logopedia o cirugía reconstructiva8. El tratamiento con nuevas terapias basadas en anticuerpos monoclonales parece prometedor pero no permiten controlar las recidivas ni la aparición de segundas neoplasias, hecho común a este tipo de tumores. Además, existen inhibidores sintéticos específicos de las distintas familias de proteasas, como las MMP, que han demostrado su capacidad para bloquear la invasión tumoral en distintos modelos in vitro e in vivo. Algunos de estos inhibidores se utilizan ya en ensayos clínicos para el tratamiento de distintos tumores, sin embargo pueden presentar importantes efectos secundarios no mostrando beneficios en la supervivencia ni en el aumento del tiempo de progresión de la enfermedad9. La inmunoterapia con el BCG se emplea con buenos resultados en el carcinoma de células transicionales de vejiga debido a que permite tratar el carcinoma in situ, reducir el número y frecuencia de las recurrencias tumorales y prevenir la progresión de la enfermedad, por tanto, este estudio se centró en determinar el efecto del tratamiento con BCG sobre la migración e invasión en el CECC.
Los resultados obtenidos en el estudio deben ser interpretados teniendo en cuenta la representación de los grupos experimentales. El grupo control representa la forma en la que se comporta el tumor, el grupo PBMC el comportamiento del sistema inmune ante el tumor y el grupo BCG representa el efecto de la activación inmunológica (inmunoterapia) sobre el tumor.
Numerosos autores han estudiado el papel de las MMP y más específicamente de MMP-2 y MMP-9 en el CECC, aplicándose abordajes diferentes para determinar la actividad de estas enzimas en la degradación de la matriz extracelular y su valor pronóstico, ya que su activación se relaciona directamente con el potencial de invasión de las células neoplásicas10. Ruokolainen et al. observaron que MMP-9 es un indicador pronóstico de recidivas y supervivencia en pacientes con CECC11. Nuestros resultados reflejan una sobreexpresión de MMP-2 y MMP-9 en el grupo control, sugiriendo que es secretada por las células tumorales11 lo cual podría atribuirse a un aumento de su síntesis en respuesta a factores presentes en el medio de cultivo, liberados por la célula tumoral y/o a la sobreexpresión de p53, entre otros. La medición de los niveles de MMP-2 y MMP-9 en plasma de pacientes con CECC ha sido usada en algunos estudios, para monitorizar la respuesta al tratamiento y predecir las recurrencias; debido a que se acusa un importante descenso de estas MMP en los respondedores. En el grupo BCG, observamos un descenso estadísticamente significativo de estas enzimas, pudiendo esto evidenciar que se ha producido una respuesta favorable tras la inmunoterapia. Resultados obtenidos por Kageyama et al. sobre un estudio in vitro para evaluar si el tratamiento con BCG en presencia de PBMC modificaba el potencial invasivo de las células neoplásicas de vejiga, encontró que BCG no afectaba la secreción de MMP-2 y MMP-9 por parte de las células neoplásicas, pero la coexistencia BCG-PBMC sí incrementaba la producción y secreción de MMP-9 por las PBMC de manera dosis dependiente12. La razón por la cual la invasión no mostró diferencias entre los grupos aunque descendieran los niveles de las MMP, puede atribuirse a que hay más factores involucrados en este complejo proceso.
ConclusiónLa inmunoterapia con BCG disminuye los niveles de MMP-2 y MMP-9 e inhibe in vitro la migración de las células tumorales del CECC, resultado alentador ya que en este tipo de tumor son frecuentes las recidivas y metástasis. Sería interesante corroborar estos resultados en modelos in vivo y comprobar si la toxicidad es menor a la que se observa con inhibidores sintéticos.
También es necesario destacar que, como se viene demostrando en la práctica clínica con los cánceres de vejiga y melanoma, cuyos resultados son óptimos y la toxicidad escasa, la terapia con BCG en CECC podría usarse como una herramienta terapéutica eficaz, con escasos efectos secundarios y bajo coste.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.