Los auto-anticuerpos son marcadores útiles en el inicio de la diabetes mellitus autoinmune, como apoyo diagnóstico. El objetivo de este trabajo fue conocer la prevalencia de autoanticuerpos en el inicio de diabetes en nuestro medio, medidos mediante ELISA y valorar su papel diagnóstico en diabetes autoinmune.
Material y métodosMuestra de 111 pacientes con diabetes de inicio: 61 tipo 1 (incluye 12 diabetes autoinmune latente del adulto [LADA]) y 50 tipo 2. Grupo control 64 no diabéticos. Se analizaron antidescarboxilasa del ácido glutámico GADA, anti-tirosina fosfatasa de membrana IA-2 y anti-insulina IAA, mediante enzimoinmunoanálisis ELISA en microplaca. Se realizó estudio observacional descriptivo para valoración de pruebas diagnósticas. Programa estadístico PASW Statistics versión 18.
ResultadosGADA(+): 78,7% DM1; 83,3% LADA; 2,0% DM2; 1,6% control. IA-2(+): 52,2% DM1; 45,5% LADA; 16,4% DM2; 12,5% control. IAA(+): 10,3% DM1; 18% LADA; 6,0% DM2; 1,7% control. GADA e IA-2 diferenciaron significativamente (p<0,0001) a los pacientes con diabetes autoinmune. No así IAA. Área bajo curva receiver operating characteristics (ROC): GADA=0,90 (p<0,0001); IA-2=0,74 (p<0,0001); IAA=0,57 (p=0,126). Criterio límite GADA(+) > 5,5 U/mL (sensibilidad 79%, especificidad 98%) e IA-2(+) > 6,0 U/mL (sensibilidad 54%, especificidad 84%). Análisis de factores riesgo asociados: Odds ratio GADA=51,44 e IA-2=4,64.
ConclusionesEn nuestro estudio, la prevalencia de GADA en el inicio de diabetes es alta y su determinación eficaz en el diagnóstico de diabetes autoinmune. IA-2 incrementó 4,6 veces la probabilidad diagnóstica. IAA medidos mediante nuestro test ELISA no han mostrado valor como marcadores en la diabetes autoinmune, aunque esto no descarta su utilidad en otras patologías.
Autoantibodies are useful markers for clinical onset of autoimmune diabetes, and as a diagnostic supports. The aim of this study was to determine the prevalence of autoantibodies at the onset diabetes mellitus in our environment, measured by an ELISA technique, and to assess its role as autoimmune diabetes diagnostic support.
Material and methodsA sample of 111 patients with diabetes onset was studied, which included, 61 type 1 diabetes (12 Latent Autoimmune Diabetes in Adults (LADA) and 50 type 2 diabetes. Control group: 64 non-diabetics. Antibodies glutamic acid decarboxylase antibodies (GADA), membrane phosphatase anti-tyrosine (IA-2), and anti-insulin (IAA) were determined by enzyme immunoassay ELISA microplates. A descriptive observational study was conducted to the measure diagnostic tests using the software PASW Statistics version 18.
ResultsGADA(+): 78.7% DM1; 2.0% DM2; 1.6% control. IA-2(+): 52.2% DM1; 45.5% LADA; 16.4% DM2; 12.5% control. IAA(+): 10.3% DM1; 18.0% LADA; 6.0% DM2; 1.7% control. Comparing means, autoimmune diabetics were significantly differentiated (P<.0001) by GADA and IA-2 values, but not with IAA. The area under the Curve using software Receiver Operating Characteristics (ROC): GADA=0.90 (P<.0001), IA-2=0.74 (P<.0001), IAA=0.57 (P=.126). Optimal cut off for GADA>5.5U/mL (sensitivity 79%, specificity 98%) and IA-2>6.0U/mL (sensitivity 54%, specificity 84%). On analysing risk factors associated with autoimmune diabetes diagnosis, the calculated Odds ratio gave GADA=51.44 and IA-2=4.64.
ConclusionsIn this study GADA(+) prevalence is high at diabetes onset, and its calculation has been effective for autoimmune diabetes diagnosis. IA-2 increases diagnostic probability 4.6 times. Anti-insulin antibodies measured by ELISA test did not demonstrate value for autoimmune diabetes diagnosis and classification, although its usefulness is not excluded for the diagnosis support of other diseases.
La diabetes autoinmune se caracteriza por la destrucción de las células beta de los islotes pancreáticos a través de mecanismos de necrosis o apoptosis mediados por células T reactivas1. Esta es la causa más común de la diabetes mellitus tipo 1 (DM1), denominada tipo autoinmune o 1A, con déficit absoluto de insulina. Durante el proceso destructivo que puede durar varios años, es posible detectar en el suero de los futuros pacientes diabéticos, inmunoglobulinas que reconocen a determinadas moléculas del islote que actúan como antígenos. Estos autoanticuerpos permiten la predicción de la DM1A y la tipificación de la diabetes autoinmune en su inicio2.
Con etiología similar, la diabetes autoinmune latente del adulto (LADA) es una forma lenta y progresiva, caracterizada por la positividad de autoanticuerpos asociados con la diabetes y la necesidad de requerimientos de insulina. La Organización Mundial de la Salud (OMS) la incluye en el grupo de DM1, como un tipo especial de progresión lenta. Se postula que los pacientes LADA con múltiples autoanticuerpos positivos y/o niveles altos de éstos tienen un fenotipo similar a los MD1, mientras que, aquellos con niveles bajos de GADA, tienen características clínicas similares a MD2, siendo independientes de la insulina durante varios años3. Por tanto, los autoanticuerpos servirían para diferenciar a los pacientes LADA de los DM2.
Su aplicación en la práctica clínica se ve mermada porque carecen de especificidad, y porque aún no están disponibles las terapias de modulación del proceso de la enfermedad, con lo que los beneficios para los pacientes individuales generalmente son cuestionables4. No obstante, por su utilidad como apoyo diagnóstico, la Sociedad Española de Diabetes aconseja, cuando sea posible para el cribado primario de la diabetes autoinmune, la determinación combinada de GADA con IA2, siendo estos últimos sustituidos por los IAA en sujetos de corta edad (< 10 años). En caso de positividad para uno o ambos anticuerpos, puede completarse la evaluación mediante el análisis de al menos un tercero y preferiblemente también un cuarto (IAA o IA-2 en su caso, conjuntamente con ICA)5.
Los anti-GAD o GADA son anticuerpos específicos contra la enzima glutamato decarboxilasa. Aproximadamente el 70% de los pacientes caucásicos con DM1 de inicio los presentan y sus niveles son estables después de 10 años del diagnóstico6. Igualmente se encuentran porcentajes altos en pacientes con diabetes LADA.
La tirosina fosfatasa 2 es una glicoproteína transmembrana perteneciente a la familia de las proteínas tirosina fosfatasa7. Anticuerpos anti-tirosina fosfatasa 2 IA-2 aparecen en el 60% de los pacientes con DM1 de inicio8.
Los IAA se definen como anticuerpos que se unen a la insulina en individuos que no reciben tratamiento con ésta. Palmer et al los hallaron en al menos el 18% de los pacientes insulin-dependientes de reciente diagnóstico aún sin ser tratados con insulina9. Aguilera en el 27,9% de adolescentes y adultos con DM1 de inicio10. Su frecuencia está asociada a la edad siendo mayor en el debut de DM1 en los niños menores de 10 años6.
La existencia de informes contradictorios sobre su prevalencia y su valor diagnóstico parece debida a los distintos procedimientos utilizados para su análisis. Mientras que las pruebas ELISA anti-GAD-65 han demostrado tener sensibilidad y especificidad tan alta como los ensayos radiactivos, así como buena precisión y manejo adecuado para uso rutinario11,12, los resultados ELISA-IA2 han sido variables12,13 y los de IAA han sido cuestionados14.
La dificultad para comparar y reproducir los resultados llevó a la creación de grupos de trabajo diseñados para estandarizar los análisis15 que se encargaron de la elaboración de sueros testigo según la Juvenile Diabetes Foundation (JDF) y los Immunology of Diabetes Workshops16. Junto a numerosos estudios de grupos concretos8,10–14,17, el programa internacional DASP (Diabetes Antibody Standardization Program), pretende evaluar y mejorar los métodos de ensayo y los reactivos de referencia internacional de la OMS18–20.
Los objetivos del presente trabajo son conocer la prevalencia de auto-anticuerpos anti-GAD, anti-IA-2 y anti-insulina en el debut de la diabetes mellitus en nuestro medio, medidos mediante técnica ELISA y valorar su papel como apoyo en diagnóstico de diabetes autoinmune.
Material y métodosSe realizó un estudio observacional descriptivo transversal para valoración de pruebas diagnósticas.
Se revisó a todos los pacientes de cualquier sexo o edad, estudiados en la Unidad de Endocrinología y el Servicio de Bioquímica Clínica del Área Sanitaria del Hospital Virgen del Rocío de Sevilla a los que se había indicado la determinación de anti-GAD, anti-IA2 y/o anti-insulina por sospecha de inicio de diabetes, durante el año 2008. Los datos clínicos fueron extraídos prospectivamente de las historias clínicas de la aplicación de Intranet SIDCA (Sistema de Información y Documentación Clínica Avanzada).
Se incluyeron un total de 175 individuos en el estudio, distinguiendo tres grupos:
- –
Pacientes con DM1: en este grupo se encuentran, siguiendo los criterios de la OMS y la American Diabetes Association (ADA)21,22, los pacientes con diabetes de autoinmunidad latente en adultos (LADA) o tipo 1 de progresión lenta.
- –
Pacientes con DM2.
- –
Grupo control de personas no diabéticas.
Se excluyeron los casos en los que no se hubiera establecido el diagnóstico de diabetes mellitus de inicio, aunque padecieran hiperglucemia objetivada o cualquier otra alteración del metabolismo de la glucosa, y aquellos en los que se desconocía el tipo de diabetes. Tampoco se consideraron los casos de diabetes gestacional y secundaria, que son objeto de otro trabajo.
En el grupo control fueron criterios de exclusión la existencia de hiperglucemia mantenida objetivada, la obesidad y ser familiares de primer grado de pacientes con DM1.
Las variables clínicas recogidas fueron: diagnóstico, edad y sexo.
Se analizaron los anticuerpos anti-GAD, IA-2 e IAA mediante enzimoinmunoanálisis en microplaca: ELISA kit for the quantitative determination of autoantibodies to Glutamic Acid Decarboxylase Autoantibody (GAD65) in serun RSR Limited, IA-2 Autoantibody ELISA kit RSR Limited y AESKULISA Insulin-G (AESKU DIAGNOSTICS), en analizador Triturus (Grifols).
Todas las determinaciones se realizaron por duplicado. Los valores de absorbancia de blanco y patrón se hallaron siempre dentro de los límites establecidos. Para un buen control de calidad, no se admitió un coeficiente de variación intra e Inter-serie superior al 20%. GADA e IA-2 fueron calibrados respecto a la preparación de referencia 97/550 según protocolo del Nacional Institute of Diabetes and Digestive and Kidney Diseases (NIDDK). Los resultados se expresaron como unidades por mL (U/mL), según OMS. En el caso de IAA, debido a la inexistencia de una calibración de referencia internacional, se calibró en unidades arbitrarias U/mL y se estableció una curva estándar trazando la densidad óptica para seis calibradores entre 0-300 U/mL Según las indicaciones del fabricante, se consideraron positivas las muestras cuyos niveles de GADA fueran superiores a 5,0 U/mL, IA-2 > 7,5 U/mL e IAA > 15,0 U/mL.
Se utilizaron como medidas de prevalencia las medianas y rango intercuartílico, ya que las variables estudiadas no seguían una distribución normal (test de Kolmogorov-Smirnov). Las variables cualitativas se expresaron como frecuencias absolutas y relativas. Para estudiar la asociación entre variables cualitativas se realizó el test Chi-cuadrado de Pearson o el test exacto de Fisher. Los diferentes marcadores, según los grupos de estudio, se compararon mediante el test de Kruskall-Wallis, así como dos a dos utilizando el test U. de Mann-Whitney con corrección de Bonferroni (p<0,0167). Mediante las curvas receiver operating characteristics (ROC) se evaluó el rendimiento de cada ensayo en la discriminación para cada uno de los grupos estudiados, observando las correspondientes áreas bajo la curva (AUC) y sus intervalos de confianza al 95% (IC 95%) y se calcularon los puntos de corte que maximicen sensibilidad y especificidad. Para valorar las variables analizadas como predictoras (factores de riesgo) de la diabetes tipo 1 realizamos un análisis de regresión logística bivariante y multivariante. Se consideró significativo un valor de p<0,05. Para el análisis estadístico se utilizó el paquete PASW Statistics versión 18.
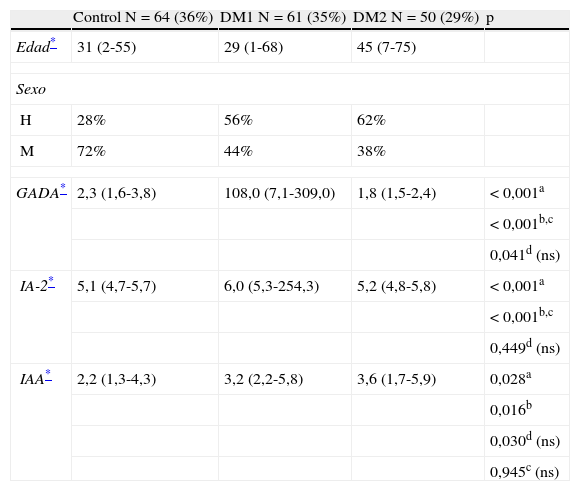
ResultadosLas variables clínicas analizadas y las características de cada grupo de estudio se describen en la tabla 1. De un total de 175 personas analizadas, 83 (47,4%) eran hombres y 92 (52,6%) mujeres. La edad mediana global fue de 33 años y su rango de 1 a 75 años. Un 14,9% de los pacientes eran niños de 10 o menos años. En el grupo DM1 (n=61) tenían 10 o menos años un 19,7%.
Características de los grupos de estudio y variables clínicas estudiadas
| Control N=64 (36%) | DM1 N=61 (35%) | DM2 N=50 (29%) | p | |
| Edad* | 31 (2-55) | 29 (1-68) | 45 (7-75) | |
| Sexo | ||||
| H | 28% | 56% | 62% | |
| M | 72% | 44% | 38% | |
| GADA* | 2,3 (1,6-3,8) | 108,0 (7,1-309,0) | 1,8 (1,5-2,4) | < 0,001a |
| < 0,001b,c | ||||
| 0,041d (ns) | ||||
| IA-2* | 5,1 (4,7-5,7) | 6,0 (5,3-254,3) | 5,2 (4,8-5,8) | < 0,001a |
| < 0,001b,c | ||||
| 0,449d (ns) | ||||
| IAA* | 2,2 (1,3-4,3) | 3,2 (2,2-5,8) | 3,6 (1,7-5,9) | 0,028a |
| 0,016b | ||||
| 0,030d (ns) | ||||
| 0,945c (ns) | ||||
DM1: diabetes mellitus tipo 1; DM2: diabetes mellitus tipo 2; GADA: anticuerpos anti-descarboxilasa del ácido glutámico; IA-2: anticuerpos anti-tirosina fosfatasa de membrana IA-2; IAA: anticuerpos anti-insulina; ns: no significativo; p: significación estadística.
asignificativas KrusKal-Wallis; bMann-Whitney con corrección de Bonferroni (p<0,0167) para comparación control-DM1; cDM1-DM2; dcontrol-DM2.
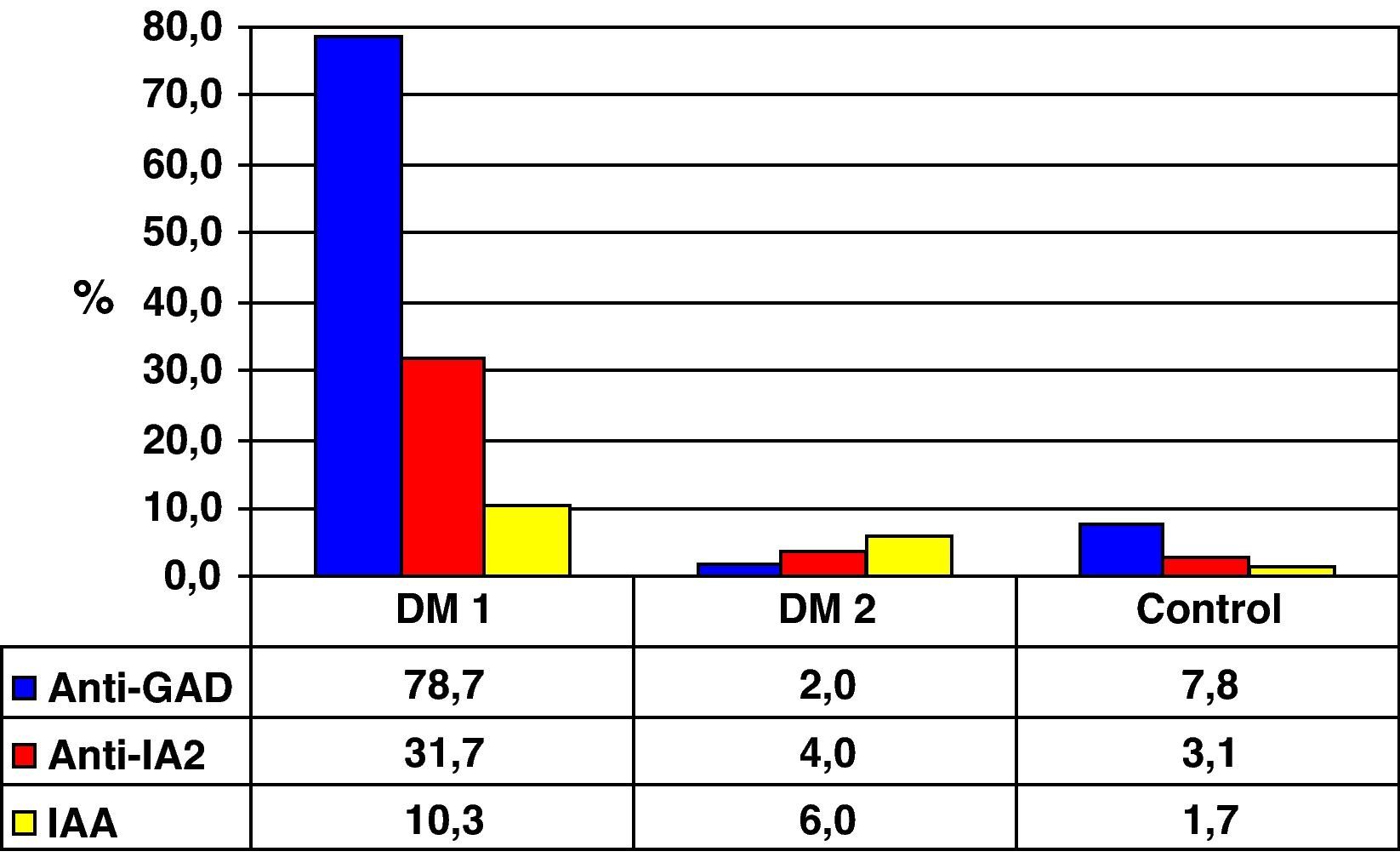
Se analizaron GADA en los 175 individuos, siendo positivos 54 (30,9%). De ellos 5 (7,8%) eran controles, 48 (78,8%) DM1 y 1 (2,0%) DM2. Se determinaron IA-2 en 174 personas, obteniendo un resultado IA-2 (+) en 23 (13,2%): 2 controles (3,1%), 19 DM1 (31,7%) y 2 DM2 (4,0%). Fueron IAA (+) 10 personas (6,0% de n=168): 1 control (1,7%), 6 DM1 (10,3%) y 3 DM2 (6,0%) (fig. 1).
Dentro del grupo DM1, los pacientes LADA tuvieron frecuencias similares al resto: fueron GADA (+) 83,3% LADA vs. un 77,6% de los diabéticos tipo 1 no LADA (DM1 no LADA) (p=0,661); IA-2 (+) 18,2% LADA vs. 34,7% DM1 no LADA (p=0.287) e IAA (+) 18,2% vs. 8,5% (p=0,343). Tampoco fue significativa la diferencia entre menores y mayores de 10 años: GADA (+) 91,0% de menores vs. 75,5% mayores (p=0.209); IA-2 (+) 41,7% vs. 29,2% (p=0,307) e IAA (+) 0% vs. 13% (p=0,231).
En la tabla 1 se muestran las medianas y rango intercuartílico obtenidos para cada uno de los autoanticuerpos. Se indican las significativas de Kruskal-Wallis junto a la comparación de los grupos estudiados con prueba de Mann-Whitney. Las medianas en niños menores de 10 años fueron: GADA=210,5 (34,6-319,3) U/mL, IA-2=6,3 (5,7-1896,7) U/mL e IAA=3,9 (1,9-6,2) U/mL. Las de los mayores de dicha edad: GADA=101,0 (5,2-304,0) U/mL, IA-2=6,0 (5,1-86,0) U/mL e IAA=3,2 (2,2-4,7) U/mL. Al compararlos, no se observan diferencias significativas entre menores y mayores de 10 años: GAD p=0,327; IA-2 p=0,196; IAA p=0,792.
Existió diferencia (p<0,05) en los valores de las medianas de GADA e IA-2 en el grupo LADA y DM1 no LADA, siendo GADA=219,0 (16,9-328,8) U/mL en LADA vs. 108,0 (5,9-304,0) U/mL en DM1 no LADA y e IA-2=5,7 (4,9-6,5) U/mL vs. 6,0 (5,3-264,5) U/mL. No fueron distintas (p=0,838) las medianas de IAA: 3,0 (2,2-4,1) U/mL en LADA vs. 3,4 (2,2-5,8) U/mL en DM1 no LADA.
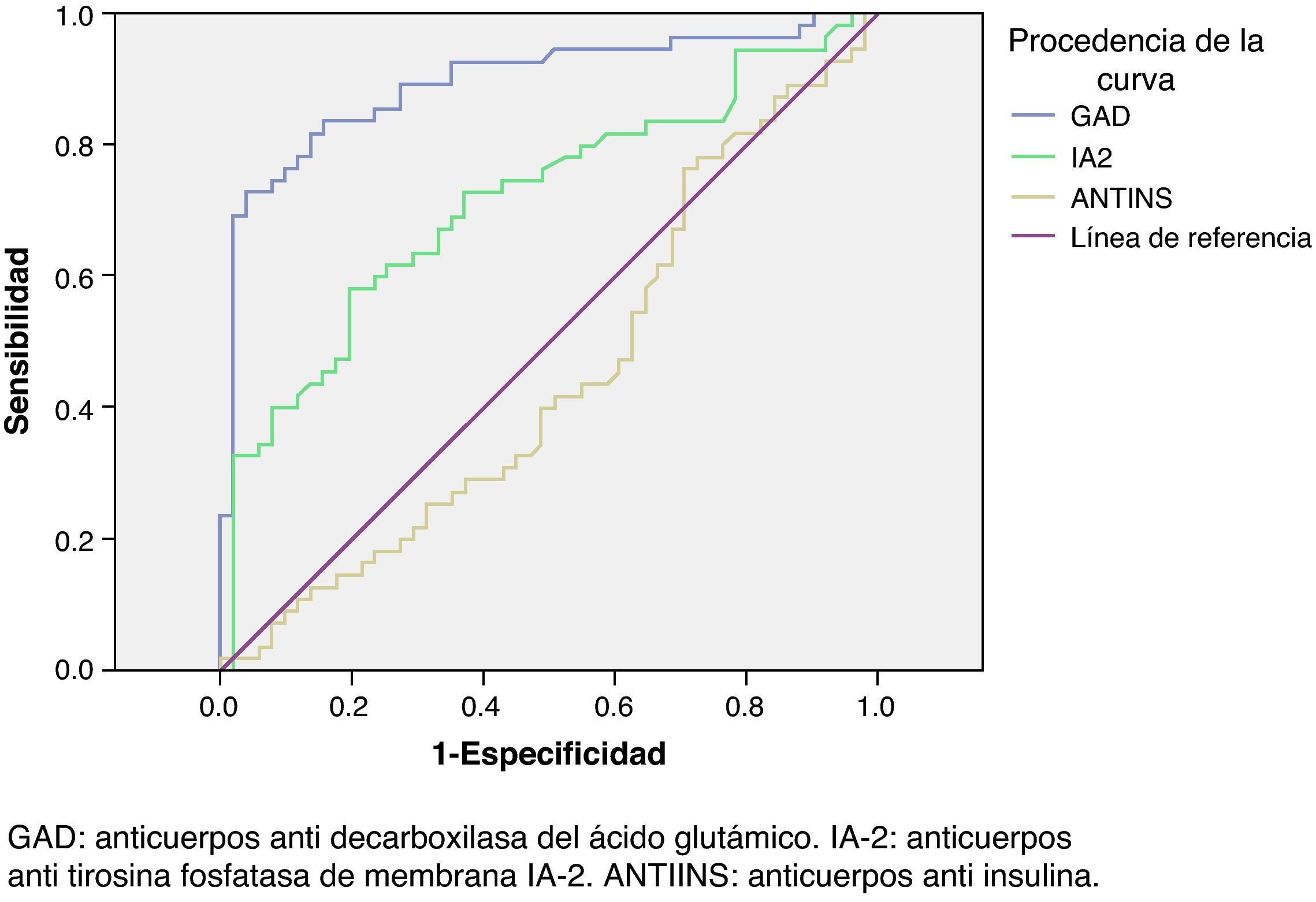
La tabla 2 y figura 2 muestran los valores hallados de la aplicación de curvas ROC.
Resultados curvas Receiver Operating Characteristics (ROC)
| GADA | IA-2 | IAA | |
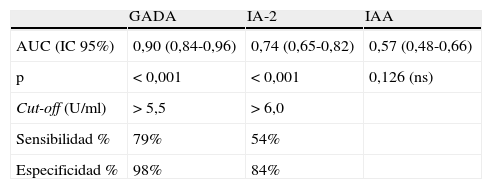
| AUC (IC 95%) | 0,90 (0,84-0,96) | 0,74 (0,65-0,82) | 0,57 (0,48-0,66) |
| p | < 0,001 | < 0,001 | 0,126 (ns) |
| Cut-off (U/ml) | > 5,5 | > 6,0 | |
| Sensibilidad % | 79% | 54% | |
| Especificidad % | 98% | 84% |
AUC: área bajo la curva; Cut-off (U/ml): criterio límite positividad en U/mL; GADA: anticuerpos anti-decarboxilasa del ácido glutámico; IA-2: anticuerpos anti-tirosina fosfatasa de membrana IA-2; IAA: anticuerpos anti-insulina; IC 95%: intervalo de confianza 95%; p: significación estadística; ns: no significativa.
Al aplicar los nuevos criterios de positividad calculados mediante las curvas ROC, obtenemos una prevalencia de GADA 78,7% en DM1, 83,3% en LADA, 2,0% en DM2 y 1,6% en grupo control. Para IA-2: 52,5% DM1, 45,5% LADA, 16,4% DM2 y 12,5% control.
Estudiando las coordenadas de la curva, si ajustamos la especificidad al 95% obtendríamos una sensibilidad para GADA del 77,6% (para un valor de corte=5,1 U/mL), para IA-2 de 37,9% (6,7 U/mL) y para IAA 13,8% (10,0 U/mL).
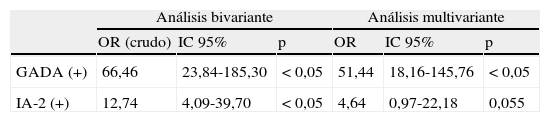
Los resultados del análisis de los factores de riesgo asociados al diagnóstico de DM1 pueden observarse en la tabla 3. En primer lugar se realizó un test bivariante para analizar las relaciones de cada una de las variables estudiadas con DM1 y posteriormente se seleccionaron para su inclusión en el modelo multivariante aquellas variables independientes que habían mostrado una relación estadísticamente significativa con DM1: GADA e IA-2.
Factores de riesgo asociados a diabetes mellitus tipo 1
| Análisis bivariante | Análisis multivariante | |||||
| OR (crudo) | IC 95% | p | OR | IC 95% | p | |
| GADA (+) | 66,46 | 23,84-185,30 | < 0,05 | 51,44 | 18,16-145,76 | < 0,05 |
| IA-2 (+) | 12,74 | 4,09-39,70 | < 0,05 | 4,64 | 0,97-22,18 | 0,055 |
R cuadrado de Naegelkerk=0,638.
GADA: anticuerpos anti-decarboxilasa del ácido glutámico; IA-2: anticuerpos anti-tirosina fosfatasa de membrana IA-2; IC 95%: intervalo de confianza del 95%; OR: Odds ratio o razón de probabilidades; p: significación estadística.
La frecuencia de GADA (+) en DM1 de inicio en nuestro estudio es alta (79%) y supera o coincide en el nivel alto con la que recoge la literatura: desde un 59% en japoneses (Ota, 200523) hasta 65-80%, según los autores6,10,14. Nuestro dato tiene mayor coincidencia con el obtenido por Brooking cuando utilizó métodos radiométricos (82%), que con el que tuvo mediante un test ELISA similar al nuestro y con igual línea de corte (5 U/mL): un 100% (39 de 39 seleccionados) positivos en pacientes con DM111. Palomer halló un 89% de GADA (+) mediante ELISA y un 71% con un ensayo radiométrico RBA (radiobilding assay)12.
La prevalencia de IA-2 en DM1 fue del 31,7%, similar a estudio de Ota (37%) pero algo menor a la recogida en nuestro país por Aguilera (45%) en 200310. Palomer et al no consiguieron buenos resultados con IA2-ELISA12.
En cuanto a IAA (10%), fue inferior o muy inferior a la de otros estudios6,10,24, en su mayoría realizados con RIA. El porcentaje de IAA positivo en DM1 fue significativamente superior al control (diferenciaría a los no diabéticos), pero no a DM2. El nivel de sensibilidad diagnóstica de nuestra prueba fue muy bajo, aunque mejor su especificidad, lo que sucede en general en los análisis de IAA mediante ELISA. Se ha sugerido que los IAA que se miden por medio de RIA se encuentran más vinculados a la enfermedad que los que se miden por ELISA, ya que un epitopo conformacional necesario para reconocer al IAA se perdería al revestir con insulina las placas de ELISA6. En cualquier caso parece que ambos métodos no miden la misma cosa. Tal vez el método ELISA detecte un subtipo dentro de los anticuerpos antiinsulina. Esto no descarta su utilidad en el diagnóstico de otras patologías y, de hecho, con esta técnica ELISA hemos observado valores altos de IAA, posiblemente asociados a hiperinsulinismo, con o sin hipoglucemia, datos presentados en el IV Congreso Nacional del Laboratorio Clínico de Zaragoza, en octubre de 2010.
Como puede apreciarse en la figura 2, los niveles promedios de GADA en los pacientes con DM1 (108,00 U/mL) están muy por encima de cualquier valor encontrado en la población normal y en DM2. Parece que los niveles altos de GADA en la fase preclínica se correlacionan con una progresión más lenta hacia la instauración de la enfermedad14, lo que se corresponde con formas lentamente progresivas o tipo LADA. Se ha descrito que tanto la determinación de GADA como de IA-2 obtienen mayor prevalencia en pacientes con LADA (GADA=86%; IA-2=49%), que en el resto de DM1 (GADA=59%; IA-2=37%)23. En nuestro estudio, aunque la frecuencia de GADA (+) ha sido algo superior en LADA que en el resto de DM1, no ha habido diferencias significativas entre ambos grupos. Sin embargo fueron significativamente mayores los valores de las medianas en el grupo LADA para GADA e IA-2, lo que se corresponde con los datos consensuados en la literatura3. Lógicamente las frecuencias y niveles diferenciaron claramente al grupo LADA de DM2. Pensamos que debemos realizar estudios con una población más amplia para confirmar estos datos.
En el caso de IAA no existió diferencia entre LADA y el resto, en concordancia con su falta de sensibilidad.
Quisimos ver el comportamiento de nuestros parámetros en niños menores de 10 años, ya que la frecuencia de IAA está asociada a la edad, siendo muy superior en los niños pequeños con DM1 de inicio5,6: El porcentaje de GADA (+) e IA-2 (+) fue mayor en los pequeños, aunque sin diferencias significativas, mientras que en IAA (+) tuvimos un 0% de prevalencia en menores de 10 años.
Por otra parte, cuando utilizamos el punto de corte recomendado por el fabricante (5 U/mL) un 7,8% de controles fueron GADA (+), frecuencia muy superior a la reflejada en la literatura para dichos controles, de hasta un 2%5, e incluso mayor que el 3,5% obtenido cuando se estudia la población general, que incluiría a los diabéticos tipo 1 y 2 y los controles17. Esto indicaría que nuestro método es poco específico. Sin embargo, hemos observado que los falsos positivos correspondían a cinco pacientes cuyos niveles de GAD eran bajos (cuatro entre 5,1 y 5,4 U/ml y uno con 9,49 U/ml). Si aplicamos nuestro nuevo criterio de positividad de 5,5 U/ml, cuatro de estos pacientes resultan negativos y por tanto la frecuencia del GADA (+) en los controles sería 1,6%. La especificidad aumenta al 98,2%, con igual sensibilidad. En este punto debemos informar que en base a nuestra experiencia, en nuestro laboratorio consideramos como valor indeterminado un GADA entre 5-10 U/mL, con lo cual ninguno de los controles se hubiera positivo. Los falsos positivos de IA-2 fueron dos casos cuyos valores de 15,6 U/mL y 9,8 U/mL también eran bajos. En principio, para el análisis de IA-2, aunque nuestro nuevo criterio límite es 6,0 U/mL, consideraremos una zona dudosa los valores entre 6-7,5 U/mL. Confirmamos la importancia de obtener criterios límites de positividad en función de los resultados propios para optimizar la especificidad de las determinaciones.
La frecuencia de GADA (+) en nuestro grupo DM2ha coincidido con la hallada por Brooking11: 2.0% vs. 1,6%.
La diferencia (p=0,028) en los valores de medianas de IAA en DM1 y sobre todo en DM2, que han sido superiores al control, concuerda con las observaciones de otros autores: IAA-ELISA son muy específicos, aunque poco sensibles6.
Nuestros resultados en las curvas ROC (AUC GADA 0,90 [0,84-0,96], AUC IA-2=0,74 [0,65-0,82]) son similares, aunque algo inferiores, a los obtenidos mediante ELISA en el programa DASP: AUC para GADA=0,94 (0,91-0,95), IA2=0,85 (0,82-0,87) en 200520. Aunque lejos del AUC GADA=0,99 (0,95-1,00) que informa Palomer12, podemos decir que nuestra prueba GADA consiguió una muy buena precisión en la identificación de la enfermedad. Fue menor la de IA-2. Nuestro test ELISA anti-insulina tuvo nula capacidad diagnóstica.
La sensibilidad y especificidad halladas fueron algo menores a las reportadas por el fabricante (que atribuye a DASP 2005): para GADA especificidad 98% y sensibilidad 92% y para IA-2 especificidad 99% y sensibilidad 66%. En DASP 2005 la sensibilidad de los test ELISA-GADA fue mayor incluso que la del RIA (sensibilidad media de 8 participantes 89% (85-92%), siendo la de RIA 80% (74-82%) y especificidad media 98% (96-99%)20.
La validez del modelo de regresión logística se comprobó con un coeficiente de determinación R cuadrado de Nagelkerke=0,638, lo que indica que el 64% de la variación de la variable DM1 es explicada por las variables incluidas en dicho modelo. Considerando el total de la población estudiada, los individuos GADA (+) tuvieron 51 veces más probabilidad de tener DM1 que los GADA (-), mientras que cuando los IA-2 eran positivos el diagnóstico de DM1 era 4,5 veces más probable que si eran negativos. La obtención conjunta de GADA e IA-2 (+) aportaría 51 x 4,5 veces mas riesgo de tener DM1. Recientemente se ha diseñado un método ELISA para determinación conjunta de GAD e IA-2, parece ser que con buenos resultados. Obtienen un 85% de positivos con el ensayo combinado GAD-65/IA-225,26.
ConclusionesEn nuestro estudio, la prevalencia de GADA (+) en el inicio de la diabetes es alta y su determinación ha sido muy eficaz para el diagnóstico de diabetes autoinmune. La determinación conjunta de IA-2 incrementa 4,5 veces la probabilidad del diagnóstico. Los anticuerpos anti-insulina medidos mediante nuestro test ELISA no han demostrado valor como marcadores en el diagnóstico y tipificación de la diabetes mellitus, aunque esto no descarta su utilidad para el diagnóstico de otras patologías. Establecemos un criterio de positividad para anti-GAD > 5,5 U/mL y para anti-IA-2 > 6,0 U/mL.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Nuestro agradecimiento al Prof. Juan Miguel Guerrero Montávez, al Dr. Manuel Conde Sánchez y a nuestro estadístico D. Juan Manuel Praena.
Este trabajo corresponde a una comunicación científica presentada y premiada en el III Congreso Nacional del Laboratorio Clínico celebrado en Valencia del 14 al 16 de octubre de 2009.