Las variables previas al procesamiento de la muestra (variables preanalíticas) pueden afectar a la estabilidad de las magnitudes bioquímicas que se determinan de forma sistemática en el laboratorio.
ObjetivoEvaluar la estabilidad de la insulina, la testosterona, el péptido C y la paratirina (PTH) en suero, y la PTH en plasma.
Material y métodoSe obtuvieron muestras de 10 voluntarios sanos. Se estudió la estabilidad según 2 modelos propuestos por la SEQC. En el modelo 1 la variable es el tiempo transcurrido desde la obtención y la centrifugación de la muestra hasta su determinación, a 4 °C en tubo primario hasta una semana; en el modelo 2 la variable es el tiempo desde la extracción hasta su centrifugación y análisis a temperatura ambiente. Las determinaciones hormonales se realizaron por inmunoanálisis electroquimioluminiscente (Modular Analytics E 170, Roche Diagnostics).
ResultadosModelo 1. El péptido C, la testosterona y la PTH en plasma se mantuvieron estables durante todo el estudio. La insulina fue estable hasta las 48 h y la estabilidad de la PTH en suero fue de 24 h. Modelo 2. Todas las magnitudes estudiadas fueron estables después de permanecer hasta 6 h a temperatura ambiente sin centrifugar.
ConclusionesLa estabilidad en idénticas condiciones preanalíticas fue muy diferente en algunas magnitudes hormonales.
The preanalytical variables to the processing of sample (variable preanalytical) can affect the stability of the biochemical magnitudes determined in the laboratory.
ObjectiveTo evaluate the stability of insulin, testosterone, C-peptide and parathormone (PTH) in serum and plasma.
Material and methodSamples from 10 healthy voluntaries were obtained. The stability was studied according to 2 different protocols recommended by SEQC. In model 1, the variable is the time elapsed from collection and centrifugation of the specimen to its determination, preserved at 4 °C in its primary tube for a week; in model 2, the variable is the time from extraction until the centrifugation and analysis maintained at room temperature. Hormonal determinations were made by electrochemiluminescence immunoanalysis (Modular Analytics E 170, ROCHE Diagnostics).
ResultsModel 1. C-peptide, testosterone and PTH plasma remained stable throughout study. Insulin was stable 48 hours and the stability of PTH in serum was only 24 hours. Model 2. All the measurements studied were stable without centrifuging after remaining up to 6 hours to room temperature.
ConclusionsIn identical preanalytical conditions, the stability was very different in some hormonal measurements.
La estabilidad de una magnitud bioquímica se puede definir como el período en que la magnitud mantiene su valor dentro de unos límites establecidos, conservando la muestra en la que se realiza la medición en unas condiciones especificadas1. La estabilidad de una muestra está influida por múltiples variables previas al procesamiento (variables preanalíticas) y durante el procesamiento (variables analíticas). Las variables preanalíticas son un componente importante de la calidad en los laboratorios, ya que las muestras no se procesan inmediatamente después de su extracción y las variaciones en su conservación (transporte y almacenamiento) pueden alterar sus componentes e influir en los resultados obtenidos2,3. Entre las variables preanalíticas que pueden afectar a la conservación de la muestra destacan el tipo de contenedor (presencia de aditivos, separador, tapón), la temperatura de almacenamiento, la agitación durante el transporte, así como la centrifugación y la separación de las células sanguíneas, entre otros. Uno de los objetivos del laboratorio clínico es conocer la estabilidad de los diferentes parámetros en las condiciones habituales de trabajo y procesar las muestras dentro de este período, con el fin de garantizar la validez del resultado analítico y, en consecuencia, su interpretación clínica. Sin embargo, la realización de estudios de estabilidad en el propio laboratorio es un procedimiento laborioso y con un coste económico elevado. Por otro lado, no es fácil disponer de datos sobre la estabilidad de las diferentes magnitudes bioquímicas ya que, aunque se dispone de numerosos trabajos publicados, hay tantas posibles variaciones de las distintas variables preanalíticas que es muy improbable que coincidan con nuestras condiciones de trabajo. Además, no existe acuerdo en la literatura científica respecto a los criterios que se deben utilizar para establecer el límite de estabilidad de las muestras. Algunos autores utilizan criterios exclusivamente estadísticos, metrológicos, biológicos o una combinación de ellos, lo que se traduce en límites de tolerancia más amplios o más estrechos en función del criterio utilizado y dificulta la interpretación de los resultados. Por este motivo, la Sociedad Española de Bioquímica Clínica y Patología Molecular (SEQC) elaboró una guía4 para evaluar la estabilidad de las magnitudes en la muestra biológica humana que permite estimar de manera protocolizada algunos factores preanalítcos. Además, formuló un criterio basado en criterios biológicos5 y metrológicos para definir el límite de variación que implica una pérdida de la estabilidad de las magnitudes biológicas en las muestras del laboratorio clínico6.
Siguiendo el modelo propuesto por la SEQC, se ha realizado un estudio en el que se evalúa el efecto del tiempo transcurrido desde la extracción hasta la obtención del resultado, con o sin centrifugación previa de la muestra, en la estabilidad de 4 magnitudes hormonales.
El objetivo de este estudio fue evaluar la estabilidad en suero de insulina, testosterona, péptido C y paratirina (PTH), y de PTH en plasma siguiendo los protocolos de la SEQC que más se ajustaban a nuestras condiciones de trabajo.
Como objetivo secundario se compararon los resultados obtenidos de PTH en suero y en plasma para averiguar si había diferencias estadísticamente significativas respecto a la muestra analizada.
Material y métodoSujetosLas muestras de sangre se obtuvieron de 10 voluntarios sanos (5 mujeres y 5 varones). La extracción de las muestras se llevó a cabo entre las 8.30 y las 9.30. Para este estudio no fue necesario estar en ayunas. Todos los sujetos fueron informados de la finalidad del estudio y dieron su consentimiento por escrito.
Se realizó el estudio siguiendo 2 modelos propuestos por la SEQC4; en uno de ellos la variable es el tiempo transcurrido desde la obtención y la centrifugación de la muestra hasta su análisis (modelo 1), mientras que en el otro la variable es el tiempo transcurrido desde la extracción de la muestra hasta su centrifugación y análisis (modelo 2).
A cada sujeto se extrajeron las siguientes muestras:
- −
1 tubo de plástico de gel de sílice de 8,5ml Vacutainer® SST II Advance Ref: 367953 (Q1) para la determinación de insulina, péptido C, testosterona y PTH en suero.
- −
2 tubos de 3,5ml gel de sílice Vacutainer® SST II Advance Ref: 367957 (M2 y M3) para la determinación de insulina, péptido C, testosterona y PTH en suero.
- −
3 tubos de plástico de 3ml con EDTAK3 BD Vacutainer® Ref: 368857 sin gel separador para la determinación de PTH en plasma (Q1p,M2p,M3p).
Durante el estudio se determinaron las concentraciones de las magnitudes estudiadas en función de la variable tiempo.
Tiempo: intervalo que transcurre desde la extracción de la muestra hasta la obtención del resultado, con o sin centrifugación previa:
- −
T1: 90-120min (es tratado como tiempo de referencia).
- −
T2: 210-240min.
- −
T3: 330-360min.
- −
T4: 450-480min.
- −
T5: 24h.
- −
T6: 48h.
- −
T7: a la semana.
Modelo 1. Estudia el efecto del tiempo una vez centrifugada la muestra hasta su procesamiento. En este protocolo las muestras Q1 y Q1p se centrifugan y analizan en el tiempo T1 (tiempo de referencia) y se considera la muestra de referencia para los estudios de suero (Q1) o de plasma (Q1p). Posteriormente, las muestras Q1 y Q1p se analizaron de manera sucesiva en los tiempos T2, T3, T4, T5, T6 y T7.
Después de cada determinación la muestra se conservó tapada en tubo primario a una temperatura controlada y registrada de entre +4 y +8°C.
Modelo 2. Estudia el efecto del tiempo trascurrido hasta la centrifugación de la muestra en la estabilidad de los parámetros (sin centrifugación previa). En este protocolo también se utilizan las muestras Q1 y Q1p como muestras de referencia en el tiempo T1. Las muestras M2 y M2p se centrifugaron y analizaron en el tiempo T2 y, por último, las muestras M3 y M3p se centrifugaron y analizaron en el tiempo T3.
La conservación de las muestras en este modelo se realizó en tubo primario, tapado y a una temperatura controlada y registrada de entre +21 y +25°C.
MétodoLas concentraciones de insulina, péptido C, testosterona y PTH se determinaron por inmunoanálisis de electroquimioluminiscencia, mediante el analizador Modular Analytics E 170 (Roche Diagnostics, GmbH, Manheim, Alemania). La imprecisión entre análisis para insulina, testosterona, péptido C y PTH fue: < 4,2, < 7,5, < 6,6 y < 4,8%, respectivamente. El límite de detección fue de 0,2μl/U/ml, < 0,01ng/ml, 1,2pg/ml y 2ng/dl, para insulina, péptido C, PTH y testosterona, respectivamente.
Todas las determinaciones se realizaron por duplicado.
CálculosEl análisis de los resultados se realizó a partir de la media obtenida de los duplicados y se compararon con los resultados medios obtenidos en las muestras de referencia Q1 y Q1p.
Siguiendo el criterio propuesto por la Comisión de Calidad Analítica de la SEQC, se considera que 2 resultados obtenidos son significativamente diferentes cuando la diferencia numérica entre ambos es mayor que la variación combinada (biológica intraindividual y analítica). La variación biológica intraindividual se considera nula, ya que la extracción de la muestra se realiza en un único tiempo. La variación analítica, por su parte, permanece constante durante todo el estudio (los métodos para determinar las distintas magnitudes permanecen invariables durante el análisis; se cumplen las especificaciones establecidas para los métodos utilizados). De esta manera se asegura que la única fuente de variabilidad en la estabilidad sea las condiciones preanalíticas. La estabilidad se obtiene a partir de la expresión:
donde 1,65 es el valor que asegura una confianza estadística del 95% y un riesgo α = 0,05, en una prueba unilateral, y CVA corresponde al coeficiente de variación analítico. En este estudio el CVA corresponde a los coeficientes de variación (CV%) obtenidos en los últimos 6 meses en nuestro laboratorio para cada magnitud estudiada6,7.
Para cada magnitud (Cx) y cada tiempo se calculó el porcentaje de cambio observado (CVO) respecto a la muestra de referencia (Cq) como se explica a continuación. Se consideró que se sobrepasaba el límite de estabilidad cuando CVO > EST. En esos casos, la estabilidad de la magnitud se estableció en el tiempo inmediatamente anterior. En los casos en que no se sobrepasó el límite de estabilidad en ninguno de los tiempos estudiados, la estabilidad de la magnitud se estableció en el último tiempo estudiado.
EstadísticaSe utilizó la prueba de Kolmogorov-Smirnov para comprobar el ajuste a la normalidad. Para la comparación de medias entre suero y plasma se utilizó la prueba de la t de Student para datos apareados. Se consideró significativa una p < 0,05.
ResultadosEfecto del tiempo. Modelo 1El péptido C y la testosterona se mantuvieron estables a lo largo de todo el estudio, mientras que la insulina fue estable hasta las 48h. La estabilidad de la PTH varió en función de tipo de muestra utilizado. La PTH en plasma fue estable durante todo el estudio (una semana) mientras que en suero la estabilidad fue solamente de 24h.
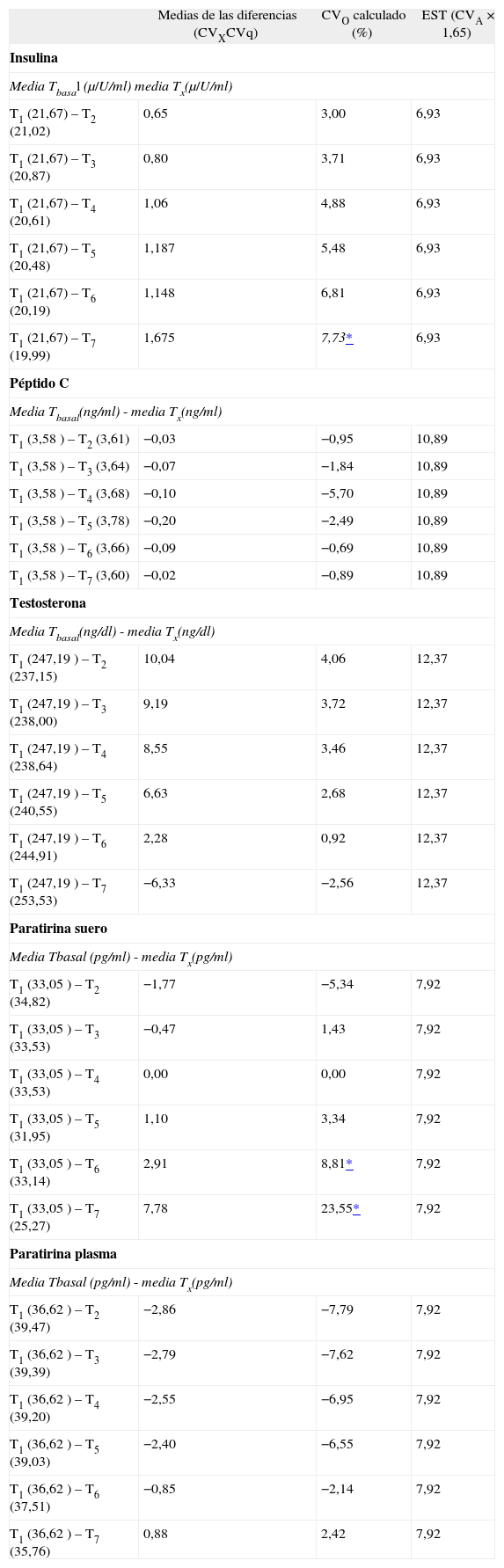
En la tabla 1 se muestra la media de las diferencias y el porcentaje de cambio respecto a la muestra de referencia (CVO) de todos los tiempos estudiados, además del límite de estabilidad obtenido para cada magnitud. Los resultados con asteriscos muestran un CVO superior al límite de estabilidad.
Porcentaje de cambio obtenido en el modelo 1 para cada tiempo estudiado respecto a la muestra de referencia y comparación con el límite de estabilidad obtenido
| Medias de las diferencias (CVXCVq) | CVO calculado (%) | EST (CVA × 1,65) | |
| Insulina | |||
| Media Tbasal (μ/U/ml) media Tx(μ/U/ml) | |||
| T1 (21,67) – T2 (21,02) | 0,65 | 3,00 | 6,93 |
| T1 (21,67) – T3 (20,87) | 0,80 | 3,71 | 6,93 |
| T1 (21,67) – T4 (20,61) | 1,06 | 4,88 | 6,93 |
| T1 (21,67) – T5 (20,48) | 1,187 | 5,48 | 6,93 |
| T1 (21,67) – T6 (20,19) | 1,148 | 6,81 | 6,93 |
| T1 (21,67) – T7 (19,99) | 1,675 | 7,73* | 6,93 |
| Péptido C | |||
| Media Tbasal(ng/ml) - media Tx(ng/ml) | |||
| T1 (3,58 ) – T2 (3,61) | −0,03 | −0,95 | 10,89 |
| T1 (3,58 ) – T3 (3,64) | −0,07 | −1,84 | 10,89 |
| T1 (3,58 ) – T4 (3,68) | −0,10 | −5,70 | 10,89 |
| T1 (3,58 ) – T5 (3,78) | −0,20 | −2,49 | 10,89 |
| T1 (3,58 ) – T6 (3,66) | −0,09 | −0,69 | 10,89 |
| T1 (3,58 ) – T7 (3,60) | −0,02 | −0,89 | 10,89 |
| Testosterona | |||
| Media Tbasal(ng/dl) - media Tx(ng/dl) | |||
| T1 (247,19 ) – T2 (237,15) | 10,04 | 4,06 | 12,37 |
| T1 (247,19 ) – T3 (238,00) | 9,19 | 3,72 | 12,37 |
| T1 (247,19 ) – T4 (238,64) | 8,55 | 3,46 | 12,37 |
| T1 (247,19 ) – T5 (240,55) | 6,63 | 2,68 | 12,37 |
| T1 (247,19 ) – T6 (244,91) | 2,28 | 0,92 | 12,37 |
| T1 (247,19 ) – T7 (253,53) | −6,33 | −2,56 | 12,37 |
| Paratirina suero | |||
| Media Tbasal (pg/ml) - media Tx(pg/ml) | |||
| T1 (33,05 ) – T2 (34,82) | −1,77 | −5,34 | 7,92 |
| T1 (33,05 ) – T3 (33,53) | −0,47 | 1,43 | 7,92 |
| T1 (33,05 ) – T4 (33,53) | 0,00 | 0,00 | 7,92 |
| T1 (33,05 ) – T5 (31,95) | 1,10 | 3,34 | 7,92 |
| T1 (33,05 ) – T6 (33,14) | 2,91 | 8,81* | 7,92 |
| T1 (33,05 ) – T7 (25,27) | 7,78 | 23,55* | 7,92 |
| Paratirina plasma | |||
| Media Tbasal (pg/ml) - media Tx(pg/ml) | |||
| T1 (36,62 ) – T2 (39,47) | −2,86 | −7,79 | 7,92 |
| T1 (36,62 ) – T3 (39,39) | −2,79 | −7,62 | 7,92 |
| T1 (36,62 ) – T4 (39,20) | −2,55 | −6,95 | 7,92 |
| T1 (36,62 ) – T5 (39,03) | −2,40 | −6,55 | 7,92 |
| T1 (36,62 ) – T6 (37,51) | −0,85 | −2,14 | 7,92 |
| T1 (36,62 ) – T7 (35,76) | 0,88 | 2,42 | 7,92 |
CVA: coeficiente de variación analítico de cada magnitud estudiada obtenido por nuestro laboratorio durante los últimos 6 meses; CVo: porcentaje de cambio observado respecto a la muestra de referencia; CVq: concentración media de la muestra de referencia para un tiempo determinado; CVx: concentración media de la muestra para un tiempo determinado; EST: límite de estabilidad analítica para cada magnitud (se calcula a partir de la fórmula: CVA × 1,65).
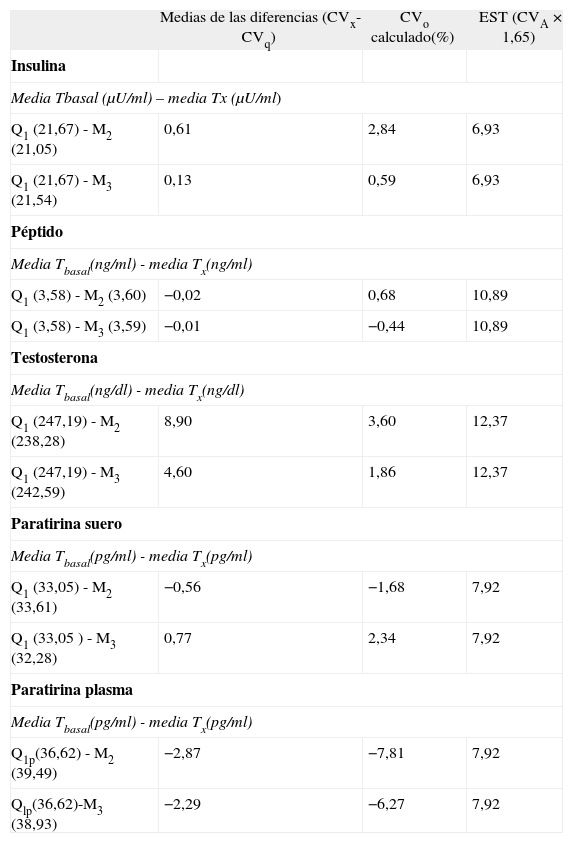
Para evaluar el efecto del tiempo en las muestras no centrifugadas hasta el momento de su procesamiento, se compararon los resultados obtenidos en M2 y M3 respecto a la muestra de referencia Q1 para cada magnitud estudiada (tabla 2).
Porcentaje de cambio obtenido en el modelo 2 para cada tiempo estudiado respecto a la muestra de referencia y comparación con el límite de estabilidad obtenido
| Medias de las diferencias (CVx-CVq) | CVo calculado(%) | EST (CVA × 1,65) | |
| Insulina | |||
| Media Tbasal (μU/ml) – media Tx (μU/ml) | |||
| Q1 (21,67) - M2 (21,05) | 0,61 | 2,84 | 6,93 |
| Q1 (21,67) - M3 (21,54) | 0,13 | 0,59 | 6,93 |
| Péptido | |||
| Media Tbasal(ng/ml) - media Tx(ng/ml) | |||
| Q1 (3,58) - M2 (3,60) | −0,02 | 0,68 | 10,89 |
| Q1 (3,58) - M3 (3,59) | −0,01 | −0,44 | 10,89 |
| Testosterona | |||
| Media Tbasal(ng/dl) - media Tx(ng/dl) | |||
| Q1 (247,19) - M2 (238,28) | 8,90 | 3,60 | 12,37 |
| Q1 (247,19) - M3 (242,59) | 4,60 | 1,86 | 12,37 |
| Paratirina suero | |||
| Media Tbasal(pg/ml) - media Tx(pg/ml) | |||
| Q1 (33,05) - M2 (33,61) | −0,56 | −1,68 | 7,92 |
| Q1 (33,05 ) - M3 (32,28) | 0,77 | 2,34 | 7,92 |
| Paratirina plasma | |||
| Media Tbasal(pg/ml) - media Tx(pg/ml) | |||
| Q1p(36,62) - M2 (39,49) | −2,87 | −7,81 | 7,92 |
| Qlp(36,62)-M3 (38,93) | −2,29 | −6,27 | 7,92 |
EST: límite de estabilidad analítica para cada magnitud (se calcula a partir de la fórmula CVA × 1,65); CVA: coeficiente de variación analítica de cada magnitud estudiada obtenido por nuestro laboratorio durante los últimos 6 meses; CVo: porcentaje de cambio observado respecto a la muestra de referencia; CVq: concentración media de la muestra de referencia para un tiempo determinado; CVx: concentración media de la muestra para un tiempo determinado.
Los resultados obtenidos en el modelo 2 indican que todos los parámetros estudiados fueron estables después de permanecer hasta 6h a temperatura ambiente sin centrifugar.
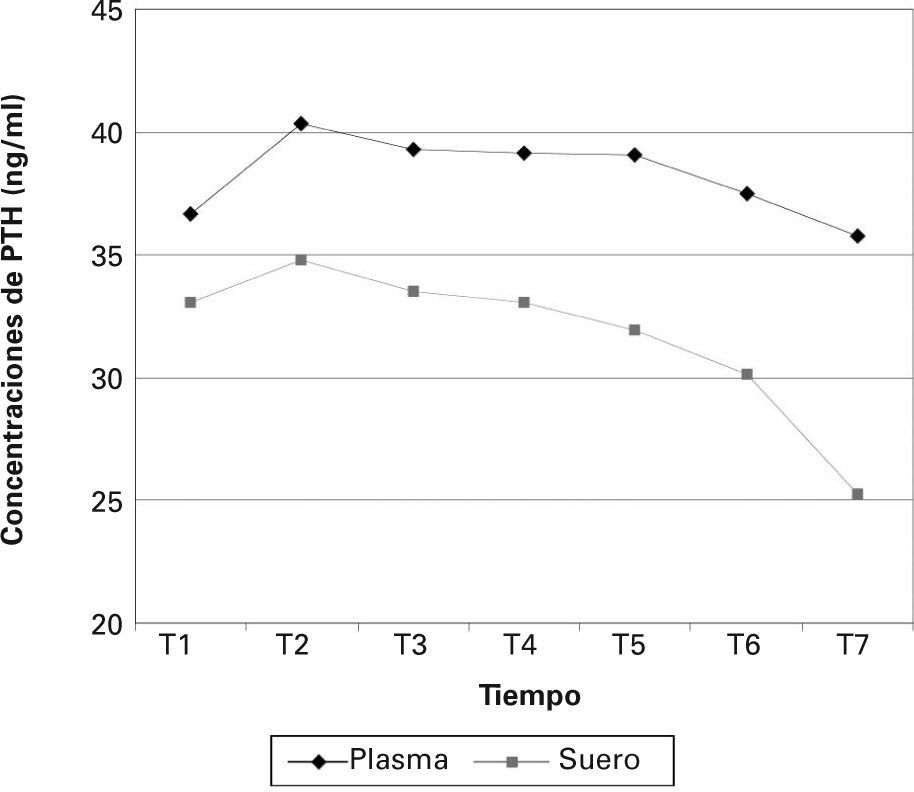
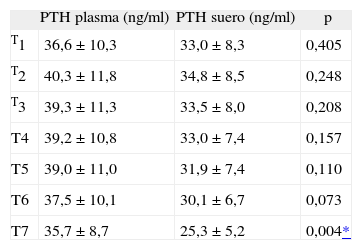
Efecto de la muestra analizadoEn la tabla 3 se muestran las concentraciones de PTH obtenidas en plasma y suero para todos los tiempos estudiados, y se expresan como la media aritmética y la desviación estándar. Las concentraciones medias en plasma fueron más elevadas que en suero (fig. 1), pero las diferencias fueron estadísticamente significativas únicamente en el tiempo T7 (p = 0,004).
Comparación de medias para los valores de PTH entre los dos tipos de muestra analizados (suero o plasma)
| PTH plasma (ng/ml) | PTH suero (ng/ml) | p | |
| T1 | 36,6 ± 10,3 | 33,0 ± 8,3 | 0,405 |
| T2 | 40,3 ± 11,8 | 34,8 ± 8,5 | 0,248 |
| T3 | 39,3 ± 11,3 | 33,5 ± 8,0 | 0,208 |
| T4 | 39,2 ± 10,8 | 33,0 ± 7,4 | 0,157 |
| T5 | 39,0 ± 11,0 | 31,9 ± 7,4 | 0,110 |
| T6 | 37,5 ± 10,1 | 30,1 ± 6,7 | 0,073 |
| T7 | 35,7 ± 8,7 | 25,3 ± 5,2 | 0,004* |
PTH: paratirina.
En los últimos años la determinación de magnitudes hormonales ha experimentado grandes cambios en la metodología utilizada. Los primeros inmunoanálisis marcados con isótopos radiactivos (radioinmunoanálisis, análisis inmunorradiométricos) han sido progresivamente reemplazados por otros con señal no isotópica que han permitido su automatización (enzimoinmunoanálisis, fluoroinmunoanálisis, análisis quimioluminiscentes, etc.). Esto se ha traducido en grandes mejoras en los resultados, fundamentalmente en la disminución de la imprecisión analítica y en el acortamiento de los tiempos de respuesta. Por otro lado, la incorporación de robots automatizados ha supuesto cambios en el abordaje preanalítico de las muestras destinadas a determinaciones hormonales, que han pasado de seguir un proceso en el que extracción (generalmente en tubos sin aditivos), centrifugación, separación del suero o plasma y congelación se realizaban en el menor tiempo posible a seguir el mismo proceso que otras muestras automatizadas, que incluye obtención, conservación y análisis de la muestra en el mismo tubo primario. Muchos de los trabajos publicados sobre la estabilidad de magnitudes hormonales están realizados en alícuotas de suero o plasma, centrifugadas y separadas inmediatamente8,9. Así, es necesario conocer la estabilidad en las condiciones de trabajo actual.
En este estudio las concentraciones de péptido C, testosterona y PTH en plasma en muestras conservadas en el tubo primario, a 4°C de temperatura permanecieron estables durante todo el estudio, es decir, 1 semana. En las mismas condiciones, la estabilidad de la PTH y de la insulina en suero fue de 24 y 48h, respectivamente. Por el contrario, todos los parámetros estudiados fueron estables después de permanecer 6h a temperatura ambiente sin centrifugar.
Los resultados obtenidos respecto a la estabilidad del péptido C a 4°C coinciden con los obtenidos por Evans et al8 y Ellis et al10. Consideran que el péptido C es una magnitud cuya concentración en suero varía poco, y permanece estable más de 120h a 4°C. Por el contrario, para otros autores11 la estabilidad del péptido C en muestras refrigeradas es inferior a 24h. En nuestro estudio las muestras de suero fueron adecuadas para la determinación de péptido C después de permanecer 6h a temperatura ambiente, sin separar, de acuerdo con lo publicado por Zhang et al12, aunque en su estudio, que abarca un período más prolongado, las muestras no fueron adecuadas para el análisis pasado este período.
Respecto a la testosterona, en nuestro estudio los procedimientos preanalíticos estudiados (tiempo de análisis, centrifugación previa y temperatura de conservación) no produjeron cambios significativos en sus concentraciones séricas. Otros trabajos publicados coinciden en que las concentraciones de testosterona en suero siguen siendo estables tras permanecer durante 24h a 4 oC13 o a temperatura ambiente11,12,14, aunque para Guder11 la estabilidad es inferior a 3 días conservando la muestra a una temperatura entre 4 y 8°C. Nuestros resultados coinciden con los de Wickings et al15 respecto a que las concentraciones de testosterona no se afectan de manera significativa tras permanecer durante varias horas sin separar a temperatura ambiente.
La estabilidad de la insulina se mantuvo hasta 48h desde la extracción de la muestra conservada a 4°C. Este hecho indica que sería necesario realizar la determinación de insulina en suero antes de 2 días tras la obtención de la muestra. Guder11 reduce este tiempo en 1 día, mientras que Evans et al8 consideran que la insulina es estable más de 120h a una temperatura de 4°C. Ellis et al10 obtienen una disminución significativa en los valores de insulina a las 16,8h antes de centrifugar la muestra y a una temperatura de conservación de 4°C.
En relación con la PTH, la estabilidad que muestra la PTH en suero es inferior que en plasma. Mientras que en plasma permanece invariable durante todo el estudio, en suero tan sólo se puede garantizar su estabilidad durante 24h conservada a 4°C. Evans et al8 indican que la PTH en plasma se mantiene estable más de 120h a 4°C, pero su estabilidad en suero a la misma temperatura de conservación se encuentra reducida a 55h. Es sabido que la PTH muestra una mayor estabilidad en plasma que en suero, y por ello se recomienda que la determinación de PTH se realice en plasma, en especial cuando la extracción de la muestra se lleva a cabo en lugares alejados16-18.
Sin embargo, hay que tener en cuenta que las concentraciones de PTH varían en función del tipo de muestra utilizado. En nuestro estudio observamos que las concentraciones de PTH en plasma eran más elevadas que en suero para todos los tiempos estudiados, en concordancia con otros estudios publicados17,19. Sin embargo, cabe destacar que la diferencia entre las medias tan sólo fue significativa en el último tiempo estudiado, al cabo de 1 semana. Este hecho puede estar relacionado con la mayor estabilidad que la PTH muestra en plasma.
Tras evaluar los resultados obtenidos en el estudio, podemos garantizar que la insulina, el péptido C, la testosterona y la PTH en suero y plasma permanecen estables sin haber centrifugado la muestra. El protocolo seguido en nuestro trabajo únicamente evaluó el efecto de la centrifugación previa hasta 6h tras la extracción de la muestra y a una temperatura de conservación entre 21 y 25°C. Sería necesario llevar a cabo más estudios para evaluar el tiempo máximo que pueden permanecer las muestras sin centrifugar sin que varíe de manera apreciable la concentración de las magnitudes biológicas, y si en ello puede influir la temperatura de conservación (temperatura ambiente, 4-8°C).
Es necesario concluir que los resultados obtenidos en este estudio únicamente pueden aplicarse a nuestro laboratorio, ya que dependen del método analítico utilizado y de las condiciones de trabajo, aunque sí pueden servir de guía para los laboratorios que utilicen el mismo analizador y el mismo método analítico. Sería necesario para cada laboratorio calcular el CVA de las magnitudes biológicas que se determinan, para poder definir su límite de estabilidad y de esta manera garantizar una adecuada interpretación.
La evaluación de la estabilidad analítica para las magnitudes biológicas en el laboratorio clínico es un proceso laborioso y con un elevado coste económico. Nuestro estudio tan sólo se realizó en muestras procedentes de 10 voluntarios sanos, en lugar de los 30 que propone el protocolo de la SEQC4, por ello es necesario llevar a cabo futuros estudios con un mayor número de sujetos sanos y también en población con diversas enfermedades20 para poder definir la estabilidad de las distintas magnitudes en las diversas situaciones clínicas en las que se trabaja en el laboratorio clínico.
AgradecimientosQueremos agradecer a la Sociedad Española de Bioquímica Clínica y Patología Molecular (SEQC) el apoyo recibido y la financiación que ha hecho posible la realización del trabajo.
Queremos agradecer a la empresa Roche, S.A. la donación de una parte de los reactivos.