La homocisteína se relaciona con enfermedad vascular, alteraciones del estado nutricional y detección de homocistinuria en neonatos, entre otras enfermedades. Debido a la importancia de su determinación, han aparecido diferentes métodos de cuantificación; el objeto de este trabajo es evaluar el método inmunonefelométrico del aparato BN II (Dade Behring).
Material y métodoSe realizó una comparación entre 2 métodos de cuantificación: el inmunoanálisis competitivo (IMMULITE 2000, DPC) y el análisis nefelométrico (BN II, Dade Behring), para lo cual se compararon los resultados de 74 muestras, además de determinar la imprecisión intraserial, imprecisión interdiaria, el límite de detección, el límite de cuantificación y el valor crítico del método inmunonefelométrico del BN II de Dade Behring.
ResultadosLa comparación entre ambos métodos mostró una buena correlación entre el inmunoanálisis competitivo, IMMULITE 2000 de DPC y el análisis nefelométrico, BN II de Dade Behring (Y=1,4825+0,8342X). El valor crítico obtenido fue de 5,46μmol/l y el límite de detección, de 5,77μmol/l. La imprecisión intraserial fue inferior al 5% (3,65-4,66%).
ConclusionesEl análisis nefelométrico (BN II, Dade Behring) ha demostrado cumplir todos los requisitos técnicos necesarios para su validación como método para la determinación de la homocisteína.
The homocysteine is associated with vascular diseases, alterations in the nutritional states, homocystinuria detection in neonates, as well as other diseases. Due to the importance of its determination, different measurement methods have been developed. The aim of this work is to evaluate the imunonephelometric method used in the Dade Behring BN II Nephelometer system.
Material and methodWe present a comparison between 2 methods: a competitive inmunoassay (IMMULITE 2000, DPC) and the nephelometric test (BN II, Dade Behring). For the determination of within batch and between-day imprecision, 74 samples were analysed and compared.
ResultsThe detection and quantification limits, and the critical value of the inmunonephelometric method, were also determined. Both methods showed good correlations (Y=1.4825+0.8342X). We also obtained a critical value of 5.46μmol/L and the detection limit was 5.77μmol/L. Within batch imprecision was below 5%(3.65-4.66%).
ConclusionsThe nephelometric test (Dade Behring BN II System) has demonstrated to fulfill all the technical requirements needed for its validation as a method for the determination of homocysteine.
La homocisteína fue descubierta en 1939 por Du Vigneaud et al, pero no fue hasta 1969 cuando, gracias a McCully, se estableció la relación entre la enfermedad vascular y los valores elevados de homocisteína en plasma. A partir de ese momento son muchos los estudios realizados, entre los que destaca, tal vez, el publicado en JAMA en 19971, donde se concluyó que "el aumento de valor plasmático de homocisteína confiere un riesgo de enfermedad vascular (aterosclerosis prematura, trombosis recurrentes de arterias coronarias, cerebrales o periféricas y de la trombosis venosa) independiente de otros factores, similar al de la hiperlipemia o el tabaquismo. Además, incrementa de forma muy marcada este riesgo si va asociado a tabaquismo y a hipertensión"2.
Pero, aunque se considera que ésta es la principal función de la homocisteína como marcador independiente de riesgo cardiovascular, son otras muchas las aplicaciones de la determinación de la homocisteína, como las relacionadas con alteraciones del estado nutricional (déficit de cobalamina y folatos, alcoholismo, embarazo, síndromes de malabsorción), la detección de la homocistinuria en los neonatos (debido generalmente al déficit de la enzima cistationina-beta sintetasa que se correlaciona con incrementos exacerbados de la homocisteína en plasma) y las relaciones entre la elevación de sus valores y diversas enfermedades (fallo renal, psoriasis, algunos pacientes con leucemia o tumores sólidos, hipertiroidismo, síndrome de Down) o fármacos (óxido nitroso, algunos antiepilépticos, metotrexato…)3-6.
Los mecanismos por los que la hiperhomocisteinemia ocasiona alteraciones vasculares se detallan a continuación.
- 1.
Producción de radicales superóxidos que producen lesión del endotelio arterial.
- 2.
Capacidad para producir alteraciones de la coagulación.
- 3.
Producción de células inflamatorias en las paredes arteriales que, junto con la dificultad para producir la dilatación de las arteriolas, favorece su obstrucción.
- 4.
La forma activa de homocisteína, tiolactona presenta la capacidad de estimular la formación de agregados plaquetarios1,4,7.
Realizar una comparación entre dos métodos para la determinación de homocisteína: uno ampliamente validado y empleado en la actualidad, el inmunoanálisis competitivo (quimioluminiscente con ésteres de acridinio, IMMULITE 2000, DPC) y un nuevo método basado en el análisis nefelométrico (competitivo, BN II, Dade Behring).
Material y métodoInstrumentaciónEl análisis competitivo por nefelometría (Dade Behring) efectuado por el aparato BN II reduce la homocisteína enlazada en la muestra a homocisteína libre por medio de ditiotreitol, y en la siguiente etapa se transforma enzimáticamente en S-adenosilhomocisteína (SAH). La S-adenosilcisteína (SAC) conjugada, añadida al comienzo de la reacción, competirá con la SAH de la muestra en la unión a los anticuerpos anti-SAH (fabricados por Dade Behring) unidos a las partículas de poliestireno. La valoración se realiza por comparación con los patrones de concentración conocida8.
El inmunoanálisis competitivo (DPC) efectuado con el aparato IMMULITE 2000 consta de 2 ciclos: uno de 30min de duración, en el que se produce una liberación de la homocisteína unida y conversión a SAH, y otro en el que se lleva a cabo la inmunorreacción.
A una bola de poliestireno recubierta de SAH y fosfatasa alcalina se le une un anticuerpo específico para SAH, de modo que la SAH transformada de la muestra pretratada compite con la SAH inmovilizada por la unión al anticuerpo anti-SAH unido a fosfatasa alcalina.
El conjugado enzimático no unido es eliminado mediante un lavado por centrifugación, a la vez que se añade más sustrato y continúa el proceso como el resto de los inmunoanálisis9.
El inmunoanálisis competitivo (DPC) efectuado con el aparato IMMULITE 2000 puede verse afectado en las determinaciones por fármacos que contengan S-adenosilmetionina, así como compuestos de la familia de la carbamazepina, fenitoína, 6-azuridina, antopterina, metotrexato, óxido nítrico, otros anticonvulsivos y los anticuerpos heterofílicos en el suero9.
El análisis competitivo por nefelometría (Dade Behring) efectuado por el aparato BN II se ve afectado por la turbidez, la lipemia, los anticuerpos heterofílicos, el factor reumatoide, los antiepilépticos, los antifolatos anestésicos y los antagonistas de la vitamina B129.
ReactivosAmbos métodos emplean una serie de reactivos comunes, como S-adenosil-L-homocisteína, ditiotritiol, anticuerpos monoclonales anti-SAH de ratón y S-adenosil-L-homocisteína hidrolasa.
Las principales diferencias entre los métodos son:
- 1.
El empleo, en el inmunoanálisis competitivo (DPC) IMMULITE 2000, de ajustadores de homocisteína en 2 niveles (bajo y alto) de 2ml cada uno de SAH derivada sintéticamente en una matriz de proteína/búfer y diluyente de homocisteína, para dilución de muestras de alta concentración, para lo que se suministran 25ml de una matriz proteica libre de homocisteína8.
- 2.
En el análisis competitivo por nefelometría (Dade Behring) efectuado en el aparato BN II, la utilización de N HCY SR B 1,1ml, en solución tamponada y estabilizada de un conjugado de SAC y tiroglobulina de cerdo (PTG-SAC) (< 0,1g/l)9.
En primer lugar, se procedió a valorar la técnica de análisis competitivo por nefelometría (Dade Behring) efectuado por el aparato BN II, mediante la determinación de la imprecisión intraserial, la imprecisión interdiaria y la determinación del límite de detección para, posteriormente, poder proceder a detectar los valores aberrantes, estimar el valor críitico (Lc), el límite de detección (Ld) y el límite de cuantificación (Lq).
Por último, se finalizó el estudio con una determinación simultánea en los aparatos IMMULITE 2000 y BN II de 74 muestras. La cantidad mínima de plasma necesaria para la medición fue de 100μl de plasma para el aparato BN II y de 15μl de plasma para el IMMULITE 2000.
- 1.
Para el estudio de la imprecisión intraserial se procedió, tras la realización de la curva de calibración realizada con N Protein Standard SL 1ml, a medir los 3 valores de control, empleándose N/T Protein Controls SL/L, SL/M y SL/H, que correspondían, respectivamente, a los controles bajo, medio y alto (suministrados en pack de 3 viales cada uno de 1ml), introduciendo el control bajo 33 veces consecutivas, el medio 34 y el alto 33 en el mismo día, y empleándose los mismos reactivos y lotes.
- 2.
La imprecisión interdiaria se evaluó por medio de controles alto, medio y bajo 20 veces, respectivamente, a lo largo de días consecutivos.
- 3.
Ld. Se empleó un blanco compuesto por albúmina bovina en solución al 30% (Imumed, Bammental, Alemania), diluyéndola al 5% con PBS (Becton Dickinson, Bélgica), compuesto por cloruro sódico, EDTA disódico, cloruro potásico, fosfato potásico monobásico y fosfato sódico dibásico (n = 30).
Se calcularon: a) valores aberrantes; b) Lc; c) Ld, y d) Lq. Para la detección de la posible presencia de valores aberrantes, se siguieron las recomendaciones10,11 consistentes en ordenar los resultados de menor a mayor y seleccionar los 2 valores menores (X1 y X2) y los 2 mayores (Xn y Xn 1).
- −
X1 se considera aberrante si (X2 - X1) > (Xn - X1) / 3.
- −
Xn se considera aberrante si (Xn - Xn 1) > (Xn - X1) / 3.
En este caso, ni X1 ni Xn fueron aberrantes y no fue preciso eliminar ninguno de los valores obtenidos con el blanco.
Para la determinación del Lc se calculó la desviación típica del blanco (S0), escogiendo un error α de 0,05 y suponiendo una distribución normal de los resultados; el Lc se calculó con la siguiente fórmula10: Lc = media + 1,645 × S0. La estimación del Ld, considerando un error ß = 0,059, se calculó con la siguiente fórmula: Ld = media + 3,29 × S0.
Para el Lq se procedió a emplear la siguiente fórmula, presuponiendo una imprecisión máxima a valores bajos del 10% y suponiendo que la desviación típica se mantiene constante entre el valor cero y el del límite de cuantificación:
Lq = media + 10 * SO = 5,15 + 10*0, 19 = 7,05
CV = 100 * SO/Lq = 100 * SO / (10 * S0) = 10%.
n = 74 por ambos métodos:
- 1.
Obtención de plasma introduciendo las muestras en hielo o en nevera a 4°C inmediatamente después de la extracción y separando la fracción celular rápidamente antes de los 20min de su extracción.
- 2.
Congelación de las muestras a -20°C para su posterior medición (en las muestras a temperatura ambiente más de 4h se produce un incremento del 35% de los valores de la homocisteína)6,12.
Para el estudio comparativo entre los 2 métodos se empleó el paquete estadístico Excel, Microsoft Office 2000, y regresión de Passing-Bablok (MEDCAL 4.020.021).
ResultadosLos resultados de las imprecisiones intradía e interdía se muestran en las tablas 1 y 2, respectivamente.
Valores de la imprecisión intraserial obtenidos por nuestro laboratorio y Zappacosta et al, con el analizador BN II (Dade Behring)
| Alto | Medio | Bajo | |
| CV 1 (Zappacosta et al) (%) | 4,20a | 3,7a | 4,3a |
| CV 2 (Dade Behring) (%) | 4,60b | 3,4b | 4,5b |
| CV 3 (Hospital Virgen de la Victoria) (%) | 4,66c | 4,4d | 3,65c |
CV 1: coeficiente de variación obtenido por Zappacosta et al; CV 2: coeficiente de variación obtenido por el fabricante; CV 3: coeficiente de variación obtenido por nuestro laboratorio.
Estudio de la imprecisión interdiaria del analizador BN II obtenidos por Zappacosta et al, el fabricante (Dade Behring) y nuestro laboratorio
| Alto | Medio | Bajo | |
| CV 1 (Zappacosta et al) (%) | 5,2a | 4,8a | 6,2a |
| CV 2 (Dade Behring) (%) | 3,7b | 5,6b | 7,3b |
| CV 3 (Hospital Virgen de la Victoria) (%) | 6,73c | 6,55c | 6,77c |
CV 1: coeficiente de variación obtenido por Zappacosta et al; CV 2: coeficiente de variación obtenido por el fabricante; CV 3: coeficiente de variación obtenido por nuestro laboratorio.
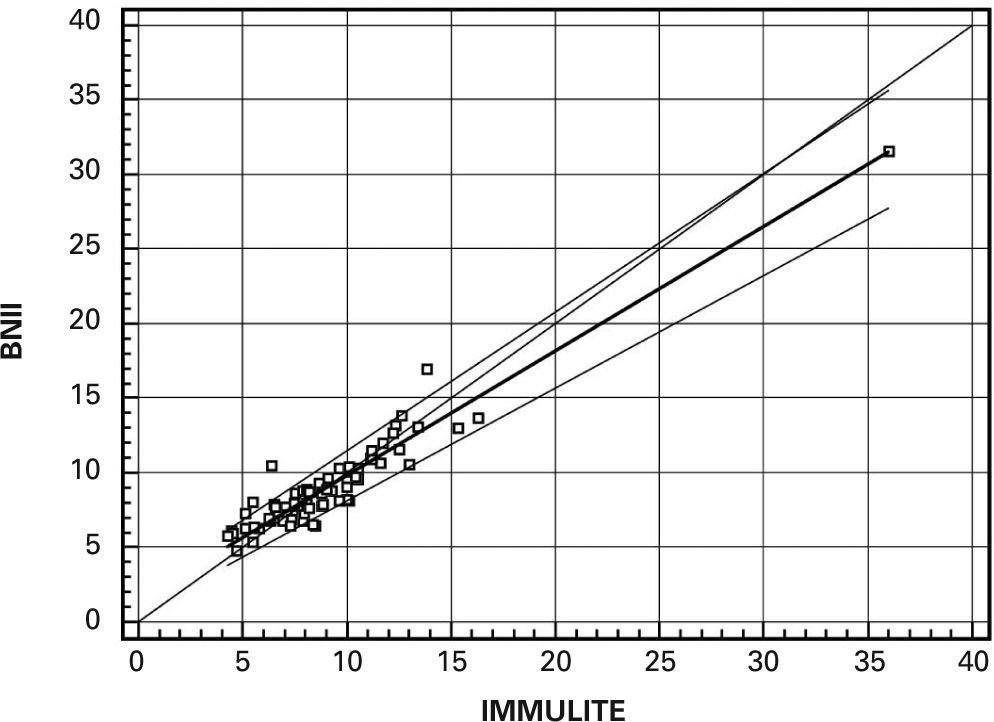
La correlación entre los 2 métodos fue: Y = 1,4825 + 0,8342X (INMULITE) (fig. 1). Los intervalos de confianza del 95% para la coordenada en el origen y la pendiente fueron: 0,355-2,238 y 0,7390,9515, respectivamente.
Empleando las fórmulas mencionadas en el apartado de "Material y método" se obtuvo un Lc = 5,46μmol/l; un Ld = 5,77μmol/l, y un Lq = 7,05μmol/l.
DiscusiónSe trata de un método que cumple las especificaciones de calidad analítica en cuanto a los CV intradía e interdía6, y el CV interdía es menor que el de las especificaciones mínimas recomendadas por la SEQC13: un 5,8% para la homocisteína.
Los resultados se correlacionan bien con el método tomado como referencia para este estudio (INMULITE), si bien no hay una transferibilidad directa entre ambos métodos, al no incluir el cero en la coordenada en origen ni el 1 en la pendiente de la recta de regresión.
Los resultados obtenidos en nuestro laboratorio comparados con los descritos por Zappacosta et al14, así como con los ofrecidos por el fabricante, son los presentados en la tabla 2, y son similares en los 3 casos.
El Ld o valor mínimo detectable11,15 obtenido por Zappacosta et al fue de 0,5 frente a 5,775μmol/l obtenido por nosotros, más de 10 veces superior. Esta diferencia podría deberse al diferente sistema empleado para la elaboración del blanco, ya que Zappacosta et al14 emplearon 3 muestras de plasma, con una concentración ya establecida de homocisteína, a las que se añadió L-homocisteína en cantidades conocidas, para posteriormente medirlas y establecer la diferencia entre los valores iniciales y los finales, obteniendo de este modo el porcentaje de recuperación.
En cambio, nosotros elaboramos una solución de albúmina bovina al 30% de Imumed (Bammental, Alemania), diluyéndola al 5% con PBS (Becton Dickinson, Bélgica), compuesto por cloruro sódico, EDTA disódico, cloruro potásico, fosfato potásico monobásico y fosfato sódico dibásico, procediendo a medirla 30 veces consecutivas en el mismo día y empleando los mismos reactivos.
Según la Comisión de Metrología de la SEQC en sus "Recomendaciones para el estudio de la capacidad de detección de los procedimientos de medida en el laboratorio clínico"11, la principal causa de errores en la estimación de los límites indicados es una selección inadecuada del material del blanco, por lo que debe emplearse un material que carezca del analito y en el que la concentración de la magnitud de medida sea cero.
Aunque en ocasiones es posible emplear agua o solución salina, es conveniente que el blanco tenga una composición lo más parecida posible a las muestras de los pacientes. Las recomendaciones de la SEQC para la preparación del material blanco aparecen publicados por Canalias Reverter10 y en nuestro caso (suero), consiste en preparar una solución de albúmina sérica bovina 50g/l y cloruro sódico 154mmol/l. Hay que destacar que el Lq (7,05μmol/l) es superior al límite inferior de la normalidad recomendado por el propio fabricante (4,9μmol/l).
En cuanto a la practicabilidad, un inconveniente es la escasa duración de sus reactivos (14 días si están en el frigorífico una vez abiertos y reconstituidos o 3 días, 8h por día, o un tiempo comparable, si están en el aparato), así como la de sus controles (14 días si se conservan en frío) y de su calibración (1 mes).