La variación biológica (VB) es la fluctuación fisiológica de los constituyentes de los fluidos humanos alrededor del punto homeostático, considerada de forma individual (CVI) o entre diferentes individuos. Los datos derivados de su estudio se usan como propuesta del valor de referencia de un cambio (VRC) entre resultados seriados de un mismo individuo. El VRC estimado a partir de individuos sanos se ha utilizado en el control de la evolución clínica de los pacientes con el fin de discriminar si se produce un cambio significativo en una serie de resultados analíticos.
ObjetivoEl objetivo del presente trabajo es revisar los datos de VB en situaciones patológicas para aplicarla al uso de la práctica clínica, especialmente en el seguimiento de pacientes.
Material y métodoEl material usado en este estudio se recogió a partir de artículos referenciados en los buscadores electrónicos, libros y tesis doctorales. Se ha recopilado y ordenado alfabéticamente un total de 66 magnitudes biológicas en 34 situaciones patológicas.
Resultados y conclusionesPara la mayoría de las magnitudes estudiadas, los valores de CVI en estados patológicos son similares a los encontrados en individuos sanos. Sin embargo, para las magnitudes consideradas como marcadores específicos de órgano, los valores de CVI son muy diferentes (superiores o inferiores) a los obtenidos en personas sanas. Esto implica que los valores VRC procedentes de personas sanas pueden no ser adecuados para el seguimiento de los pacientes. Hay un riesgo de que se produzcan falsos positivos (o negativos) sobre cambios del estado de salud, con sus correspondientes implicaciones clínicas.
Biological variation (BV) refers to the natural fluctuation of a physiological constituent around the homeostatic set point within a person (CVI), as well as the natural variation between persons. The data derived from the components of BV are used to propose the reference change value (RCV) for monitoring patients.
ObjectiveThe aim of this review is to show the state of the art for biological variation data in non-healthy situations in order to have an indication of whether the data derived in specific pathological situations might be useful for clinical applications.
Material and methodThe information used in this study was retrieved from published articles referenced in electronic search systems, books and a doctoral thesis. The analytes studied were listed in alphabetical order.
Results and conclusionsFor the majority of quantities studied, CVI values are of the same order in disease and health: thus the use of RCV derived from healthy subjects for monitoring patients would be reasonable. However, for a small number of quantities considered to be disease specific markers, the CVI differed from those in health. This could mean that RCV derived from healthy CVI may not be appropriate for monitoring patients in certain diseases. Hence, disease specific RCV may be clinically useful.
La variación biológica (VB) es la fluctuación fisiológica de un constituyente en un fluido biológico, considerada de forma individual o entre diferentes individuos. Existen 2 componentes en la VB: la variación en un individuo alrededor del punto homeostático (variación individual) y las diferencias en los puntos homeostáticos en un grupo de individuos (variación interindividual), que en términos matemáticos se expresan como coeficientes de variación: CVI y CVG, respectivamente.
El método para estimar los componentes de la VB ha sido descrito exhaustivamente por Fraser y Harris1 y Fraser2. Esencialmente, se basa en el análisis de varias muestras seriadas procedentes de varios individuos, obtenidas siguiendo un protocolo establecido. Las condiciones más importantes de este protocolo se exponen a continuación:
- –
Los individuos deben estar en condiciones estables. En personas sanas se trata simplemente de seguir con su estilo de vida. En estados patológicos, la enfermedad no debe estar en fase aguda, ya que esto podría implicar fuertes cambios en períodos cortos. Además, se ha de tener en cuenta que en los estados patológicos el punto de homeostasis se puede alterar por pautas medicamentosas, cambios fisiológicos e impacto de posibles disfunciones de otros órganos; por tanto, se debe estudiar la variación biológica en períodos de estabilidad dentro del estado patológico.
- –
La fase preanalítica ha de estar muy bien estandarizada, tanto en la preparación del paciente como en el procedimiento de obtención de las muestras y almacenamiento y manipulación de éstas hasta su análisis en el laboratorio.
- –
La variabilidad del proceso analítico debe minimizarse y estar perfectamente medida.
- –
El estudio estadístico de los datos obtenidos debe ponderar todas las causas de variabilidad, por lo que ha de utilizarse la prueba de análisis de la varianza (ANOVA)1,2.
Los datos derivados de los componentes de la VB se usan, entre otros, para los siguientes fines:
- –
Descripción de las especificaciones de la calidad analítica como base para la toma de decisiones médicas3.
- –
Determinar el número de muestras que se requieren para la estimación del punto homeostático4.
- –
Establecer la utilidad del intervalo de referencia poblacional5.
- –
Calcular el valor de referencia de un cambio (VRC) entre resultados seriados de un paciente6-8.
El VRC estimado a partir de individuos sanos se ha utilizado en el control de la evolución clínica de pacientes, con el fin de discriminar si existe un cambio significativo en una serie de resultados analíticos2, es decir, si la diferencia entre los resultados obtenidos en 2 análisis consecutivos realizados en un tiempo determinado se debe a cambios en el estado de salud del paciente o a la variabilidad analítica y/o biológica. Si la diferencia, expresada en porcentaje, es mayor que el VRC, se puede pensar que el estado de salud del paciente ha variado desde que se realizó la anterior analítica. Sin embargo, teniendo en cuenta que la enfermedad puede implicar alteración del punto de equilibrio homeostático, el uso del VRC obtenido de personas sanas puede no ser apropiado para controlar a pacientes cuya enfermedad esté en fase evolutiva. Se han publicado varios trabajos en esta línea, por ejemplo, en pacientes trasplantados renales para detectar rechazos o crisis9, así como en la enfermedad hepática crónica para detectar carcinoma hepatocelular10. Estos estudios (los primeros que han aplicado datos derivados de la VB para controlar a pacientes) han demostrado que el laboratorio puede detectar cambios relevantes en la situación analítica del paciente utilizando el VRC antes de que estos cambios se manifiesten clínicamente.
Muchos autores han publicado trabajos sobre los componentes de la variación biológica. Hace algunos años, este mismo grupo de trabajo recogió en una base de datos los componentes de variación biológica para un número considerable de magnitudes en sujetos sanos, que se ha ido actualizando y está disponible en diversas publicaciones e internet11,14.
El objetivo del presente trabajo es revisar los datos de VB en situaciones patológicas y organizar la información obtenida de una forma asequible para su uso en la práctica clínica, especialmente en el seguimiento de pacientes. Mostramos el componente individual de la variación biológica (CVI) para un amplio abanico de situaciones patológicas y un gran número de magnitudes biológicas comúnmente determinadas en los laboratorios clínicos asistenciales. Se comparan los resultados obtenidos en pacientes con los de personas sanas, para conocer si los datos derivados de situaciones patológicas concretas pueden ser de utilidad para aplicaciones clínicas.
Material y métodoEl material usado en este estudio se recogió, junto con los datos para individuos sanos, a partir de artículos cuyo objetivo era determinar componentes de VB. También se recogieron libros y tesis doctorales facilitados por sus autores al grupo autor de este trabajo. El presente trabajo recoge solamente los artículos que hacen referencia a pacientes.
Cada artículo fue revisado por 2 autores para valorar de forma independiente su inclusión o rechazo. Los criterios de rechazo se exponen a continuación:
- –
Artículos que no estaban específicamente diseñados para estimar los componentes de VB.
- –
Cálculo de componentes de VB con modelos matemáticos poco robustos y no basados en análisis de varianza.
Para cada magnitud recopilada, cada situación patológica y cada artículo revisado se registraron los siguientes datos:
- –
Componentes de la VB, sobre todo CVI.
- –
Sistema biológico estudiado.
- –
Número de sujetos estudiados en cada trabajo (N).
- –
Período de tiempo de estudio, expresado en días (D).
- –
Número de muestras obtenidas en cada sujeto (M).
- –
Situación patológica.
- –
Media y unidades de expresión de resultados.
Para facilitar el estudio de esta información, se utilizó el siguiente método:
- –
Ordenar alfabétiamente las magnitudes biológicas recopiladas en cada estado patológico.
- –
Para cada magnitud, ordenar los valores de CVI de menor a mayor.
- –
Comparar los CVI encontrados con los de sujetos sanos.
- –
Cuando se encontraban diferencias, se revisaba cada magnitud para detectar posibles asociaciones entre el CVI y alguna otra variable, como situación patológica (fase aguda o crónica), amplitud del intervalo entre muestreos y número de sujetos estudiados.
Tomando los datos de fosfatasa alcalina como ejemplo del procedimiento seguido, observamos que esta magnitud se estudió en 3 situaciones patológicas diferentes. En 2 de ellas, los valores de CVI eran similares a los encontrados en sujetos sanos, mientras que en una tercera situación este valor se duplicaba.
En una inspección de los datos se observó lo siguiente:
- –
El número de sujetos estudiado era similar en las 2 situaciones patológicas con CVI parecido al de sujetos sanos y en el grupo de sanos.
- –
La amplitud del intervalo de estudio era similar en sujetos sanos y en las 3 situaciones patológicas, aunque el CVI fuese diferente en una de ellas.
- –
En todas las situaciones patológicas, los sujetos estaban en fase crónica, por lo que se consideró que las diferencias observadas eran reales y no influían otros factores.
La base de datos contiene 66 magnitudes, descritas en 34 situaciones patológicas, obtenidas de 45 artículos publicados en 15 revistas distintas. Los autores realizan estudios en individuos de distinta procedencia. La mayoría de las muestras analizadas corresponden a suero y en menor número a orina y sudor.
Respecto al número de artículos revisados, se observa que 39 magnitudes se encuentran publicadas en un único artículo y 27 aparecen en más de uno; el sodio y el potasio son las magnitudes más estudiadas, con 8 artículos cada una.
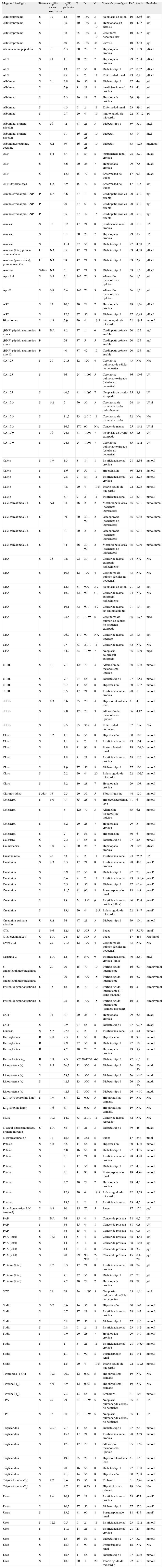
Los resultados obtenidos se presentan en la tabla 1.
Recopilación de datos de variación biológica en enfermedades
| Magnitud biológica | Sistema | cvI(%) sanos (mediana) | cvI(%) pacientes | N | D | M | Situación patológica | Ref. | Media | Unidades |
| Alfafetoproteína | S | 12 | 12 | 30 | 180 | 3 | Neoplasia de colon | 10 | 2,86 | μg/l |
| Alfafetoproteína | S | 35 | 40 | 180 | 3-10 | Hepatopatía sin cirrosis | 10 | 4,07 | μg/l | |
| Alfafetoproteína | S | 38 | 85 | 180 | 3-10 | Carcinoma hepatocelular | 10 | 3,97 | μg/l | |
| Alfafetoproteína | S | 40 | 45 | 180 | 38 | Cirrosis | 10 | 3,83 | μg/l | |
| Alanina aminopeptidasa | S | 4,1 | 4,3 | 20 | 28 | 7 | Hepatopatía crónica | 29 | 1,39 | μKat/l |
| ALT | S | 24 | 11 | 20 | 28 | 7 | Hepatopatía crónica | 29 | 2,04 | μKat/l |
| ALT | S | 13 | 27 | 56 | 8 | Diabetes tipo 1 | 27 | 0,52 | μKat/l | |
| ALT | S | 25 | 9 | 2 | 11 | Enfermedad renal | 23 | 0,21 | μKat/l | |
| Albúmina | S | 3,1 | 2,8 | 16 | 56 | 8 | Diabetes tipo 1 | 27 | 44 | g/l |
| Albúmina | S | 2,9 | 8 | 21 | 8 | jnsuficiencia renal crónica | 28 | 41 | g/l | |
| Albúmina | S | 3,3 | 20 | 28 | 7 | Hepatopatía crónica | 29 | 39 | g/l | |
| Albúmina | S | 4,3 | 9 | 2 | 11 | Enfermedad renal | 23 | 39,1 | g/l | |
| Albúmina | S | 6,7 | 20 | 4 | 19 | jnfarto agudo de miocardio | 22 | 37,12 | g/l | |
| Albúmina, primera micción | U | 36 | 42 | 47 | 21 | 3 | Diabetes tipo 1 | 39 | 350 | mg/l |
| Albúmina, primera micción | U | 61 | 16 | 21-28 | 10 | Diabetes | 33 | 14 | mg/l | |
| Albúmina/creatinina, cociente | U | NA | 39 | 16 | 21-28 | 10 | Diabetes | 33 | 1,25 | mg/mmol |
| ALP | S | 6,4 | 6,4 | 8 | 84 | 8 | jnsuficiencia renal crónica | 28 | 3,21 | μKat/l |
| ALP | S | 6,6 | 20 | 28 | 7 | Hepatopatía crónica | 29 | 7,5 | μKat/l | |
| ALP | S | 12,4 | 15 | 72 | 5 | Enfermedad de Paget | 17 | 9,8 | μKat/l | |
| ALP isoforma ósea | S | 6,2 | 4,9 | 15 | 72 | 5 | Enfermedad de Paget | 17 | 136 | μg/l |
| Aminoterminal pro-BNP | P | NA | 8,6 | 37 | 1 | 6 | Cardiopatía crónica estable | 20 | 570 | ng/l |
| Aminoterminal pro-BNP | P | 20 | 37 | 5 | 5 | Cardiopatía crónica estable | 20 | 570 | ng/l | |
| Aminoterminal pro-BNP | P | 35 | 37 | 42 | 15 | Cardiopatía crónica estable | 20 | 570 | ng/l | |
| Amilasa | S | 12 | 8,2 | 17 | 21 | 8 | jnsuficiencia renal crónica | 28 | 110 | U/l |
| Amilasa | S | 8,4 | 20 | 28 | 7 | Hepatopatía crónica | 29 | 8,7 | U/l | |
| Amilasa | S | 11,1 | 27 | 56 | 8 | Diabetes tipo 1 | 27 | 4,58 | U/l | |
| Amilasa (total) primera orina mañana | U | NA | 35 | 47 | 21 | 3 | Diabetes tipo 1 | 39 | 4,58 | μKat/l |
| Amilasa (pancreática), primera micción | U | NA | 38 | 47 | 21 | 3 | Diabetes tipo 1 | 39 | 2,9 | μKat/l |
| Amilasa | Saliva | NA | 51 | 47 | 21 | 3 | Diabetes tipo 1 | 39 | 1,6 | μKat/l |
| Apo A-1 | S | 6,5 | 7,1 | 143 | 70 | 3 | Alteración metabolismo lipídico | 36 | 1,5 | g/l |
| Apo B | S | 6,9 | 6,4 | 143 | 70 | 3 | Alteración metabolismo lipídico | 36 | 1,71 | g/l |
| AST | S | 12 | 10,6 | 20 | 28 | 7 | Hepatopatía crónica | 29 | 1,76 | μKat/l |
| AST | S | 12,3 | 37 | 56 | 8 | Diabetes tipo 1 | 27 | 0,48 | μKat/l | |
| Bicarbonato | S | 4,8 | 7,9 | 20 | 4 | 19,5 | jnfarto agudo de miocardio | 22 | 19,5 | mmol/l |
| (BNP) péptido natriurético tipo a | P | NA | 8,2 | 37 | 1 | 6 | Cardiopatía crónica estable | 20 | 135 | ng/l |
| (BNP) péptido natriurético tipo a | P | 24 | 37 | 5 | 5 | Cardiopatía crónica estable | 20 | 135 | ng/l | |
| (BNP) péptido natriurético tipo 13 | P | 40 | 37 | 42 | 15 | Cardiopatía crónica estable | 20 | 135 | ng/l | |
| CA 125 | S | 29 | 21,8 | 12 | 120 | 4 | Carcinoma pulmonar de células no pequeñas | 43 | NA | NA |
| CA 125 | S | 36 | 24 | 1.095 | 5 | Carcinoma pulmonar extirpado (células no pequeñas) | 36 | 10,6 | U/l | |
| CA 125 | S | 46,2 | 41 | 1.095 | 7 | Neoplasia de ovario extirpada | 35 | 8,8 | U/l | |
| CA 15.3 | S | 6,2 | 7 | 50 | 30 | 3 | Carcinoma de mama extirpado radicalmente | 24 | 16 | U/ml |
| CA 15.3 | S | 11,2 | 33 | 2.010 | 11 | Carcinoma de mama extirpado | 32 | NA | NA | |
| CA 15.3 | S | 16,7 | 170 | 90 | NA | Cáncer de mama | 25 | 16,2 | U/ml | |
| CA 19.9 | S | 16 | 24,5 | 41 | 1.095 | 7 | Neoplasia de ovario extirpado | 35 | 8,8 | U/l |
| CA 19.9 | S | 24,5 | 24 | 1.095 | 7 | Carcinoma pulmonar extirpado (células no pequeñas) | 35 | 13,2 | U/l | |
| Calcio | S | 1,9 | 1,3 | 8 | 84 | 8 | Insuficiencia renal crónica | 28 | 2,34 | mmol/l |
| Calcio | S | 1,6 | 14 | 56 | 8 | Hipertensión | 30 | 2,34 | mmol/l | |
| Calcio | S | 2,8 | 9 | 84 | 11 | Insuficiencia renal crónica | 28 | 2,23 | mmol/l | |
| Calcio | S | 4,8 | 20 | 4 | 19,5 | Infarto agudo de miocardio | 22 | 2,25 | mmol/l | |
| Calcio | S | 6,7 | 9 | 2 | 11 | Insuficiencia renal | 23 | 2,4 | mmol/l | |
| Calcio/creatinina 2h | U | NA | 33 | 46 | 2 | 2 | Metabolopatía ósea (pacientes ingresados) | 45 | 0,31 | mmol/mmol |
| Calcio/creatinina 2h | U | 39 | 20 | 30-90 | 2 | Osteoporosis (pacientes no ingresados) | 45 | 0,48 | mmol/mmol | |
| Calcio/creatinina 2h | U | 41 | 20 | 2 | 2 | Osteoporosis (pacientes ingresados) | 45 | 0,31 | mmol/mmol | |
| Calcio/creatinina 2h | U | 44 | 46 | 30-90 | 2 | Metabolopatía ósea (pacientes no ingresados) | 45 | 0,39 | mmol/mmol | |
| CEA | S | 13 | 9,8 | 92 | 30 | 3 | Cáncer de mama extirpado radicalmente | 24 | NA | NA |
| CEA | S | 10,6 | 12 | 120 | 4 | Carcinoma de pulmón (células no pequeñas) | 43 | NA | NA | |
| CEA | S | 12,4 | 31 | 900 | 3-7 | Neoplasia de colon | 21 | 1,8 | μg/l | |
| CEA | S | 16,2 | 420 | 90 | > 3 | Cáncer de mama extirpado radicalmente | 24 | NA | NA | |
| CEA | S | 19,1 | 32 | 901 | 4-7 | Cáncer de mama sin sintomatología | 21 | 1,4 | μg/l | |
| CEA | S | 23,6 | 24 | 1.095 | 5 | Carcinoma de pulmón de células no pequeñas extirpado | 35 | 1,77 | mg/l | |
| CEA | S | 26,9 | 170 | 90 | NA | Cáncer de mama operado | 25 | 1,6 | μg/l | |
| CEA | S | 27 | 33 | 2.010 | 11 | Cáncer de mama | 32 | NA | NA | |
| CEA | S | 44,9 | 33 | 1.095 | 7 | Neoplasia colorrectal extirpada | 35 | 1,99 | mg/l | |
| cHDL | S | 7,1 | 7,1 | 128 | 70 | 3 | Alteración del metabolismo lipídico | 36 | 1,36 | mmol/l |
| cHDL | S | 7,7 | 27 | 56 | 8 | Diabetes tipo 1 | 27 | 1,53 | mmol/l | |
| cHDL | S | 8,7 | 14 | 56 | 8 | Hipertensión | 30 | 1,07 | mmol/l | |
| cHDL | S | 9,5 | 17 | 21 | 8 | Insuficiencia renal crónica | 28 | 1 | mmol/l | |
| cLDL | S | 8,3 | 6,6 | 35 | 28 | 4 | Hipercolesterolemia leve | 41 | 4,3 | mmol/l |
| cLDL | S | 7,8 | 128 | 70 | 3 | Alteración del metabolismo lipídico | 36 | 4,12 | mmol/l | |
| cLDL | S | 9,5 | 85 | 365 | 4 | Enfermedad coronaria | 37 | NA | NA | |
| Cloro | S | 1,2 | 1,1 | 14 | 56 | 8 | Hipertensión | 30 | 105 | mmol/l |
| Cloro | S | 1,1 | 9 | 2 | 11 | Insuficiencia renal | 23 | 104 | mmol/l | |
| Cloro | S | 1,8 | 41 | 90 | 8 | Postrasplantado renal | 18 | 108,6 | mmol/l | |
| Cloro | S | 1,8 | 8 | 21 | 8 | Insuficiencia renal crónica | 28 | 110 | mmol/l | |
| Cloro | S | 1,9 | 27 | 56 | 8 | Diabetes tipo 1 | 27 | 100 | mmol/l | |
| Cloro | S | 2,2 | 20 | 4 | 20 | Infarto agudo de miocardio | 22 | 102,7 | mmol/l | |
| Cloro | S | 3,2 | 10 | 28 | 7 | Hepatopatía crónica | 29 | 103 | mmol/l | |
| Cloruro sódico | Sudor | 15 | 7,3 | 20 | 35 | 5 | Fibrosis quistita | 44 | 120 | mmol/l |
| Colesterol | S | 6,0 | 4,7 | 35 | 28 | 4 | Hipercolesterolemia leve | 41 | 6 | mmol/l |
| Colesterol | S | 5 | 128 | 70 | 3 | Alteración metabolismo lipídico | 35 | 6,1 | mmol/l | |
| Colesterol | S | 5,2 | 20 | 28 | 7 | Hepatopatía crónica | 29 | 5 | mmol/l | |
| Colesterol | S | 7 | 14 | 56 | 8 | Hipertensión | 30 | 6 | mmol/l | |
| Colesterol | S | 7,2 | 27 | 56 | 8 | Diabetes tipo 1 | 27 | 5,6 | mmol/l | |
| Colinesterasa | S | 7,0 | 7,1 | 20 | 28 | 7 | Hepatopatía crónica | 29 | 103 | μKat/l |
| Creatincinasa | S | 23 | 43 | 9 | 2 | 11 | Insuficiencia renal | 23 | 75,2 | U/l |
| Creatinina | S | 4,3 | 5,3 | 17 | 21 | 8 | Insuficiencia renal crónica | 28 | 483 | μmol/l |
| Creatinina | S | 5,9 | 27 | 56 | 8 | Diabetes tipo 1 | 27 | 73 | μmol/l | |
| Creatinina | S | 6,4 | 9 | 2 | 11 | Insuficiencia renal | 23 | 190,4 | μmol/l | |
| Creatinina | S | 6,5 | 11 | 56 | 8 | Diabetes tipo 1 | 27 | 63,6 | μmol/l | |
| Creatinina | S | 11,5 | 41 | 90 | 8 | Postransplantado renal | 18 | 148 | μmol/l | |
| Creatinina | S | 13 | 54 | 540 | 9 | Insuficiencia renal crónica (niños) | 40 | 52,4 | μmol/l | |
| Creatinina | S | 13,4 | 20 | 4 | 19,5 | Infarto agudo de miocardio | 22 | 84,7 | μmol/l | |
| Creatinina, primera micción | U | NA | 34 | 47 | 21 | 3 | Diabetes tipo 1 | 39 | 10,1 | mmol/l |
| CTx | S | 9,6 | 12,4 | 15 | 365 | 5 | Paget | 17 | 5.976 | pmol/l |
| CTx/creatinina 2h | U | NA | 24 | 15 | 365 | 5 | Paget | 17 | 484 | Mg/mmol |
| Cyfra 21,1 | S | 22 | 21,8 | 12 | 120 | 4 | Carcinoma de pulmón (células no pequeñas) | 43 | NA | NA |
| Cistatina-C | S | NA | 12 | 54 | 540 | 9 | Insuficiencia renal crónica (niños) | 40 | 2,81 | mg/l |
| 8-aminolevulínico/creatinina | U | 20 | 20 | 15 | 70 | 10 | Porfiria aguda intermitente | 16 | 6,9 | Mmol/mmol |
| 8-aminolevulínico/creatinina | U | 20 | 15 | 720 | 15 | Porfiria aguda intermitente | 16 | 6,7 | Mmol/mmol | |
| Fosfobilinógeno/creatinina | U | 15 | 18 | 15 | 70 | 10 | Porfiria aguda intermitente (1.' orina mañana) | 16 | 5 | Mmol/mmol |
| Fosfobilinógeno/creatinina | U | 25 | 15 | 720 | 15 | Porfiria aguda intermitente (primera micción) | 16 | 5 | Mmol/mmol | |
| GGT | S | 14 | 4,7 | 20 | 28 | 7 | Hepatopatía crónica | 29 | 6,8 | μKat/l |
| GGT | S | 9,9 | 27 | 56 | 8 | Diabetes tipo 1 | 27 | 0,37 | μKat/l | |
| Glucosa | S | 5,7 | 27,4 | 9 | 2 | 11 | Insuficiencia renal | 23 | 5,1 | mmol/l |
| Hemoglobina | B | 2,8 | 2,3 | 14 | 56 | 8 | Hipertensión | 30 | 9,8 | mmol/l |
| Hemoglobina | B | 2,9 | 27 | 56 | 8 | Diabetes tipo 1 | 27 | 10,1 | mmol/l | |
| Hemoglobina | B | 4,2 | 20 | 28 | 7 | Hepatopatía crónica | 29 | 8,9 | mmol/l | |
| Hemoglobina A1c | B | 1,9 | 4,3 | 47720-1260 | 4-7 | Diabetes tipo 2 | 42 | 6,5 | % | |
| Lipoproteína (a) | S | 8,5 | 26,2 | 12 | 360 | 4 | Diabetes tipo 1 | 26 | 20-30 | mg/dl |
| Lipoproteína (a) | S | 23,3 | 24 | 360 | 4 | Diabetes tipo 1 | 26 | > 40 | mg/dl | |
| Lipoproteína (a) | S | 42,3 | 13 | 360 | 4 | Diabetes tipo 1 | 26 | 10-20 | mg/dl | |
| Lipoproteína (a) | S | 42,3 | 21 | 360 | 4 | Diabetes tipo 1 | 26 | < 10 | mg/dl | |
| LT3 (triyodotironina libre) | S | 7,9 | 8,7 | 12 | 0,33 | 5 | Hipotiroidismo primario | 19 | NA | NA |
| LT4 (tiroxina libre) | S | 7,6 | 5,7 | 12 | 0,33 | 5 | Hipotiroidismo primario | 19 | NA | NA |
| MCA | S | 10,1 | 14,9 | 33 | 2.010 | 11 | Cáncer de mama resecado | 32 | NA | NA |
| N-acetil-glucosaminidasa, primera micción | U | NA | 58 | 47 | 21 | 3 | Diabetes tipo 1 | 39 | 48 | nKat/l |
| NTx/creatinina 2h | U | 17 | 15,8 | 15 | 365 | 5 | Paget | 17 | 248 | nmol |
| Potasio | S | 4,8 | 4,5 | 14 | 56 | 8 | Hipertensión | 30 | 4,36 | mmol/l |
| Potasio | S | 4,8 | 16 | 56 | 8 | Diabetes tipo 1 | 27 | 4,65 | mmol/l | |
| Potasio | S | 5,1 | 17 | 21 | 8 | Insuficiencia renal crónica | 28 | 4,98 | mmol/l | |
| Potasio | S | 7 | 11 | 56 | 8 | Diabetes tipo 1 | 27 | 4,81 | mmol/l | |
| Potasio | S | 7,1 | 41 | 90 | 8 | Postransplantado renal | 18 | 4,46 | mmol/l | |
| Potasio | S | 7,7 | 20 | 28 | 7 | Hepatopatía crónica | 29 | 4,5 | mmol/l | |
| Potasio | S | 12,4 | 20 | 4 | 19,5 | Infarto agudo de miocardio | 22 | 3,68 | mmol/l | |
| Potasio | S | 13,3 | 9 | 2 | 11 | Insuficiencia renal | 23 | 4,5 | mmol/l | |
| Procolágeno (tipo I, N-terminal) | S | 6,8 | 10 | 15 | 72 | 5 | Paget | 17 | 176 | μg/l |
| PAP | S | NA | 34 | 15 | 4 | 8 | Cáncer de próstata | 38 | 6,7 | U/l |
| PAP | S | 34 | 15 | 4 | 8 | Cáncer de próstata | 38 | 0,8 | U/l | |
| PAP | S | 34 | 15 | 4 | 8 | Cáncer de próstata | 38 | 0,3 | U/l | |
| PSA (total) | S | 18,1 | 14 | 5 | 4 | 8 | Cáncer de próstata | 38 | 40,3 | μg/l |
| PSA (total) | S | 14 | 5 | 4 | 8 | Cáncer de próstata | 38 | 10,8 | μg/l | |
| PSA (total) | S | 14 | 5 | 4 | 8 | Cáncer de próstata | 38 | 3,2 | μg/l | |
| PSA (total) | S | 20 | 890 | 90-960 | 2-10 | Cáncer de próstata | 15 | 0,1-20 | μg/l | |
| Proteína (total) | S | 2,7 | 3,3 | 17 | 21 | 8 | Insuficiencia renal crónica | 28 | 74 | g/l |
| Proteína (total) | S | 4,1 | 27 | 56 | 8 | Diabetes tipo 1 | 27 | 73 | g/l | |
| Proteína (total) | S | 4,2 | 20 | 28 | 7 | Hepatopatía crónica | 29 | 78 | g/l | |
| SCC | S | 39 | 39 | 24 | 1.095 | 5 | Neoplasia pulmonar de células no pequeñas | 35 | 1,01 | mg/l |
| Sodio | S | 0,7 | 0,6 | 14 | 56 | 8 | Hipertensión | 30 | 143 | mmol/l |
| Sodio | S | 0,7 | 17 | 21 | 8 | Insuficiencia renal crónica | 28 | 142 | mmol/l | |
| Sodio | S | 0,8 | 27 | 56 | 8 | Diabetes tipo 1 | 27 | 140 | mmol/l | |
| Sodio | S | 0,8 | 9 | 2 | 11 | Insuficiencia renal | 23 | 142 | mmol/l | |
| Sodio | S | 0,9 | 20 | 28 | 7 | Hepatopatía crónica | 29 | 140 | mmol/l | |
| Sodio | S | 1 | 8 | 21 | 11 | Insuficiencia renal crónica | 28 | 143,4 | mmol/l | |
| Sodio | S | 1,1 | 41 | 90 | 8 | Postransplante renal | 18 | 141 | mmol/l | |
| Sodio | S | 1,5 | 20 | 4 | 19.5 | Infarto agudo de miocardio | 22 | 139,8 | mmol/l | |
| Tirotropina (TSH) | S | 19,3 | 20,2 | 12 | 0,33 | 5 | Hipotiroidismo primario | 19 | NA | NA |
| Tiroxina (T4) | S | 4,9 | 4,9 | 12 | 0.33 | 5 | Hipotiroidismo primario | 19 | NA | NA |
| Tiroxina (T4) | S | 7,3 | 13 | 56 | 8 | Embarazo | 31 | 108 | mmol/l | |
| TPA | S | 29 | 29 | 24 | 1.095 | 5 | Neoplasia pulmonar de células no pequeñas | 35 | 61 | U/l |
| TPS | S | 36 | 36 | 24 | 1.095 | 5 | Neoplasia pulmonar de células no pequeñas | 35 | 47 | U/l |
| Triglicéridos | S | 20,9 | 7,7 | 11 | 56 | 8 | Diabetes tipo 1 | 27 | 2,4 | mmol/l |
| Triglicéridos | S | 15,4 | 17 | 21 | 8 | Insuficiencia renal crónica | 28 | 3,59 | mmol/l | |
| Triglicéridos | S | 17,8 | 128 | 70 | 3 | Alteración metabolismo lipídico | 35 | 1,46 | mmol/l | |
| Triglicéridos | S | 19,6 | 35 | 28 | 4 | Hipercolesterolemia leve | 41 | 1,41 | mmol/l | |
| Triglicéridos | S | 20 | 16 | 56 | 8 | Diabetes tipo 1 | 27 | 1,88 | mmol/l | |
| Triglicéridos | S | 21,8 | 14 | 56 | 8 | Hipertensión | 30 | 2,88 | mmol/l | |
| Triyodotironina (T3) | S | 8,7 | 8,4 | 13 | 56 | 8 | Embarazo | 31 | 2,96 | mmol/l |
| Triyodotironina (T3) | S | 8,7 | 12 | 0,33 | 5 | Hipotiroidismo primario | 19 | NA | NA | |
| Urato | S | 8,6 | 10,1 | 17 | 21 | 8 | Insuficiencia renal crónica | 28 | 477 | μmol/l |
| Urato | S | 10,3 | 27 | 56 | 8 | Diabetes tipo 1 | 27 | 276 | μmol/l | |
| Urato | S | 13,2 | 41 | 90 | 8 | Postransplantado renal | 18 | 415 | μmol/l | |
| Urea | S | 12,3 | 6,5 | 9 | 2 | 11 | Insuficiencia renal | 23 | 13,2 | mmol/l |
| Urea | S | 11,7 | 17 | 21 | 8 | Insuficiencia renal crónica | 28 | 21 | mmol/l | |
| Urea | S | 13 | 16 | 56 | 8 | Diabetes tipo 1 | 27 | 5,9 | mmol/l | |
| Urea | S | 15,3 | 41 | 90 | 8 | Postransplante renal | 18 | NA | NA | |
| Urea | S | 15,6 | 11 | 56 | 8 | Diabetes tipo 1 | 27 | 5,26 | mmol/l | |
| Urea | S | 18,3 | 20 | 4 | 20 | Infarto agudo de miocardio | 22 | 5,31 | mmol/l | |
ALT: alanina aminotransferasa; ALP: fosfatasa alcalina; Apo A-1: apolipoproteína A-1; Apo B: apolipoproteína B; AST: aspartato aminotransferasa; B: sangre total; BNP: péptido natriurético cerebral; CEA: antígeno carcinoembrionario; cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; CTx: C-telopéptido del colágeno tipo I; CV1 : variación biológica intraindividual; D: período (días); GGT: gammaglutamil transferasa; M: número de muestras obtenido de cada sujeto; MCA: antígeno mucinoso asociado a carcinoma; N: número de sujetos estudiado; NA: no disponible; NTx: N-telopéptido del colágeno tipo I; P: plasma; PAP: fosfatasa ácida prostática; PSA: antígeno prostático especifico; Ref.: referencia bibliográfica; S: suero; SCC: antígeno de carcinoma de células escamosas; U: orina.
En la misma tabla se muestra el CVI para sujetos sanos, procedente de nuestra base de datos11 que se actualiza cada 2 años13,14.
DiscusiónLos datos derivados de la VB en individuos sanos se han utilizado para la toma de decisiones clínicas en estados patológicos. Sin embargo, debe verificarse la conveniencia de esta práctica, puesto que hasta ahora no había información que clarificase si la variación biológica era similar en individuos sanos o enfermos.
Los resultados de este estudio demuestran que los valores de CVI encontrados en pacientes son similares a los hallados en individuos sanos.
No se pudo realizar estudios estadísticos debido al pequeño número de medidas disponibles para cada magnitud, la heterogeneidad de los diseños y los métodos usados por los distintos autores, así como que en ocasiones las situaciones patológicas no estaban perfectamente definidas.
La distribución de los valores de CVI en magnitudes no consideradas como marcadores específicos de órgano era similar a la encontrada en personas sanas. Así, por ejemplo, el sodio en suero, una de las magnitudes descritas en un mayor número de artículos, presentó valores de CVI comprendidos entre el 0,6 y el 1,5%, con una mediana del 0,8% (la distribución en individuos sanos es del 0,3 al 2%, con una mediana del 0,7%). Estos resultados podrían no tener repercusiones en sus aplicaciones clínicas, lo que implicaría que en muchas situaciones patológicas en estado crónico estable se podrían utilizar VRC procedentes de individuos sanos, como se ha mencionado anteriormente2.
No obstante, la inspección visual de los resultados permite resaltar una observación importante. En ciertas enfermedades, las magnitudes consideradas como marcadores específicos de órgano muestran valores de CVI más elevados, que en otras situaciones patológicas (tabla 1):
- –
Alfafetoproteína: el CVI es más alto en enfermedades hepáticas que en sujetos sanos, y es similar al de éstos en otras situaciones patológicas (neoplasia de colon).
- –
Antígeno carcinoembrionario: los valores de CVI son más altos en pacientes con cáncer colorrectal que en otras enfermedades.
- –
CA 125: el CVI en cáncer de ovario es superior al encontrado en personas sanas, y esta magnitud es el marcador con mayor especificidad para dicha enfermedad.
- –
CA 15.3: el CVI en cáncer de mama es más alto que en personas sanas, y esta magnitud es el marcador con mayor especificidad para dicha neoplasia.
- –
Creatinina: el CVI es más alto en pacientes renales tras el trasplante que en individuos sanos.
- –
Fosfatasa alcalina: el CVI es más alto en la enfermedad de Paget, mientras que en la insuficiencia renal crónica y en enfermedades hepáticas crónicas los valores de CVI son casi idénticos que los encontrados en individuos sanos.
- –
Hemoglobina glucosilada, lipoproteína(a) y albúmina en orina: el CVI es más elevado en pacientes con diabetes mellitus tipo 1.
Una de las aplicaciones de los datos derivados de VB en la práctica diaria es la detección de cambios significativos en la monitorización de los pacientes utilizando el VRC. Si el VRC se calcula con los datos de personas sanas, se podrían producir avisos de falsos positivos, puesto que el componente CVI de la fórmula de cálculo puede ser inferior en personas sanas que en pacientes. Los falsos positivos podrían repercutir en la toma de decisiones médicas incorrectas, como el aumento de la dosis de tratamiento, con el consecuente riesgo de toxicidad, y realización de pruebas invasivas, o afectación psicológica del paciente por una notificación falsamente positiva.
Tomemos como ejemplo el caso de la glucohemoglobina para un laboratorio con un CVA de 1,0. Según puede observarse en la tabla 1, el CVI es de 1,9 en personas sanas y de 4,3 en pacientes con diabetes mellitus tipo 2. Aplicando la fórmula del VRC9,10 se observa lo siguiente:
siendo Zp = 1,96 (desviación estándar para una riesgo de error del 5% en pruebas bidireccionales).
Si aplicamos el CVI del grupo de personas sanas:
y si aplicamos el CVI del grupo de pacientes con diabetes mellitus tipo 2:
Supongamos el caso de un paciente con diabetes mellitus tipo 2, cuyo valor de glucohemoglobina pasa del 6,5 al 7,2%, es decir, que presenta un aumento del 10,8%.
Aplicando el VRC calculado para personas sanas, se consideraría que el cambio es significativo (con una probabilidad del 95%) y se modificaría el tratamiento. Si embargo, aplicando el VRC calculado para el grupo con diabetes mellitus tipo 2, el cambio no se consideraría significativo y no se realizaría ninguna acción.
Sin embargo, para las enzimas hepáticas alanina aminotransferasa, aspartato aminotransferasa, gammaglutamil transferasa, típicos marcadores de la función hepática, se observan valores de CVI más bajos en la enfermedad hepática crónica que en personas sanas, lo que resulta algo sorprendente. Estos resultados requerirían una posterior confirmación, puesto que proceden de un único estudio; pero si resultan ciertos, el valor VRC obtenido de datos de personas sanas produciría falsos negativos en el seguimiento de estos pacientes. Las posibles repercusiones de avisos falsamente negativos podrían ser la supresión o la reducción del tratamiento y el retraso de las visitas clínicas de seguimiento, con el consiguiente menoscabo de la adecuada atención al paciente. La detección temprana es muy importante para proporcionar el tratamiento adecuado, antes de que el estado del paciente sea más desfavorable.
En nuestra opinión, el cálculo de los valores VRC podría ser de gran utilidad para situaciones patológicas bien definidas, con magnitudes biológicas clave para el seguimiento de los pacientes y protocolos clínicos de monitorización claramente establecidos. Esto ya fue descrito en los trabajos de Biosca et al9 en trasplante renal y Trapé et al10 en estudios de carcinoma hepatocelular, que han identificado cambios biológicos en el estado de los pacientes antes de cualquier manifestación clínica. Asimismo, un artículo reciente de Solétormos et al15 (Grupo Europeo de Marcadores Tumorales) constituye una excelente guía para interpretar resultados seriados de PSA total en pacientes con cáncer de próstata basándose en los datos derivados de la VB.
ConclusionesEn esta revisión se aportan los datos de VB individual para un número magnitudes y de enfermedades disponibles en las publicaciones actuales. Para la mayoría de las magnitudes estudiadas los valores de CVI en estados patológicos son similares a la distribución en individuos sanos, es decir, el uso de VRC en individuos sanos podría aplicarse al seguimiento de pacientes. Sin embargo, para las magnitudes consideradas como marcadores específicos de órgano los valores de CVI en determinadas enfermedades son diferentes (superiores o inferiores) a los obtenidos en personas sanas, con una importante repercusión práctica.
Esto implica que los VRC procedentes de personas sanas pueden no ser adecuados para el seguimiento de pacientes con determinadas afecciones. Hay un riesgo de producir avisos falsamente positivos (o negativos) de cambios del estado de salud, con sus correspondientes implicaciones clínicas.
Este trabajo pone de manifiesto la complejidad del cálculo de los VRC en situaciones patológicas y, al mismo tiempo, indica cuándo puede ser de gran utilidad.
En conclusión, a la luz de este trabajo, se considera recomendable proseguir estudios centrados en determinadas enfermedades bien acotadas.
Los autores agradecen al profesor Callum G. Fraser sus comentarios a este trabajo y a Montse Horno y Maite Masó su dedicación y excelente labor técnica en las tareas de rutina de Laboratoris Clínics Hospital Vall d'Hebron.