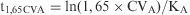Se presenta un estudio multicéntrico realizado en 12 hospitales andaluces sobre la estabilidad de 24 magnitudes del suero.
Se analizaron muestras de suero de 5 pacientes de cada hospital, sometidas a 4 temperaturas en los siguientes medios: congelador, nevera, ambiente y estufa, durante períodos fijos entre 1 y 7 días.
Se registraron las temperaturas en cada medio. Para estudiar la degradación se calculó la pendiente de la recta de regresión de cada suero, para cada magnitud y para cada centro, durante los 7 días. Los logaritmos naturales de estas pendientes de degradación se usaron frente a las temperaturas absolutas de cada medio en cada centro, para obtener una recta de regresión conjunta para cada magnitud.
Se acordó aceptar como nivel de pérdida de estabilidad el de 1,65 veces el control de calidad analítica (CV) para esa magnitud.
Se ha hecho la predicción de estabilidad con 4 temperaturas elegidas, y se ha obtenido un rango que ha ido desde la magnitud más estable, ión cloruro (33,1; 25,9; 22,5 y 19,6 días), para las temperaturas de −20°C, +4°C, +20°C y +37°C, respectivamente, a la magnitud menos estable, alanina aminotransferasa (4; 2,6; 2 y 1,6 días), para las temperaturas de −20°C, +4°C, +20°C y +37°C, respectivamente.
La imprecisión de dichas predicciones se ha calculado mediante el intervalo de confianza del 95%.
Este protocolo de degradación acelerada mediante estrés térmico puede usarse para ver la estabilidad de magnitudes más inestables, o en otros medios (orina, sangre total, etc.).
A multicentre study is presented on the stability of twenty four serum biochemical parameters in twelve Andalusian hospitals.
Serum samples from five patients from each hospital were stored at four different temperatures, as follows: freezer, refrigerator, room temperature and incubator, for periods from 1 to 7 days.
Actual temperatures were recorded for each medium. In order to study degradation, the slope of the regression line for each serum sample over the seven day period was calculated. Then, their natural logarithms were used, together with the absolute temperatures in each medium and laboratory, to calculate a new regression line for each parameter.
It was decided to accept that a sample was degraded when it reached a value 1.65 times the analytical coefficient of variation for this parameter.
The prediction for degradation at the four temperatures showed a range of values from the most stable, chloride ion (33.1; 25.9; 22.5 and 19.6 days) to the least stable, alanine aminotransferase (4; 2.6; 2 and 1.6 days), for temperatures of −20°C, +4°C, +20°C and +37°C, respectively.
The imprecision of the predicted values was estimated with the confidence interval at 95%.
This protocol of accelerated degradation by thermal stress can be used to study the stability of other, more unstable parameters, or in other media: urine, whole blood, etc.
La estabilidad de las muestras biológicas enviadas al laboratorio es un asunto de importancia, ya que, en numerosas ocasiones, se trasladan desde lugares más o menos distantes, y en condiciones diversas, no siempre ideales. Esto ocasiona que las magnitudes a estudiar puedan sufrir procesos de degradación que conducirán a que su medición posterior en el laboratorio proporcione valores distintos a los que dichas muestras tenían originalmente.
La mayoría de los materiales biológicos consiste en una compleja mezcla de moléculas diversas, susceptibles de sufrir, por efecto de la temperatura, cambios conformacionales o disociativos, que conducen, por efecto del paso del tiempo, a una alteración de su reactividad en el procedimiento analítico.
Por tanto, los factores que de forma más clara van a afectar a la estabilidad serán la temperatura a que se mantiene la muestra y el tiempo que transcurre desde su obtención del paciente hasta el momento de analizarla.
Por otra parte, los numerosos estudios realizados sobre la estabilidad de diversas magnitudes muestran discordancias que a veces son muy acusadas, probablemente debido a diferentes protocolos de estudio1–6.
El presente trabajo, iniciativa de la Sociedad Andaluza de Análisis Clínicos, intenta establecer un protocolo de ensayo estándar para estudiar el efecto de las variables temperatura y tiempo de permanencia durante el transporte de las muestras hasta el momento de su análisis.
Materiales y métodosObtención de las muestrasHan participado en el estudio 12 laboratorios de hospitales públicos de Andalucía. Cada laboratorio tomó una muestra adicional de sangre a 5 pacientes ambulatorios sin aspecto de enfermedad manifiesta, excluyendo a niños o ancianos. En total se analizaron muestras de 60 pacientes. De cada paciente se obtuvo su consentimiento verbal ante uno o más testigos, tras informarle del propósito del estudio.
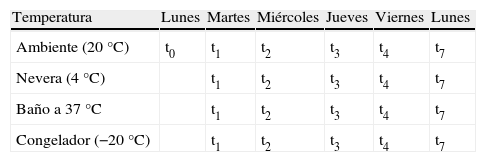
Se extrajeron 30ml de sangre a cada paciente, en tubos sin ningún conservante ni anticoagulante, ni gel separador. Tras la centrifugación se separaron 21 alícuotas. Una alícuota de suero fue analizada de forma inmediata, y el resto de alícuotas fueron sometidas a los tratamientos de “estrés térmico acelerado”7–10, manteniéndolas congeladas, en nevera, a temperatura ambiente, o calentadas a 37°C, por los períodos descritos en la tabla 1.
Programa de estrés térmico acelerado de las muestras
| Temperatura | Lunes | Martes | Miércoles | Jueves | Viernes | Lunes |
| Ambiente (20°C) | t0 | t1 | t2 | t3 | t4 | t7 |
| Nevera (4°C) | t1 | t2 | t3 | t4 | t7 | |
| Baño a 37°C | t1 | t2 | t3 | t4 | t7 | |
| Congelador (−20°C) | t1 | t2 | t3 | t4 | t7 |
Alícuotas obtenidas de cada suero y su permanencia en cada medio termostatizado. La muestra t0 representa la que es analizada de forma inmediata. El resto permanece por tiempos variables a cada temperatura: t1=1 día; t2=2 días; t3=3 días; t4=4 días; t7=7 días.
Para alcanzar las temperaturas esperadas se sumergieron los tubos de suero, debidamente marcados, en alcohol mantenido desde varios días antes en un congelador, en un recipiente con agua guardado en la nevera, en un recipiente con agua mantenido a temperatura ambiente, o en una estufa de cultivos mantenida a 37°C.
Previamente al comienzo del estudio, cada laboratorio utilizó un termómetro digital para comprobar la temperatura y su estabilidad en cada uno de los medios usados. Cuando se observó una desviación considerable en el rango de temperatura esperada (en torno a −20°C, 4–6°C, +20°C y 37°C), se ajustaron los elementos térmicos empleados.
Durante los 7 días de duración del estudio, se registró diariamente la temperatura de cada medio (congelador, nevera, temperatura ambiente o estufa), para usar los valores en el cálculo de degradación.
Duración de los tratamientos térmicosLas muestras de suero se mantuvieron a cada temperatura durante períodos diferentes. Así, una muestra de cada paciente fue analizada de forma rápida (menos de 30min tras la separación del suero). Es el considerado como tiempo cero, y por tanto como el valor inicial de cada magnitud analizada, o valor al 100%, sin degradación.
El resto de las muestras fueron mantenidas por períodos de tiempo de 1, 2, 3, 4 y 7 días. Transcurridos estos tiempos, se analizaron las muestras de los 5 pacientes. La tabla 1 describe las duraciones de los tratamientos térmicos en cada grupo de alícuotas de suero.
Controles de calidadCada centro calculó el coeficiente de variación del control de calidad interno e interdía de nivel intermedio, utilizando para ello los datos obtenidos en cada una de las magnitudes analizadas en este estudio en los últimos 3 meses.
Asimismo, se analizó en paralelo un suero de control de valor intermedio durante los 7 días de duración del estudio.
El primero se utilizó para el cálculo de predicción de estabilidad (véase “Análisis de datos”, punto 6), mientras que el segundo, control intraensayo, permitió comprobar que las posibles derivas de las mediciones analíticas durante el estudio se mantuvieron en valores pequeños.
Magnitudes analizadasSe han medido las magnitudes detalladas en la tabla 3. Para ello se han utilizado los equipos de uso habitual en cada Laboratorio, sin realizar ajustes ni calibraciones fuera de las habituales.
Recogida de datosPara la recogida de datos se ha usado una hoja de cálculo proporcionada por la Sociedad Andaluza de Análisis Clínicos (SANAC) a cada centro, y que una vez rellena se remitió al coordinador del estudio.
Análisis de los datosLos resultados se han analizado siguiendo el procedimiento ya descrito7–8, que se puede resumir de la siguiente forma:
- 1.
Porcentaje. Conversión de todos los datos en sus correspondientes porcentajes, considerando el valor obtenido a tiempo cero como el valor inicial, sin degradación (valor del 100%). Durante todo el cálculo, se han usado solamente los valores en porcentaje, y por tanto, no se han usado ni las unidades de cada centro ni los valores medidos, sino los porcentajes de los valores encontrados en días sucesivos respecto al valor del primer día (valor de 100%).
- 2.
Control intraensayo. Variación de los resultados de los sueros control introducidos durante el estudio. Se ha calculado el coeficiente de variación obtenido al analizar un suero control de nivel intermedio, durante los 7 días del estudio, medido en paralelo con los sueros de los pacientes.
- 3.
Temperatura. Determinación de la temperatura media registrada en cada laboratorio para cada medio (congelador, nevera, ambiente o estufa), durante el período de estudio. Conversión en valores de la escala Kelvin.
- 4.
Pendiente de degradación de un suero. Se calculó la pendiente individual de degradación (k) propia de cada suero, para cada magnitud, y para cada uno de los valores de temperatura, en cada laboratorio. Para este cálculo, la serie de valores, expresados en porcentaje, de cada paciente, para cada temperatura y para cada magnitud analizada en el estudio, y a lo largo de este período, se sometió a análisis de ajuste a una recta, mediante mínimos cuadrados. En ordenadas se recoge, para la temperatura registrada, el porcentaje del valor inicial, y en abscisas el tiempo transcurrido. La pendiente k de esta recta ajustada, negativa en caso de disminución de los valores encontrados en días sucesivos, o positiva en los casos de aumento de los valores encontrados (p. ej., fosfato no esterificado), expresa la degradación que ha sufrido esa muestra concreta de suero, a esa temperatura, durante los días del estudio. Así, para cada magnitud bioquímica estudiada, se obtuvieron hasta 240 valores de k individuales (60 pacientes, y cuatro temperaturas).
- 5.
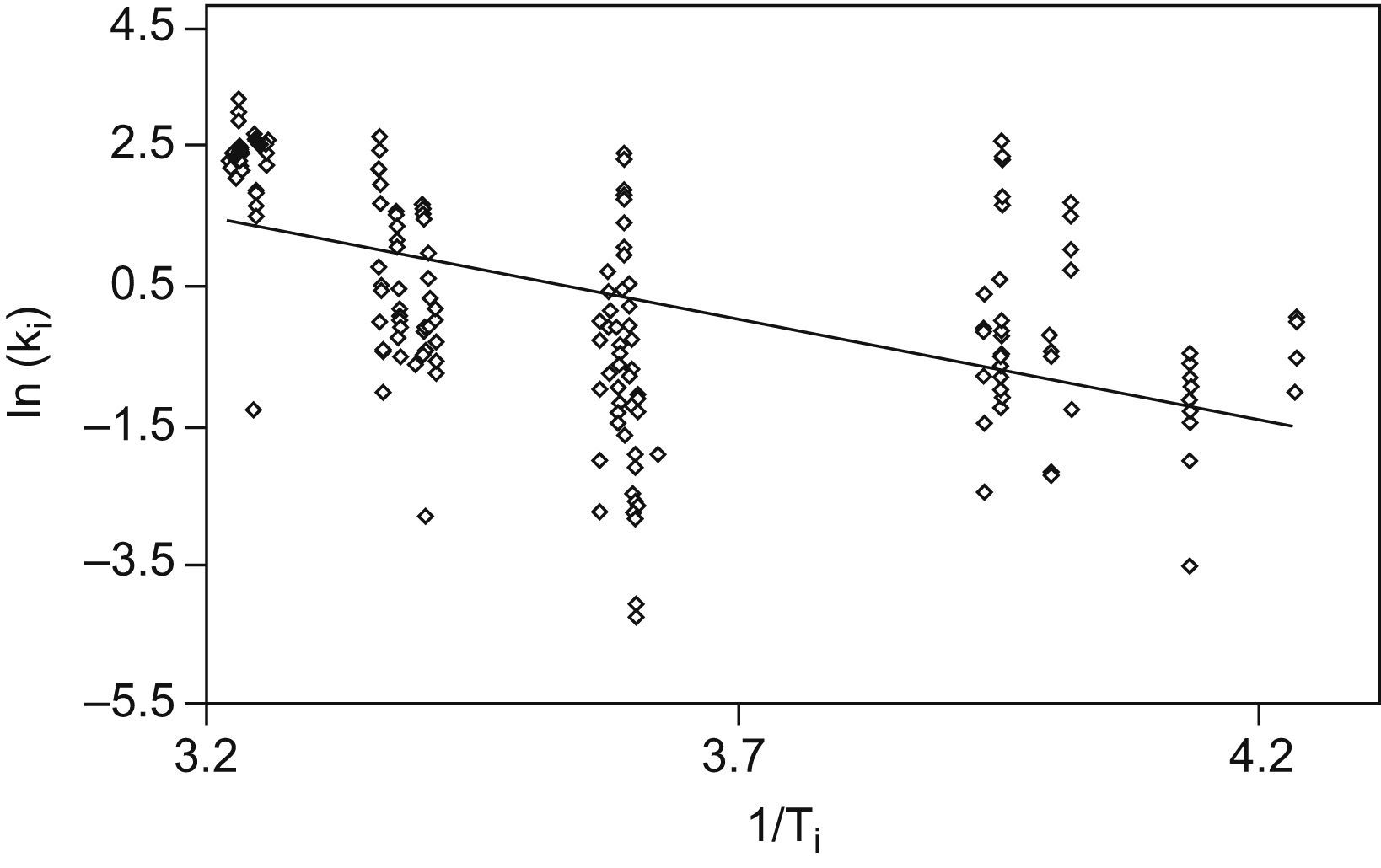
Gráfica de Arrehnius. Las pendientes individuales de cada suero (ki) a cada temperatura registrada, del punto anterior fueron transformadas en sus logaritmos naturales ln (ki). Estos valores se utilizaron en el eje de ordenadas. Cada temperatura individual fue transformada en valores Kelvin, y se calcularon sus inversos: 1/Ti, y se llevaron al eje X. Se estimó, así, mediante una nueva recta de regresión, la cinética de degradación propia de cada magnitud, pero con los ejes transformados tal como se ha descrito.
- 6.
Cálculo de pendiente para una temperatura elegida. Con esta recta se calcula, para cada valor elegido de temperatura (en este caso, −20°C, 46°C, +20°C y 37°C) la pendiente de degradación KA para una magnitud A, cuidando de revertir las transformaciones de los ejes (logaritmos naturales e inversos de la temperatura absoluta). Esta pendiente KA propia de cada temperatura será utilizada para la predicción de la estabilidad (véase la fórmula del punto 9 del “Análisis de datos”, más adelante).
- 7.
Coeficiente de variación analítica. Los coeficientes de variación analíticos interdía obtenidos durante tres meses por los laboratorios para cada magnitud estudiada se usaron para obtener los valores promedio, desviación típica e intervalo de confianza del 95%, por cada magnitud y cada centro (CVA).
- 8.
Criterio de estabilidad (EST). Se ha considerado, de acuerdo con el Comité de Garantía de Calidad y Acreditación de los Laboratorios de la Sociedad Española de Química Clínica4, que una muestra se ha degradado cuando la variación entre resultados supere 1,65 veces el coeficiente de variación analítico para una magnitud concreta (EST=1,65×CVA). En este caso se ha usado el valor de la media de los coeficientes de variación obtenidos por los 12 laboratorios.
- 9.
Predicción del período de estabilidad. Usando la regresión obtenida mediante la ecuación de Arrehnius7,11, y de acuerdo con el punto 6 anterior se ha calculado el tiempo que tarda cada magnitud A en alcanzar el nivel de degradación considerado como límite (EST), si se mantiene la muestra a una temperatura teórica elegida discrecionalmente: −20°C, +4°C, +20°C o+37°C. Para este cálculo se ha usado la fórmula:
donde t representa el número de días en los que la magnitud permanece estable; CVA es el coeficiente de variación analítico medio para dicha magnitud, y KA es la pendiente de la recta de regresión obtenida con los inversos de las temperaturas absolutas (1/Ti) y los logaritmos naturales de las pendientes individuales [ln (ki)] de cada suero a cada temperatura, según se detalla en el punto 7 anterior.
- 10.
Intervalo de confianza de la predicción. Se ha estimado la imprecisión de estos cálculos de predicción, obtenidos con la ecuación anterior. Para ello, se ha determinado el intervalo de confianza del 95%, de los valores de predicción (valor de Y para un valor elegido de X) obtenidos mediante la recta de regresión22. Se han elegido dos temperaturas intermedias: +4°C y +20°C.
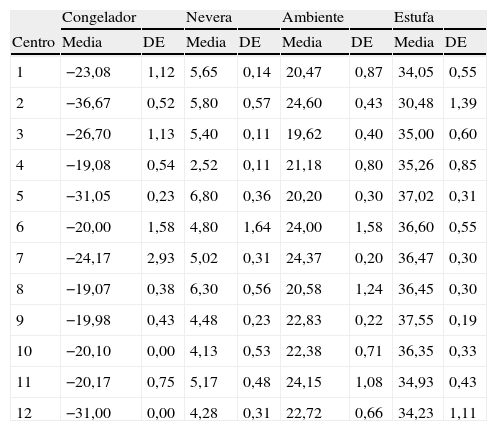
En la tabla 2 se describen las temperaturas medias registradas por cada laboratorio en los cuatro diferentes niveles: congelador, nevera, ambiente y estufa. Los valores de cada nivel son diferentes en cada centro: las temperaturas de congelador oscilaron entre −19,07 y −36,67°C; en nevera oscilaron entre +2,52°C y +6,30°C; las mantenidas a temperatura ambiente variaron entre +19,62°C y +24,60°C, y las calentadas en estufa o baño se mantuvieron entre +30,48°C y +37,55°C. Sin embargo, la constancia en el mantenimiento de estas temperaturas en cada laboratorio se manifiesta en el hecho de que las desviaciones típicas fueron pequeñas.
Temperaturas registradas en los laboratorios
| Congelador | Nevera | Ambiente | Estufa | |||||
| Centro | Media | DE | Media | DE | Media | DE | Media | DE |
| 1 | −23,08 | 1,12 | 5,65 | 0,14 | 20,47 | 0,87 | 34,05 | 0,55 |
| 2 | −36,67 | 0,52 | 5,80 | 0,57 | 24,60 | 0,43 | 30,48 | 1,39 |
| 3 | −26,70 | 1,13 | 5,40 | 0,11 | 19,62 | 0,40 | 35,00 | 0,60 |
| 4 | −19,08 | 0,54 | 2,52 | 0,11 | 21,18 | 0,80 | 35,26 | 0,85 |
| 5 | −31,05 | 0,23 | 6,80 | 0,36 | 20,20 | 0,30 | 37,02 | 0,31 |
| 6 | −20,00 | 1,58 | 4,80 | 1,64 | 24,00 | 1,58 | 36,60 | 0,55 |
| 7 | −24,17 | 2,93 | 5,02 | 0,31 | 24,37 | 0,20 | 36,47 | 0,30 |
| 8 | −19,07 | 0,38 | 6,30 | 0,56 | 20,58 | 1,24 | 36,45 | 0,30 |
| 9 | −19,98 | 0,43 | 4,48 | 0,23 | 22,83 | 0,22 | 37,55 | 0,19 |
| 10 | −20,10 | 0,00 | 4,13 | 0,53 | 22,38 | 0,71 | 36,35 | 0,33 |
| 11 | −20,17 | 0,75 | 5,17 | 0,48 | 24,15 | 1,08 | 34,93 | 0,43 |
| 12 | −31,00 | 0,00 | 4,28 | 0,31 | 22,72 | 0,66 | 34,23 | 1,11 |
Temperaturas en grados centígrados (media y desviación estándar [DE]) registradas durante el estudio, en cada medio y en cada laboratorio.
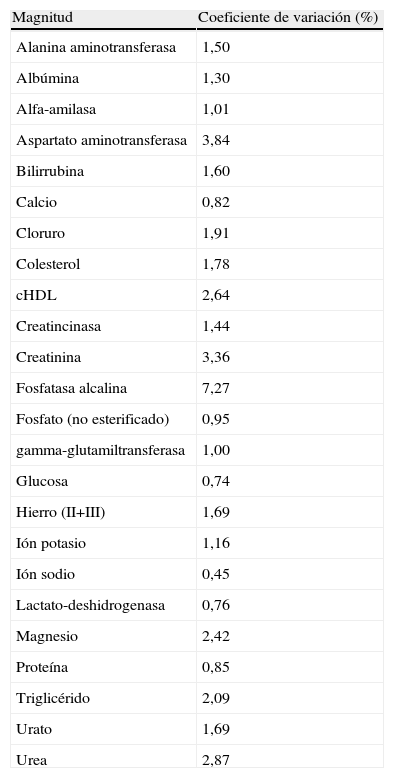
Los sueros control, analizados de forma paralela durante todo el período de estudio presentaron una imprecisión pequeña, tal como muestra la tabla 3, en la que se detallan los promedios de los 12 coeficientes de variación analítica (%), obtenidos al analizar las magnitudes estudiadas, durante los 7 días.
Coeficiente de variación analítica promedio durante el período de estudio
| Magnitud | Coeficiente de variación (%) |
| Alanina aminotransferasa | 1,50 |
| Albúmina | 1,30 |
| Alfa-amilasa | 1,01 |
| Aspartato aminotransferasa | 3,84 |
| Bilirrubina | 1,60 |
| Calcio | 0,82 |
| Cloruro | 1,91 |
| Colesterol | 1,78 |
| cHDL | 2,64 |
| Creatincinasa | 1,44 |
| Creatinina | 3,36 |
| Fosfatasa alcalina | 7,27 |
| Fosfato (no esterificado) | 0,95 |
| gamma-glutamiltransferasa | 1,00 |
| Glucosa | 0,74 |
| Hierro (II+III) | 1,69 |
| Ión potasio | 1,16 |
| Ión sodio | 0,45 |
| Lactato-deshidrogenasa | 0,76 |
| Magnesio | 2,42 |
| Proteína | 0,85 |
| Triglicérido | 2,09 |
| Urato | 1,69 |
| Urea | 2,87 |
Los sueros control se analizaron en paralelo con las muestras de pacientes y se calculó el valor del coeficiente de variación promedio de los 12 laboratorios, durante los 7 días, para cada magnitud.cHDL: colesterol ligado a lipoproteínas de alta densidad.
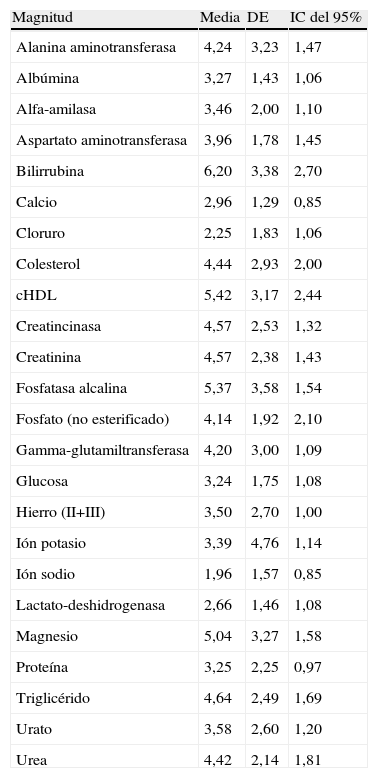
Los controles de calidad interdía calculados con los valores de los últimos 3 meses por cada laboratorio se muestran en la tabla 4. En ella se expresa el valor promedio, la desviación típica y el intervalo de confianza del 95%, del conjunto de los coeficientes de variación obtenidos por los 12 laboratorios, para cada magnitud analizada. Estos valores promedio de error analítico son los utilizados para calcular el nivel de degradación en el que se considera que ésta es significativa (1,65 veces el coeficiente de variación del error analítico).
Coeficiente de variación analítica promedio de los 12 laboratorios durante los últimos 3 meses
| Magnitud | Media | DE | IC del 95% |
| Alanina aminotransferasa | 4,24 | 3,23 | 1,47 |
| Albúmina | 3,27 | 1,43 | 1,06 |
| Alfa-amilasa | 3,46 | 2,00 | 1,10 |
| Aspartato aminotransferasa | 3,96 | 1,78 | 1,45 |
| Bilirrubina | 6,20 | 3,38 | 2,70 |
| Calcio | 2,96 | 1,29 | 0,85 |
| Cloruro | 2,25 | 1,83 | 1,06 |
| Colesterol | 4,44 | 2,93 | 2,00 |
| cHDL | 5,42 | 3,17 | 2,44 |
| Creatincinasa | 4,57 | 2,53 | 1,32 |
| Creatinina | 4,57 | 2,38 | 1,43 |
| Fosfatasa alcalina | 5,37 | 3,58 | 1,54 |
| Fosfato (no esterificado) | 4,14 | 1,92 | 2,10 |
| Gamma-glutamiltransferasa | 4,20 | 3,00 | 1,09 |
| Glucosa | 3,24 | 1,75 | 1,08 |
| Hierro (II+III) | 3,50 | 2,70 | 1,00 |
| Ión potasio | 3,39 | 4,76 | 1,14 |
| Ión sodio | 1,96 | 1,57 | 0,85 |
| Lactato-deshidrogenasa | 2,66 | 1,46 | 1,08 |
| Magnesio | 5,04 | 3,27 | 1,58 |
| Proteína | 3,25 | 2,25 | 0,97 |
| Triglicérido | 4,64 | 2,49 | 1,69 |
| Urato | 3,58 | 2,60 | 1,20 |
| Urea | 4,42 | 2,14 | 1,81 |
Coeficiente de variación obtenido durante los 3 últimos meses anteriores al estudio por los laboratorios participantes. Se expresa el valor medio de los 12 laboratorios, la desviación estándar (DE) y el intervalo de confianza (IC) del 95%.cHDL: colesterol ligado a lipoproteínas de alta densidad.
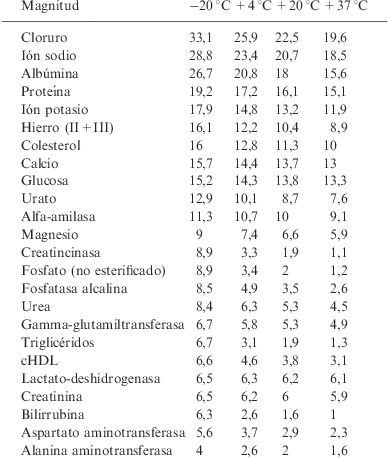
La tabla 5 muestra las predicciones de estabilidad de cada magnitud, basadas en la ecuación de Arrehnius. Se han elegido para el cálculo 4 temperaturas (−20°C, +4°C, +20°C y +37°C). En esta tabla se expresan los días durante los que permanece estable cada magnitud, a la temperatura elegida para el cálculo.
Días durante los cuales cada magnitud es estable a una temperatura
| Magnitud | −20°C | +4°C | +20°C | +37°C |
| Cloruro | 33,1 | 25,9 | 22,5 | 19,6 |
| Ión sodio | 28,8 | 23,4 | 20,7 | 18,5 |
| Albúmina | 26,7 | 20,8 | 18 | 15,6 |
| Proteína | 19,2 | 17,2 | 16,1 | 15,1 |
| Ión potasio | 17,9 | 14,8 | 13,2 | 11,9 |
| Hierro (II+III) | 16,1 | 12,2 | 10,4 | 8,9 |
| Colesterol | 16 | 12,8 | 11,3 | 10 |
| Calcio | 15,7 | 14,4 | 13,7 | 13 |
| Glucosa | 15,2 | 14,3 | 13,8 | 13,3 |
| Urato | 12,9 | 10,1 | 8,7 | 7,6 |
| Alfa-amilasa | 11,3 | 10,7 | 10 | 9,1 |
| Magnesio | 9 | 7,4 | 6,6 | 5,9 |
| Creatincinasa | 8,9 | 3,3 | 1,9 | 1,1 |
| Fosfato (no esterificado) | 8,9 | 3,4 | 2 | 1,2 |
| Fosfatasa alcalina | 8,5 | 4,9 | 3,5 | 2,6 |
| Urea | 8,4 | 6,3 | 5,3 | 4,5 |
| Gamma-glutamiltransferasa | 6,7 | 5,8 | 5,3 | 4,9 |
| Triglicéridos | 6,7 | 3,1 | 1,9 | 1,3 |
| cHDL | 6,6 | 4,6 | 3,8 | 3,1 |
| Lactato-deshidrogenasa | 6,5 | 6,3 | 6,2 | 6,1 |
| Creatinina | 6,5 | 6,2 | 6 | 5,9 |
| Bilirrubina | 6,3 | 2,6 | 1,6 | 1 |
| Aspartato aminotransferasa | 5,6 | 3,7 | 2,9 | 2,3 |
| Alanina aminotransferasa | 4 | 2,6 | 2 | 1,6 |
Predicción del número de días que permanecerán estables las magnitudes a las temperaturas indicadas, ordenadas de mayor a menor duración de la estabilidad predicha para la temperatura de –20°C.cHDL: colesterol ligado a lipoproteínas de alta densidad.
Se han ordenado las magnitudes en función de los valores de mayor a menor estabilidad, a la temperatura teórica de −20°C. Se puede observar que a esta temperatura se predice que la magnitud más estable de las analizadas es el ión cloruro, que se calcula como estable durante 33,1 días, mientras que la magnitud menos estable de las estudiadas es la alanina aminotransferasa, que sólo lo es durante 4 días a −20°C. A temperatura ambiente, por ejemplo, el ión cloruro es estable durante 22,5 días, mientras que la alanina aminotransferasa es estable en suero durante 2 días.
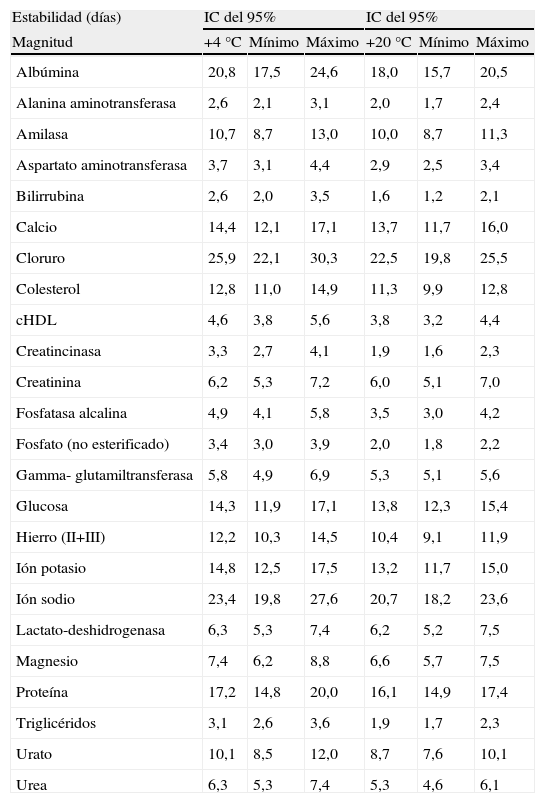
La tabla 6 muestra el intervalo de confianza de estos valores de predicción de estabilidad. Para su cálculo se han elegido dos de las 4 temperaturas teóricas (+4°C y +20°C). Se expresan los valores de predicción obtenidos (los de la tabla 5), y el intervalo de confianza del 95%, con sus valores mínimo y máximo. Es decir, en esta tabla se describe, para cada magnitud, el número de días durante los que será estable, con sus valores mínimo y máximo de estabilidad. Por ejemplo, la estabilidad calculada del ión cloruro oscilará, a +20°C, entre 19,8 y 25,5 días, mientras que la magnitud menos estable, alanina aminotransferasa, se mantendrá estable entre 1,7 y 2,4 días.
Intervalo de confianza del 95% de los valores de estabilidad
| Estabilidad (días) | IC del 95% | IC del 95% | ||||
| Magnitud | +4°C | Mínimo | Máximo | +20°C | Mínimo | Máximo |
| Albúmina | 20,8 | 17,5 | 24,6 | 18,0 | 15,7 | 20,5 |
| Alanina aminotransferasa | 2,6 | 2,1 | 3,1 | 2,0 | 1,7 | 2,4 |
| Amilasa | 10,7 | 8,7 | 13,0 | 10,0 | 8,7 | 11,3 |
| Aspartato aminotransferasa | 3,7 | 3,1 | 4,4 | 2,9 | 2,5 | 3,4 |
| Bilirrubina | 2,6 | 2,0 | 3,5 | 1,6 | 1,2 | 2,1 |
| Calcio | 14,4 | 12,1 | 17,1 | 13,7 | 11,7 | 16,0 |
| Cloruro | 25,9 | 22,1 | 30,3 | 22,5 | 19,8 | 25,5 |
| Colesterol | 12,8 | 11,0 | 14,9 | 11,3 | 9,9 | 12,8 |
| cHDL | 4,6 | 3,8 | 5,6 | 3,8 | 3,2 | 4,4 |
| Creatincinasa | 3,3 | 2,7 | 4,1 | 1,9 | 1,6 | 2,3 |
| Creatinina | 6,2 | 5,3 | 7,2 | 6,0 | 5,1 | 7,0 |
| Fosfatasa alcalina | 4,9 | 4,1 | 5,8 | 3,5 | 3,0 | 4,2 |
| Fosfato (no esterificado) | 3,4 | 3,0 | 3,9 | 2,0 | 1,8 | 2,2 |
| Gamma- glutamiltransferasa | 5,8 | 4,9 | 6,9 | 5,3 | 5,1 | 5,6 |
| Glucosa | 14,3 | 11,9 | 17,1 | 13,8 | 12,3 | 15,4 |
| Hierro (II+III) | 12,2 | 10,3 | 14,5 | 10,4 | 9,1 | 11,9 |
| Ión potasio | 14,8 | 12,5 | 17,5 | 13,2 | 11,7 | 15,0 |
| Ión sodio | 23,4 | 19,8 | 27,6 | 20,7 | 18,2 | 23,6 |
| Lactato-deshidrogenasa | 6,3 | 5,3 | 7,4 | 6,2 | 5,2 | 7,5 |
| Magnesio | 7,4 | 6,2 | 8,8 | 6,6 | 5,7 | 7,5 |
| Proteína | 17,2 | 14,8 | 20,0 | 16,1 | 14,9 | 17,4 |
| Triglicéridos | 3,1 | 2,6 | 3,6 | 1,9 | 1,7 | 2,3 |
| Urato | 10,1 | 8,5 | 12,0 | 8,7 | 7,6 | 10,1 |
| Urea | 6,3 | 5,3 | 7,4 | 5,3 | 4,6 | 6,1 |
Cálculo de los intervalos de confianza para un nivel del 95% de los valores de predicción de estabilidad obtenidos para las temperaturas de +4°C y +20°C. Los intervalos de confianza se expresan en días.cHDL: colesterol ligado a lipoproteínas de alta densidad; IC: intervalo de confianza.
De esta forma, se refleja que el período de tiempo durante el cual se considera que una magnitud permanece estable tiene un rango de oscilación debido, entre otros factores, a la imprecisión analítica y al uso de equipos diferentes, y probablemente también al diferente comportamiento de cada suero individual.
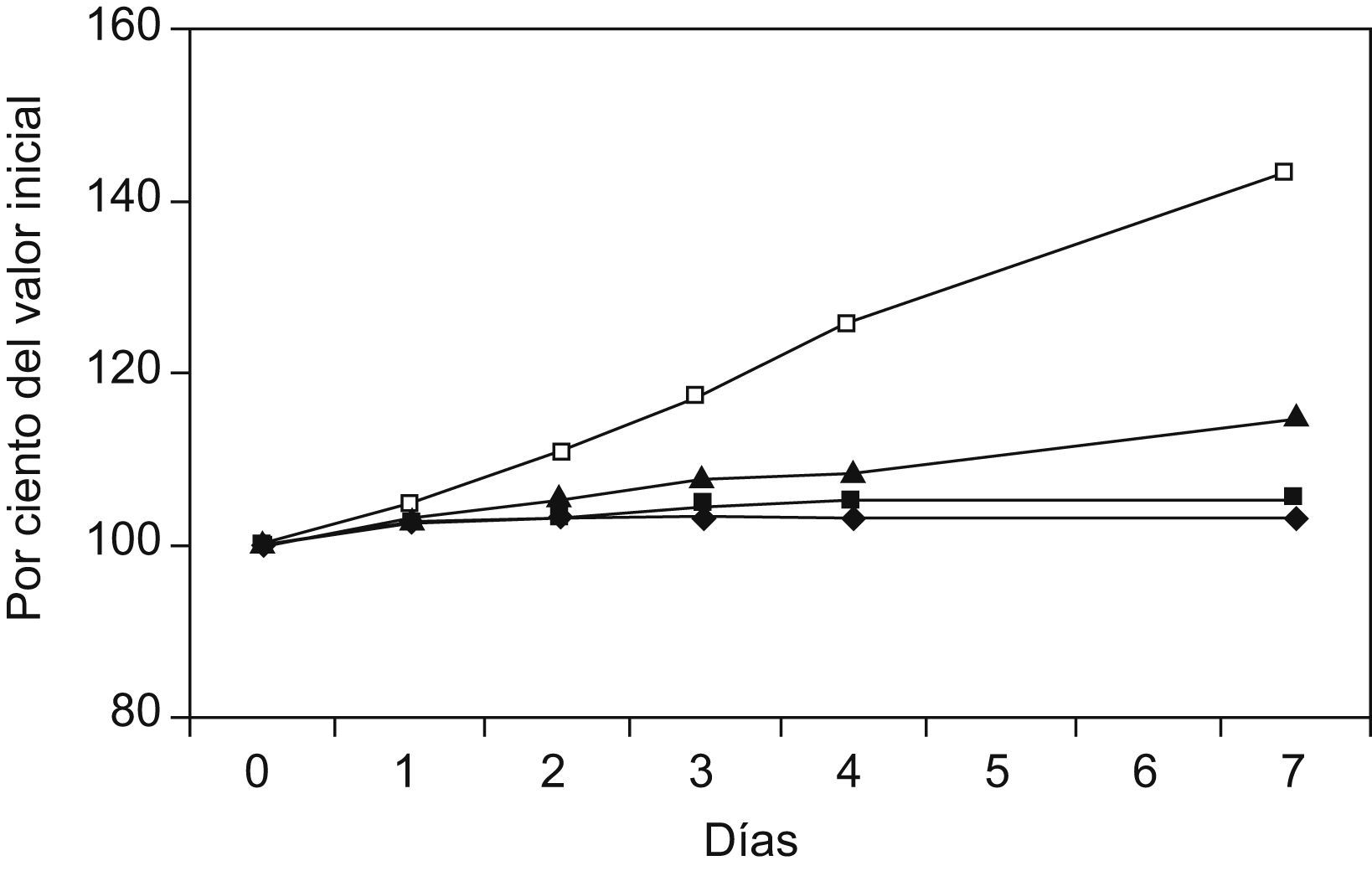
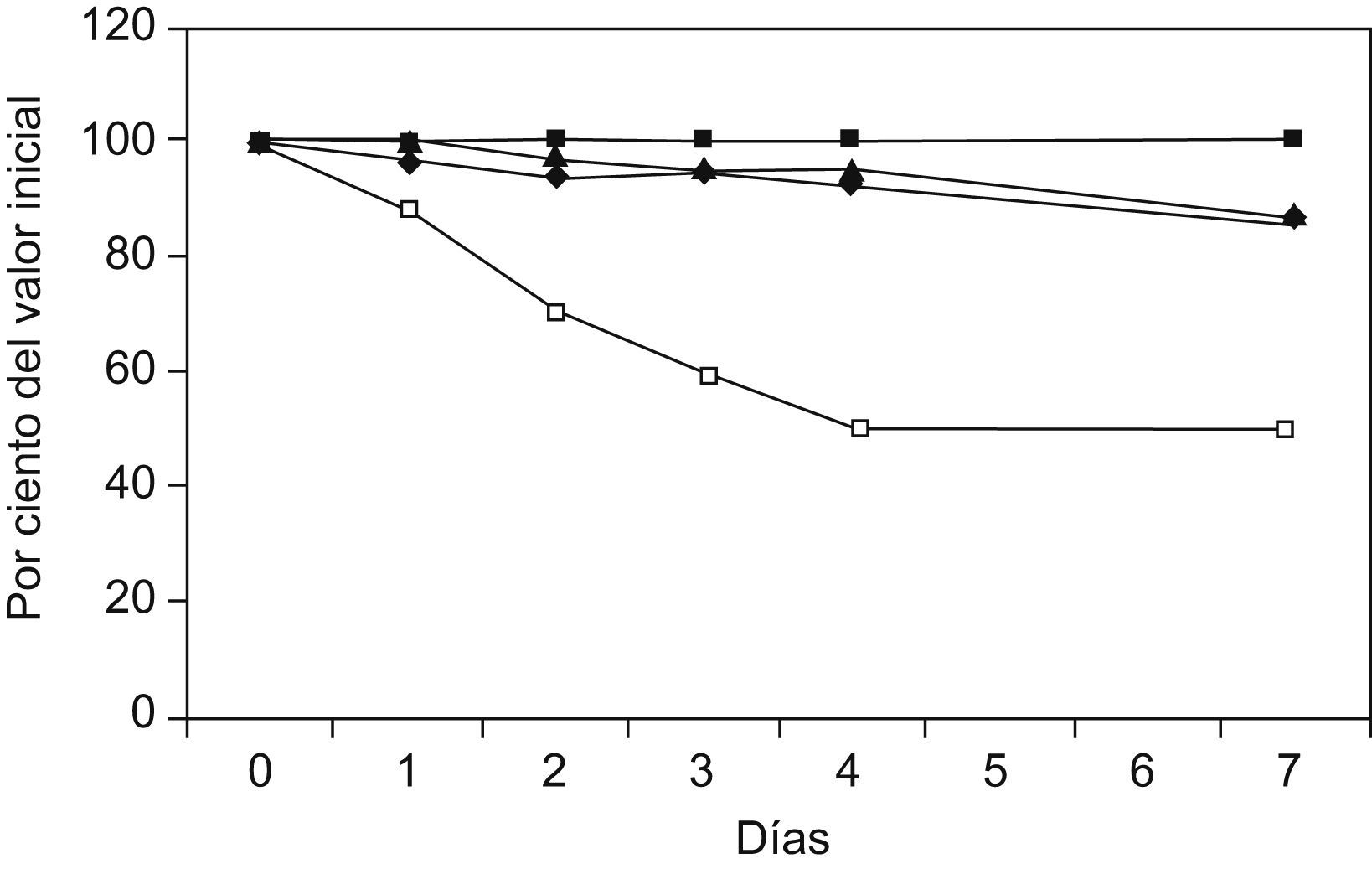
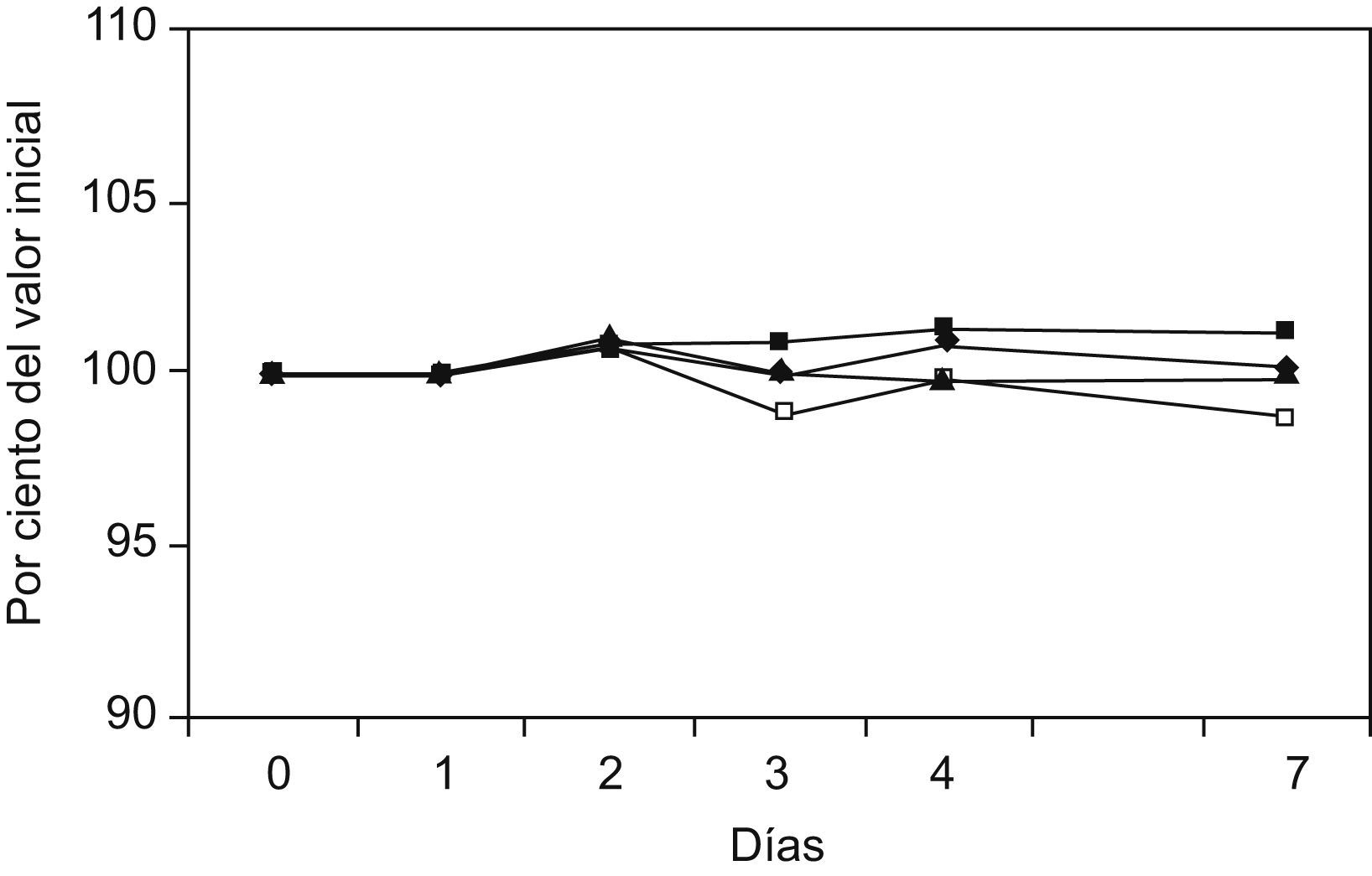
La figura 1 muestra la variación de los niveles medidos de fosfato inorgánico en suero durante el estudio. En la figura 2 se muestra la degradación sufrida por la enzima alanina aminotransferasa, cuando se somete el suero a diferentes temperaturas. La figura 3 muestra que la glucosa se mantiene aceptablemente estable durante el período de estudio.
Modificación de los valores de fosfato no esterificado durante los 7 días de estudio, en función de la temperatura. Los puntos expresan el valor mediana de los porcentajes individuales, con respecto al valor inicial, de cada muestra (N=60), durante el período de estudio, para cada una de las diferentes temperaturas (=congelador; ¿=nevera; ▴=temperatura ambiente; □=estufa a 37°C).
Degradación de los valores de alalina aminotransferasa (ALT) durante los 7 días de estudio, en función de la temperatura. Los puntos expresan el valor mediana de los porcentajes individuales, con respecto al valor inicial, de cada muestra (N=60), durante el período de estudio, para cada una de las diferentes temperaturas (=congelador; ¿=nevera; ▴=temperatura ambiente; □=estufa a 37°C).
Degradación de los valores de glucosa durante los 7 días de estudio, en función de la temperatura. Los puntos expresan el valor mediana de los porcentajes individuales, con respecto al valor inicial, de cada muestra (N=60), durante el período de estudio, para cada una de las diferentes temperaturas (=congelador; ¿=nevera; ▴=temperatura ambiente; □=estufa a 37°C).
En las 3 gráficas, para claridad de los datos presentados, se han calculado las medianas de los valores por ciento respecto al valor inicial, en cada período de tiempo, y para cada temperatura.
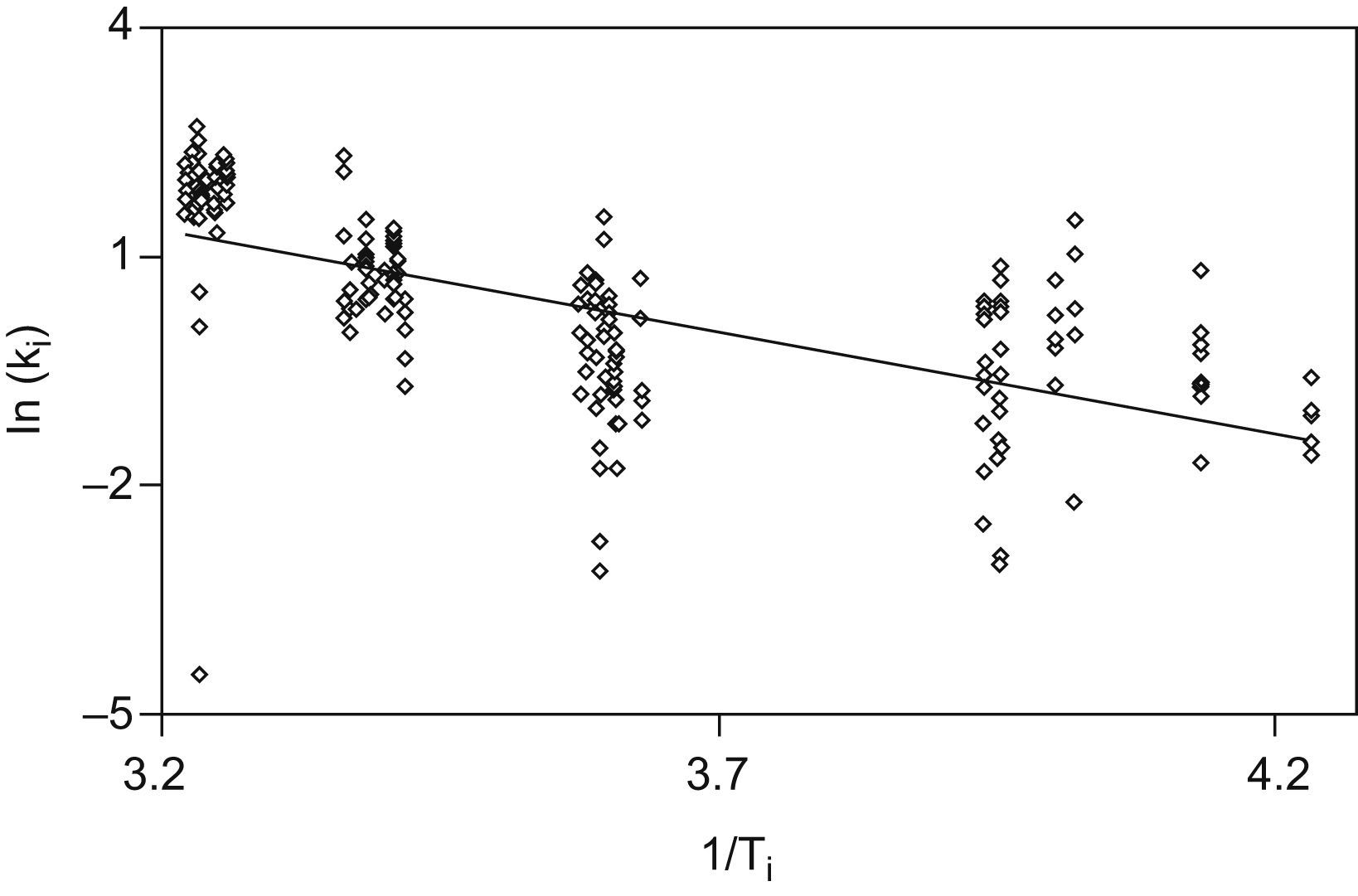
La figura 4 muestra el ajuste mediante recta de regresión lineal, de los valores individuales de las pendientes de degradación, como logaritmos naturales, frente a las temperaturas, en forma de los inversos de grados Kelvin.
DiscusiónLas muestras biológicas que llegan al laboratorio para ser analizadas no siempre se transportan con la suficiente rapidez y a la temperatura adecuada (que puede variar para cada magnitud que se mide). A veces, intervienen otros factores adicionales, distintos de la temperatura o el paso del tiempo, como la luz, para el caso de la cuantificación de bilirrubina, o la vibración o el vacío, que pueden provocar hemólisis o pérdida de los gases disueltos.
Además de esto, en algunas ocasiones, las muestras se dejan a temperatura de refrigeración, o incluso a temperatura ambiente, durante demasiado tiempo en el laboratorio, antes de ser analizadas.
Y, desde luego, el contacto de las células sanguíneas con el plasma o el suero, una vez extraídas las muestras, ocasiona importantes alteraciones en las concentraciones de diferentes analitos, lo que ocurre a veces a gran velocidad23.
Todo esto hace que a veces la cuantificación que se realiza en los laboratorios produzca resultados que están más o menos alejados de los valores iniciales.
Los valores de estabilidad de las magnitudes biológicas que se pueden consultar en la literatura científica varían con frecuencia, y en bastantes casos son claramente contradictorios1–6. Y esto puede deberse a la utilización de criterios de definición del nivel de estabilidad, o con más frecuencia a la utilización de protocolos de estudio bastante dispares. Estas revisiones, alguna de ellas muy amplia, y otras que amplían revisiones anteriores, como las de la Base de datos sobre estabilidad de magnitudes de la Comisión de Garantía de Calidad de la SEQC1 y Guder et al6, son esfuerzos importantes, pero pudiera ocurrir que cuanto más amplia sea la revisión de datos de estabilidad de una magnitud, mayores discordancias se encuentren.
Estos datos de revisión proporcionan una orientación muy apreciable a la hora de decidir si una muestra puede ser almacenada con objeto de realizar comprobaciones posteriores, o con fines de investigación. Pero podría haber llegado el momento de que cada laboratorio trate de encontrar, en su propio medio, y con los equipos en uso, una respuesta al reto de saber cuánto tiempo, y a qué temperatura puede almacenar sus muestras, y quiere estar seguro de que la magnitud a medir más tarde va a ser razonablemente estable.
En este estudio se ha aceptado como criterio de estabilidad el que ha definido el Comité de Garantía de Calidad y Acreditación de los Laboratorios de la Sociedad Española de Química Clínica4. Este Comité considera que una magnitud se ha degradado de forma significativa en una muestra cuando su valor excede por encima o por debajo, el nivel que representa el valor inicial más (si aumentan los valores) o menos (si disminuyen) 1,65 veces el coeficiente de variación analítica de esa magnitud.
En el presente estudio se ha usado un valor promedio de los coeficientes de variación obtenidos por los Centros participantes, en la esperanza de que los valores de los controles fueran aceptablemente constantes durante estos 3 meses. Y en el caso de que alguna magnitud mostrara, en algún centro, una desviación excesiva, esto se vería compensado por el número de centros participantes. En rigor y, desde el punto de vista teórico, los centros participantes que han obtenido coeficientes de variación analítica superiores al deseable, en función de la variabilidad biológica intraindividual, no deberían usar los datos de estabilidad obtenidos en este estudio.
Sin embargo, hemos observado que si se utiliza para el cálculo del criterio de estabilidad otro valor, como por ejemplo una pérdida de un 10% del valor inicial, tal y como se acepta en otros trabajos7,8, o del 5%, como se acepta en otros9, el cálculo del período durante el cual una magnitud de las estudiadas en este estudio, permanecería estable, no se modifica de forma importante. La diferencia al aplicar estos 2 criterios, variación del 10%, o el de la Sociedad Española de Química Clínica, sobre la predicción del número de días de estabilidad diferiría sólo en horas (datos no mostrados), lo que es poco relevante en la práctica diaria de los laboratorios.
En cualquier caso, se ha preferido mantener el criterio de la Sociedad Española de Química Clínica antes expresado, ya que, además de su sólido fundamento teórico, puede ser necesario cuando se utilice para la predicción de estabilidad de magnitudes con coeficientes de variación analítica excesivamente grandes, o con estabilidades muy cortas.
El protocolo de degradación acelerada, utilizado en este trabajo ya ha sido probado7,8, y es ampliamente usado por la industria farmacéutica para predecir la estabilidad de sus preparaciones. Los procedimientos de realización, de análisis de los datos y de predicción del período de estabilidad han sido acordados y revisados por una Conferencia Internacional sobre Armonización en 20039,10.
La utilización de un número importante de laboratorios aporta varias ventajas, ya que de esa forma se consigue un mayor número de pacientes, el trabajo es menor en cada centro, y se incluyen diferentes temperaturas, dentro de cada medio elegido, al no estar ajustados exactamente a los mismos niveles. Además, el registro diario, previo al comienzo del estudio, permitió en algún caso reajustar los equipos de mantenimiento de temperatura, que estaban desajustados de forma inadvertida.
Pero el uso de mediciones por varios laboratorios también puede tener algún inconveniente, ya que se han usado equipos analizadores distintos, con metodologías de análisis que pudieran producir resultados demasiado dispares. De todas formas, no es esperable que estas diferencias puedan ser significativas en las magnitudes estudiadas.
Sin embargo, se puede suponer que esto será distinto al analizar concentraciones séricas de magnitudes mediante reacciones antígeno-anticuerpo. Cabría imaginar que, durante la conservación del suero, la hidrólisis espontánea de una proteína sérica produjera fragmentos que pudieran ser todavía reconocidos por el anticuerpo de un fabricante, mientras que no lo serían por el anticuerpo de otro fabricante distinto, dependiendo de los epítopos implicados. Y esto produciría diferentes estabilidades de una misma magnitud, según el método usado para el análisis.
En cualquier caso, se recomienda que cada laboratorio compruebe, usando sus propios equipos de análisis, la predicción de estabilidad para las magnitudes que considere conveniente revisar. Así, además, al usar el coeficiente de variación analítico obtenido por cada laboratorio, no tendrá que usar un valor intermedio, como se ha hecho en este caso, con lo que sus resultados se ajustarán más a su propia realidad. Esto será especialmente conveniente en casos de que la metodología de análisis presente coeficientes de variación analítica claramente diferentes de los usados en este trabajo, o para calcular la predicción de estabilidad de magnitudes bioquímicas supuestamente muy inestables, o al utilizar métodos inmunológicos.
La posible deriva en la medida de los analizadores utilizados por los centros, durante el estudio, ha sido evaluada mediante el uso de un suero control en paralelo. La tabla 3 muestra que las mediciones se han mantenido dentro de un rango aceptable.
Someter las muestras de suero a temperaturas altas, en torno a +37°C, lo que no ocurre generalmente en los laboratorios, se debe al propio diseño de “estrés térmico acelerado”. Esto permite establecer un rango de temperaturas que ha oscilado en un rango de alrededor de 60°C, y que establece condiciones muy diferentes para la estabilidad de cada magnitud estudiada. Con este diseño “acelerados” se pueden predecir estabilidades largas (meses o incluso años) con estudios de corta duración (días o semanas).
En algunos casos la degradación no ha significado la obtención de un valor más bajo que el inicial, sino justo lo contrario, como por ejemplo, se puede esperar por las actividades esterásicas más o menos específicas del suero, actuando sobre el fosfato esterificado (figs. 1 y 4). Los valores de fosfato no esterificado aumentan de forma muy significativa con el paso del tiempo y el incremento de temperatura, a causa de la hidrólisis de los ésteres de fosfato (fosfolípidos, proteínas fosforiladas, etc.). No debe olvidarse, por tanto, que la degradación de un analito no siempre equivale a una disminución de su valor con respecto al inicial.
No debe extrañar, tal y como muestra la figura 4, que la gráfica de Arrehnius muestre en el caso del fosfato no esterificado una línea de ajuste con tendencia negativa, como ocurre también en el resto de los casos (fig. 5), ya que ello expresa que, a mayor temperatura, mayor es la diferencia con el valor inicial de la magnitud analizada, es decir, más intenso es el proceso de degradación. En otras palabras, a más temperatura, mayor es la pendiente de degradación.
Las magnitudes analizadas muestran, como es lógico, valores de estabilidad muy diferentes, con valores que han ido desde más de 1 mes a algo más de 1 día (véase en la figura 2 la degradación de alanina aminotransferasa).
Es llamativo el hecho de que la concentración de glucosa en suero, lo que no es esperable en sangre total23, muestra una excelente estabilidad (fig. 3). La fiabilidad de las predicciones de estabilidad obtenidas en este estudio se ha determinado calculando los intervalos de confianza para las temperaturas estudiadas, aunque sólo se han calculado para valores próximos a la zona media de las temperaturas utilizadas (entornos de +4 y +20°C), ya que en estas zonas las dispersiones son lógicamente más cercanas a la recta teórica. Consideramos que puede ser conveniente que los laboratorios utilicen un protocolo de estudio de la estabilidad de las magnitudes a analizar y que dicho protocolo sea común, para que los valores sean más o menos comparables, especialmente para magnitudes que se sospecha, a veces con poco fundamento, que son especialmente delicadas, y que pueden degradarse rápidamente12–14, o bien para comprobar si las sustancias anticoagulantes15 conservantes o estabilizantes, como por ejemplo los inhibidores de proteasas, son realmente eficaces y en cuánto alargan la estabilidad.
De la misma manera, se considera que es muy conveniente extender este tipo de estudios de estabilidad a otra serie de muestras biológicas que plantean problemas mayores que el suero, como la sangre completa16–18,23, que es cómo en ocasiones se transporta durante períodos excesivamente largos, y a otros líquidos biológicos analizados en el laboratorio, como la orina19–21.
Comunicación premiada en el I Congreso del Laboratorio Clinico de Sevilla 2007.
Autores participantes en el estudio:
Rosario Aguilar Peña (Complejo Hospitalario de Jaén)
Purificación Gallardo Flores (Hospital de Antequera. Málaga)
Juan José Pérez Guerrero (Hospital de Baza. Granada)
Francisca García Caballero y Rocío Jiménez Machado (Hospital de Huércal Overa. Almería)
Fernando Pérez Valero (Hospital de Linares. Jaén)
Gemma Álvarez Corral y Félix Gascón Luna (Hospital de Pozoblanco. Córdoba)
Javier Lázaro Rodríguez, Salvador Moreno Hevilla y M. Jesús Gutiérrez (Hospital de Ronda. Málaga)
Aurora Jurado (Hospital I. Margarita. Cabra. Córdoba)
Fernando Rodríguez Cantalejo (Hospital Reina Sofía. Córdoba)
M. de la Cruz Rueda Rubio (Hospital Torrecárdenas. Almería)
Raúl Ramos (Hospital V. Victoria. Málaga)
Ana Luisa Delgado García, Diego Santotoribio y Fernando Mancha Molina (Hospital Virgen del Rocío. Sevilla). Coordinador del estudio: Fernando Recio Quijano
Los autores declaran que no existe ningún conflicto de intereses en la realización de este trabajo