La procalcitonina (PCT) es un marcador bioquímico para el diagnóstico de sepsis. La electroquimioluminiscencia se considera actualmente el método de referencia para cuantificar PCT. El objetivo de este trabajo es estudiar un método inmunoturbidimétrico para cuantificar la PCT, comprobar su correlación analítica con el método electroquimioluminiscente y establecer su capacidad para el diagnóstico de sepsis bacteriana.
Material y métodosEl método inmunoturbidimétrico fue el Diazyme® Procalcitonin Assay (Diazyme Laboratories, Poway, CA, EE. UU.) y el método electroquimioluminiscente fue el Elecsys Brahms PCT (Roche Diagnostics®). El estudio comparativo se realizó con muestras de plasma de pacientes provenientes de diferentes servicios del Hospital Francesc de Borja. Las muestras se analizaron en paralelo en un modular Cobas 6000 (Roche Diagnostics®).
ResultadosSe analizaron 97 muestras. Se obtuvo un coeficiente de correlación intraclase de 0,86 (IC95%: 0,80-0,91). Comparando los dos métodos según los rangos aceptados en la literatura, se observó un acuerdo total del 79,4%, con un coeficiente k no ponderado de 0,72 (IC95%: 0,61-0,83) y de 0,82 (IC95%: 0,74-0,90) tras ponderación con pesos lineales. Se obtuvo un área bajo la curva de 0,88 para el método electroquimioluminiscente y de 0,86 para el método inmunoturbidimétrico. Las odds ratio para la PCT fueron 1,19 (IC95%: 1,06-1,33) y 1,06 (IC95%: 1,00-1,11) medida por electroquimioluminiscencia y por inmunoturbidimetría, respectivamente.
ConclusionesEl método inmunoturbidimétrico de Diazyme® es un método fiable para el diagnóstico y manejo de los pacientes con sospecha de sepsis tal y como lo es en la actualidad el método electroquimioluminiscente de Brahms®.
Procalcitonin (PCT) is a biochemical marker for the diagnosis of sepsis. Electrochemiluminescence is currently considered the reference method for quantifying PCT. The aim of this work is to study an immunoturbidimetric method to measure PCT, compare it with electrochemiluminescence method, and establish its capacity for diagnosis of bacterial sepsis.
Material and methodsThe immunoturbidimetric method was the Diazyme® Procalcitonin Assay (Diazyme Laboratories, Poway, CA, USA), and the electrochemiluminescence method was the Elecsys Brahms PCT. The comparative study was performed with patient plasma samples from different services of the Hospital Francesc de Borja. Samples were analysed in parallel on a Cobas 6000 modular.
ResultsA total of 97 samples were analysed. Intraclass correlation coefficient of 0.86 (95% CI: 0.80-0.91) was obtained. Comparing the two methods according to the ranges accepted in the literature, total agreement of 79.4% was observed, with an unweighted k coefficient of 0.72 (95% CI: 0.61 - 0.83) and 0.82 (95% CI: 0.74 - 0.90) after weighting with linear weights. An Area under the curve of 0.88 was obtained for the electrochemiluminescence method and 0.86 for the immunoturbidimetric method. The odds ratio for the PCT were 1.19 (95% CI: 1.06 - 1.33) and 1.06 (95% CI: 1.00 - 1.11) measured by electrochemiluminescence and immunoturbidimetry, respectively.
ConclusionsDiazyme® immunoturbidimetric method seems to be as reliable a method for the diagnosis and management of patients with suspected sepsis as the current Brahms® electrochemiluminescence method.
La sepsis es una respuesta inflamatoria sistémica a un estímulo infeccioso. Cuando se sospecha o se prueba una infección bacteriana en el contexto de un síndrome de respuesta inflamatoria severa, se puede considerar diagnóstico de sepsis1. La mortalidad intrahospitalaria por un cuadro clínico de sepsis es muy alta2 y es por ello que la precocidad del tratamiento del paciente diagnosticado de sepsis con antibióticos es crucial para su pronóstico y evolución3. Por tanto, la inclusión de la PCT en la cartera de prestaciones de los laboratorios de Urgencias es recomendable.
La procalcitonina (PCT) se produce en las células C de la glándula tiroides y es la prohormona de la calcitonina. Está formada por 116 aminoácidos y tiene un peso molecular de 12,7kDa. La sangre de individuos sanos contiene bajas concentraciones de PCT4,5 mientras que durante una infección de origen bacteriano, la concentración de PCT aumenta y en pacientes con sepsis bacteriana, especialmente en casos de sepsis severas y de shock séptico, se encuentran concentraciones elevadas de PCT6,7. La PCT es considerada como un marcador bioquímico para el diagnóstico de sepsis y que contribuye a predecir su evolución8,9. Sin embargo, tiene sus limitaciones diagnósticas ya que puede permanecer disminuida en algunas infecciones, o bien elevarse en situaciones inflamatorias no infecciosas como en casos de pancreatitis o en infecciones respiratorias extrahospitalarias10,11.
En la actualidad, la electroquimioluminiscencia es un método ampliamente utilizado y validado para la cuantificación de PCT y se considera como método de referencia. Sin embargo, la instrumentación requerida para su análisis obliga a los laboratorios a disponer de equipamiento especializado, que en ocasiones, es inasumible por las limitaciones presupuestarias actuales. La aparición en el mercado de un método inmunoturbidimétrico para la medida de PCT, con mayor practicabilidad, menor tiempo de respuesta y menor coste económico, hace que el análisis de la PCT pueda introducirse en la cartera de servicios de un mayor número de laboratorios de Urgencias.
El objetivo de este trabajo es estudiar un método inmunoturbidimétrico de reciente comercialización para analizar PCT, estudiar su correlación analítica con el método de electroquimioluminiscencia y establecer la capacidad de este nuevo método inmunoturbidimétrico para el diagnóstico de sepsis bacteriana.
Material y métodosAspectos clínicosEn función de la concentración de PCT, se han propuesto tres puntos de corte (0,5ng/mL, 2,0ng/mL y 10,0ng/mL), los cuales establecen cuatro posibles situaciones clínicas: 1) concentraciones de PCT inferiores a 0,5ng/mL indican una situación de bacteriemia improbable; 2) valores de PCT entre 0,5 y 2,0ng/mL, es una zona de concentración indeterminada para el diagnóstico de proceso infeccioso con riesgo de consecuencias sistémicas; 3) concentraciones en el rango entre 2,0 y 10,0ng/mL indican una alta probabilidad de sepsis grave o shock séptico; y 4) concentraciones superiores a 10,0ng/mL, que se encuentran en procesos infecciosos con fallo multiorgánico12,13.
Se consideró que un paciente era diagnosticado de sepsis cuando así constaba en la historia clínica o bien cuando existió un resultado positivo de hemocultivo.
Descripción de los ensayos y métodos utilizadosEl nuevo método, que utiliza reactivos de Diazyme® Procalcitonin Assay (Diazyme Laboratories, Poway, CA, EE. UU.), se basa en un ensayo inmunoturbidimétrico intensificado con látex donde la PCT presente en la muestra se une a anticuerpos monoclonales de ratón anti-PCT humana que revisten partículas de látex, cuya interacción provoca la aglutinación. El nivel de turbidez causado por esta aglutinación se cuantifica ópticamente y es directamente proporcional a la cantidad de PCT presente en la muestra. La lectura óptica debe realizarse con una longitud de onda de 600nm. El analizador calcula la concentración de PCT por interpolación de la señal óptica obtenida en una curva de calibración. Las soluciones de calibración utilizadas contienen PCT en una matriz sérica humana. El material de calibración es provisto por el fabricante en el kit y se utiliza en una curva de calibración de 6 puntos (Blanco; Nivel 1: 0,65ng/mL; Nivel 2: 2,54ng/mL; Nivel 3: 13,94ng/mL; Nivel 4: 28,31ng/mL; Nivel 5: 58,95ng/mL). Por último, se utilizaron 2 niveles de control, provistos también por el fabricante en el kit (Nivel 1: 1,19ng/mL; Nivel 2: 14,38ng/mL).
Por otro lado, el reactivo Elecsys Brahms PCT comercializado por Roche Diagnostics®, se basa en un inmunoensayo de electroquimioluminiscencia (ECLIA) tipo sándwich empleando un anticuerpo biotinilado monoclonal específico anti-PCT y un anticuerpo específico monoclonal anti-PCT marcado con quelato de rutenio. Posteriormente, se añaden micropartículas recubiertas de estreptavidina y el complejo formado se fija a la fase sólida por interacción entre la biotina y la estreptavidina. A continuación, se aplica una corriente eléctrica definida que produce una reacción quimioluminiscente, cuya emisión de luz se mide con un fotomultiplicador. Los resultados se obtuvieron mediante una curva de calibración a 2 puntos generada por el sistema y una curva máster incluida en cada pack de reactivo. La concentración de los calibradores utilizados fueron: Nivel 1: 0,110ng/mL; Nivel 2: 54,00ng/mL.
Para la determinación de la concentración de PCT, en los dos casos, se utilizó un modular Cobas 6000 de Roche Diagnostics®. Concretamente, para el análisis de PCT por el método inmunoturbidimétrico, se utilizó el módulo c501 y para la cuantificación de PCT por el método ECLIA se empleó el módulo e601 del mismo autoanalizador. Todas las muestras se procesaron a la vez y en menos de 2 horas desde su recogida.
Estudio de imprecisiónSe prepararon alícuotas del material de control suministrado en el kit de Diazyme® y se congelaron a -80°C. Para el estudio de imprecisión se calculó el coeficiente de variación inter e intraensayo del reactivo de Diazyme®. El estudio intraensayo se realizó con una alícuota de cada nivel de control de calidad, el cual se analizó 10 veces para cada concentración. Para el estudio de la imprecisión interensayo, se utilizaron los datos obtenidos de los 2 niveles de control de calidad que se analizaron cada día durante los 21 días que duró el estudio.
Estudio de linealidadSe analizaron por triplicado los niveles de las soluciones de calibración (0,65ng/mL; 2,54ng/mL; 13,94ng/mL; 28,31ng/mL; 58,95ng/mL). A continuación, se calculó la regresión lineal y el CV.
Estudio comparativoSe analizó la PCT por ambos métodos en el laboratorio de Urgencias del Hospital Francesc de Borja de Gandía en muestras consecutivas de pacientes provenientes de diferentes servicios del hospital durante 21 días consecutivos. Una vez conocido el tamaño muestral, se hizo una estimación de la potencia según el objetivo principal, obteniendo un resultado de 84%. Las muestras fueron de plasma que se obtuvo tras centrifugar a 3.000rpm durante 5 minutos los tubos que contenían heparina de litio como anticoagulante (BD Vacutainer®, LH PST™ II, Ref: 367374).
Estudio estadísticoPara la estimación de la concordancia entre ambos métodos se utilizó el coeficiente de correlación intraclase y el método gráfico de Bland-Altman14,15 cuando se trabajó con las variables originales en escala continua. Cuando estas fueron categorizadas según los puntos de corte mencionados con anterioridad, se usó el coeficiente κ de Cohen16 sin ponderar y ponderado con pesos lineales. Para evaluar la capacidad diagnóstica de sepsis de ambos reactivos se utilizó la regresión logística univariante y la estimación del área bajo la curva ROC. Se trabajó a un nivel de confianza del 95%. Se utilizó, para el análisis estadístico, el software SPSS 15.0 (SPSS Software, Inc., Chicago, Illinois) y EPIDAT 4.1 (Consellería de Sanidade, Xunta de Galicia).
ResultadosDurante los 21 días en que se realizó el estudio, se analizaron 97 muestras consecutivas de pacientes provenientes de diferentes servicios del hospital: 30 de Medicina Interna (30,9%); 26 de la Unidad de Cuidados Intensivos (26,8%); 15 del Servicio de Urgencias (15,5%); 7 de Cirugía General (7,2%); 6 de Pediatría (6,2%); 4 de Urología (4,1%); 4 de Ginecología y Obstetricia (4,1%); 2 de Hematología (2,1%); 2 de la Unidad de Corta Estancia (2,1%) y uno de Cardiología (1,0%).
El rango de concentraciones de las muestras analizadas por el método electroquimioluminiscente fue de 0,03ng/mL a 86,78ng/mL y para el método inmunoturbidimétrico de 0,17ng/mL a 117,99ng/mL.
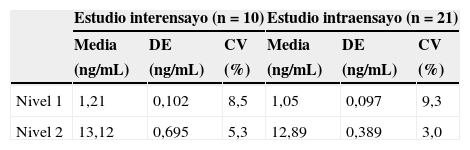
La imprecisión intra- e interensayo se especifica en la tabla 1. Se observó una adecuada linealidad entre los rangos de los calibradores utilizados (0,65ng/mL a 58,95ng/mL) según el análisis de regresión lineal (r=0,9995; p<0,001).
Estudio de imprecisión intra- e interensayo para la PCT de Diazyme®
| Estudio interensayo (n=10) | Estudio intraensayo (n=21) | |||||
|---|---|---|---|---|---|---|
| Media | DE | CV | Media | DE | CV | |
| (ng/mL) | (ng/mL) | (%) | (ng/mL) | (ng/mL) | (%) | |
| Nivel 1 | 1,21 | 0,102 | 8,5 | 1,05 | 0,097 | 9,3 |
| Nivel 2 | 13,12 | 0,695 | 5,3 | 12,89 | 0,389 | 3,0 |
CV: coeficiente de variación; DE: desviación estándar.
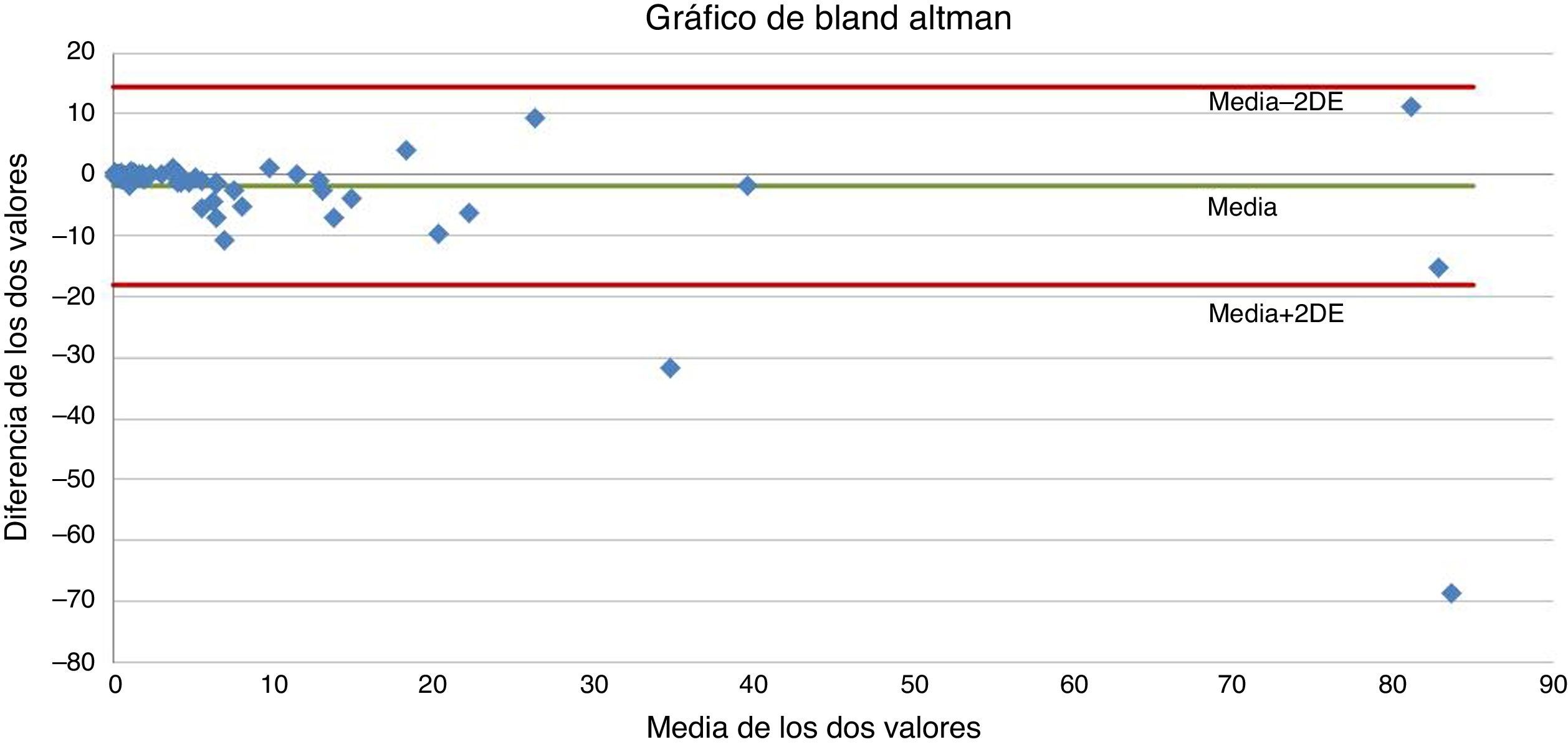
En el estudio de concordancia, se obtuvo un coeficiente de correlación intraclase de 0,86 (IC95%: 0,80-0,91). El gráfico de Bland Altman se muestra en la figura 1. Cuando se compararon los dos métodos según los rangos aceptados en la literatura, se observó un acuerdo total del 79,4%, con un coeficiente κ no ponderado de 0,72 (IC95%: 0,61-0,83) y de 0,82 (IC95%: 0,74-0,90) tras ponderación con pesos lineales.
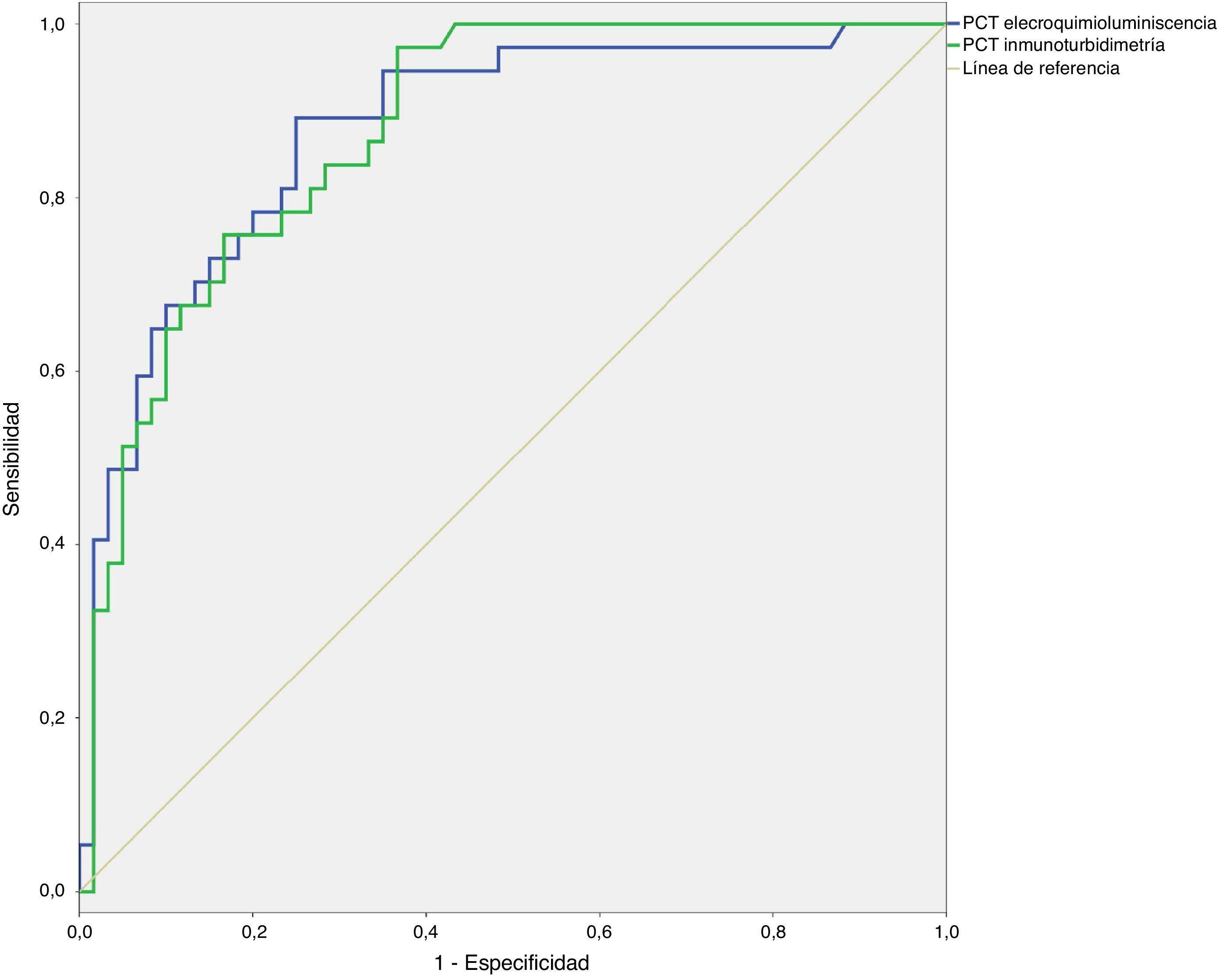
En lo referente a la capacidad diagnóstica de sepsis, se obtuvo un área bajo la curva (AUC) de 0,88 (p<0,001) para el método ECLIA y de 0,86 (p<0,001) para el método inmunoturbidimétrico. El gráfico de la curva ROC se muestra en la figura 2. La odds ratio para la PCT medida por ECLIA fue de 1,19 (IC95%: 1,06–1,33) y para la PCT medida por inmunoturbidimetría, de 1,06 (IC95%: 1,00–1,11).
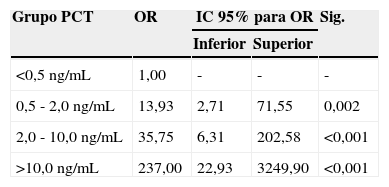
Al categorizar las medidas de PCT en 4 grupos según los puntos de corte establecidos (PCT<0,5ng/mL, PCT entre 0,5ng/mL y 2,0ng/mL, PCT entre 2,0ng/mL y 10,0ng/mL y PCT>10,0ng/mL) se obtuvieron, tras regresión logística, para el método de Brahms, los OR que se muestran en la tabla 2. No fue posible ajustar el modelo de regresión logística univariante para el método de Diazyme® debido a que todos los pacientes con PCT<0,5ng/mL no tuvieron infección.
OR obtenidos mediante regresión logística para PCT con el método inmunoturbidimétrico
| Grupo PCT | OR | IC 95% para OR | Sig. | |
|---|---|---|---|---|
| Inferior | Superior | |||
| <0,5ng/mL | 1,00 | - | - | - |
| 0,5 - 2,0ng/mL | 13,93 | 2,71 | 71,55 | 0,002 |
| 2,0 - 10,0ng/mL | 35,75 | 6,31 | 202,58 | <0,001 |
| >10,0ng/mL | 237,00 | 22,93 | 3249,90 | <0,001 |
IC: intervalo de confianza; OR: odds ratio; Sig.: significación estadística.
La imprecisión obtenida con el método inmunoturbidimétrico de Diazyme® Procalcitonin Assay es similar entre los estudios intra- e interensayo, similar a un estudio publicado recientemente17 (2,9-7,7% y 3,5-8,8%) y al estudio intraensayo realizado por el propio proveedor. Cabe señalar que la concentración de PCT del Nivel 1 de control de calidad suministrado en el kit de reactivos Diazyme® Procalcitonin Assay (1,19ng/mL) es elevada para los valores decisión clínica, ya que uno de los puntos de corte utilizado para este fin es 0,5ng/mL. Dado que se ha utilizado como método de referencia, un método ampliamente establecido y validado como es el Elecsys Brahms PCT (Roche Diagnostics®), no se ha profundizado más en la evaluación de las características analíticas del nuevo método (Diazyme® Procalcitonin Assay - Diazyme Laboratories, Poway, CA, EE. UU.). El estudio se ha basado en las indicaciones citadas en el la información del proveedor, las cuales se han considerado suficientes para la adaptación del método en el analizador utilizado18.
Se ha obtenido un buen coeficiente de correlación intraclase, y además, la distribución en el gráfico de Bland Altman es adecuada. Por último, se ha encontrado un buen coeficiente κ tras ponderación con pesos lineales. Todos estos datos estadísticos indican la bondad o la existencia de una adecuada concordancia entre ambos métodos.
Se observa que, en promedio, con el aumento de un ng/mL (método ECLIA) la probabilidad de sepsis se incrementa en un 19%. Adicionalmente, se puede afirmar que las pruebas proporcionan resultados muy similares vista su concordancia y su capacidad diagnóstica. Por lo tanto, se puede considerar que ambos métodos tienen similares características diagnósticas en cuanto a la valoración clínica de sepsis con los puntos de corte establecidos.
Con todos estos resultados, se puede afirmar que el método inmunoturbidimétrico de Diazyme® es un método fiable para el diagnóstico y manejo de los pacientes con sospecha de sepsis, tal y como lo es en la actualidad el método ECLIA de Brahms®19,20, considerado de referencia. El método inmunoturbidimétrico tiene ventajas con respecto al ECLIA: menor tiempo de respuesta analítico (10 minutos frente a 18), menor volumen de muestra necesario para el análisis (20μL frente a 30μL) y un coste considerablemente menor tanto del propio reactivo como de los analizadores que permiten desarrollar la técnica analítica correspondiente. Todo ello posibilita que un mayor espectro de laboratorios clínicos puedan tener disponible la PCT en su cartera de servicios urgentes y por lo tanto, dar apoyo a un diagnóstico de sepsis que, en el entorno hospitalario, es crucial para iniciar el tratamiento antibiótico lo antes posible y permitir una hipotética reducción de la mortalidad asociada a este cuadro clínico.
Como conclusión, el kit diagnóstico Diazyme® Procalcitonin Assay, a pesar de alguna limitación como la elevada concentración del Nivel 1 de control suministrado, presenta una buena correlación con un método ampliamente utilizado y validado como es el Elecsys Brahms PCT y puede emplearse en el contexto de diagnóstico de sepsis.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.